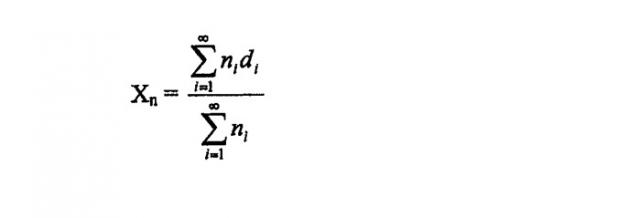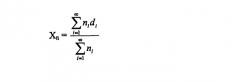Контрастное средство для ультразвуковой визуализации
Иллюстрации
Показать всеИзобретение относится к области ультразвуковой диагностики. Проведены клинические исследования и разработаны специфические препаративные формы с использованием полимерных микросфер, содержащих введенный в них перфторуглерод. Препаративные формы содержат микросферы, образованные биологически совместимым полимером, предпочтительно содержащие включенные в полимер липиды и содержащие перфторуглерод, который при температуре тела представляет собой газ. Микросферы вводят пациенту в количестве, эффективном для улучшения ультразвуковой визуализации в камерах желудочков в течение более чем 5 мин или в миокарде в течение более чем 1 мин, в дозе варьирующей от 0,025 до 8,0 мг микросфер/кг массы тела. Предпочтительно доза варьирует от 0,05 до 4,0 мг микросфер/кг массы тела. Препаративная форма обычно содержится в ампуле. Препарат в форме сухого порошка, который перед использованием восстанавливают стерильной водой, добавляя воду в ампулу или шприц с сухим порошком и встряхивая до получения изоосмотической или изотонической суспензии микросфер. Изобретение обеспечивает получение улучшенного изображения при ультразвуковой визуализации сердечно-сосудистой области в течение продолжительного времени. 6 н. 27 з.п. ф-лы, 5 табл.
Реферат
Предпосылки изобретения
Настоящее изобретение относится к области средств для диагностической визуализации и особенно относится к специфическим средствам для ультразвуковой диагностики, обеспечивающим улучшенные изображения и продолжительные изображения.
При использовании ультразвука с целью получения изображения внутренних органов и структур человека или животного ультразвуковые колебания, колебания звуковых волн по частоте выше тех, которые воспринимает человеческое ухо, отражаются, так как они проходят через тело. Различные типы тканей организма отражают ультразвуковые колебания по-разному, и отражения, которые вызываются ультразвуковыми колебаниями, отраженными от различных внутренних структур, выявляют и автоматически преобразуют в видимое изображение.
При некоторых медицинских показаниях получение нужного изображения органа или представляющей интерес структуры особенно трудно, поскольку детали структуры не являются достаточно отличимыми от окружающей ткани на ультразвуковом изображении, полученном отражением ультразвуковых колебаний в отсутствие увеличивающего контраст вещества. Выявление и наблюдение некоторых физиологических и патологических состояний можно значительно усовершенствовать, повышая контраст ультразвукового изображения введением в орган или другую представляющую интерес структуру контрастного средства для ультразвука. В остальных случаях особенно важным является выявление движения ультразвукового контрастного вещества. Например, определенная модель кровотока, которая, как известно, является результатом только специфических сердечно-сосудистых нарушений, может быть более видимой при введении контрастного средства для ультразвука в кровоток и дальнейшем наблюдении за кровотоком или за объемом крови.
Вещества, которые эффективны в качестве контрастных средств для ультразвука, действуют посредством влияния на ультразвуковые колебания по мере того, как они проходят через тело и отражаются, образуя изображение, по которому ставят медицинский диагноз. Различные типы веществ влияют на ультразвуковые колебания различным образом и в различной степени. Кроме того, некоторые из эффектов, вызываемые усиливающими контрастность средствами, более легко оценить и наблюдать, чем другие. Представленное вещество в подобранном идеальном составе контрастного средства для ультразвука, вероятно, обладает наиболее сильным действием на ультразвуковые колебания, так как проникает через тело. Также действие на ультразвуковое колебание должно быть легко измеримо. Газы являются предпочтительной средой для использования в качестве контрастного средства для ультразвука. Перед применением в виде сурфактант-стабилизированных пузырьков или посредством инкапсулирования в липосомах или микрочастицах газ нужно стабилизировать. Существуют три основных усиливающих контраст эффекта, которые можно наблюдать при ультразвуковом изображении: обратное рассеяние, ослабление пучка и разница скорости звука.
Для инкапсуляции контрастных средств для ультразвуковой визуализации использовали различные природные и синтетические полимеры, такие как воздух, при нагнетании, чтобы получить контрастное средство для ультразвука, которое служит дольше после введения. В Schneider et al., Invest. Radiol., Vol. 27, pp. 134-139 (1992) описаны трехмикронные наполненные воздухом синтетические полимерные частицы. Как сообщали, эти частицы являются устойчивыми в плазме и под внешним давлением. Однако при 2,5 МГц их эхогенность была сниженной. Другой тип суспензии микропузырьков получали из альбумина, подвергнутого воздействию ультразвука. Feinstein et al., J. Am. Coll. Cardiol., Vol. 11, pp. 59-65 (1988). Feinstein описывает получение микропузырьков, с соответствующими для транспульмонального прохождения размерами при превосходной устойчивости in vitro. Однако эти микропузырьки являются короткоживущими in vivo, обладая временем полужизни порядка нескольких секунд (которое приближенно равно одному кругообороту) вследствие их неустойчивости под давлением. Gottlieb, S. et al., J. Am. Soc. Echo., Vol. 3, pp. 328 (1990), Abstract; и Shapiro, J. R. et al., J. Am. Coll. Cardiol. Vol. 16, pp. 1603-1607 (1990).
Заключенные в желатин микропузырьки также были описаны Rasor Associates, Inc. в WO 80/02365. Они образованы в результате "слипания" желатина. Заключенные внутри оболочки из фторсодержащего материала газовые микропузырьки описаны Molecular Biosystems, Inc. в WO 96/04018.
Кроме того, о микропузырьках, стабилизированных микрокристаллами галактозы (SHU 454 и SHU 508), сообщали Fritzch et al. Fritzsch, T. et al., Invest. Radiol. Vol. 23 (Suppl 1), pp. 302-305 (1988); и Fritzsch, T. et al., Invest. Radiol., Vol. 25 (Suppl 1), 160-161 (1990). Микропузырьки сохраняются вплоть до 15 мин in vitro, но менее чем 20 сек in vivo. Rovai, D. et al., J. Am. Coll. Cardiol., Vol. 10, pp. 125-134 (1987); и Smith, M. et al., J. Am. Coll. Cardiol., Vol. 13, pp. 1622-1628 (1989). В патенте EP 398935 Schering Aktiengesellschaft показали получение и использование микроинкапсулированного газа или летучих жидкостей для ультразвукового изображения, в которых микрокапсулы образованы синтетическими полимерами или полисахаридами. В европейском патенте 458745 Sintetica показали воздушные или газовые микрошарики, окруженные пограничной нанесенной полимерной мембраной, которые можно рассеивать в водном носителе для введения в животное-хозяина или для перорального, ректального или уретрального введения, для терапевтических или диагностических целей.
В WO 92/18164 Delta Biotechnology Limited описано получение микрочастиц посредством сушки распылением водного белкового раствора до образования полых сферических оболочек, содержащих внутри газ, для использования в получении изображений. В WO 93/25242 описан синтез микрочастиц для ультразвуковой визуализации, состоящих из газа, который содержится внутри оболочки из полицианоакрилата или полиэфира. В WO 92/21382 показано производство микрочастиц контрастных средств, которые включают ковалентно связанную основу, содержащую газ, в котором основа представляет собой углевод. В патентах США 5334381, 5123414 и 5352435 Unger описаны липосомы для применения в качестве контрастных средств для ультразвука, которые включают газы, газовые предшественники, такие как активированные pH или светом газообразные предшественники, а также другие жидкие или твердые улучшающие контраст средства.
Наблюдали действие заключенного в капсулу газа и предложили применение фторсодержащего газа для улучшения изображения по сравнению с воздухом. В патенте США 5393524 Quay показано применение средств, включающих перфторуглероды, для улучшения контраста при ультразвуковой визуализации. Состоящие из маленьких пузырьков или микропузырьков средства из подобранных газов, которые демонстрируют длительную жизнеспособность, заполняют раствор и являются довольно маленькими для проникновения через легкие, облегчая свое использование при ультразвуковой визуализации сердечно-сосудистой системы и других критических органов. В европейском патенте 554213 Bracco показано применение газов фторированных углеводородов для предотвращения коллапса микровезикул после оказания давления на сосудистое русло. В WO 95/23615 Nycomed показаны микрокапсулы для визуализации, которые образованы комплексами донорно-акцепторного типа из раствора, например, белкового раствора, содержащего перфторуглерод. В WO 95/03357 Massachusetts Institute of Technology показаны микрочастицы, образованные блок-сополимером полиэтиленгликоль - сополимеры лактида с гликолидом, содержащие инкапсулированные радиоактивныепрепараты, включащие газы, такие как воздух и перфторуглероды. Как описано в WO 94/16739 Sonus Pharmaceuticals, Inc., несмотря на то, что твердые и жидкие вещества отражают сигнал в одинаковой степени, известно, что газы являются более эффективными и предпочтительными средами для использования в качестве контрастных средств для ультразвука. Действительно, как показано в WO 94/16739 в примере 12, белковые микрокапсулы были отвергнуты как повышающий опасность фактор (а также вследствие проблем с эффективностью) при введении карликовым свиньям. В патентах США 6132699 и 5611344 описаны способы усиления контраста с использованием перфторуглерода в синтетических полимерных оболочках. В патенте США 5837221 описан способ получения проницаемой полимерной микрочастицы, содержащей гидрофобное вещество, объединенное в полимер для усиления эхогенности.
Некоторые контрастные средства для ультразвука были утверждены в США или Европе для сильно ограниченных сердечных применений. OPTISON® (Amersham, Mallinkrodt) состоит из микрокапсул альбумина человека, денатурированного нагреванием, которые содержат газ октафторпропан. Каждый миллилитр суспензии микросфер содержит 5-8·108 микросфер со средним диаметром в интервале 2-4,5 микрон и 220 мкг октафторпропана. Эти микросферы не были утверждены для оценки коронарного кровотока, а утверждены исключительно для выделения контуров камеры желудочка. В высоких ударных дозах (5 мл суспензии или 1100 мкг октафторпропана) выделение контуров камеры желудочка продолжается вплоть до 5 мин.
DEFINITY® (Bristol Myers Medical Imaging) состоит из октафторпропана, содержащего липидные микросферы, в которых липидная оболочка состоит из фосфолипидов DPPA, DPPC и mPEG-DPPE. Каждый мл суспензии содержит 1,2·1010 микрочастиц, имеющих средний диаметр в интервале 1,1-3,3 микрон и 1100 мкг октафторпропана. Средство апробировано исключительно для выделения контуров камеры желудочка, а не для оценки коронарного кровотока. В ударной дозе 700 мкл (на 70 кг веса человека) или 5133 мкг газа средство увеличивало время работы в камерах желудочка до приблизительно 3,4 мин.
IMAGENT® (Photogen Inc.) состоит из липидных микросфер, содержащих перфторгексан, липидная оболочка которого состоит из фосфолипида DMPC. Каждый мл суспензии содержит 1,4·109 микрочастиц, имеющих средний диаметр меньше, чем 3 микрона, и 92 мкг перфторгексана. Средство апробировано исключительно для выделения контуров камеры желудочка, а не для оценки коронарного кровотока. В ударной дозе 0,43 мл (на 70 кг веса человека) или 40 мкг газа вещество имеет среднее увеличение времени работы в камерах желудочка приблизительно до 2,6 мин.
Во всех случаях эти коммерческие средства имеют ограниченное применение и не утверждены для применения, кроме выделения контуров камеры желудочка и обеспечения средней продолжительности улучшения качества изображения в камерах желудочка, продолжающихся в течение 5 мин или меньше. Существует недостаток коммерческих контрастных средств для ультразвука, которые длительно обеспечивают усиленные изображения сердечно-сосудистой системы, особенно миокарда и камер желудочка. Описанные в известном уровне техники средства при введении в виде ударной дозы или короткой инфузии дают в результате изображения миокарда, которое продолжается в течение значительно меньшего времени, чем суммарно необходимое время для проведения полного исследования сердца. Обычно средства известного уровня техники обеспечивают изображения, которые длятся значительно меньше 1 мин для миокарда. Средство, которое может обеспечить продолжительности усиленного изображения, превосходящие 1 мин в миокарде и/или выше, чем 5 мин в камерах желудочка, предпочтительно.
Поэтому цель изобретения состоит в создании препаративной формы, содержащей микрочастицы, которые позволяют получить усиленные изображения и долговременные изображения, в особенности для сердечных применений.
Другая цель изобретения состоит в обеспечении набора для введения препаративной формы, содержащей микрочастицы для использования при способах ультразвуковой визуализации.
Сущность изобретения
Были проведены клинические исследования и были разработаны специфические дозированные препаративные формы с использованием полимерных микрочастиц, содержащих внутри газ перфторуглерод, которые обеспечивают долговременное значительное усиление изображения. Препаративная форма обычно включает одну, две или до пяти доз, наиболее предпочтительно - одна или две дозы микрочастиц, образованных биосовместимыми полимерами, предпочтительно включающих введенные внутрь липиды, и содержащих перфторуглерод, который при температуре тела представляет собой газ. Микрочастицы вводятся пациенту в дозе, эффективной для усиления ультразвуковой визуализации камер желудочка более чем на 5 мин и/или миокарда более чем на минуту, и в пределах дозы от 0,025 до 8,0 мг микрочастиц/кг веса тела. Предпочтительно вводимая доза для пациента варьировала от 0,05 до 4,0 мг микрочастиц/кг веса тела. В предпочтительном варианте осуществления ультразвуковое изображение усиливается в камерах желудочка в течение 9 мин и/или в миокарде в течение 2 мин.
Препаративная форма обычно находится в ампуле или в шприце.
Стандартная препаративная форма имеет форму сухого порошка, который перед использованием восстанавливают стерильной водой посредством добавления воды в ампулу или шприц с сухим порошком и встряхиванием до образования изоосмотической или изотонической суспензии микрочастиц. В предпочтительном варианте осуществления этой препаративной формы суспензия содержит 1,0-3,5·109 микрочастиц/мл суспензии или 25-50 мг микрочастиц/мл суспензии с наиболее предпочтительной концентрацией полученной суспензии, содержащей 1,5-2,8·109 микрочастиц/мл суспензии или 30-45 мг микрочастиц/мл суспензии. В предпочтительном варианте осуществления микрочастицы имеют средний размер частиц меньше, чем 8 микрон, наиболее предпочтителен средний размер частиц 1,8-3,0 микрон.
В наиболее предпочтительном варианте осуществления газ представляет собой CF4, C2F4, C2F6, C3F6, C3F8, C4F8, C4F10, или SF6. В предпочтительном варианте осуществления газ представляет собой н-перфторбутан (C4F10), приготовленный в количестве 75-500 мкг/мл введенного объема суспензии микрочастиц; предпочтительно н-перфторбутан приготавливается в количестве 100-400 мкг/мл введенного объема суспензии микрочастиц и наиболее предпочтительно 150-350 мкг/мл введенного объема суспензии микрочастиц; или газ представляет собой н-октафторпропан, приготовленный в количестве 75-375 мкг/мл введенного объема суспензии микрочастиц, наиболее предпочтительно 120-300 мкг/мл введенного объема суспензии микрочастиц.
В наиболее предпочтительном варианте осуществления микрочастица образована синтетическим полимером, таким как полиоксикислоты, который включает полимолочную кислоту, полигликолевую кислоту и сополимер молочной кислоты и гликолевой кислоты, полигликолиды, полилактиды и сополимер лактида с гликолидом, полиангидриды, полиортоэфиры, полиамиды, поликарбонаты, полиалкилены, такие как полиэтилен и полипропилен, полиалкиленгликоли, такие как полиэтиленгликоль, полиалкиленоксиды, такие как полиэтиленоксид поливиниловых спиртов, поливалериановая кислота, и сополимер лактида с капролактоном, производные вещества, сополимеры и их смеси и включают гидрофобное соединение, введенные в состав полимера в отношении от 0,01 до 30 мас.% гидрофобного соединения к массе полимера, наиболее предпочтительно введенный в состав полимера липид в отношении от 0,01 до 30% (масса липида/масса полимера). В особенно предпочтительном варианте осуществления липид представлен диолеоилфосфатидилхолином (DOPC), димиристоилфосфатидилхолином (DMPC), дипентадеканоилфосфатидилхолином (DPDPC), дилауроилфосфатидилхолином (DLPC), дипальмитоилфосфатидилхолином (DPPC), дистеароилфосфатидилхолином (DSPC), диарахидоилфосфатидилхолином (DAPC), дибехеноилфосфатидилхолином (DBPC), дитрикозаноилфосфатидилхолином (DTPC), дилигноцероилфатидилхолином (DLGPC); или фосфатидилэтаноламином.
Наиболее предпочтительный синтетический полимер в микрочастицах представляет собой сополимер лактида с гликолидом с соотношением лактида к гликолиду 50:50 (т.е. 1:1) и средневесовая молекулярная масса в интервале 20000-40000 Дальтон, и гидрофобное соединение в микрочастицах является DAPC, в отношении от 5 до 6,6% (масса DAPC/масса полимера).
Препаративная дозированная форма может находиться в виде сухого порошка в ампуле или в шприце, содержащего микрочастицы, или в комплекте, включающем в себя раствор для ресуспендирования микрочастиц. Обычно сухой порошок в ампуле или шприце содержит также носители, такие как сахар и соль, чтобы сделать раствор изоосмотическим или изотоническим после восстановления. Эта препаративная дозированная форма вводится пациенту, чтобы визуализироваться инъекцией, или как болюс или инъекция за период времени вплоть до 30 мин.
Микрочастицы применяют в различных процедурах диагностической визуализации, включающих ультразвуковую визуализацию, магнитно-резонансную томографию, рентгеноскопическое исследование, рентгеновское исследование и компьютерную томографию. Микрочастицы были исследованы в клинических испытаниях для применения в кардиологии, таких как оценка коронарного кровотока и выделение контуров камер желудочка.
Подробное описание изобретения
Описаны усовершенствованные способы, микрочастицы, наборы и препаративные формы для ультразвуковой визуализации. Микрочастицы применяют в различных областях диагностической ультразвуковой визуализации, в особенности в ультразвуковых способах, таких как визуализация кровеносных сосудов и ультразвуковая кардиография, такая как оценка коронарного кровотока, оценка объема крови в миокарде и выделение контуров камер желудочка.
I. Определения
Как правило, в рамках настоящей заявки термин "микрочастица" включает в себя "микросферы" и "микрокапсулы", а также другие микрочастицы, за исключением особо указанных случаев. Микрочастицы могут или не могут быть сферическими по форме. "Микрокапсулы" определены здесь как микрочастицы, имеющие внешнюю полимерную оболочку, окружающую ядро из газа. "Микросферы", как определено здесь, могут представлять собой твердые полимерные сферы или пористые сферы с ячеистой структурой или губкоподобной структурой, образованной порами во всей толще полимера, которые заполнены газом. Некоторые микросферы могут содержать внешнюю полимерную оболочку с ячеистой структурой или губкоподобной структурой, образованной порами во всей толще оболочки полимера, и поры заполнены газом. Для этого типа микросфер эта внешняя полимерная оболочка окружает ядро из газа.
Как правило, в рамках настоящей заявки термины "дозировка" и "доза" используется как синонимы для ссылки на количество вещества, которое дается одновременно, или количество вещества, которое необходимо, чтобы вызвать желательное диагностическое или контрастное действие.
В рамках настоящей заявки термин "препаративная форма" относится к ампуле или другой стандартной таре, такой как шприц, содержащим одну или более дозы вещества, необходимых, чтобы вызвать желательное диагностическое или контрастное действие.
Как правило, в рамках настоящей заявки "область пациента" относится к тому или иному участку или органу пациента. В ряде случаев "область пациента" относится целиком ко всему организму пациента. Примерами таких областей являются область легких, желудочно-кишечная область, сердечно-сосудистая область (включающая в себя миокардиальную ткань и миокард (т.е. сердечную мышцу), камеры желудочка, камеры предсердия, функцию клапана), почечная область, а также другие области тела, ткани, органы и т.п., включая сосудистую сеть и систему кровообращения, а также больную ткань, включая злокачественные ткани. Например, в "область пациента" включают участки для проведения диагностической визуализации. "Область пациента" является преимущественно внутренней, хотя она может быть и внешней.
Как правило, в рамках настоящей заявки "сосудистая сеть" означает кровеносные сосуды (включающие в себя артерии, вены, капилляры и т.п.).
Как правило, в рамках настоящей заявки "желудочно-кишечная область" включает в себя область, определенную пищеводом, желудком, тонким и толстым кишечником и прямой кишкой.
Как правило, в рамках настоящей заявки "почечная область" относится к области, определенной почкой и сосудистой сетью, которая непосредственно приводит к и от почки, и включает в себя брюшную аорту.
Как правило, в рамках настоящей заявки "область нацеливания" и "орган-мишень" применяют взаимозаменяемо для ссылки на участок в организме пациента, к которому желательна доставка средства.
Как правило, в рамках настоящей заявки "область визуализации" и "визуализация области" применяется взаимозаменяемо для ссылки на область пациента, в которой желательна визуализация.
Как правило, в рамках настоящей заявки "желудочковый кровоток или выделения контуров камеры желудочка" относятся к кровотоку через желудочки сердца в одном или более сердечных циклах.
Как правило, в рамках настоящей заявки "предсердный кровоток" относится к кровотоку в предсердие сердца в одном или более сердечных циклах.
Как правило, в рамках настоящей заявки "миокардиальный кровоток" относится к кровотоку в сосудистой сети сердечной мышцы или миокарда, включая кровеносные сосуды сердца в одном или более сердечных циклах.
Как правило, в рамках настоящей заявки "объем крови миокарда" относится к объему крови в сосудистой сети сердечной мышцы или миокарда.
Как правило, в рамках настоящей заявки "сердечный цикл" относится к осуществлению периода сокращения сердца и включает в себя и диастолический, и систолический периоды.
Как правило, в рамках настоящей заявки "увеличенная яркость" относится к усилению яркости изображения по сравнению с изображением, полученным без контрастного средства для ультразвука.
Как правило, в рамках настоящей заявки "улучшенное изображение" относится к изображению с повышенной яркостью в сравнении с изображением, получаемым в отсутствие контрастного средства для ультразвука.
Как правило, в рамках настоящей заявки "продолжительность" относится к общему времени, в котором могло быть определено происходящее увеличение яркости изображения.
Как правило, в рамках настоящей заявки "коронарный вазодилятатор" относится к биоактивному средству, такому как дипиридамол или аденозин, который при введении пациенту вызывает сужение сосудов в сердечно-сосудистой области.
II. Микрочастицы.
В предпочтительном варианте осуществления микрочастицы содержат полимер, липид и газ перфторуглерод. Микрочастицы могут состоять как из микросфер, так и микрокапсул, или только микросфер, или микрокапсул.
Полимеры
В предпочтительном варианте осуществления микрочастицы образуются из синтетических полимеров. Из синтетических полимеров производят микрочастицы, которые являются биологически совместимыми и не загрязняют биоматериалы.
Кроме того, синтетические полимеры предпочтительны вследствие их более репродуктивного синтеза и деградации и in vitro, и in vivo. Полимер подбирают с учетом необходимого времени для устойчивости in vivo, т.е. это необходимое время для распределения в участке, в котором необходима визуализация, и необходимое время для визуализации. Синтетические полимеры могут быть изменены для производства микрочастиц с различными свойствами (например, изменение молекулярного веса и/или функциональных групп).
Характерные синтетические полимеры представляют собой полигидроксикислоты, такие как полимолочная кислота, полигликолевая кислота и сополимер молочной кислоты и гликолевой кислоты, полигликолиды, полилактиды, сополимер лактида с гликолидом и их смеси, полиангидриды, полиортоэфиры, полиамиды, поликарбонаты, полиалкилены, такие как полиэтилен и полипропилен, полиалкиленгликоли, такие как полиэтиленгликоль, полиалкиленоксиды, такие как полиэтиленоксид поливиниловых спиртов, поливалериановая кислота, и сополимер лактида с капролактоном, производные вещества, сополимеры и их смеси. В рамках настоящей заявки в "производные" включают полимеры, содержащие замены, присоединения химических групп, например, алифатический радикал, алкилен, гидроксилирование, окисление и другие модификации, как принято делать у специалистов в данной области.
Примеры предпочтительных биологически разлагаемых полимеров включают в себя полимеры из гидроксикислот, такие как молочная кислота и гликолевая кислота, полилактид, полигликолид, сополимер лактида с гликолидом, сополимеры с PEG, полиангидриды, полиортоэфиры, полиуретаны, полимасляная кислота, поливалериановая кислота, сополимер лактида с капролактоном, их смеси и сополимеры. Наиболее предпочтительный полимер представляет собой сополимер лактида с гликолидом с соотношением лактида к гликолиду 50:50 (т.е. 1:1) и полимер, обладающий средневесовой молекулярной массой в диапазоне 20000-40000 Дальтон. Средневесовая молекулярная масса (Mw) полимера представляет собой средний молекулярный вес, исходя из расчета массы молекул с данным молекулярно-массовым распределением отдельных полимерных цепей. Mw можно определять с помощью гель-проникающей хроматографии (GPC).
Гидрофобные соединения
В предпочтительном варианте осуществления полимер содержит гидрофобное соединение, как описано в патенте США № 5837221. Как правило, включение соединений, таких как липиды, которые гидрофобны и в эффективном количестве в полимерах, ограничивает проникновение и/или поглощение воды микрочастицами и поэтому ограничивает утечку газа из микрочастиц. Это эффективно при увеличении длительности работы улучшенного изображения, обеспеченного микрочастицами, которые содержат липид, синтетический полимер и инкапсулированный в них газ, в частности, фторсодержащие газы, такие как перфторуглерод. Липиды, которые могут быть использованы для обеспечения устойчивости газа внутри полимерных микрочастиц, включают в себя, но ими не ограничиваются, следующие классы липидов: жирные кислоты и производные, моно-, ди- и триглицериды, фосфолипиды, сфинголипиды, холестерин и стероидные производные, терпены и витамины.
Жирные кислоты и их производные могут включать в себя, но ими не ограничиваться, насыщенные и ненасыщенные жирные кислоты, четное или нечетное количество жирных кислот, цис- и транс-изомеры, и производные жирных кислот, включающих спирты, сложные эфиры, ангидриды, жирные гидроксикислоты и простагландины. Насыщенные и ненасыщенные жирные кислоты, которые могут быть использованы, включают в себя, но ими не ограничиваются, молекулы, которые содержат от 12 углеродных атомов до 22 углеродных атомов как в неразветвленной, так и в разветвленной форме. Примеры насыщенных жирных кислот, которые могут быть использованы, включают в себя, но ими не ограничиваются, лауриновую, миристиновую, пальмитиновую и стеариновую кислоты. Примеры ненасыщенных жирных кислот, которые могут быть использованы, включают в себя, но ими не ограничиваются, лауриновую, физотерическую, миристолеиновую, пальмитолеиновую, петроселиновую и олеиновую кислоты. Примеры разветвленных жирных кислот, которые могут быть использованы, включают в себя, но ими не ограничиваются, изолауриновую, изомиристиновую, изопальмитиновую и изостеариновую кислоты и изопреноиды. Производные жирных кислот включают 12-(((7'-диэтиламинкумарин-3-ил)карбонил)метиламино)октадеканоиновую кислоту; N-[12-(((7'-диэтиламинокумарин-3-ил)карбонил)метиламино)октадеканоил]-2-аминопальмитиновую кислоту, N-сукцинилдиолеоилфосфатидилэтаноламин и пальмитоилгомоцистеин; и/или их комбинации. Моно-, ди- и триглицериды или их производные, которые могут быть использованы, включают в себя, но ими не ограничиваются, молекулы, которые содержат жирные кислоты или смеси жирных кислот, содержащих от 6 до 24 атомов углерода, дигалактозилдиглицерид, 1,2-диолеоил-sn-глицерол; 1,2-дипальмитоил-sn-3-сукцинилглицерол; и 1,3-дипальмитоил-2- сукцинилглицерол.
Фосфолипиды, которые могут быть использованы, включают в себя, но ими не ограничиваются, фосфатидные кислоты, фосфатидилхолины как с насыщенными, так и с ненасыщенными липидами, фосфатидилэтаноламины, фосфатидилглицерины, фосфатидилсерины, фосфатидилинозиты, лизофосфатидилпроизводные, кардиолипин и β-ацилалкилфосфолипиды. Примеры фосфолипидов включают в себя, но ими не ограничиваются, фосфатидилхолины, такие как диолеоилфосфатидилхолин (DOPC), димиристоилфосфатидилхолин (DMPC), дипентадеканоилфосфатидилхолин (DPDPC), дилауроилфосфатидилхолин (DLPC), дипальмитоилфосфатидилхолин (DPPC), дистеароилфосфатидилхолин (DSPC), диарахидоилфосфатидилхолин (DAPC), дибехеноилфосфатидилхолин (DBPC), дитрикозаноилфосфатидилхолин (DTPC), дилигноцероилфосфатидилхолин (DLPC); и фосфатидилэтаноламины, такие как диолеоилфосфатидилэтаноламин или 1-гексадецил-2- пальмитоилглицерофосфоэтаноламин. Также могут быть использованы синтетические фосфолипиды с асимметричными ацильными цепями (например, с одной ацильной цепью из 6 углеродов и другой ацильной цепью из 12 углеродов).
Сфинголипиды, которые могут быть использованы, включают в себя церамиды, сфингомиелины, цереброзиды, ганглиозиды, сульфатиды и лизосульфатиды. Примеры сфинголипидов включают в себя, но ими не ограничиваются, ганглиозиды GM1 и GM2.
Стероиды, которые могут быть использованы, включают в себя, но ими не ограничиваются, холестерин, холестеринсульфат, холестерингемисукцинат, 6-(5-холестерол-3в-илокси)гексил-6-амино-6-дезокси-1-тио-б-D-галактопиранозид, 6-(5-холестен-3в-илокси)гексил-6-амино-6-дезоксил-l-тио-б-D-маннопиранозид и холестерил)-4'-триметил-35-аммонио)бутаноат.
Вспомогательные липидные соединения, которые можно использовать, включают в себя токоферол и производные и масла и производные масел, такие как стеариламин.
Можно использовать различные катионогенные липиды, такие как DOTMA, N-[1-(2,3-диолеоилокси)пропил-N,N,N-триметиламмония хлорид; DOTAP, 1,2-диолеоилокси-3-(триметиламмоний)пропан; и DOTB, 1,2-диолеоил-3-(4'-триметиламмоний)бутаноил-sn-глицерин.
Наиболее предпочтительные липиды представляют собой липиды и фосфолипиды, предпочтительно DPPC, DAPC, DSPC, DTPC, DBPC, DLPC и наиболее предпочтительно DPPC, DSPC, DAPC и DBPC.
Содержание липидов варьирует от 0,01 до 30% (масса липида/масса полимера); предпочтительно от 0,1 до 20% (масса липида/масса полимера) и наиболее предпочтительно 1-12% (масса липида/масса полимера).
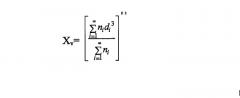
При получении описанными способами размер микрочастиц постоянно воспроизводим. В рамках настоящей заявки термины "размер" или "диаметр" по отношению к частицам относятся к среднечисловому размеру частиц, за исключением особо указанных случаев. Ниже представлен пример формулы, которая может быть использована для определения количества средней величины частиц (Xn):
где ni = число частиц данного диаметра (di).
В рамках настоящей заявки термин "объем среднего диаметра" относится к средней величине объемного массового диаметра. Ниже представлен пример формулы, которая может быть использована для определения диаметра среднего объема (Xv):
где ni = число частиц данного диаметра (di).
Анализ размера частиц может быть выполнен на счетчике Коултера, световой микроскопией, сканирующей электронной микроскопией, трансмиссионной электронной микроскопией, способами лазерной дифракции, такими как способы, использующие Malvern Mastersizer, способами светорассеяния или способами отбора частиц по времени пролета. В рамках настоящей заявки "способ Коултера" относится к способу, в котором порошок диспергируется в электролите, и полученную суспензию анализировали с использованием Coulter Multisizer II, снабженным 50-мкм диаметром объектива трубы. В этом способе обеспечивают измерения размеров и концентраций частиц.
В предпочтительном варианте осуществления для получения вводимых инъекцией, способных проникать через капиллярный слой легких микрочастиц, микрочастицы имеют диаметр меньше, чем 8 микрон. Микрочастицы большего размера могут забивать легочную выстилку, а более маленькие частицы могут не обеспечить достаточного контрастного действия. Предпочтительный размер микрочастицы для внутривенного введения ультразвукового контрастного средства представляет собой от 0,75 до 5 микрон, а наиболее предпочтительно - от 1,8 до 3,0 микрон.
В предпочтительном варианте осуществления микрочастицы представляют собой ячеистую структуру или губкоподобную структуру, образованную порами по всему полимеру, или микрочастицы обладают полимерной оболочкой с ячеистой или губкоподобной, пористой структурой. В обоих случаях поры заполнены газом. Эти микрочастицы образуются сушкой с распылением полимерного раствора, содержащего образующее пустоты средство, такое как углекислый аммоний, как описано ниже.
Контрастные средства для ультразвуковой визуализации
Примеры фторсодержащих газов включают в себя CF4,C2F4, C2F6, C3F6, C3F8, C4F8, C4F10 и SF6. н-Перфторбутан (C4F10) особенно предпочтителен, так как он обеспечивает нерастворимость газа, который не будет растворяться при температуре использования, и является фармакологически приемлемым.
Количество газа, содержащегося в микрочастицах, будет зависеть от вида газа, но обычно составляет 75-500 мкг/мл введенного объема суспензии микрочастиц. Для н-перфторбутана предпочтительное содержание газа составляет 100-400 мкг/мл введенного объема суспензии микрочастиц, а наиболее предпочтительно - составляет 150-350 мкг/мл введенного объема суспензии микрочастиц. Для н-октафторпропана предпочтительное содержание газа составляет 75-375 мкг/мл введенного объема суспензии микрочастиц, а наиболее предпочтительно - 120-300 мкг/мл введенного объема суспензии микрочастиц.
III. Способы получения микрочастиц
Микрочастицы можно получать различными способами, а предпочтительно получать сушкой с распылением. Основным способом оценки является то, что полимер должен быть растворен или расплавлен с гидрофобным соединением или липидом до образования микрочастицы.
Растворители
Во время образования полимер обычно растворяют в растворителе. В рамках настоящей заявки полимерный растворитель представляет собой органический растворитель, который легко испаряется или обладает сравнительно низкой точкой кипения, или может быть устранен под действием вакуума, и который приемлем для введения людям в микроколичествах, такой как дихлорметан. Также могут использоваться другие растворители, такие как этилацетат, этиловый эфир муравьиной кислоты, этанол, метанол, диметилформамид (DMF), ацетон, ацетонитрил, тетрагидрофуран (THF), формамид, уксусная кислота, диметилсульфоксид (ДМСО) и хлороформ, или их сочетания. Как правило, полимер растворяют в растворителе для образования полимерного раствора, имеющего концентрацию от 0,1 до 60% массы к объему (мас./об.), более предпочтительно от 0,25 до 30% (мас./об.) и наиболее предпочтительно 0,5-10% (мас./об.).
Сушка с распылением
Предпочтительно получать микрочастицы сушкой с распылением растворением биосовместимого полимера и липида в подходящем растворителе, диспергируя поры образующего средства как твердые или как раствор внутри раствора полимера, а затем сушка с распылением раствора полимера и поры образующего средства, для образования микрочастицы. В рамках настоящей заявки способ "сушка с распылением" раствора полимера и образующее поры средство относят к способу, в котором раствор полимера и образующее поры средство тончайше измельчают для образования мелкодисперсного тумана и высушивают непосредственным контактом с горячими газами-носителями. В предлагаемом в данной области техники применении распылительных сушек раствор и образующее поры средство могут быть тонко измельчены на входе в камеру распылительной сушилки, проходя как минимум через одну сушильную камеру, а затем собирают в виде порошка. Температура может изменяться в зависимости от используемых газа или полимера. Температуру на входе и выходе в камеру можно контролировать для получения целевых продуктов.
Размер и морфология полученных во время сушки распылением микрочастиц зависит от распылителя, служащего для распыления раствора полимера и образующего поры средства, давления распылителя, объемной скорости раствора полимера с образующим поры средством, используемого полимера, концентрации полимера в растворе, вида полимерного растворителя, вида и количества образующего поры средства, т