Способ получения 4-амино-3-хинолинкарбонитрилов
Иллюстрации
Показать всеИзобретение относится с способу получения 4-амино-3-хинолинкарбонитрила, включающему: а) сочетание аминосоединения с цианоуксусной кислотой и кислотным катализатором с получением цианоацетамида; b) конденсирование цианоацетамида со стадии а с анилином, спиртовым растворителем и триалкилортоформиатом с получением 3-амино-2-цианоакриламида и с) сочетание 3-амино-2-цианоакриламида с оксихлоридом фосфора в ацетонитриле, бутиронитриле, толуоле или ксилоле, необязательно в присутствии катализатора, с получением 4-амино-3-хинолинкарбонитрила. Также описывается способ (вариант) получения 4-амино-3-хинолинкарбонитрила, способ получения 7-аминотиено[3,2-b]пиридин-6-карбонитрила и способ получения цианоацетамида. 4 н. и 20 з.п. ф-лы.
Реферат
Предпосылки создания изобретения
Изобретение относится к способам производства 4-амино-3-хинолинкарбонитрилов, которые могут служить промежуточными соединениями для синтеза дополнительных аналогов 4-амино-3-хинолинкарбонитрила. Такие замещенные хинолины, а также их фармацевтически приемлемые соли подавляют действие некоторых протеинкиназ (ПК), подавляя тем самым анормальный рост клеток некоторых типов.
Соединения, получаемые по этому изобретению, пригодны, например, для лечения поликистозного заболевания почек, полипов толстого кишечника, рака и инсульта у млекопитающих.
В данной патентной заявке хинолиновая циклическая система будет нумероваться, как показано в формуле, представленной ниже:
Данное изобретение относится также к производству 7-аминотиено[3,2-b]пиридин-6-карбонитрилов, пригодных в качестве промежуточных соединений для синтеза 7-аминотиено[3,2-b]пиридин-6-карбонитрильных аналогов. В данной патентной заявке тиено[3,2-b]пиридиновая циклическая система будет нумероваться, как показано в формуле, представленной ниже:
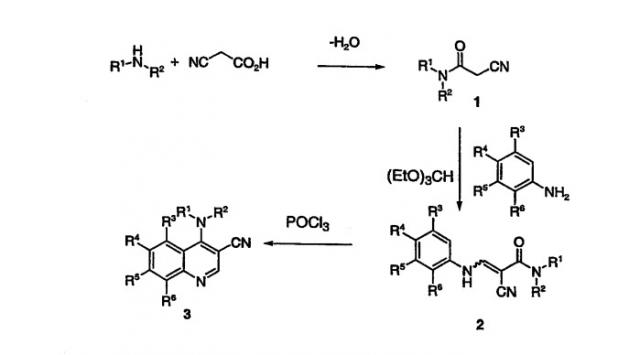
Исторически существуют несколько способов получения 4-аминозамещенных хинолинов, и два наиболее часто применяемых способа включают внутримолекулярные реакции Фриделя-Крафтса (Friedel-Crafts) или замыкания кольца электроциклизацией N(2-карбоксивинил)анилиновых производных при повышенных температурах. Циклодегидрирование соответствующих амидных субстратов через промежуточные соединения типа Вилсмейера (Vilsmeier) кажется привлекательным, но данные литературы скудны, и в примере, представленном ниже, желаемые аминохинолиновые группы нестабильны в условиях реакции и хлорхинолин предпочтителен [Meth-Cohn, O., Taylor, D.L. (1995) Tetrahedron, 51, 12869].
Подход, описанный здесь, является подходящим благодаря легкости получения цианоацетамидной части из цианоуксусной кислоты, желаемого анилина и соответственно замещенного анилина, который дает в результате карбоциклическое кольцо. В литературе существует один пример, где с 3-хлоранилином проводят реакции через ряд цианоацетамидов с образованием енаминонитрилов, которые подвергают циклизации до 4-аминохинолинов в некоторых случаях. Условия, использованные для получения енаминонитрила, являются гораздо более жесткими, чем условия, описанные в общих чертах здесь, и условия циклизации в некоторых примерах не дают в результате циклодегидрирования [Price, C.C., Boekelheide, V. (1946) J. Am. Chem. Soc., 68, 1246]. Кроме того, соединения, описанные в данном изобретении, имеют значительно отличающиеся виды замещения.
Краткое описание изобретения
Данное изобретение относится к способу получения 4-амино-3-хинолинкарбонитрила, включающему сочетание аминосоединения с цианоуксусной кислотой и кислотным катализатором с получением цианоацетамида; конденсацию цианоацетамида с, необязательно до тетразамещенного, анилином в спиртовом растворителе и триалкилортоформиате с получением 3-амино-2-цианоакриламида, а затем сочетание 3-амино-2-цианоакриламида с оксихлоридом фосфора в ацетонитриле, бутиронитриле, толуоле или ксилоле, необязательно в присутствии катализатора, с получением 4-амино-3-хинолинкарбонитрила.
Данное изобретение относится также к способу получения 7-аминотиено[3,2-b]пиридин-6-карбонитрила, включающему сочетание, необязательно до двухзамещенного, 3-аминотиофена с цианоацетамидом и триалкилортоформиатом в спиртовом растворителе с получением 3-амино-2-цианоакриламида, и сочетание 3-амино-2-цианоакриламида с оксихлоридом фосфора в ацетонитриле, бутиронитриле, толуоле или ксилоле, необязательно в присутствии катализатора, с получением 7-аминотиено[3,2-b]пиридин-6-карбонитрила.
Кроме того, данное изобретение относится к способу получения 4-амино-3-хинолинкарбонитрила по реакции сочетания аминосоединения с цианоуксусной кислотой и пептидного связующего реагента с получением раствора, фильтрования раствора с получением цианоацетамида; конденсации цианоацетамида с, необязательно до тетразамещенного, анилином, спиртовым растворителем и триалкилортоформиатом с получением алкоксиенаминонитрила; и сочетание алкоксиенаминонитрила с оксихлоридом фосфора с получением 4-амино-3-хинолинкарбонитрила.
Данное изобретение включает способ получения цианоацетамида, включающий сочетание диметилформамида (ДМФА), амина и цианоуксусной кислоты с получением смеси; охлаждение смеси; добавление раствора N,N'-дициклогексилкарбодиимида в ДМФА так, чтобы поддерживать температуру ниже 15°С с получением суспензии; фильтрование суспензии и промывание полученных твердых побочных продуктов с получением фильтрата; добавление воды к фильтрату с получением смеси и фильтрование смеси с получением цианоацетамида.
Следующие детали эксперимента представлены для того, чтобы помочь пониманию изобретения, и не предназначены для ограничения каким-либо образом данного изобретения, представленного в формуле изобретения, которая следует за этим.
Подробное описание изобретения
Данное изобретение представляет простой в осуществлении способ производства 4-амино-3-хинолинкарбонитрилов, необязательно, с заместителями в 5, 6, 7 и 8 положениях с высоким выходом и высокой чистотой, включающий:
(а) получение цианоацетамида;
(b) получение 3-амино-2-цианоакриламида, необязательно, замещенных анилинов с использованием цианоацетамида и триалкилортоформиата и
(с) циклодегидрирование 3-амино-2-цианоакриламида, полученного, как представлено выше, с оксихлоридом фосфора в подходящем растворителе с добавлением третично-аминовых оснований или спиртов.
Методология, описанная здесь, дает функционализированный анилин, содержащий заместители, которые делают возможной внутримолекулярную циклизацию в условиях дегидрирования.
В последовательности, представленной ниже, описано изобретение, заявляемое здесь.
где
R1 и R2, каждый независимо, представляют водород, алкил из 1-6 атомов углерода, замещенный и незамещенный арил; и
R3, R4, R5 и R6, каждый независимо, представляют водород, гидрокси, галоген, алкил из 1-6 атомов углерода, алкенил из 2-6 атомов углерода, алкинил из 2-6 атомов углерода, алкокси из 1-6 атомов углерода, -алкоксиалкокси-, галогеналкокси-,
-алкилгетероалкил, необязательно замещенный арил, N-алкилпиперазино, причем алкильная часть состоит из 1-6 атомов углерода, пирролидино, морфолино, пиперазино, -алкокси[(N)-алкилпиперазино], где алкильная и алкоксигруппа состоят из 1-6 атомов углерода, или необязательно замещенный гетероарил.
Цианоацетамид 1 может быть получен из соответствующего амина и цианоуксусной кислоты в толуоле с кислотным катализатором или в тетрагидрофуране (ТГФ) с пептидным связующим веществом при нагревании с обратным холодильником. Примеры, включенные сюда, представляют предпочтительные условия и включают использование 1,03 эквивалента цианоуксусной кислоты по отношению к амину, и 1,3-диизопропилкарбодиимида в ТГФ при 77-80°С. Оптимальная методика позволяет фильтровать суспензии, затем следует разбавление водой, чтобы дать возможность продукту выпасть в осадок, и сбор последнего фильтрованием. Эта процедура обеспечивает почти количественный выход 1 с достаточной чистотой для использования на последующей стадии без дополнительной очистки.
Использование связующего реагента из водорастворимого пептида в ТГФ позволяет осуществить прямое выделение цианоацетамида при обработке водой.
Реакцию конденсации цианоацетамида с, необязательно, до тетразамещенных, анилинами можно произвести с гидрохлоридной солью или свободным основанием анилина с триалкилортоформиатом, используя спиртовые растворители при 20-140°С. Оптимальными условиями этого превращения являются проведение реакции в изопропаноле при 80°С с гидрохлоридной солью или свободным основанием анилина и 2,0-7,0 эквивалентами триэтилортоформиата. Эти условия дают возможность получения осадка продукта 2, который выделяют после фильтрования с хорошим выходом и высокой степенью чистоты, и его можно использовать на последующей стадии без очистки.
Циклодегидрирование осуществляют с помощью оксихлорида фосфора в ацетонитриле, бутиронитриле, толуоле или ксилоле, необязательно со спиртами или аминовыми основаниями в качестве катализаторов при 80-110°С. Превращение может быть выполнено нагреванием субстрата в ацетонитриле или бутиронитриле с метанолом и оксихлоридом фосфора. Соль продукта выпадает в осадок из реакционной смеси и может быть непосредственно нейтрализована или выделена и нейтрализована в отдельном сосуде с получением 3 с хорошим выходом и высокого качества. Добавление такого основания к реакционной смеси, как пиридин, триэтиламин или диизопропиламин, может значительно ускорить реакцию.
В соответствии с данным изобретением высокий выход и простой в осуществлении способ получения 7-аминотиено[3,2-b]пиридин-6-карбонитрилов с высокой степенью чистоты получают способом, который составляет последовательность, представленную ниже:
где
R1 и R2, каждый независимо, представляют водород, алкил из 1-6 атомов углерода, замещенный и незамещенный арил; и
R3 и R4, каждый независимо, представляют водород, галоген, алкил из 1-6 атомов углерода, алкенил из 2-6 атомов углерода, алкинил из 2-6 атомов углерода, -алкилгетероарил, арил или гетероарил.
Реакция конденсации цианоацетамида 1 с 3-аминотиофеном может быть выполнена с гидрохлоридной солью или свободным основанием 3-аминотиофена с триалкилортоформиатом при использовании спиртовых растворителей при 20-140°С. Оптимальными условиями для этого превращения являются проведение реакции в изопропаноле при 80°С с 3-аминотиофеном и 2,0-7,0 эквивалентами триэтилортоформиата. Эти условия дают возможность для выпадения в осадок продукта 4, выделяемого после фильтрования с хорошим выходом и высокой степенью чистоты, и его можно использовать на последующей стадии без очистки.
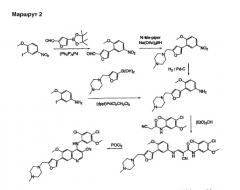
Циклодегидрирование выполняют с оксихлоридом фосфора в ацетонитриле, бутиронитриле, толуоле или ксилоле, необязательно со спиртами или аминовыми основаниями в качестве катализатора, при 80-110°С. Оптимальной процедурой для этого превращения является нагревание субстрата в ацетонитриле с оксихлоридом фосфора. Продукт, соль, выпадает в осадок из реакционной смеси и может быть непосредственно нейтрализован или выделен и нейтрализован в отдельном сосуде с получением 7-аминотиено[3,2-b]пиридин-6-карбонитрилов формулы 5 с хорошим выходом и высоким качеством. Описанный маршрут 1 показан с использованием примеров 4, 6, 42, 43, 44 и 45.
Описанный маршрут 2 показан с использованием примеров 4, 46, 47, 48, 49 и 50.
В некоторых воплощениях данного изобретения цианоуксусную кислоту используют в количестве 1-1,5 эквивалента по отношению к амину с предпочтительной концентрацией, равной 1,03 эквивалента.
В некоторых воплощениях данного изобретения, необязательно до тетразамещенного, анилин является гидрохлоридной солью. В другом воплощении, необязательно до тетразамещенного, анилин является свободным основанием.
Определения
Для удобства здесь собраны некоторые термины, используемые в данном описании, примерах и прилагаемой формуле изобретения.
Термин «алкил» относится к радикалу из насыщенных алифатических групп, включающему алкильные группы с прямой цепью, алкильные группы с разветвленной цепью, циклоалкильным (алициклическим) группам, замещенным алкилом циклоалкильным группам и замещенным циклоалкилом алкильным группам. В предпочтительном воплощении алкил с прямой или разветвленной цепью имеет 6 или менее атомов углерода в своей боковой цепи. Термин «алкил» может быть использован отдельно или в виде части химического названия, как, например, «триалкилортоформиат».
Термины «алкенил» и алкинил» относятся к ненасыщенным алифатическим группам, аналогичным по длине и возможному замещению алкилам, описанным выше, но которые содержат, по меньшей мере, одну двойную или тройную углерод-углеродную связь, соответственно.
Термин «алкокси», как он использован здесь, относится к алкильной группе, которой дано определение выше, имеющей соединенный с ней кислородный радикал. Представленные алкоксильные группы включают метокси, этокси, пропилокси, трет-бутокси и тому подобное. Термин алкокси могут быть использован отдельно или в виде части химического названия, как, например, «алкоксиенаминонитрил».
Аналогичные замещения могут быть произведены у алкенильных и алкинильных групп с получением, например, алкениламинов, алкиниламинов, алкениламидов, алкиниламидов, алкенилиминов, алкинилиминов, тиоалкенилов, тиоалкинилов, карбонилзамещенных алкенилов или алкинилов, алкениоксилов, алкиноксилов, металлоалкенилов и металлоалкинилов.
Термин «арил», в соответствии с описанием, включает 4-, 5-, 6-, 7- и 10-членные карбоциклические моноциклические или конденсированные полициклические ароматические группы, которые могут быть замещенными или незамещенными.
Термин «гетероарил» относится к 4-10-членной ароматической циклической структуре, которая включает в структуре цикла от одного до четырех гетероатомов. Гетероарилы включают, но не ограничиваются этим, пирролидин, оксолан, тиолан, пиперидин, пиперазин, пиррол, фуран, тиофен, имидазол, оксазол, тиазол, триазол, пиразол, пиридин, пиразин, пиридазин и пиримидин, и морфолин.
Термин «гетероатом», в соответствии с описанием, означает атом любого элемента, помимо углерода или водорода. Предпочтительными гетероатомами являются азот, кислород, сера, фосфор и селен.
Термин «галоген» относится к атому фтора, хлора, брома и йода.
В соответствии с описанием, термин «замещенный», как предполагается, включает все допустимые заместители органических соединений. В широком аспекте допустимые заместители органических соединений включают ациклические и циклические, разветвленные и неразветвленные, карбоциклические и гетероциклические, ароматические и неароматические заместители органических соединений. Допустимые заместители могут представлять один заместитель или более, одинаковых или разных, для соответствующих органических соединений. Для целей данного изобретения гетероатомы, такие как азот, могут иметь водородные заместители и/или любые допустимые заместители органических соединений, описанные здесь, которые замещают валентности гетероатомов. Данное изобретение не ограничено определенными допустимыми заместителями органических соединений.
В соответствии с описанием кислотные и щелочные катализаторы данного изобретения включают вещество, которое повышает скорость реакции без изменения общей стандартной энергии Гиббса при реакции. При предпочтительном воплощении кислотные и щелочные катализаторы включают, например, пиридин и 3-нитрофенилбороновую кислоту.
В соответствии с описанием, связующий пептидный реагент включает, например, 1,3-диизопропилкарбодиимид, 1,3-[(диметиламино)пропил]-3-этилкарбодиимида гидрохлорид и дициклогексилкарбодиимид (ДЦК; DCC).
В соответствии с описанием, спиртовой растворитель является жидкостью или гомогенной смесью жидкостей, в которой экстрагируемое(ые) вещество(а) и возможный(ые) модификатор(ы) может(гут) быть растворены с образованием растворенной фазы. При одном из воплощений спиртовым растворителем является, например, этиленгликоль, метанол, изопропанол или бутанол. При предпочтительном воплощении спиртовым растворителем является изопропанол.
В соответствии с описанием, стадию конденсации данного изобретения осуществляют при температуре 10-200°С. В более предпочтительном воплощении температура составляет 140°С. В другом предпочтительном воплощении температура составляет 80°С.
При одном из некоторых воплощений данного изобретения спирт является катализатором. В другом воплощении аминовое основание является катализатором.
В одном из воплощений данного изобретения пептидный связующий реагент водорастворим.
Пример 1
(3-хлор-4-фтор)-2-цианоацетамид
В 5-литровую круглодонную колбу в атмосфере N2, оборудованную монтируемой сверху мешалкой, холодильником, термопарой и 500-мл капельной воронкой, загружали цианоуксусную кислоту (150 г, 1,77 моль), 3-хлор-4-фторанилин (250 г, 1,72 моль) и тетрагидрофуран (ТГФ) (750 мл). Смесь нагревали до 75°С. По каплям в течение 25 минут добавляли раствор 1,3-диизопропилкарбодиимида (221,6 г, 275 мл, 1,77 моль) в ТГФ (50 мл) при 75-79°С. В конце добавления из раствора выпадала в осадок диизопропилмочевина. Суспензию перемешивали в течение часа, затем охлаждали до 13°С. Суспензию фильтровали и осадок на фильтре промывали ТГФ (2×250 мл). Фильтрат переносили в 2-л капельную воронку и твердые вещества удаляли.
В 12-литровую круглодонную колбу, оборудованную смонтированной сверху мешалкой и термопарой, загружали воду (4250 мл) при 15°С. Фильтрат, указанный выше, медленно добавляли в воду в течение 25 минут с образованием белой суспензии. Суспензию перемешивали при комнатной температуре в течение ночи.
Суспензию фильтровали и осадок на фильтре промывали водой (2×250 мл) и сушили в вакууме (50 мм Hg) при 45°С с получением (3-хлор-4-фтор)-2-цианоацетамида в виде твердого вещества белого цвета (294,5 г, 81% выход, >99% чистоты по ВЭЖХ, т.пл. 155,7-157°С). 1Н ЯМР (300 МГц, ДМСО-d6): 10,4 (с, 1Н), 7,80 (д, J=8 Гц, 1Н), 7,5-7,3 (м, 2Н), 3,92 (с, 2Н).
Пример 2
(3-Хлор-4-фтор)-2-цианоацетамид
В 500-миллилитровую круглодонную колбу в атмосфере N2, оборудованную монтируемой сверху мешалкой, холодильником, термопарой и 100-мл капельной воронкой, загружали 1-[3-(диметиламино)пропил]-3-этилкарбодиимида гидрохлорид (21,17 г, 0,11 мл) и ТГФ (140 мл). В капельную воронку добавляли раствор цианоуксусной кислоты (10,03 г, 0,118 моль) и 3-хлор-4-фторанилин (15,44 г, 0,106 моль) в ТГФ (60 мл) и добавляли в реакционную колбу при 25-45°С. В конце добавления реакционная смесь становилась прозрачным раствором. Раствор перемешивали при комнатной температуре в течение 1,5 часов, затем медленно выливали в воду (500 мл) с образованием белой суспензии. Суспензию перемешивали при комнатной температуре в течение ночи, затем фильтровали, и осадок на фильтре промывали водой и сушили в вакууме (50 мм Hg) при 45°С с получением (3-хлор-4-фтор)-2-цианоацетамида в виде твердого вещества белого цвета (21,27 г, 94% выход, 97,5% по ВЭЖХ). 1Н ЯМР (300 МГц, ДМСО-d6): 10,4 (с, 1Н), 7,80 (д, J=8 Гц, 1Н), 7,5-7,3 (м, 2Н), 3,92 (с, 2Н).
Пример 3
(3-Хлор-4-фтор)-2-цианоацетамид
В 500-миллилитровую круглодонную колбу в атмосфере N2, оборудованную монтируемой сверху мешалкой, насадкой Дина-Старка, холодильником, термопарой, загружали цианоуксусную кислоту (28,04 г, 0,33 моль), 3-хлор-4-фторанилин (40,0 г, 0,28 моль), 3-нитрофенилбороновую кислоту (2,28 г, 0,014 моль) и толуол (200 мл). Смесь нагревали до кипения c обратным холодильником и воду собирали в ловушку Дина-Старка. Через 5,5 часов тонкослойная хроматография (ТСХ) показала полное израсходование анилина. Реакционную смесь охлаждали до комнатной температуры (КТ) с образованием розовой суспензии. Твердые вещества отделяли фильтрованием, промывали МТБЭ (2×200 мл) и сушили с получением (3-хлор-4-фтор)-2-цианоацетамида в виде твердого вещества бледно-розового цвета (46,40 г, 79% выход, 96,7% по ГХ-МС). 1Н ЯМР (300 МГц, ДМСО-d6): 10,4 (с, 1Н), 7,80 (д, J=8 Гц, 1Н), 7,5-7,3 (м, 2Н), 3,92 (с, 2Н).
Пример 4
2-Циано-N-(2,4-дихлор-5-метоксифенил)ацетамид
2,4-Дихлор-5-метоксианилин (5,00 г, 26 ммоль) и цианоуксусную кислоту (2,28 г, 26,8 ммоль) смешивали в 50 мл тетрагидрофурана до тех пор, пока не образовывался раствор. Этот раствор нагревали до кипения с обратным холодильником и по каплям добавляли 1,3-диизопропилкарбодиимид (4,2 мл, 26,8 ммоль). Через 30 минут смесь охлаждали до ˜15°С на ледяной бане. Твердое вещество собирали фильтрованием и промывали тетрагидрофураном. Фильтрат медленно выливали в воду и перемешивали в течение 30 минут. Белое твердое вещество собирали фильтрованием, промывали водой и затем растворяли в 500 мл этилацетата. Раствор сушили над сульфатом натрия и концентрировали в вакууме с получением 5,9 г (88%) 2-циано-N-(2,4-дихлор-5-метоксифенил)ацетамида в виде твердого вещества белого цвета, т.пл. 180-181°С; 1Н ЯМР (400 МГц, ДМСО-d6) δ: 3,84 (с, 3Н), 4,02 (с, 2Н), 7,58 (с, 1Н), 7,66 (с, 1Н), 10,00 (с, 1Н).
МС(ЭС) m/z 257,0, 259,0(М-Н)-
Анализ для С10Н8Cl2N2О2
Вычислено: С, 46,36; Н, 3,11; N, 10,81
Найдено: С, 46,25; Н, 3,10; N, 10,85.
Альтернативный пример 4
В реакционную колбу загружали диметилформамид (ДМФА) (500 мл), 2,4-дихлор-5-метоксианилин (100 г, 0,52 моль) и цианоуксусную кислоту (46,6 г, 0,55 моль). Смесь охлаждали до 10°С на ледяной бане. В охлажденную смесь по каплям добавляли раствор N,N'-дициклогексилкарбодиимида (119,1 г, 0,58 моль) в ДМФА (240 мл) так, чтобы температура сохранялась ниже 15°С. После того, как добавление завершали, охлаждение прекращали и реакционную смесь перемешивали в течение 2 часов. Побочный продукт, мочевину, затем удаляли фильтрованием, и осадок промывали дважды ДМФА. К фильтрату добавляли 700 мл воды. Из раствора выпадал твердый продукт. Суспензию охлаждали до 5°С и выдерживали в течение, по меньшей мере, 30 минут. Продукт собирали фильтрованием и промывали водой, а затем сушили в вакууме при 60°С с получением 127,08 г твердого вещества светлого желто-коричневого цвета.
Пример 5
2-Циано-N-(3,4,5-триметоксифенил)ацетамид
3,4,5-Триметоксианилин (10,00 г, 54,6 ммоль) и цианоуксусную кислоту (4,78 г, 56,19 ммоль) смешивали в 100 мл тетрагидрофурана и нагревали с обратным холодильником. К полученному раствору добавляли по каплям 1,3-диизопропилкарбодиимид (8,8 мл, 56,29 ммоль). Смесь охлаждали на ледяной бане и твердое вещество собирали фильтрованием, промывая тетрагидрофураном. Фильтрат медленно выливали в воду и перемешивали в течение 30 минут. Белое твердое вещество собирали фильтрованием, промывали водой и сушили с получением 2,58 г 2-циано-N-(3,4,5-триметоксифенил)ацетамида в виде твердого вещества белого цвета, т.пл. 146-147°С; 1Н ЯМР (400 МГц, ДМСО-d6) δ: 3,61 (с, 3Н), 3,74 (с, 6Н), 3,86 (с, 2Н), 6,90 (с, 2Н), 10,23 (с, 1Н);
МС(ЭС) m/z 251,1 (М+Н)+
Анализ для С12Н14N2О4
Вычислено: С, 57,59; Н, 5,64; N, 11,19
Найдено: С, 57,24; Н, 5,67; N, 11,08.
Пример 6
2-(3-Хлорпропокси)-1-метокси-4-нитробензол
Смесь 2-метокси-5-нитрофенола (16,90 г, 100 ммоль), 3-хлорпропил-п-толуолсульфоната (29,2 г, 120 ммоль) и карбоната калия (27,0 г, 195 ммоль) в 160 мл N,N-диметилформамида нагревали и выдерживали при 80°С в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и распределяли между водой и этилацетатом. Органический слой промывали насыщенным раствором бикарбоната натрия, сушили над сульфатом магния и фильтровали. Раствор концентрировали в вакууме и перекристаллизовывали из гексана и этилацетата с получением 4,68 г 2-(3-хлорпропокси)-1-метокси-4-нитробензола в виде первой порции не совсем белых кристаллов. Вторую порцию из 11,10 г получали из маточной жидкости. Оставшийся раствор концентрировали в вакууме и очищали колоночной флэш-хроматографией, элюируя смесью гексан:этилацетат 4:1 с получением 1,31 г 2-(3-хлорпропокси)-1-метокси-4-нитробензола в виде не совсем белых кристаллов, т.пл. 85-87°С; 1Н-ЯМР (400 МГц, ДМСО-d6) δ: 2,23 (м, 2Н), 3,79 (т, J=6 Гц, 2Н), 3,92 (с, 3Н), 4,21 (т, J=6 Гц, 2Н), 7,19 (д, J=9 Гц, 1Н), 7,77 (д, J=2 Гц, 1Н), 7,92 (дд, J=9,2 Гц, 1Н);
МС(ЭС) m/z 246,1; 248,1(М+Н)+
Анализ для С10Н12ClNO4
Вычислено: С, 48,89; Н, 4,92; N, 5,70
Найдено: С, 49,09; Н, 4,68; N, 5,62.
Альтернативный пример 6
2-метокси-5-нитрофенол (50 г, 0,30 моль) объединяли с 250 мл изопропилового спирта. К смеси добавляли 1N раствор гидроксида натрия, 310 мл (0,31 моль) с такой скоростью, чтобы температура оставалась ниже 40°С. После того, как добавление завершали, смесь перемешивали в течение, по меньшей мере, 30 минут. В реакционную смесь затем загружали 1-бром-3-хлорпропан (93,1 г, 0,59 моль) одной порцией. Смесь нагревали до 75°С и периодически контролировали по высокоэффективной жидкостной хроматографии (ВЭЖХ). Через 8 часов нагревание прекращали, и реакционной смеси давали остыть до комнатной температуры в течение ночи. Продукт постепенно выпадал в осадок из смеси в виде твердого вещества светло-желтого/желто-коричневого цвета. Добавляли воду, 200 мл, одной порцией, и полученную суспензию перемешивали в течение, по меньшей мере, 30 минут. Суспензию фильтровали и промывали водой. Из влажного неочищенного продукта готовили суспензию в 650 мл метанола и нагревали с обратным холодильником до тех пор, пока твердые вещества растворялись или по большей части растворялись. Раствору давали постепенно остыть при перемешивании при комнатной температуре в течение 3-5 часов или более. Смесь затем охлаждали до 10-15°С и выдерживали в течение, по меньшей мере, 30 минут. Твердые вещества отфильтровывали и промывали холодным метанолом. Продукт затем сушили в вакууме с получением 60,3 г 2-(3-хлорпропокси)-1-метокси-4-нитробензола.
Пример 7
3-(3-Хлорпропокси)-4-метоксианилин
Смесь 2-(3-хлорпропокси)-1-метокси-4-нитробензола (2,15 г, 8,77 ммоль) и дигидрата хлорида олова (II) (6,1 г, 27,11 ммоль) в 50 мл этилацетата нагревали с обратным холодильником в течение 6,5 часов. Реакционную смесь охлаждали до комнатной температуры и выливали в 250 мл насыщенного водного раствора бикарбоната натрия. После перемешивания в течение 40 минут дополнительно добавляли этилацетат и слои разделяли. Органический слой промывали насыщенным раствором бикарбоната натрия и водой, затем сушили над сульфатом магния и фильтровали. Раствор концентрировали в вакууме и очищали колоночной флэш-хроматографией, элюируя смесью гексан:этилацетат 1:1 с получением 753 мг 3-(3-хлорпропокси)-4-метоксианилина в виде масла темно-коричневого цвета; 1Н-ЯМР (400 МГц, ДМСО-d6) δ: 2,13 (м, 2Н), 3,62 (с, 3Н), 3,78 (т, J=6 Гц, 2Н), 3,96 (т, J=6 Гц, 2Н), 4,77 (шир. с, 2Н), 6,10 (дд, J=8,2 Гц, 1Н), 6,29 (д, J=2 Гц, 1Н), 6,66 (д, J=8 Гц, 1Н);
МС(ЭС) m/z 216,1, 218,1 (М+Н)+.
Пример 8
1-Этокси-2-йод-4-нитробензол
Суспензию 2-йод-4-нитрофенола (21 г, 79,2 ммоль) [ист: Kometani, T.; Watt, D.S.; Ji, T., Tetrahedron Lett. (1985), 26(17), 2043], этилйодида (9 мл, 0,48 моль) и карбоната калия (40,7 г, 0,3 моль) в 100 мл N,N-диметилформамида нагревали и выдерживали при 70°С в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат. Неорганические соли отфильтровывали и промывали этилацетатом. Органические вещества трехкратно промывали водой и насыщенным раствором соли, сушили над сульфатом магния и фильтровали. При концентрировании фильтрата выпадало твердое вещество. Это твердое вещество отфильтровывали и промывали гексанами с получением 5,2 г 1-этокси-2-йод-4-нитробензола в виде белых кристаллов. Концентрирование фильтрата дает дополнительно 11,3 г желаемого продукта, т.пл. 81-83°С; 1Н-ЯМР (400 МГц, ДМСО-d6) δ: 1,42 (т, 3Н), 4,26 (кв., 2Н), 7,18 (д, 1Н), 8,26 (дд, 1Н), 8,55 (д, 1Н)
Анализ для С8Н8INO3
Вычислено: С, 32,79; Н, 2,75; N, 4,78
Найдено: С, 32,71; Н, 2,58; N, 4,53.
Пример 9
(4-Этокси-3-йодфенил)амин
Суспензию железа (3,81 г, 0,70 ммоль) и хлорида аммония (5,47 г, 102 ммоль) в 80 мл этанола и 25 мл воды нагревали с обратным холодильником. Порциями добавляли 1-этокси-2-йод-4-нитробензол (5,0 г, 20 ммоль), и реакционную смесь нагревали с обратным холодильником в течение 1 часа. Горячую смесь фильтровали через целит, промывая горячим этанолом. Фильтрат концентрировали в вакууме и обрабатывали этилацетатом и водой. Органический слой экстрагировали, промывали насыщенным раствором соли, сушили над сульфатом магния и фильтровали. Удаление растворителя в вакууме давало 5,1 г (4-этокси-3-йодфенил)амина в виде масла светло-коричневого цвета; 1Н ЯМР (400 МГц, ДМСО-d6) δ: 1,30 (с, 3Н), 3,89 (кв., 2Н), 4,82 (шир. с, 2Н), 6,53 (дд, 1Н), 6,72 (д, 1H), 7,11 (д, 1Н);
МС(ЭС) m/z 263,9(М+Н)+
Анализ для С8Н10INO
Вычислено: С, 36,52; Н, 3,83; N, 5,32
Найдено: С, 36,84; Н, 3,71; N, 4,96.
Пример 10
2-Йод-1-(2-метоксиэтокси)-4-нитробензол
Суспензию 2-йод-4-нитрофенола (15,5 г, 58,7 ммоль) [ист: Kometani, T.; Watt, D.S.; Ji, T., Tetrahedron Lett. (1985), 26(17), 2043], 2-хлорэтилметилового эфира (10,69 мл, 117 ммоль), карбоната калия (16,8 г, 117 ммоль) и йодида натрия (100 мг) в 160 мл N,N-диметилформамида нагревали при 70-80°С в течение 4 часов. Дополнительно добавляли 5,35 мл 2-хлорэтилметилового эфира и реакционную смесь нагревали до тех пор, пока тонкослойная хроматография (ТСХ) не показывала отсутствие фенола. Смесь фильтровали, и фильтрат концентрировали в вакууме. Твердые вещества распределяли между этилацетатом и 1 N гидроксидом натрия. Органический слой сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией, элюируя градиентом от гексана до 50% этилацетата в гексане. Полученное масло перекристаллизовывали из эфира с получением 7,5 г 2-йод-1-(2-метоксиэтокси)-4-нитробензола в виде твердого вещества белого цвета, т.пл. 35-36°С; 1Н ЯМР (400 МГц, ДМСО-d6) δ: 3,37 (с, 3Н), 3,74 (т, 2Н), 4,33 (т, 2Н), 7,20 (д, 1Н), 8,26 (д, 1Н), 8,56 (с, 1Н)
Анализ для С9Н10INO4
Вычислено: С, 33,46; Н, 3,12; N, 4,34
Найдено: С, 34,39; Н, 3,11; N, 4,41.
Пример 11
[3-Йод-4-(2-метоксиэтокси)фенил]амин
Суспензию железа (3,89 г, 69,7 ммоль), хлорида аммония (5,0 г, 93,5 ммоль) в 100 мл этанола и 28 мл воды нагревали с обратным холодильником. Добавляли 2-йод-1-(2-метоксиэтокси)-4-нитробензол (7,5 г, 23,2 ммоль) и реакционную смесь нагревали с обратным холодильником в течение 3 часов. Смесь охлаждали до комнатной температуры и фильтровали через целит (Celite), промывали этанолом. Фильтрат концентрировали в вакууме до тех пор, пока не появлялся осадок. Осадок удаляли фильтрованием через магнезол (Magnesol) и фильтрат концентрировали в вакууме с получением 4,0 г [3-йод-4-(2-метоксиэтокси)фенил]амина в виде масла; 1Н ЯМР (300 МГц, ДМСО-d6) δ: 3,33 (с, 3Н), 3,62 (т, 2Н), 3,95 (т, 2Н), 5,01 (д, 2Н), 6,55 (д, 1Н), 6,73 (д, 1Н), 7,03 (с, 1Н);
МС(ЭС) m/z 294,0(М+Н)+
Анализ для С9Н12INO2
Вычислено: С, 36,88; Н, 4,13; N, 4,78
Найдено: С, 37,28; Н, 4,29; N, 4,80.
Пример 12
3,4-Диметоксианилино-N-(диметил)-2-циано-2-пропенамид
3,4-Диметоксианилин (1,50 г, 0,010 моль), диметиламиноцианоацетамид (1,50 г, 0,013 моль) и триэтилортоформиат (2 мл, 0,012 моль) смешивали в этиленгликоле (10 мл) и раствор нагревали с обратным холодильником. Раствор перемешивали в течение 5 часов, затем ему давали остыть до комнатной температуры, пока не образовывался осадок. Добавляли воду (120 мл) и суспензию фильтровали. Влажные твердые вещества суспендировали в дихлорметане (100 мл), перемешивали с сульфатом магния, фильтровали и концентрировали с получением 3,4-диметоксианилино-N-(диметил)-2-циано-2-пропенамида в виде твердого вещества серого цвета (1,54 г, 57% выход, 88% чистоты по ГХ). 1Н ЯМР (300 МГц, ДМСО-d6): 10,9 (д, J=21 Гц, 1Н), 8,23 (д, J=21 Гц, 1Н), 7,08 (с, 1Н), 6,9-6,9 (м, 2Н), 3,78 (с, 3Н), 3,72 (с, 3Н), 3,03 (шир. с, 6Н)
Пример 13
3,4-Диметоксианилино-N-(3-хлор-4-фторфенил)-2-циано-2-пропенамид
3,4-Диметоксианилин (0,30 г, 0,002 моль) и (3-хлор-4-фтор)-2-цианоацетамид (0,50 г, 0,0024 моль) и триэтилортоформиат (2 мл, 0,012 моль) смешивали в этиленгликоле (4 мл) и нагревали с обратным холодильником. Раствор перемешивали в течение 1,5 часов, затем ему давали остыть до ˜50°С и добавляли воду (15 мл). Суспензии давали остыть до комнатной температуры и твердые вещества отделяли фильтрованием, промывали МТБЭ (2×15 мл) с получением 3,4-диметоксианилино-N-(3-хлор-4-фторфенил)-2-циано-2-пропенамида в виде твердого вещества бежевого цвета (0,55 г, 93% чистоты по ЖХМС): 1Н-ЯМР (ДМСО-d6): 11,3 (д, J=15 Гц, 1Н), 9,76 (с, 1Н), 8,70 (д, J=15 Гц, 1Н), 7,97 (д, J=8 Гц, 1Н), 7,6-7,57 (м, 1Н), 7,51 (д, J=9 Гц, 1Н), 7,38 (т, J=9 Гц, 1Н), 7,29 (с, 1H), 6,97 (д, J=8 Гц, 1Н), 3,72 (с, 3Н), 3,03 (шир. с, 6Н).
Пример 14
4-Бром-3-этоксианилино-(N-3-хлор-4-фторфенил)-2-циано-2-пропенамид
В 2-л круглодонную колбу в атмосфере N2, оборудованную смонтированной сверху мешалкой, холодильником, термопарой и 100-мл капельной воронкой, загружали (3-хлор-4-фтор)-2-цианоацетамид (100 г, 0,47 моль), 4-бром-3-этоксианилина гидрохлорид (100,4 г, 0,40 моль) и изопропанол (500 мл). Добавляли триэтилортоформиат (64 мл, 57 г, 0,38 моль) и суспензию нагревали до 72°С. Через 1,5 часа приливали следующую аликвотную часть триэтилортоформиата (64 мл, 57 г, 0,38 моль) и продолжали нагревание с обратным холодильником. Еще через 2 часа при кипении с обратным холодильником добавляли третью аликвотную часть триэтилортоформиата (64 мл, 57 г, 0,38 моль) и нагревание продолжали в течение 10 часов. Реакционную смесь охлаждали до 20-25°С и осадок собирали фильтрованием. Осадок на фильтре промывали изопропанолом (2×100 мл) и сушили в вакууме (45°С, 50 мм Hg) с получением 4-бром-3-этоксианилино-(N-3-хлор-4-фторфенил)-2-циано-2-пропенамида в виде твердого вещества не совсем белого цвета (136,5 г, 70% выход, >97,5% чистоты по ВЭЖХ, т.пл. 226-228°С). 1Н-ЯМР (ДМСО-d6): 11,3 (д, J=15 Гц, 1Н), 9,76 (с, 1Н), 8,70 (д, J=15 Гц, 1Н), 7,97 (д, J=8 Гц, 1Н), 7,6-7,57 (м, 1Н), 7,51 (д, J=9Гц, 1Н), 7,38 (т, J=9 Гц, 1Н), 7,29 (с, 1Н), 6,97 (д, J=8 Гц, 1Н), 4,14 (кв., J=9 Гц, 2Н), 1,37 (т, J=9 Гц, 3Н).
Пример 15
3-Фтор-4-метоксианилино-N-(2,4-дихлор-5-метоксифенил)-2-циано-2-пропенамид
К суспензии 2-циано-N-(2,4-дихлор-5-метоксифенил)ацетамида (1,00 г, 3,86 ммоль) в 200 мл изопропанола добавляли 3-фтор-п-анизидин (0,60 г, 4,25 ммоль). Эту смесь нагревали с обратным холодильником с получением прозрачного желтого раствора. К этому раствору по каплям добавляли триэтилортоформиат (1,72 мл, 10,34 ммоль), и реакционную смесь нагревали с обратным холодильником в течение ночи. Добавляли дополнительно 2 мл триэтилортоформиата, и смесь нагревали с обратным холодильником в течение ночи. Дополнительно добавляли 2 мл триэтилортоформиата и смесь нагревали с обратным холодильником в течение ночи. Смеси давали остыть до комнатной температуры, и белое твердое вещество собирали фильтрованием, промывали изопропанолом и сушили в течение ночи при ˜40°С под пониженным давлением. Очистка суспензии в горячем этилацетате с последующим добавлением холодного гексана давала 1,08 г (68%) 3-фтор-4-метоксианилино-N-(2,4-дихлор-5-метоксифенил)-2-циано-2-пропенамида в виде твердого вещества белого цвета, т.пл. 275-276°С; МС 408,1; 410,1 (М-Н)-.
Анализ для С18Н14Cl2FN3О3
Вычислено: С, 52,70; Н, 3,44; N, 10,24
Найдено: С, 52,44; Н, 3,26; N, 10,14.
Пример 16
3-(3-Хлорпропокси)-4-метоксианилино-N-(2,4-дихлор-5-метоксифенил)-2-циано-2-пропенамид
К суспензии 2-циано-N-(2,4-дихлор-5-метоксифенил)ацетамида (738 мг, 2,84 ммоль) в 100 мл изопропанола добавляли 3-(3-хлорпропокси)-4-метоксианилин (611 мг, 2,84 ммоль). Смесь нагревали с обратным холодильником и по каплям добавляли триэтилортоформиат (3,0 мл, 18,0 ммоль). Реакционную смесь нагревали с обратным холодильником в течение ночи. Теплую смесь фильтровали и собранное твердое вещество белого цвета промывали изопропанолом с получением 610 мг 3-(3-хлорпропокси)-4-метоксианилино-N-(2,4-дихлор-5-метоксифенил)-2-циано-2-пропенамида, т.пл. 185-192°С; МС(ЭС) m/z 482,1, 484,2, 486,0 (М-Н)-.
Анализ для С21Н20Cl3N3О4
Вычислено: С, 52,03; Н, 4,16; N, 8,67
Найдено: С, 51,89; Н, 4,11; N, 8,53.
Пример 17
3-Бром-4-метоксианилино-N-(2,4-дихлор-5-метоксифенил)-2-циано-2-пропенамид
К суспензии 2-циано-N-(2,4-дихлор-5-метоксифенил)ацетамида (900 мг, 3,46 ммоль) в 100 мл изопропанола добавляли 3-бром-4-метоксианилин (700 мг, 3,46 ммоль). Эту смесь нагревали с обратным холодильником и по каплям добавляли триэтилортоформиат (3,3 мл, 19,8 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 6 часов. Теплую смесь фильтровали и собранное твердое вещество белого цвета промывали изопропанолом с получением 376 мг 3-бром-4-метоксианилино-N-(2,4-дихлор-5-метоксифенил)-2-циано-2-пропенамида, т.пл. >250°С; МС(ЭС) m/z 467,7; 469,9; 471,7 (М-Н)-.
Анализ для С18Н14BrCl2N3О3
Вычислено: С, 45,89; Н, 3,00; N, 8,92
Найдено: С, 45,75; Н, 2,77; N, 8,78.
Пример 18
3-Бром-4-этоксианилино-N-(2,4-дихлор-5-метоксифенил)-2-циано-2-пропенамид
К суспензии 2-циано-N-(2,4-дихлор-5-метоксифенил)ацетамида (715 мг, 2,74 ммоль) в 50 мл изопропанола добавляли 3-бром-4-этоксианилин (586 мг, 2,71 ммоль). Эту смесь нагревали с обратным холодильником и по каплям добавляли триэтилортоформиат (2,7 мл, 16,2 ммоль). Реакционную смесь нагревали с обратным холодильником в течение ночи. Теплую смесь фильтровали и собранное твердое вещество белого цвета промывали изопропанолом с получением 666 мг 3-бром-4-этоксианилино-N-(2,4-дихлор-5-метоксифенил)-2-циано-