Получение терминально дифференцированных дофаминергических нейронов из эмбриональных стволовых клеток человека
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описана дифференцированная клеточная популяция в культуре in vitro, применяемая для лечения нейродегенеративных расстройств, полученная путем дифференцировки плюрипотентных стволовых клеток приматов и селекции нестин-положительных клеток и NCAM-положительных клеток путем культивирования клеток в присутствии TGF-β3, или интерлейкина-1β, или обоих этих факторов и N-ацетилцистеина, где по крайней мере 60% дифференцированных клеток являются дофаминергическими нейронами или где 85% или более клеток представляют собой селектированную популяцию нестин-положительных клеток, и 80% или более клеток являются обогащенной популяцией, которая экспрессирует NCAM, и 60% или более дифферецированных клеток экспрессируют тирозингидроксилазу. Раскрыт способ получения описанной дифференцированной клеточной популяции. Предложены способы получения дофаминергических нейронов и серотонинергических нейронов. Также предложен способ лечения пациентов с нейродегенеративными расстройствами и неврологическими заболеваниями. Настоящее изобретение позволяет получать нейрональные клетки-предшественницы и терминально дифференцированные клетки в больших количествах, и таким образом они могут служить прекрасным источником для клеточно-заместительной терапии при неврологических расстройствах, таких как болезнь Паркинсона. 6 н. и 38 з.п. ф-лы, 17 ил., 5 табл.
Реферат
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
1. ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к улучшенному способу получения терминально дифференцированных нейрональных клеток, таких как дофаминергические или серотонинергические нейроны, из плюрипотентных эмбриональных стволовых клеток, таких как человеческие эмбриональные стволовые клетки. Дофаминергические и серотонинергические нейроны, полученные в соответствии с настоящим изобретением, могут служить в качестве превосходного источника для клеточно-заместительной терапии при нейродегенеративных нарушениях и нейрональных заболеваний.
2. ОПИСАНИЕ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
Нейродегенеративные нарушения и неврологические заболевания, такие как болезнь Паркинсона, болезнь Альцгеймера и шизофрения, являются деструктивными заболеваниями, которые становятся все более распространенными в нашем обществе. Многие из этих неврологических заболеваний связаны с дофаминергическими или серотонинергическими нейронами. Дофаминергические нейроны находятся в вентральной или вентролатеральной области среднего мозга и контролируют постуральные рефлексы, движение и вознаграждение, ассоциированное с поведением. Эти нейроны иннервируют различные структуры переднего мозга, и их разрушение или анормальная функция связаны с болезнью Паркинсона, шизофренией или склонностью к наркотикам (Hynes et al., 1995, Cell 80:95-101). Серотонинергические нейроны концентрируются в вентральной или вентролатеральной области заднего мозга и иннервируют различные части центральной нервной системы, включая кору головного мозга, лимбическую систему и спинной мозг. Эти нейроны контролируют уровень сознания, пробуждения, особенностей поведения, потребление пищи, и их анормальная функция связана с агрессией, депрессией и шизофренией (Jacobs и Gelperin, 1981, Serotonin Neurotransmission and Behavior. The MIT Press, Cambridge, Mass.). Серотонинергическая дисфункция также может играть роль в патофизиологии различных психиатрических, неврологических и других заболеваний, например, умственной депрессии (Asberg et al., 1986, J. Clin. Psychiatry 47:23-35), суицида (Lester, 1995, Pharmocopsychiatry 28(2):45-50) и вспыльчивого агрессивного поведения (Brown et al., J. Clin. Psychiatry, 1990, 54:31-41; Eichelman, 1990, Annu. Rev. Med. 41:149-158).
Болезнь Паркинсона является прогрессирующим неврологическим заболеванием, вызванным разрушением нервных клеток (нейронов) в области мозга, которая контролирует движения. Это разрушение вызывает недостаток сигнального агента (нейромедиатор) в мозге, известного как дофамин, что вызывает нарушение двигательной активности, которое характеризует это заболевание. Исследования патологии показывают, что потеря дофаминергических нейронов в черном веществе способствуют возникновению болезни Паркинсона. Например, билатеральное поражение нигростриатального пути (эфферентной связи черного вещества с полосатым телом) приводит у экспериментальных животных к синдрому, очень сходному с наблюдаемой моторной дисфункцией при болезни Паркинсона: тремор в покое, ригидность, акинез и постуральные отклонения. Следствием билатерального повреждения нигростриатального пути, вызванные 6-гидроксидопамином (OHDA), является значительная акинезия, адипсия, афагия и сенсорная нечувствительность у грызунов (Ungerstedt, 1971, U. Acta Physiol. Scand. Suppl. 367:95-121; Yirek and Sladek, 1990, Annu. Rev. Neurosci. 13:415-440).
При паркинсонизме изменение статуса дофаминергических рецепторов может зависеть от стадии прогрессирования заболевания. Признаком паркинсонизма является значительное уменьшение дофамина во всех компонентах базального ганглия (Hornykiewicz, 1988, Mt. Sinai J. Med. 55:11-20). Когда дофамин исчерпан, возникает дисфункция различных других областей мозга, таких как таламус, бледный шар и субталамическое ядро. Поскольку эти области посылают сигналы в другие области мозга, дисфункция этой небольшой области может привести к обширному мозговому нарушению.
Распространение болезни Паркинсона широко варьирует от 82 больных на 100000 человек в Японии и 108 больных на 100000 человек в Великобритании до практически 1% (предположительно 1 миллион) населения Северной Америки. В Индии величина распространения болезни Паркинсона составляет 14 больных на 100000 человек в Северной Индии, 27 больных на 100000 человек в Южной Индии, 16 больных на 100000 человек в Восточной Индии и 363 больных на 100000 человек в общине Парси в Западной Индии. В настоящий момент болезнь Паркинсона считается неизлечимой, но доступен широкий набор медикаментов, которые облегчают симптоматику болезни Паркинсона, к ним относятся леводопа, бромокриптин, перголид, селегилин, антихолинергик и амантадин. Хотя эти лекарства могут облегчать симптомы болезни Паркинсона, зачастую они обладают побочными эффектами. Более того, эти лекарства не оказывают влияния ни на саму болезнь, ни на разрушение нейронов, а только ослабляют симптомы, при этом зачастую со временем положительный эффект ослабляется. Некоторые пациенты становятся менее чувствительными к препаратам, тогда как другие становятся гиперчувствительными и у них развивается дискинезия.
Такие неудовлетворительные результаты привели к разработке других стратегий для лечения этого заболевания, таких как терапия агонистами дофарецепторов и хирургические подходы, которые включают паллидотомию, глубокую стимуляцию мозга (ГСМ) в районе бледного шара и попытки прервать сетевые аномалии с помощью разрушения гиперактивных областей мозга или размещением ГСМ электродов для успокоения этой области. Хотя эти и другие виды хирургии для пациентов с болезнью Паркинсона привели к некоторым положительным результатам, долгосрочные эффекты таких хирургических операций пока не известны. Эти подходы к лечению также имеют некоторые ограничения и побочные эффекты.
Другой стратегией, которая в настоящий момент рассматривается для этого неизлечимого заболевания, является генная терапия. Открытие молекулярной основы неврологического заболевания и достижения в системах переноса генов, позволили целенаправленно и глобально доставлять терапевтические гены при большом количестве расстройств центральной нервной системы. Но генная терапия имеет определенные ограничения, такие как стабильность и регуляция трансгенной экспрессии, и безопасность как вектора, так и экспрессируемых трансгенов (Costantini et al., 2000, Gene Therapy 7:93-109). Векторы, обычно используемые для генной терапии, включают, но ими не ограничиваются вирусом простого герпеса 1 типа (HSV-1) (During et al., 1994, Science 266:1399-1403), аденоассоциированный вирусный вектор (AAV) (During et al., 1998, Gene Therapy 5:820-827), ретровирусы, гибридный вектор HSV/вирус Эпштейна-Барра (HSV/EVB), и HSV/AAV гибридный вектор. Было показано, что подход лечения, связанный с одним геном, может быть эффективным на моделях болезни Паркинсона на животных. Инкапсулированная, генетически сгенерированная клеточная линия выделяла нейропротективную молекулу - ген глиального нейротрофического фактора (GDNF), и лентивирусный вектор, кодирующий ген GDNF, улучшал выживание трансплантата и дифференцировку, таким образом ускоряя восстановление поведения у модельных животных (Zurn et al., 2001, Brain Res Rev. 36:222-229; Date et al., 2001, Cell Transplant 10:397-401). Также было показано, что генная терапия с использованием нейрональных стволовых клеток также эффективна для экспрессии терапевтических доз GDNF in vivo (Akerud et al., 2001. J. Neurosci. 21:8108-8118).
Клеточная имплантация является другим подходом к лечению, который возможно поможет заменить нервные клетки, потерянные при болезни Паркинсона, а также других нейродегенеративных расстройств и нейрональных заболеваний. Благодаря клиническим исследованиям с трансплантацией эмбриональной ткани, находящихся все еще в процессе реализации, были разработаны методы имплантации клеток в мозге и показана возможность этого подхода, а также многообещающие результаты по крайней мере для некоторых пациентов. Также были предприняты некоторые попытки трансплантации предшественниц дофаминергических нервных клеток прямо в полосатое тело пациентов с болезнью Паркинсона, и было показано, что трансплантация человеческих эмбриональных или зародышевых дофаминергических нейронов приводило к положительному эффекту у пациентов с болезнь Паркинсона (Freed et al., 2001, N. Engl. J. Med. 344:710- 719). На основании этих данных было сделано предположение, что для полного восстановления необходима анатомическая замена путей, а не эктопическое помещение трансплантата (Winkler et al., 2000, Prog. Brain Res. 127:233-265). Кроме того, для трансплантации эмбрионального черного вещества и получения клинически достоверного улучшения у пациентов необходимы эмбриональные ткани человека по крайней мере от 5-10 утробных плодов, что связано с огромными этическими, юридическими проблемами и проблемами безопасности. Таким образом, в настоящее время остро необходимы альтернативные источники нейрональных клеток, таких как дофаминергических нейронов для лечения нейродегенеративных расстройств и нейрональных заболеваний.
Недавно было обнаружено, что в мозге взрослого человека имеется возобновляемый источник нервных стволовых клеток. Нервные стволовые клетки со способностью возобновлять сами себя и образовывать все типы клеток мозга являются потенциально неограниченным источником клеток мозга, продуцирующих дофамин, обеспечивая, такие образом, полностью новый терапевтический подход к нейродегенеративным расстройствам и неврологическим заболеваниям (Eriksson et al., 1998, Nature Medicine 4:1313-1317). Сообщалось, что культуры нервных стволовых клеток, полученных из переднего мозга человеческого эмбриона, могут быть увеличены до десяти миллионов раз in vitro. Эти взрослые нервные стволовые клетки были трансплантированы во взрослых крыс, обладающих ярко выраженной моделью болезни Паркинсона. Клетки в этих животных моделях выживали вплоть до года после трансплантации, дифференцировались в нейроны и были способны уменьшить нарушение моторики у некоторых экспериментальных животных (Svendsen et al., 1997, Exp. Neurol. 148:135-146). К сожалению, взрослые нервные стволовые клетки имеют ограниченную продолжительность жизни в культуре ткани (Kukekov et al., 1999, Exp. Neurol. 156:333-344).
Одним жизнеспособным альтернативным источником дофаминергических нейронов и других нейронов, которые могут быть использованы для лечения различных нейродегенеративных расстройств и нейрональных заболеваний, являются плюрипотентные эмбриональные стволовые (ЭС) клетки, в особенности человеческие ЭС клетки. ЭС клетки могут пролиферировать бесконечно в недифференцированном состоянии и являются плюрипотентными, что означает, что они способны дифференцироваться практически во все типы клеток, присутствующих в организме. Так как ЭС клетки способны становиться практически всеми специализированными клетками тела, они вероятно могут использоваться для получения замещающих клеток для большого множества тканей и органов, таких как сердце, поджелудочная железа, нервная ткань, мускулы, хрящ и тому подобное. ЭС клетки могут быть получены из внутренней клеточной массы (ВКМ) бластоциста, являющегося стадией эмбрионального развития, которая происходит до имплантации. Человеческие ЭС клетки могут быть получены из человеческого бластоциста на ранних стадиях эмбрионального развития, длящегося от 4- до 7-го дня после оплодотворения. ЭС клетки, полученные из ВКМ, можно культивировать in vitro и при подходящих условиях пролиферировать бесконечно.
ЭС клеточная линия была успешно получена для некоторых видов, включая мышей (Evans et al., 1981, Nature 292:154-156), крыс (Iannaccone et al., 1994, Dev. Biol., 163:288-292), свиней (Evans et al., 1990, Theriogenology 33:125-128; Notarianni et al., 1990, J. Reprod. Fertil. Suppl. 41:51-6), овец и коз (Meinecke-Tillmann и Meinecke, 1996, J. Animal Breeding and Genetics 113:413-426; Notarianni et al., 1991, J. Reprod. Fertil. Suppl. 43:255-60), кроликов (Giles et al., 1993, Mol. Reprod. Dev. 36:130-138; Graves et al., 1993, Mol. Reprod. Dev. 36:424-433), норок (Sukoyan et al., Mol. Reprod. Dev. 1992, 33:418-431), хомяков (Doetschman et al., 1988, Dev. Biol. 127:224-227), домашних птиц (Pain et al., 1996, Development 122(8):2339-48), приматов (патент США № 5843780) и человека (Thomson et al., 1998, Science 282:1145-1147; Reubinoff et al., 2000, Nature Biotech. 18:399-403). Как и другие ЭС клетки млекопитающих, человеческие ЭС клетки дифференцируются и образуют ткани всех трех зародышевых листков при введении иммунодефицитным мышам, обеспечивая их плюрипотентность. Опубликованные данные показывают, что человеческие ЭС клетки, поддерживаемые в культуре в течение более одного года, сохраняли свою плюрипотентность, способность самовозобновляться и нормальный кариотип (Thomson et. al., 1995, PNAS 92:7844-7848).
Исследования показали, что ЭС клетки могут дифференцироваться в нейрональные клетки-предшественницы (Zhang et al., 2001, Nature Biotech. 19:1129-33; WO 01/88104; США № 09/872,183, 09/888,309, 10/157,288; WO 03/000868; каждый конкретно приведенный здесь в качестве ссылки). Эти клетки затем могут дополнительно дифференцироваться в дофаминергические нейроны (Rolletschek et al., 2001, Mech. Dev. 105:93-104). Первоначальным шагом в дифференцировке ЭС клеток может быть образование эмбриоидных тел, например, 1 мкМ ретиноидной кислоты способствует нейрональной дифференцировке в эмбриоидные тела (Bain et al., 1995, Dev. Biol. 168:342-357). Тогда как ретиноидная кислота может быть использована для получения нервных клеток, ретиноидная кислота является сильным тератогеном. В некоторых отчетах была опубликована информация о том, что ЭС клетки могут дифференцироваться в дофаминергические нейроны благодаря индуцирующей активности стромальных клеток (SIDA) (Kawasaki et al., 2000, Neuron 28:1-20), путем экспрессии гена ядерного рецептора 1 (Nurr-1) (Kim et al., 2002, Nature 418:50-56) или путем трансплантации недифференцированных ЭС клеток непосредственно в мышиную модель (Bjorklund et al., 2002, Proc. Natl Acad. Sci. 99:2344-2349). Lee et al. (2000, Nat. Biotechnol. 18:675-79) сообщил о методе дифференцировки ЭС клеток в клетки-предшественницы нейронов и в дофаминергические и серотонинергические нейроны in vitro. Все эти эксперименты, однако, были проведены с использованием ЭС клеток мышей, и в протоколах выход дифференцировки дофаминергических нейронов изменялся в пределах от 5 до 50%. Около 20% ЭС клеток мышей развивались в дофаминергические нейроны в исследовании Lee et al. (WO 01/83715) и 5-50% в исследовании Studer et al. (WO 02/086073). Были получены данные о том, что несмотря на то, что дофаминергические нейроны также дифференцировались из ЭС клеток человека, выход дофаминергических нейронов составлял лишь 5-7% от всей клеточной популяции (WO 03/000868).
Полагают, что при болезни Паркинсона особенно удобным клиническим подходом может быть трансплантация клеток, поскольку болезнь характеризуется селективной и постепенной потерей дофаминергических нейронов в субстанции нигра среднего мозга. Потеря дофаминпродуцирующих нейронов в этой конкретной области мозга приводит к патологической активации нервных клеток, что приводит к неспособности пациентов контролировать или направлять движения. Но для клеточно-заместительной терапии необходимо большое количество дофаминергических нейронов. Поэтому необходимы альтернативные способы более эффективного получения дофаминергических нейронов из ЭС клеток человека, которые позволят как ускорить доступность этого лечения болезни Паркинсона, так и увеличить вероятность успешного лечения. Кроме того, эти дофаминергические нейроны могут быть использованы in vitro для определения веществ, которые предотвратят или уменьшат смертность клеток мозга, продуцирующих дофамин при нейродегенеративных расстройствах и нейрональных заболеваниях.
КРАТКАЯ СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к улучшенным способам получения нейрональных клеток-предшественниц, а также терминально дифференцированных нейронов из плюрипотентных стволовых клеток, таких как эмбриональные стволовые клетки человека. Например, в настоящем описании показано, что популяция эмбриональных стволовых клеток человека может дифференцироваться с высоким количественным выходом в нейроны позитивные для тирозингидроксилазы (ТН), которая является специфическим маркером для дофаминергических нейронов (например, по крайней мере около 60%). В настоящем описании также показано, что популяция эмбриональных стволовых клеток человека может дифференцироваться с высоким количественным выходом в серотонинергические нейроны. Процент дофаминергических и серотонинергических нейронов, полученных в соответствии со способами настоящего изобретения, выше по сравнению со способами, описанными ранее. Способы, описанные здесь, могут также использоваться для получения клеток с фенотипическими характеристиками холинергических и сенсорных нейронов, а также астроцитов и олигодендроцитов из эмбриональных стволовых клеток человека.
Благодаря настоящему изобретению можно получить дифференцированную клеточную популяцию в культуре in vitro путем дифференцирующихся плюрипотентных стволовых клеток приматов, где по крайней мере 60% дифференцированных клеток являются дофаминергическими нейронами, экспрессируют тирозингидроксилазу, или являются дофаминергическими нейронами, которые экспрессируют тирозингидроксилазу. В другом варианте осуществления по крайней мере около 30, 40, 50, 70, 80, 90, 95 или 99% дифференцированных клеток являются дофаминергическими нейронами. Благодаря настоящему изобретению можно получить также дифференцированную клеточную популяцию в культуре in vitro путем дифференцировки плюрипотентных стволовых клеток приматов, где по крайней мере 30% дифференцированных клеток являются серотонинергическими нейронами. В другом варианте осуществления по крайней мере около 40, 50, 60, 70, 80, 90, 95 или 99% дифференцированных клеток являются серотонинергическими нейронами. В предпочтительном варианте осуществления плюрипотентные стволовые клетки приматов, дифференцированные в клетки-предшественницы нейронов или нейроны, являются эмбриональными стволовыми клетками человека.
В настоящем описании представлены также способы получения дифференцированных нейрональных клеточных популяций из плюрипотентных стволовых клеток приматов, предусматривающие следующие стадии:
(а) увеличение культуры плюрипотентных стволовых клеток приматов;
(b) культивирование плюрипотентных стволовых клеток для селекции нейрональных нестин-положительных клеток-предшественниц;
(с) сортировку нестин-положительных нейрональных клеток-предшественниц для увеличения NCAM-положительных клеток;
(d) дифференцировку нестин-положительных, NCAM-положительных клеток для получения дифференцированной нейрональной клеточной популяции путем культивирования клеток в среде для дифференцировки.
В предпочтительном варианте осуществления плюрипотентные стволовые клетки приматов являются человеческими эмбриональными стволовыми клетками. В другом предпочтительном варианте осуществления плюрипотентные стволовые клетки, использованные в приведенных выше способах, предпочтительно получают с помощью способа лазерного разрушения.
В другом варианте осуществления вышеуказанные способы предусматривают также стадию культивирования плюрипотентных стволовых клеток в стадии (b) с образованием эмбриоидных тел. Предпочтительно, эти эмбриоидные тела культивируют в условиях, которые выбраны для нейрональных нестин-положительных клеток-предшественниц, например, путем культивирования плюрипотентных стволовых клеток или эмбриоидных тел в среде без сыворотки. В предпочтительном варианте осуществления средой, не содержащей сыворотку, является безсывороточная среда ITSFn, которая предпочтительно включает один или несколько растворимых факторов, выбранных из группы, включающей инсулин, селенит натрия, основной фактор роста фибробластов, трансферрин и фибронектин. В предпочтительном варианте осуществления на основании этих способов можно получить нейрональные клетки-предшественницы, которые предпочтительно включают по крайней мере около 60-75% нестин-положительных клеток, более предпочтительно около 80-90% нестин-положительных клеток и наиболее предпочтительно около 95-99% нестин-положительных клеток.
Нестин-положительные нейрональные клетки-предшественницы затем могут быть отсортированы с получением обогащения NCAM-положительными клетками, используя подходящие иммунологические методы, такие как сортировка иммуномечением и флуоресцентная сортировка, например, магнитоактивируемая клеточная сортировка (MACS), адсорбция на твердой фазе, флуоресцентно-активируемая клеточная сортировка (FACS), проточная иммуноцитохимия для клеточных маркеров или проточный цитометрический анализ. В предпочтительном варианте осуществления эти методы дают нестин-положительные клетки, которые предпочтительно включают по крайней мере около 40-70% NCAM-положительных клеток, более предпочтительно около 50-60% NCAM-положительных клеток и наиболее предпочтительно около 80-99% NCAM-положительных клеток. В конкретном варианте осуществления указанные выше способы также предусматривают стадию роста нестин-положительных, NCAM-положительных нейрональных клеток-предшественниц стадии (с) в среде для роста предпочтительно в течение 6-10 дней. Предпочтительно, чтобы среда для роста содержала один или несколько растворимых факторов, выбранных из группы, включающей инсулин, селенит натрия, трансферрин, ламинит, путресцин, прогестерон, основной фактор роста фибробластов (bFGF), эпидермальный фактор роста (EGF), "звуковой ежик" (SHH), фактор роста фибробластов-8 (FGF-8) и мозговой нейротрофический фактор (BDNF).
Для удвоения или большего увеличения популяции предпочтительно, чтобы нестин-положительные, NCAM-положительные нейрональные клетки-предшественницы росли в культуре и их периодически пассировали. Эти клетки также могут быть заморожены в жидком азоте. NCAM-положительные нейрональные клетки-предшественницы предпочтительно выращивать в среде для дифференцировки в течение 30-50 дней, как указано в четвертой стадии (d) указанных выше способов. В предпочтительном варианте осуществления среда для дифференцировки включает нейробазальную среду с добавлением эмбриональной сыворотки теленка, В27, аскорбиновую кислоту и N-ацетилцистеин. В другом предпочтительном варианте осуществления среда для дифференцировки может содержать TGF-β3, или интерлейкин-1β, или оба этих факта. Предпочтительно среда для дифференцировки также включает один или несколько агентов для дифференцировки выбранных из группы, включающей аскорбиновую кислоту, N-ацетилцистеин, глиальный нейротрофический фактор (GDNF), дибутирил-цикло АМР (db-cAMP), нейротрофический мозговой фактор (BDNF), неутурин, белок "звуковой ежик" (SHH), фактор роста фибробластов-8 (FGF-8).
В предпочтительных вариантах осуществления способы, описанные выше, используются для получения дифференцированной нейрональной клеточной популяции, которая предпочтительно содержит около 40-60% дофаминергических нейронов, более предпочтительно около 70-80% дофаминергических нейронов и наиболее предпочтительно около 90-99% дофаминергических нейронов. В определенном варианте осуществления эти способы применяют для получения дифференцированных нейрональных клеточных популяций, которые предпочтительно включают около 20-50% серотонинергических нейронов, более предпочтительно около 30-70% серотонинергических нейронов и наиболее предпочтительно около 60-99% серотонинергических нейронов. В другом варианте осуществления эти способы применяют для получения дифференцированной нейрональной клеточной популяции, которая предпочтительно включает около 15-40% олигодендроцитов, более предпочтительно около 25-50% олигодендроцитов и наиболее предпочтительно около 60-99% олигодендроцитов.
Настоящее изобретение относится к способам получения дофаминергических нейронов из нейрональных клеток-предшественниц, предусматривающим обогащение нейрональных клеток-предшественниц нестин-положительными клетками, дифференцировку нестин-положительных клеток для получения дофаминергических нейронов путем культивирования клеток в присутствии TGF-β3, или интерлейкина-1β, или обоих этих факторов. Предпочтительно по крайней мере около 40-99% нестин-положительных клеток дифференцируются в дофаминергические нейроны в соответствии с этими методами. В другом варианте осуществления эти способы также предусматривают обогащение нейрональных клеток-предшественниц NCAM-положительными клетками, и эти нестин-положительные, NCAM-положительные клетки предпочтительно дифференцируются с получением дофаминергических нейронов (например, по крайней мере около 60-99% клеток дифференцируются в дофаминергические нейроны). Настоящее изобретение также относится к способам получения нейронов из нейрональных клеток-предшественниц, которые предусматривают обогащение нейрональных клеток-предшественниц клетками, которые являются положительными по нестину и NCAM, и дифференцировку нестин-положительных, NCAM-положительных клеток с получением серотонинергических нейронов путем культивирования клеток в присутствии TGF-β3, или интерлейкина-1β, или обоих этих факторов. Предпочтительно по крайней мере около 30-99% нестин-положительных, NCAM-положительных клеток дифференцируется в серотонинергические нейроны в соответствии с этими способами.
Настоящее изобретение также относится к способам лечения индивидуумов с нейродегенеративными нарушениями или неврологическими заболеваниями путем введения индивидуумам дифференцированных нервных клеток, полученных из плюрипотентных стволовых клеток приматов, как описано здесь. Например, популяция дифференцированных нейрональных клеток может быть получена следующим образом:
(а) увеличением культуры плюрипотентных стволовых клеток приматов;
(b) культивированием плюрипотентных стволовых клеток с отбором нейрональных клеток-предшественниц, которые положительны по нестину;
(с) сортировкой нестин-положительных нейрональных клеток-предшественниц с обогащением NCAM-положительными клетками;
(d) дифференцировкой нестин-положительных, NCAM-положительных клеток с получением дифференцированной популяции нервных клеток путем культивирования клеток в среде для дифференцировки;
(е) введением терапевтически эффективных количеств популяции дифференцированных нервных клеток в центральную нервную систему пациента.
Предпочтительно среда для дифференцировки включает TGF-β3, или интерлейкин-1, или оба этих фактора. В предпочтительном варианте осуществления, индивидуумом является пациент, более предпочтительно пациентом является человек, и плюрипотентные стволовые клетки приматов являются эмбриональными стволовыми клетками человека. Предпочтительно, человеческие эмбриональные стволовые клетки гистосовместимы с пациентом, например, используемые плюрипотентные стволовые клетки содержат геном, по существу идентичный геному пациента. В конкретном варианте осуществления дофаминергические, серотонинергические, холинергические или сенсорные нейроны или же астроциты или олигодендроциты выделяют из дифференцированной популяции нервных клеток и вводят пациенту. Эти клетки, включая дифференцированную популяцию нервных клеток, могут вводиться индивидууму для лечения различных нейродегенеративных расстройств или неврологических заболеваний, включая, но не ими ограничиваясь, болезни ЦНС, болезнь Паркинсона, болезнь Альцгеймера, хорею Гентингтона, повреждение спинного мозга, боковой амиотрофический склероз (БАС), эпилепсию, инсульт и ишемию. Предпочтительно, клетки вводятся путем трансплантации, например трансплантации желаемых клеток в мозг индивидуума.
В другом варианте осуществления дифференцированные нервные клетки, полученные из плюрипотентной стволовой клетки, как описано здесь, могут быть использованы для скрининга соединений, например, небольших молекул и лекарств, для определения их влияния на дифференцированные нервные клетки или активность этих клеток. Соединения могут быть также оценены на их токсичность в отношении нервных клеток или на способность их модулировать. Соединение может быть оценено путем добавления соединения к популяции дифференцированных нервных клеток и сравнением их выживания, морфологии, фенотипа, функциональной активности или других характеристик клеток по сравнению с дифференцированными нервными клетками, культивируемыми в тех же условиях, но не обработанными соединением. Например, соединения могут быть проскринированы для определения изменения синтеза нейромедиаторов, высвобождения или захвата клетками.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Следующие чертежи составляют часть настоящего описания и приведены здесь для дополнительной демонстрации некоторых аспектов настоящего изобретения, которое может быть лучше понято при отсылке на один или несколько из этих рисунков в сочетании с подробным описанием конкретных вариантов осуществлений, представленных здесь.
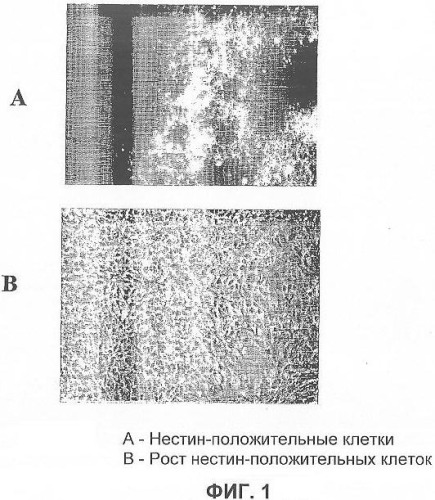
На фигуре 1 показаны нейрональные клетки-предшественницы, полученные из эмбриональной стволовой клетки человека, которые положительны по нестину: на (А) показаны нервные клетки-предшественницы, которые являются иммунореактивными с маркерами нестина; на (B) показана фазово-контрастная фотография нестин-положительных клеток, которые росли в среде без добавления сыворотки в присутствии выбранных факторов роста.
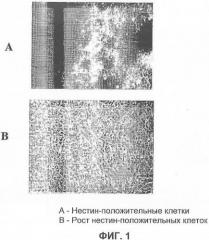
На фигуре 2 показан FACS анализ нестин-положительных клеток, полученных из эмбриональных стволовых клеток человека и меченных NCAM-FITC: на (A) представлен анализ немеченых клеток, которые были обработаны антикроличьими антителами, меченными FITC; на (B) показан анализ клеток, обработанных первичными антителами к NCAM, и меченных антикроличьими антителами с FITC (вторичное антитело). В этом исследовании около 50-60% нестин-положительных клеток были иммуноположительными для NCAM.
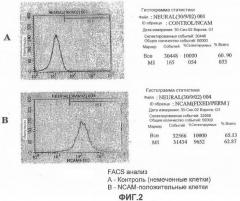
На фигурах 3А и 3В представлены флуоресцентные микрофотографии NCAM-положительных клеток, полученных из эмбриональных стволовых клеток человека, которые были отсортированы с использованием MACS и пересажены на чашку с культурой ткани.
На фигурах 4А и 4В представлены флуоресцентные микрофотографии нейронов, меченных MAP-2 и β-тубулином, полученных из эмбриональных стволовых клеток человека.
На фигуре 5 показано наличие нейронов, положительных для тирозингидроксилазы (TH): (А) иммунофлуоресцентный анализ показал, что около 60% нейронов были положительными для TH в обогащенной c использованием MACS популяции NCAM-положительных клеток; (В) иммунофлуоресцентный анализ показал, что около 40% нейронов были положительными для TH после размножения и дифференцировки несортированных нестин-положительных клеток.
На фигуре 6 представлена характерная флуоресцентная микрофотография олигодендроцитов. Иммунофлуоресцентный анализ показал, что приблизительно 25-30% выделенных нестин-положительных клеток окрашивались как олигодендроциты.
На фигуре 7 представлена флуоресцентная микрофотография нервных клеток, экспрессирующих нейромедиатор серотонин. Предположительно 30% нестин-положительных клеток, а также предположительно 20% NCAM-положительных, были иммунореактивными с серотонином.
На фигуре 8 представлена флуоресцентная микрофотография дофаминергических нейронов иммуномеченных TH (зеленый) и другим специфическим для нейронов антигеном (красный): солокализация ТН с (А) β-тубулином; (В) МАР-2; (С) Nurr1 и (D) DAT.
На фигуре 9 представлена столбчатая диаграмма, показывающая процент МАР-2 положительных нейронов, положительных в отношении ТН (дофаминергические нейроны): как видно, процент нейронов положительных по ТН увеличивается на протяжении 7, 22 и 37 дня дальнейшей дифференцировки.
На фигуре 10 представлена столбчатая диаграмма, показывающая количественный анализ различных нейрональных клеточных популяций в NCAM-положительных обогащенных клетках: приблизительно 60% NCAM-положительных клеток были также иммуноположительными к ТН; приблизительно 30% были иммуноположительными к серотонину и приблизительно 15% были иммуноположительными по ГАМК и глутамату.
На фигуре 11 представлена столбчатая диаграмма, показывающая количественный анализ различных нейрональных клеточных популяций после роста и дифференцировки нестин-положительных клеток, анализируемых с помощью иммунофлуоресценции: приблизительно 40% нестин-положительных клеток были иммуноположительными к ТН; приблизительно 30% были иммуноположительными к серотонину; приблизительно 28% были иммуноположительными к олигодендроцитам и приблизительно 2% были иммуноположительными к глиальному фибриллярному кислому белку (GFAP, маркер для астроцитов).
На фигуре 12 представлен профиль генетической экспрессии эмбриональных стволовых клеток человека в течение терминальной дифференцировки этих клеток in vitro в условиях, описанных в примере 1: UD = недифференцированные; EB = эмбриоидные тела; NS = нестин-положительные клетки; NE = нестин увеличенные клетки; и оставшееся время указывает число дней культивирования клеток в нейробазальной среде и выбранных факторов роста, как описано в примере 1. Факторы транскрипции, специфичные для дофаминергических нейронов, таких как Nurr1, En-1, D2RL, экспрессируются в течение ранних стадий дифференцировки. Экспрессия гена ТН, специфичного для дофаминергического нейрона, наблюдалась на всех стадиях, за исключением недифференцированных стволовых клеток. Отсутствие любой экспрессии DBH подтверждает фенотип этих клеток (среднего мозга), характерный для среднего мозга.
На фигуре 13 показан внутриклеточный уровень дофамина в клеточных лизатах, определенный с помощью ОФ-ВЭЖХ на 7, 22 и 37 день дифференцировки. В присутствии факторов роста уровень дофамина был значительно выше (4-6 мкг/мл), чем в их отсутствие (1-4 мкг/мл). Дофамин не был обнаружен в клетках, обработанных MPTP, на 7, 22 дни, тогда как на 37 день уровень дофамина был пониженным.
На фигуре 14 представлена столбчатая диаграмма, демонстрирующая, что KCl вызывает высвобождение дофамина в культуре дифференцированных клеток в кондиционированной среде после 7, 22 и 37 дня дифференцировки. Клетки были стимулированы 56 мМ KCl в течение 15 минут с индукцией секреции дофамина, супернатант культуры стабилизировали 7,5% ортофосфорной кислотой и пиросульфитом натрия перед проведением анализа ОФ-ВЭЖХ.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам эффективного получения клеток нейрональной линии, которые дифференцируются из плюрипотентной стволовой клетки. Клетки, полученные здесь, включают, но ими не ограничиваются, клетками с фенотипическими признаками нейрональных клеток-предшественниц, дофаминергических, серотонинергических, холинергических и сенсорных нейронов, а также астроцитов и олигодендроцитов. Клетки, полученные здесь, идентифицируют с помощью фенотипических признаков, морфологических признаков и/или клеточных маркеров, которые хорошо известны специалисту в данной области. Как используется здесь, термин «нейрональная клетка-предшественница» является взаимозаменяемым с термином «клетка-предшественница нейрона» и относится к клетке, которая может образовывать предков, которые являются либо нейрональными клетками, такими как нейрональные предшественницы или нейроны, либо глиальными клетками, такими как глиальные предшественницы, астроциты или олигодендроциты. Способы, описанные здесь, предусматривают культивирование клеток в сочетании с растворимыми факторами и условиями культивирования, которые способствуют дифференцировке клеток в клетки нейрональной линии. Кроме того, для еще большего обогащения желаемыми клетками нейронального типа могут быть использованы методы физического разделения или манипуляции.
Эти предшественницы и дифференцированные нейрональные клетки могут использоваться для различных применений, включая терапевтическое и экспериментальное применение, а также при разработке лекарств in vitro и скрининга, такого как скрининг соединений, являющихся токсичными для клетки или способных модулировать функцию нейрональных клеток. Получение предшественниц и дифференцированных нейрональных клеток, таких как дофаминергических или серотонинергических нейронов, а также других специализированных нейрональных клеточных типов из плюрипотентной стволовой клетки, является, по сути, неограниченным источником этих клеток с огромным возможным положительным эффектом для людей, страдающих разрушающими нейродегенеративными нарушениями и неврологическими заболеваниями. Предшественник и дифференцированные нервн