Гематопоэтические стволовые клетки и способы лечения неоваскулярных заболеваний глаз с их помощью
Иллюстрации
Показать всеИзобретение относится к области медицины и касается гематопоэтических стволовых клеток и способов лечения неоваскулярных заболеваний глаз с их помощью. Сущность изобретения включает выделенную популяцию гемапоэтических стволовых клеток негативной линии дифференцировки (Lin- HSC), содержащую эндотелиальные клетки-предшественники (ЕРС), способные защищать кровеносные сосуды сетчатки и нейрональные сети глаза, способ выделения из костного мозга взрослой особи млекопитающего популяции гематопоэтических стволовых клеток негативной линии дифференцировки, при этом приблизительно 20% клеток в выделенных Lin- HSC экспрессируют антиген клеточной поверхности CD31. Преимущество изобретения заключается в том, что выделенные популяции Lin- HSC могут использоваться для лечения сосудистых заболеваний глаз. 8 н. и 14 з.п. ф-лы, 24 ил., 2 табл.
Реферат
Перекрестные ссылки на родственные заявки
Данная заявка является частичным продолжением заявки США на патент с серийным No. 10/628783, поданной 25 июля 2003 г., приоритетом для формулы изобретения которой является предварительная заявка на патент с серийным No. 60/398522, поданная 25 июля 2002 г., и предварительная заявка на патент с серийным No. 60/467051, поданная 2 мая 2003 г., полное описание которых приведено здесь в качестве ссылки.
Заявление о правительственных интересах
Часть описанной здесь работы была осуществлена при поддержке грантом номер CA92577 Национального института рака и грантами номер EY11254, EY12598 и EY125998 Национальных институтов здоровья. Правительство Соединенных штатов имеет определенные права на настоящее изобретение.
Область техники, к которой относится изобретение
Это изобретение относится к выделенным популяциям гематопоэтических стволовых клеток млекопитающих негативной линии дифференцировки (Lin- HSC), полученным из костного мозга, и к их применению. Более конкретно, изобретение относится к выделенным популяциям гематопоэтических стволовых клеток млекопитающих негативной линии дифференцировки (Lin- HSC), содержащим клетки-предшественники эндотелия (EPC). Изобретение также относится к лечению сосудистых заболеваний глаза путем введения популяций Lin- HSC и трансфецированных Lin- HSC в глаз.
Известный уровень техники
Наследуемая дегенерация сетчатки поражает 1 из 3500 индивидуумов и характеризуется прогрессирующей ночной слепотой, потерей полей зрения, атрофией зрительного нерва, артериолярным истощением, измененной сосудистой проницаемостью и центральной потерей зрения, часто прогрессирующей до полной слепоты (Heckenlively, J. R., editor, 1988; Retinitis Pigmentosa, Philadelphia: JB Lippincott Co.). Молекулярно-генетический анализ таких заболеваний выявил мутации в более 110 различных генах, ответственных только за относительно небольшой процент известных поражений у индивидуумов (Humphries et al., 1992, Science 256:804-808; Farrar et al. 2002, EMBO J. 21:857-864.). Многие из этих мутаций связаны с ферментативными и структурными компонентами механизма передачи фотосигнала, включая родопсин, фосфодиэстеразу цГМФ, периферин rds и RPE65. Несмотря на такие наблюдения, все еще нет эффективного лечения для замедления или обращения прогрессии дегенеративных заболеваний сетчатки. Последние достижения в генной терапии привели к успешной трансформации фенотипов rds (Ali et al. 2000, Nat. Genet. 25:306-310) и rd (Takahashi et al. 1999, J. Virol. 73:7812-7816) у мышей и фенотипа RPE65 у собак (Acland et al. 2001, Nat. Genet. 28:92-95) при доставке трансгена дикого типа к фоторецепторам или пигментированному эпителию сетчатки (RPE) у животных с конкретной мутацией.
Связанная с возрастом дегенерация желтого пятна (ARMD) и диабетическая ретинопатия (DR) являются основными причинами потери зрения у индустриально развитых народов, и их возникновение связано с аномальной неоваскуляризацией сетчатки. Так как сетчатка состоит из хорошо определяемых слоев нервных, глиальных и сосудистых элементов, относительно небольшие изменения, такие как наблюдаемые при пролиферации сосудов или отеке, могут привести к существенной потере зрительной функции. Наследуемая дегенерация сетчатки, такая как пигментозный ретинит (RP), также связана с аномалиями сосудов, такими как сужение артериол и атрофия сосудов. Несмотря на то, что был достигнут существенный прогресс в идентификации факторов, которые стимулируют или ингибируют ангиогенез, в настоящее время в распоряжении не имеется способа специфического лечения сосудистого заболевания глаза.
В течение многих лет было известно, что популяция стволовых клеток существует в системной циркуляции и в костном мозге нормального взрослого индивидуума. Различные субпопуляции данных клеток могут дифференцироваться в сторону гематопоэтической линии по направлениям позитивной линии (Lin+) или негативной линии (Lin-) дифференцировки. Более того, популяция гематопоэтических стволовых клеток (HSC) негативной линии, как было показано недавно, содержит эндотелиальные клетки-предшественники, способные образовывать кровеносные сосуды in vitro и in vivo (Смотри, Asahara et al. 1997, Science 275: 964-7). Данные клетки могут участвовать в нормальном и патологическом постнатальном ангиогенезе (Смотри, Lyden et al. 2001 Nat. Med. 7, 1194-201; Kalka et al. 2000, Proc. Natl. Acad. Sci. U. S. A. 97:3422-7 и Kocher et al. 2001, Nat. Med. 7: 430-6), а также дифференцироваться в различные не эндотелиальные типы клеток, включая гепатоциты (Смотри, Lagasse et al. 2000, Nat. Med. 6:1229-34), микроглию (Смотри, Priller et al. 2002 Nat. Med. 7:1356-61), кардиомиоциты (Смотри, Orlic et al. 2001, Proc. Natl. Acad. Sci. U. S. A. 98:10344-9) и эпителий (Смотри, Lyden et al. 2001, Nat. Med. 7:1194-1201). Хотя данные клетки применяли в различных экспериментальных моделях ангиогенеза, механизм направленной доставки EPC к месту неоваскуляризации не известен и не разработана стратегия, которая будет эффективно увеличивать количество клеток, которые вносят вклад в индивидуальное образование сосудистой сети.
Гематопоэтические стволовые клетки костного мозга являются в настоящее время единственным типом стволовых клеток, обычно применяемым для терапевтического использования. HSC костного мозга применяли в трансплантатах в течение более 40 лет. В настоящее время исследуются усовершенствованные способы сбора очищенных стволовых клеток для разработки способов лечения лейкоза, лимфомы и наследуемых заболеваний крови. Исследуется клиническое применение стволовых клеток у человека для лечения диабета и прогрессирующего рака почки у ограниченного числа больных людей.
Краткое изложение существа изобретения
Настоящее изобретение относится к выделенной популяции гематопоэтических стволовых клеток млекопитающих (HSC), которые не экспрессируют на своей поверхности поверхностные антигены линий дифференцировки (Lin), т.е. к гематопоэтическим стволовым клеткам негативной линии дифференцировки (Lin- HSC). Популяции Lin- HSC по настоящему изобретению включают клетки-предшественники эндотелия (EPC), также известные как эндотелиальные клетки-предшественники, которые избирательно направляются к активированным астроцитам сетчатки при введении в стекловидное тело глаза. Lin- HSC по настоящему изобретению, предпочтительно, происходят из костного мозга взрослых млекопитающих, более предпочтительно, из костного мозга взрослых людей.
В предпочтительном варианте осуществления популяции Lin- HSC по настоящему изобретению выделяют путем экстрагирования костного мозга из взрослой особи млекопитающего; отделения множества моноцитов из костного мозга; мечения моноцитов набором конъюгированных с биотином антител для линий дифференцировки против одного или более поверхностных антигенов линий дифференцировки; удаления моноцитов, которые являются позитивными в отношении поверхностных антигенов линий дифференцировки; и затем получения популяции Lin- HSC, содержащей EPC. Предпочтительно, моноциты метят набором конъюгированных с биотином антител линий дифференцировки против одного или более поверхностных антигенов, выбранных из группы, состоящей из CD2, CD3, CD4, CD11, CD11a, Mac-1, CD14, CD16, CD19, CD24, CD33, CD36, CD38, CD45, Ly-6G, TER-119, CD45RA, CD56, CD64, CD68, CD86, CD66b, HLA-DR и CD235a (гликофорин A) линий дифференцировки. Предпочтительно, по меньшей мере приблизительно, 20% клеток выделенной популяции Lin- HSC по настоящему изобретению экспрессирует поверхностный антиген CD31.
EPC в популяции Lin- HSC по настоящему изобретению экстенсивно включаются в развивающиеся сосуды сетчатки и остаются стабильно включенными во вновь образованную сосудистую сеть глаза. После выделения, популяции Lin- HSC по настоящему изобретению могут быть использованы для защиты и стабилизации дегенерирующей сосудистой сети сетчатки у млекопитающих, защиты нейрональных сетей и способствования восстановления ишемической ткани.
В одном из предпочтительных вариантов осуществления клетки выделенных популяций Lin- HSC трансфецируют терапевтически эффективным геном. Например, клетки могут быть трансфецированы полинуклеотидами, которые операбельно кодируют нейротрофические агенты или антиангиогенные агенты, которые селективно направлены на неоваскуляризацию и ингибируют образование новых сосудов, не влияя на уже образованные сосуды, при генной терапии на основе клеток. В одном варианте осуществления популяции Lin- HSC по настоящему изобретению после выделения включают ген, кодирующий пептид, ингибирующий ангиогенез. Ингибирующие ангиогенез Lin- HSC могут использоваться для модуляции аномального роста кровеносных сосудов при таких заболеваниях как ARMD, DR и определенные типы дегенерации сетчатки, связанные с аномальной васкуляризацией. В другом предпочтительном варианте осуществления Lin- HSC по настоящему изобретению после выделения включают ген, кодирующий нейротрофический пептид. Нейротрофические Lin- HSC пригодны для содействия защиты нейронов при заболеваниях глаз, при которых происходит дегенерация нейронов сетчатки, таких как глаукома, пигментозный ретинит и тому подобное.
Особым преимуществом лечения глазных заболеваний выделенными популяциями Lin- HSC по настоящему изобретению является васкулотрофический и нейротрофический эффекты для глаз при введении Lin- HSC в стекловидное тело. При лечении выделенными Lin- HSC по изобретению обеспечивается защита нейронов сетчатки и фоторецепторов и поддерживается функция зрения в глазах. В настоящем изобретении предлагается способ лечения дегенерации сетчатки, предусматривающий введение выделенных клеток Lin- HSC, полученных из костного мозга, которые содержат эндотелиальные клетки-предшественники, избирательно направленные на активированные астроциты сетчатки, где, по меньшей мере, 50% выделенных Lin- HSC экспрессирует поверхностный антиген CD31 и по меньшей мере 50% выделенных Lin- HSC экспрессирует поверхностный антиген CD117 (c-kit).
Настоящее изобретение также относится к способу выделения популяций гематопоэтических стволовых клеток негативной линии дифференцировки, содержащих эндотелиальные клетки-предшественники, из костного мозга взрослых млекопитающих, предпочтительно, из костного мозга взрослых людей. Кроме того, из Lin- HSC может быть создана линия генетически идентичных клеток (т.е. клонов), которая пригодна для регенеративной и репаративной терапии сосудов сетчатки, а также для лечения дегенерации нервной ткани сетчатки или улучшения ее состояния.
Краткое описание фигур
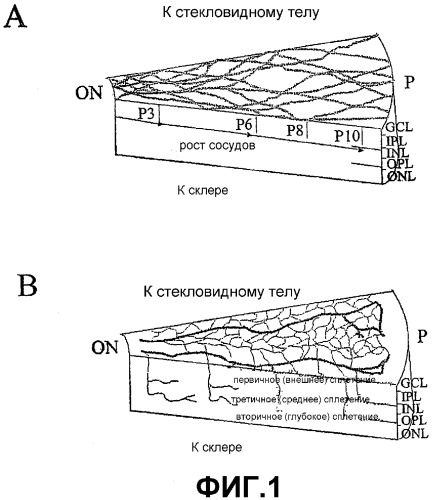
На фигуре 1 (a и b) изображены схематические диаграммы развивающейся сетчатки мыши. (a) Развитие первичного сплетения. (b) Вторая фаза образования сосудов сетчатки. GGL, слой клеток ганглиев; IPL, внутренний слой сплетения; INL, внутренний ядерный слой; OPL, внешний слой сплетения; ONL, внешний ядерный слой; RPE, пигментированный эпителий сетчатки; ON, зрительный нерв; P, периферия.
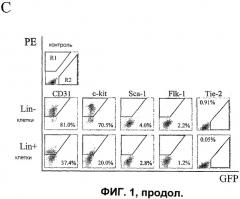
На фигуре 1c изображена характеристика разделенных с помощью проточной цитометрии клеток Lin+ HSC и Lin- HSC, происходящих из костного мозга. Верхний ряд: точечная диаграмма распределения клеток, не меченных антителами, в которых R1 определяет поддающуюся количественному определению зону PE-позитивного окрашивания; R2 указывает на GFP-позитивное окрашивание; средний ряд: Lin- HSC (C57B/6), и нижний ряд: клетки Lin+ HSC (C57B/6), каждая клеточная линия помечена конъюгированными с PE антителами против Sca-1, c-kit, Flk-1/KDR, CD31. Данные по Tie-2 были получены от мышей Tie-2-GFP. Проценты указывают на процент позитивно меченых клеток вне суммарной популяции Lin- HSC или Lin+ HSC.
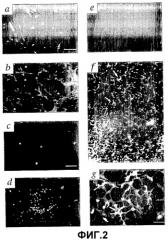
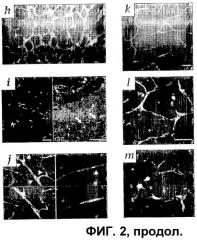
На фигуре 2 изображено приживление трансплантата Lin- HSC в развивающейся сетчатке мыши. (a) Через 4 дня после введения (P6) в стекловидное тело eGFP+ Lin- HSC клетки прикрепляются и дифференцируются на сетчатке. (b) Lin- HSC (мыши B6.129S7-Gtrosa26, окраска антителами против β-gal) фиксируются впереди сосудов, окрашенных антителами на коллаген IV (звездочка указывает верхушку сосудистой сети). (c) Большинство клеток Lin+ HSC (eGFP+) через 4 дня после введения (P6) были не способны дифференцироваться. Брыжеечные EC eGFP+ мыши через 4 дня после введения (P6). (e) Lin- HSC (eGFP+) вводили в глаза взрослой мыши. (f) Слабое увеличение, eGFP+ Lin- HSC (стрелки) усаживаются и дифференцируются вдоль предсуществующей астроцитной матрицы у трансгенной мыши GFAP-GFP. (g) Более высокое увеличение, связь между клетками Lin- (eGFP) и подлежащим астроцитом (стрелки). (h) Трансгенный контроль без введения GFAP-GFP. (i) Через 4 дня после введения (P6) eGFP+ Lin- HSC клетки мигрируют и подвергаются дифференцировке в зоне будущего глубокого сплетения. На левой фигуре представлена активность Lin- HSC на монтированной сетчатке целиком; на правой фигуре показана локализация клеток Lin- (стрелки) в сетчатке (верх представляет собой сторону к стекловидному телу, низ - сторону к склере). (j) Двойное мечение антителами α-CD31-PE и α-GFP-alexa 488. Через семь дней после введения введенные Lin- HSC (eGFP), (красные) включались в сосудистую сеть (CD31). Стрелки указывают на зоны включения. (k) Клетки eGFP+ Lin- HSC образуют сосуды через четырнадцать дней после введения (P17). (l и m) Внутрисердечное введение родамин-декстрана указывает на то, что сосуды являются интактными и функционируют как в первичном (l), так и в глубоком (m) сплетении.
На фигуре 3 (a и b) показано, что клетки eGFP+ Lin- HSC фиксируются на глиоз (обозначенный астроцитами, экспрессирующими GFAP, дальнее левое изображение), индуцируемый как лазером (a), так и механическим повреждением (b) в сетчатке взрослой особи (звездочка указывает на место повреждения). Дальние правые изображения представляют собой более сильное увеличение, что говорит о тесной связи Lin- HSC и астроцитов. Отрезок калибровки = 20 мкм.
На фигуре 4 показано, что клетки Lin- HSC защищают сосудистую сеть мыши с дегенерацией сетчатки. (a-d) Сетчатка через 27 дней после введения (P33) с окраской на коллаген IV; (a) и (b) сетчатка с введенными клетками Lin+ HSC (Balb/c) не демонстрируют различий в сосудистой сети по сравнению с нормальными мышами FVB; (c) и (d) сетчатка с введенными Lin- HSC (Balb/c) демонстрируют богатую сосудистую сеть, аналогичную таковой у мышей дикого типа; (a) и (c) криосрезы цельной сетчатки (верх представляет собой сторону к стекловидному телу, низ - сторону к склере) с окрашиванием DAPI; (b) и (d) глубокое сплетение целиком смонтированной сетчатки; (e) гистограмма, иллюстрирующая увеличение сосудистой сети глубокого сосудистого сплетения, образованной в сетчатках с введенными клетками Lin- HSC (n = 6). Протяженность глубокой васкуляризации сетчатки была оценена с помощью расчета суммарной длины сосудов в каждом изображении. Сравнивали среднюю суммарную длину сосудов/на поле с высоким увеличением (в микронах) для Lin- HSC, Lin+ HSC или контрольных сетчаток. (f) Сравнение длины глубокого сосудистого сплетения после введения клеток Lin- HSC (R, правый глаз) или Lin+ HSC (L, левый глаз) от мыши rd/rd. Представлены результаты шести независимых мышей (каждый цвет представляет каждую мышь). (g) и (h) клетки Lin- HSC (Balb/c) также защищают сосудистую сеть rd/rd при введении в глаз на P15. Показано промежуточное и глубокое сосудистое сплетение сетчаток с введенными клетками Lin- HSC (G) или Lin+ HSC (H) (через один месяц после введения).
На фигуре 5 показаны микрофотографии ткани сетчатки мышей: (a) глубокий слой целиком смонтированной сетчатки (мышь rd/rd), через пять дней после введения (P11) видны eGFP+ Lin- HSC (серые). (b) и (c) сосудистая сеть сетчатки мышей Tie-2-GFP (rd/rd) на P60, которые получали клетки Lin- Balb/c (b)или Lin+ HSC клетки (c), введение на P6. Только эндогенные эндотелиальные клетки (окрашенные GFP) визуализируются на левых панелях (b) и (c). Средние панели (b) и (c) окрашены антителом против CD31; стрелки указывают на сосуды, окрашенные на CD31, но не на GFP, правые панели (b) и (c) демонстрируют окрашивание как на GFP, так и на CD31. (d) окрашивание на α-SMA введенных Lin- HSC (левая панель) и контрольной сетчатки (правая панель).
На фигуре 6 показано, что Lin- HSC, трансфецированные T2-TrpRS, ингибируют развитие сосудистой сети сетчатки мыши. (a) Схематическое представление TrpRS, T2-TrpRS и T2-TrpRS с сигнальной последовательностью Igk на аминоконце. (b) Сетчатка с введенными Lin- HSC, трансфецированными T2-TrpRS, экспрессируют белок T2-TrpRS in vivo. (1) Рекомбинантный T2-TrpRS, продуцируемый в E. coli; (2) Рекомбинантный T2-TrpRS, продуцируемый в E. coli; (3) Рекомбинантный T2-TrpRS, продуцируемый E. coli; (4) контрольная сетчатка; (5) сетчатка с введенными Lin- HSC + pSecTag2A (только вектор); (6) сетчатка с введенными Lin- HSC + pKLe135 (Igk-T2-TrpRS в pSecTag). (a) Эндогенный TrpRS. (b)Рекомбинантный T2-TrpRS. (c) Сетчатка с введенным T2-TrpRS в Lin- HSC. (c-f) Примеры первичного (поверхностного) и вторичного (глубокого) сплетений в сетчатках после введения, семь дней после введения. (c) и (d) Глаза с введенными Lin- HSC, трансфецированными пустой плазмидой, развиваются нормально; (e) и (f) в большинстве случаев глаз с введенными Lin- HSC, трансфецированными T2-TrpRS, характеризуется ингибированием глубокого сплетения; (c) и (e) первичное (поверхностное) сплетение; (d) и (f) вторичное (глубокое) сплетение. Нечеткое очертание сосудов, наблюдаемое в (f), представляет собой «проступание» изображений первичной сосудистой сети, представленной в (e).
На фигуре 7 представлена последовательность ДНК, кодирующая His6-меченный T2-TrpRS, SEQ ID NO: 1.
На фигуре 8 представлена аминокислотная последовательность His6-меченного T2-TrpRS, SEQ ID NO: 2.
На фигуре 9 представлены микрофотографии и электроретинограммы (ERG) сетчаток мышей, в глаза которых вводили Lin- HSC по настоящему изобретению и Lin+ HSC (контроли).
На фигуре 10 изображены статистические графики, представляющие корреляцию между нейрональной защитой (ось Y) и васкулярной защитой (ось X) как для промежуточного (Int.), так и для глубокого слоя глаз мышей rd/rd, которым вводили Lin- HSC.
На фигуре 11 изображены статистические графики, демонстрирующие отсутствие корреляции между нейрональной защитой (ось Y) и васкулярной защитой (ось X) для глаз мышей rd/rd, которым вводили Lin+ HSC.
На фигуре 12 представлена гистограмма длины сосудов (ось Y) в относительных условных единицах для глаз мышей rd/rd, которым вводили Lin- HSC (темные столбики) и для глаз мышей rd/rd, которым не вводили Lin- HSC (светлые столбики) во временные точки 1 месяц (1М), 2 месяца (2М) и 6 месяцев (6М) после введения.
На фигуре 13 представлены три гистограммы количества ядер во внешнем нервном слое (ONR) мышей rd/rd через 1 месяц (1М), 2 месяца (2М) и 6 месяцев (6М) после введения, и они демонстрируют значительное увеличение числа ядер для глаз, которым вводили Lin- HSC (темные столбики) по отношению к контрольным глазам, которым вводили Lin+ HSC (светлые столбики).
На фигуре 14 изображены графики числа ядер во внешнем нейрональном слое для индивидуальных мышей rd/rd, сравнение правого глаза (R, вводили Lin- HSC) с левым глазом (L, вводили Lin+ HSC) во временные точки (после введения) 1 месяц (1М), 2 месяца (2М) и 6 месяцев (6М); каждая линия на графике - сравнение глаз индивидуальной мыши.
На фигуре 15 изображены изменения сосудистой сети и нервных клеток сетчатки у мышей rd1/rd1 (C3H/HeJ, левые панели) и мышей дикого типа (C57BL/6, правые панели). Сосудистая сеть промежуточного (верхние панели) или глубокого (средние панели) сосудистых сплетений в целиком собранной сетчатке (красный: коллаген IV, зеленый: CD31) и представлены срезы (красный: DAPI, зеленый: CD31, нижние панели) тех же самых сетчаток (P: постнатальный день). (GCL: слой клеточных ганглиев, INL: внутренний ядерный слой, ONL: внешний ядерный слой).
На фигуре 16 показано, что введение Lin- HSC защищает нервные клетки мышей rd1/rd1 от дегенерации. A, B и C сосудистая сеть сетчатки промежуточного (int.) или глубокого сплетения и срезы глаза с введением Lin- HSC (правые панели) и второго глаза с введением контрольных клеток (CD31-) (левые панели) на P30 (A), P60 (B) и P180 (C). D, средняя суммарная длина сосудистой сети (+ или - стандартная ошибка среднего) в сетчатках с введением Lin- HSC и с введением контрольных клеток (CD31-) на P30 (левый, n = 10), P60 (средний, n = 10) и P180 (правый, n = 6). Данные по промежуточному (Int.) и глубокому сосудистому сплетению показаны отдельно (ось Y: относительная длина сосудистой сети). E, среднее число клеточных ядер в ONL на P30 (левый, n = 10), P60 (средний, n = 10) и P180 (правый, n = 6) в сетчатках с введением контрольных клеток (CD31-) или Lin- HSC (ось Y: относительное число клеточных ядер в ONL). F, Линейные корреляции между длиной сосудистой сети (ось X) и числом клеточных ядер в ONL (ось Y) на P30 (левый), P60 (средний) и P180 (правый) в сетчатках с введением Lin- HSC или контрольных клеток.
На фигуре 17 показано, что защитная функция сетчатки достигается путем введения Lin- HSC. Для оценки функции сетчаток с введением Lin- HSC или контрольных клеток (CD31-) применяли электроретинографические (ERG) записи. A и B, примеры случаев защищенной и не защищенной сетчаток через 2 месяца после введения. Показаны срезы сетчатки правого глаза с введением Lin- HSC (A) и левого глаза с введением контрольных клеток CD31- (B) (зеленый: сосудистая сеть, окрашенная на CD31, красный: ядра, окрашенные DAPI). C, результаты ERG от того же животного, что и представленный в A и B.
На фигуре 18 показано, что популяция клеток костного мозга человека может защищать дегенерирующие сетчатки у мыши rd1 (A-C). Защита наблюдалась также на другой модели дегенерации сетчатки, rd10 (D-K). A, Lin- HSC человека (hLin- HSC), меченные зеленым красителем, могут дифференцироваться в клетки сосудов сетчатки после введения в стекловидное тело мышам C3SnSmn.CB17-Prkdc SCID. B и C, сосудистая сеть сетчатки (левые панели; верх: промежуточное сплетение, низ: глубокое сплетение) и нервные клетки (правая панель) в глазе с введением hLin- HSC (B) или во втором, контрольном глазе (C) через 1,5 месяца после введения. D-K, защита мышей rd10 с помощью Lin- HSC (введенных на P6). Показаны примеры сетчаток на P21 (D: Lin- HSC, H: контрольные клетки), P30 (E: Lin- HSC, I: контрольные клетки), P60 (F: Lin- HSC, J: контрольные клетки) и P105 (G: Lin- HSC, K: контрольные клетки) (глаза, подвергавшиеся лечению, и контрольные глаза в каждой временной точке были от того же животного). Сосудистую сеть сетчатки (верхнее изображение в каждой панели представляет собой промежуточное сплетение; среднее изображение в каждой панели представляет собой глубокое сплетение) окрашивали на CD31 (зеленый) и коллаген IV (красный). В изображении внизу каждой панели представлен поперечный срез, сделанный из той же сетчатки (красный: DAPI, зеленый: CD31).
На фигуре 19 продемонстрировано, что количество кристаллин αA повышается при защите клеток внешнего ядерного слоя после введения Lin- HSC, но не в контрольных глазах с введением контрольных клеток. Левая панель; контроль IgG в защищенной сетчатке, средняя панель; кристаллин αA в защищенной сетчатке, правая панель; кристаллин αA в не защищенной сетчатке.
На фигуре 20 представлены таблицы генов, которые стимулированы в сетчатках мышей, которым вводили Lin- HSC по настоящему изобретению. (A) Гены, чья экспрессия повышена в 3 раза в сетчатках мышей, которым вводили мышиный Lin- HSC. (B) Гены кристаллина, которые стимулируются в сетчатках мышей, которым вводили мышиные Lin- HSC. (C) Гены, чья экспрессия увеличена в 2 раза в сетчатках мышей, которым вводили Lin- HSC человека. (D) Гены нейротрофических факторов или ростовых факторов, чья экспрессия увеличена в сетчатках мышей, которым вводили Lin- HSC человека.
На фигуре 21 показано распределение поверхностных антигенов CD31 и интегрина α6 на позитивных CD133 (CD133+) и на негативных CD133 (CD133-) популяциях Lin- HSC по настоящему изобретению.
На фигуре 22 представлено постнатальное развитие сетчатки мышей C57/B16 дикого типа при нормальных уровнях кислорода (нормоксия) на постнатальные дни с P0 до P30.
На фигуре 23 представлена модель индуцированной кислородом ретинопатии у мышей C57/B16, содержащихся при высоких уровнях кислорода (гипероксия; 75% кислорода), между P7 и P12 с последующей нормоксией с P12-P17.
На фигуре 24 представлена защита сосудов с помощью введения популяций Lin- HSC по настоящему изобретению в модели индуцированной кислородом ретинопатии.
Подробное описание предпочтительных вариантов осуществления
Стволовые клетки обычно идентифицируют по распределению антигенов на поверхности клеток (для подробного обсуждения смотри, Stem Cells: Scientific Progress and Future Directions, доклад, подготовленный национальными институтами здоровья, управление научной политикой, июнь 2001 г., приложение E: Stem Cell Markers, который включен здесь в качестве ссылки в полном объеме).
Гематопоэтические стволовые клетки представляют собой такие стволовые клетки, которые способны развиваться в различные типы клеток крови, например, в В-клетки, Т-клетки, гранулоциты, тромбоциты и эритроциты. Поверхностные антигены линий дифференцировки представляют собой группу белков клеточной поверхности, которые являются маркерами линий дифференцировки зрелых клеток крови, включая CD2, CD3, CD11, CD11a, Mac-1 (CD11b:CD18), CD14, CD16, CD19, CD24, CD33, CD36, CD38, CD45, CD45RA, Ly-6G мыши, TER-119 мыши, CD56, CD64, CD68, CD86 (B7.2), CD66b, антиген лейкоцитов человека DR (HLA-DR) и CD235a (гликофорин A). Гематопоэтические стволовые клетки, которые не экспрессируют существенные уровни данных антигенов, обычно относят к негативной линии дифференцировки (Lin-). Гематопоэтические стволовые клетки человека обычно экспрессируют другие поверхностные антигены, такие как CD31, CD34, CD117 (c-kit) и/или CD133. Гематопоэтические стволовые клетки мыши обычно экспрессируют другие поверхностные антигены, такие как CD34, CD117 (c-kit), Thy-1, и/или Sca-1.
Настоящее изобретение относится к выделенным гематопоэтическим стволовым клеткам, которые не экспрессируют существенные уровни «поверхностного антигена линии дифференцировки» (Lin) на поверхности своих клеток. Такие клетки обозначают здесь как гематопоэтические стволовые клетки «негативной линии дифференцировки» или «Lin-». В частности, изобретение относится к популяции гематопоэтических стволовых клеток Lin- (Lin- HSC), которая включает эндотелиальные клетки-предшественники (EPC), которые способны включаться в развивающуюся сосудистую сеть и затем дифференцироваться, становясь клетками эндотелия сосудов. Предпочтительно, выделенные популяции Lin- HSC присутствуют в культуральной среде, такой как забуференный физиологический раствор (ЗФР).
Используемое здесь и в прилагаемой формуле изобретения выражение «взрослый» в отношении к костному мозгу включает костный мозг, выделенный в постнатальный период, т.е. от неполовозрелых и взрослых индивидуумов в отличие от эмбрионов. Термин «взрослое млекопитающее» относится как к неполовозрелым, так и к полностью половозрелым млекопитающим.
Настоящее изобретение относится к выделенным популяциям гематопоэтических стволовых клеток млекопитающих негативной линии дифференцировки (Lin- HSC), содержащим эндотелиальные клетки-предшественники (EPC). Выделенные популяции Lin- HSC по настоящему изобретению, предпочтительно, включают клетки млекопитающих, в которых по меньшей мере приблизительно 20% клеток экспрессируют поверхностный антиген CD31, обычно присутствующий на эндотелиальных клетках. В другом варианте осуществления, по меньшей мере приблизительно 50% клеток экспрессируют CD31, более предпочтительно, по меньшей мере приблизительно 65%, наиболее предпочтительно, по меньшей мере приблизительно 75%. Предпочтительно, по меньшей мере приблизительно 50% клеток популяций Lin- HSC по настоящему изобретению, предпочтительно, экспрессируют антиген интегрина α6.
В одном из предпочтительных вариантов осуществления популяции Lin- HSC мыши по меньшей мере приблизительно 50% клеток экспрессирует антиген CD31 и по меньшей мере, приблизительно, 50% клеток экспрессирует антиген CD117 (c-kit). Предпочтительно, по меньшей мере приблизительно 75% клеток Lin- HSC экспрессирует антиген CD31, более предпочтительно, приблизительно 81% клеток. В другом предпочтительном варианте осуществления у мышей по меньшей мере приблизительно 65% клеток экспрессирует поверхностный антиген CD117, более предпочтительно, приблизительно 70% клеток. В особенно предпочтительном варианте осуществления настоящего изобретения представлена популяция Lin- HSC мыши, в которой от приблизительно 50% до приблизительно 85% клеток экспрессирует поверхностный антиген CD31 и от приблизительно 70% до приблизительно 75% клеток экспрессирует поверхностный антиген CD117.
Другим предпочтительным вариантом осуществления является популяция Lin- HSC человека, в которой клетки являются негативными в отношении CD133, в которой по меньшей мере приблизительно 50% клеток экспрессирует поверхностный антиген CD31 и, по меньшей мере, приблизительно 50% клеток экспрессирует антиген интегрина α6. Еще одним предпочтительным вариантом осуществления является популяция Lin- HSC человека, в которой клетки являются позитивными в отношении CD133, в которой настолько мало как приблизительно 30% клеток экспрессирует поверхностный антиген CD31 и настолько мало как приблизительно 30% клеток экспрессирует антиген интегрина α6.
Выделенные популяции Lin- HSC по настоящему изобретению избирательно направлены на астроциты и включаются во вновь образующуюся сосудистую сеть сетчатки при введении в стекловидное тело глаза таких видов млекопитающих, как мышь или человек, из которых клетки были выделены.
Выделенные популяции Lin- HSC по настоящему изобретению включают эндотелиальные клетки-предшественники, которые дифференцируются в эндотелиальные клетки и создают сосудистые структуры в сетчатке. В частности, популяции Lin- HSC по настоящему изобретению могут использоваться для лечения заболеваний с неоваскуляризацией сетчатки и дегенеративных заболеваний сосудов сетчатки, а также для восстановления поврежденных сосудов сетчатки. Клетки Lin- HSC по настоящему изобретению стимулируют защиту нервных клеток в сетчатке и усиливают позитивную регуляцию антиапоптозных генов. Неожиданно было обнаружено, что клетки Lin- HSC взрослого человека по настоящему изобретению могут ингибировать дегенерацию сетчатки даже у мышей с тяжелым комбинированным иммунодефицитом (SCID), страдающих дегенерацией сетчатки. Кроме того, популяции Lin- HSC могут использоваться для лечения дефектов сетчатки глаз новорожденных млекопитающих, таких, которые страдают индуцированной кислородом ретинопатией или ретинопатией недоношенных.
Настоящее изобретение также относится к способу лечения глазных заболеваний у млекопитающего, предусматривающему выделение из костного мозга млекопитающего популяции гематопоэтических стволовых клеток негативной линии дифференцировки, которая включает эндотелиальные клетки-предшественники, и введение выделенных стволовых клеток в стекловидное тело глаза млекопитающего в количестве, достаточном для купирования заболевания. Настоящий способ может быть применен для лечения глазных заболеваний, таких как дегенеративные заболевания сетчатки, дегенеративные заболевания сосудов сетчатки, ишемические ретинопатии, кровоизлияния сосудов, утечка из сосудов и хороидопатии новорожденных, неполовозрелых или полностью половозрелых млекопитающих. Примеры таких заболеваний включают связанную с возрастом дегенерацию желтого пятна (ARMD), диабетическую ретинопатию (DR), предполагаемый глазной гистоплазмоз (POHS), ретинопатию недоношенных (ROP), серповидно-клеточную анемию и пигментозный ретинит, а также повреждения сетчатки.
Количество стволовых клеток, вводимых в глаз, достаточно для купирования патологического состояния глаза. Например, число клеток может быть эффективным для восстановления повреждения сетчатки глаза, стабилизации неоваскуляризации сетчатки, созревания новых сосудов сетчатки и предотвращения утечки из сосудов или их восстановления и кровоизлияния сосудов.
Клетки популяций Lin- HSC по настоящему изобретению могут быть трансфецированы терапевтически эффективными генами, такими как гены, кодирующие антиангиогенные белки для применения при генной терапии глазных заболеваний на основе клеток, и гены, кодирующие нейротрофические агенты для увеличения эффектов защиты нервных клеток.
Трансфецированные клетки могут включать любой ген, который терапевтически эффективен для лечения нарушений сетчатки. В одном из предпочтительных вариантов осуществления трансфецированные Lin- HSC по настоящему изобретению включают операбельный ген, кодирующий антиангиогенный пептид, включая белки или фрагменты белков, такие как TrpRS или его антиангиогенные фрагменты, например, фрагменты T1 и T2 TrpRS, которые подробно описаны в находящейся в процессе одновременного рассмотрения патентной заявке США, сообладателями которой являются заявители, с серийным No. 10/080839, описание которой приведено здесь в качестве ссылки в полном объеме. Трансфецированные Lin- HSC, кодирующие антиангиогенный пептид по настоящему изобретению, могут использоваться для лечения заболеваний сетчатки, связанных с аномальным развитием сосудов, таких как диабетическая ретинопатия и подобные ей заболевания. Предпочтительно, Lin- HSC являются клетками человека.
В другом предпочтительном варианте осуществления трансфецированные Lin- HSC по настоящему изобретению включают операбельный ген, кодирующий нейротрофический агент, такой как фактор роста нервов, нейротрофин-3, нейротрофин-4, нейротрофин-5, цилиарный нейротрофический фактор, нейротрофический фактор, происходящий из пигментного эпителия сетчатки, инсулиноподобный ростовой фактор, нейротрофический фактор, происходящий из линии глиальных клеток, нейротрофический фактор, происходящий из мозга, и тому подобное. Такие нейротрофические Lin- HSC могут использоваться для стимуляции защиты нервных клеток при дегенеративных заболеваниях нервных клеток сетчатки, таких как глаукома и пигментозный ретинит, при лечении повреждений нервных клеток сетчатки и тому подобное. Сообщалось, что имплантаты цилиарного нейротрофического фактора могут использоваться для лечения пигментозного ретинита (смотри, Kirby et al. 2001, Mol Ther. 3(2):241-8; Farrar et al. 2002, EMBO Journal 21:857-864). Нейротрофический фактор, полученный из мозга, как сообщают, модулирует гены, связанные с ростом, в поврежденных ганглиях сетчатки (смотри, Fournier, et al., 1997, J. Neurosci. Res. 47:561-572). Нейротрофический фактор, полученный из линии глиальных клеток, как сообщается, снижает дегенерацию фоторецепторов при пигментозном ретините (смотри, McGee et al. 2001, Mol Ther. 4(6):622-9).
Настоящее изобретение также относится к способу выделения гематопоэтических стволовых клеток негативной линии дифференцировки, включающих эндотелиальные клетки-предшественники, из костного мозга млекопитающего. Способ предусматривает стадии (a) экстрагирования костного мозга из взрослой особи млекопитающего; (b) отделения количества моноцитов из костного мозга; (c) мечения моноцитов набором конъюгированных с биотином антител линий дифференцировки против одного или нескольких поверхностных антигенов, предпочтительно, против антигенов линий дифференцировки, выбранных из группы, включающей CD2, CD3, CD4, CD11, CD11a, Mac-1, CD14, CD16, CD19, CD24, CD33, CD36, CD38, CD45, Ly-6G (мышиный), TER-119 (мышиный), CD45RA, CD56, CD64, CD68, CD86 (B7.2), CD66b, антиген лейкоцитов человека DR (HLA-DR) и CD235a (гликофорин A); (d) удаления моноцитов, которые являются позитивными в отношении указанного одного или нескольких поверхностных антигенов линий дифференцировки из множества моноцитов, и получения популяции гематопоэтических стволовых клеток негативной линии дифференцировки, содержащей эндотелиальные клетки-предшественники, в которой, предпочтительно, по меньшей мере приблизительно 20% клеток экспрессирует CD31.
Когда Lin- HSC выделяют из костного мозга взрослых людей, предпочтительно, моноциты метят набором конъюгированных с биотином антител для линий дифференцировки против поверхностных антигенов линий дифференцировки CD2, CD3, CD4, CD11a, Mac-1, CD14, CD16, CD19, CD33, CD38, CD45RA, CD64, CD68, CD86 (B7.2) и CD235a. Когда Lin- HSC выделяют из костного мозга взрослых мышей, предпочтительно, моноциты метят набором конъюгированных с биотином антител линий дифференцировки против поверхностных антигенов линий дифференцировки CD3, CD11, CD45, Ly-6G и TER-119.
В предпочтительном способе клетки выделяют из костного мозга взрослых людей и, дополнительно, от