Способ лечения онкологических заболеваний
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии, и может быть использовано при комплексном лечении пациентов с онкологическими заболеваниями. Способ основан на введении в организм пациента препарата цитостатической группы, механизм действия которого основан на формировании межцепочечных сшивок в молекуле ДНК раковых клеток организма, совместно с препаратом фрагментированной аллогенной ДНК с фрагментами, имеющими биологически активный размер и составляющими полный геном физиологически и генетически здорового донора. Способ позволяет активировать рекомбинационную систему клетки и провести гомологичную интеграцию препарата ДНК в геном реципиента. 2 з.п. ф-лы, 5 ил., 1 табл.
Реферат
Изобретение относится к медицине и может быть использовано при комплексном лечении пациентов препаратами цитостатической группы, формирующих двуцепочечные ковалентные сшивки между цепями молекулы ДНК с одновременным лечением препаратом, содержащим аллогенный генетический материал, в частности, для лечения пациентов с онкологическими заболеваниями методами заместительной терапии поврежденных и огомозигоченных аллелей генома фрагментами аллогенной ДНК, когда причиной онкологических заболеваний являются мутации в онкогенах, генах онкосупрессоров и тотальное огомозигочивание аллелей генов клетки, претерпевающей раковое перерождение.
Известен способ лечения, основанный на исправлении точечных мутаций в клетках [1].
Способ отличается относительно низкой эффективностью лечения и ограниченностью применения, поскольку согласно этому способу мутации должны быть точно определены еще до начала лечения.
Ввиду того что ни для одной мутации нет достоверного доказательства того, что именно эта мутация является причиной рака, развитие этого метода требует скрупулезных и длительных исследований по выявлению конкретных мутаций, требующих коррекции, а следовательно, существует необходимость в создании способов лечения, которые могли бы применяться на основе уже имеющихся знаний о причинах рака, не делая акцента на конкретных изменениях генома, приведших к злокачественному перерождению.
Известны также способы лечения, основанные на локальном применении ДНК фрагментов для лечения предраковых состояний в коже пациентов и стимуляции солнечного загара [2, 3].
Эти способы также имеют ограниченную применимость, поскольку ни конкретные последовательности, ни источники ДНК в указанных патентах не определены. В них предлагается использовать как природную, так и синтетическую ДНК из «любых подходящих источников», например ДНК лосося длиной от 200 мононуклеотидов и нуклеозидов, включая димеры, что в соответствии с тестами авторов является наиболее эффективным. Однако действие и последствия применения ДНК иной природы на человеческий организм пока не полностью изучены, что предопределяет определенную опасность применения способов.
Наиболее близким по своей сущности к предложенному является способ, основанный на использовании цитостатических препаратов, например препарата цисплатины для лечения больных с плоскоклеточным раком кожи туловища, путем использования цисплатины в дозе 100 мг/м2 (1 день), внутривенно капельно 30 мг/м2 1 раз в неделю, или 60-150 мг/м2 каждые 3-5 недель, или 20 мг/м2 ежедневно 5 дней с повторением каждые 4 недели, или 50 мг/м2 в 1-й и 8-й дни каждые 4 недели, препарата митомицин С для лечения больных раком желудка, кишечника, поджелудочной железы, мочевого пузыря, молочной железы, легкого, вульвы, предстательной железы (в составе лекарственных комбинаций), путем использования митомицина С внутривенно в дозе 10 мг/м2 1 раз в 3-4 недели (в составе лекарственных комбинаций) или также 2 мг/м2 с 1-го по 5-й и с 8-го по 12-й дни курса, суммарная доза 50 мг/м2, или препарата дактиномицина для лечения больных с хориокарциномой матки, саркомой мягких тканей, злокачественных опухолей яичка, меланомы, лимфосаркомы, нейробластом путем использования дактиномицина внутривенно 350 мкг/м2 ежедневно в течение 5 дней каждые 3-5 недель или 1-2 раза в неделю в течение 3-5 недель, суммарная доза 3000 мкг [4].
Действие цитостатических препаратов, таких как псорален, цисплатина, ЦФ, нитроген мустард, мельфолан митомицин С и др., используемых при терапии различных раков, основано на их свойстве образовывать двуцепочечные сшивки в произвольных местах генома.
При терапевтической дозе цитостатика в геноме клеток организма образуются до 2000 межцепочечных сшивок. Репаративная система клетки не в состоянии справиться с таким количеством одновременных повреждений, что приводит к гибели раковой клетки.
Однако наиболее близкий способ обладает относительно низкой эффективностью лечения, обусловленной тем, что раковая клетка гибнет не изменяя своего ракового статуса и распространяет в окружающее клетку пространство фрагменты ДНК несущие онкомутации, которые могут служить источником генометастазирования. При этом одновременно с раковыми гибнут все остальные активно пролиферирующие клетки организма, такие как СКК, клетки эпителиев, клетки волосяных фолликул и т.д., что приводит к крайне негативным и даже летальным последствиям.
Все это снижает эффективность лечения пациентов с онкологическими заболеваниями, причиной которых являются как мутации в онкогенах и генах онкосупрессоров, так же как и тотальное огомозигочивание генов.
Требуемый результат заключается в повышении эффективности лечения пациентов с онкологическими заболеваниями, причиной которых являются как мутации в онкогенах и генах онкосупрессоров, так и тотальное огомозигочивание генов.
В более широком плане задачей настоящего изобретения является разработка обоснованного и экспериментально подтвержденного способа совместного воздействия на раковые клетки и опухоль в целом цитостатических препаратов, индуцирующих сшивку цепей молекулы ДНК, и препарата фрагментированной гомологической ДНК, составляющей полный геном физиологически и генетически здорового донора таким образом, что в целом в результате индукции межцепочечных сшивок активируется вся рекомбинационная система клетки, приводящая к тому, что формируется открытая для рекомбинационной машины структура хроматина, создаются сайты репаративного гомологичного обмена в местах индукции кросс-линков и многократно усиливается рекомбинация, связанная с нахождением концевых гомологий экзогенных фрагментов по всему геному, включая ранее недоступный ввиду конформационных особенностей хроматин. При этом в местах индуцированных цитостатическим кросс-линком репаративных событий происходит гомологическое репаративное замещение поврежденных участков хроматина на гомологические фрагменты экзогенной терапевтической ДНК, депонированной в ядерном пространстве. Вследствие химической природы цитостатика сшивки молекулы ДНК происходят статистически по геному и не зависят от структуры хроматина и других ядерных факторов. Виду этого будет формироваться открытая для рекомбинационной машины структура хроматина. Поэтому онкомутации, содержащиеся в геноме, будут с определенной долей вероятности замещаться на недефектные последовательности за счет экзогенных терапевтических фрагментов, участвующих как в репаративной гомологической рекомбинации, так и в рекомбинации, связанной с нахождением концевых гомологий экзогенных фрагментов по всему геному, включая ранее недоступный, ввиду конформационной закрытости хроматина.
При совместном воздействии цитостатика и препарата фрагментированной гомологичной ДНК на протяжении нескольких курсов химиотерапии (с постоянным мониторингом биохимических маркеров онкотрансформации) происходит изменение генного гомеостаза, когда клетки претерпевают реверсивное генетическое перерождение, при котором исчезает основное свойство раковой клетки - ее неограниченная пролиферативная активность.
Требуемый результат достигается тем, что по способу лечения онкологических заболеваний, основанному на введении в организм пациента препарата цитостатической группы, механизм действия которого основан на формировании межцепочечных сшивок в молекуле ДНК раковых и других активно пролиферирующих клеток организма, в организм пациента дополнительно вводят препарат фрагментированной ДНК с фрагментами, имеющими биологически активный размер и составляющими полный геном физиологически и генетически здорового донора.
Кроме того, требуемый результат достигается тем, что препарат фрагментированной ДНК с фрагментами, имеющими биологически активный размер и составляющими полный геном физиологически и генетически здорового донора, вводят пациенту за один час и через час после введении препарата цитостатической группы и далее каждые два часа до завершения полного репаративного цикла в количестве, равном или превышающем количество собственно ДНК плазмы крови и тканевых жидкостей пациента, но не более максимально допустимого количества, равного 30 мкг/мл крови.
Кроме того, требуемый результат достигается тем, что полный реперативный цикл составляет 12 часов.
Кроме того, требуемый результат достигается тем, что препарат фрагментированной ДНК с фрагментами, имеющими биологически активный размер и составляющими полный геном физиологически и генетически здорового донора, используют в качестве субстрата для гомологической рекомбинации с однонитчатыми участками ДНК и областями двуцепочечных разрывов молекулы ДНК, возникающими при репарации межцепочечных сшивок, которые в силу химической природы цитостатика появляются в геноме статистически и место их локализации не зависит от структуры хроматина и связанных с этой структурой других факторов клетки.
Кроме того, требуемый результат достигается тем, что число процедур, основанных на введении в организм пациента препаратов цитостатической группы, механизм действия которых основан на формировании межцепочечных сшивок в молекуле ДНК раковых и других активно пролиферирующих клеток организма, и дополнительном введении в организм пациента препарата фрагментированной ДНК с фрагментами, имеющими биологически активный размер и составляющими полный геном физиологически и генетически здорового донора, определяется запуском нескольких механизмов, определяющих скорость и эффективность заместительного терапевтического действия фрагментов экзогенной ДНК. К таким механизмам относятся: а) освобождение молекулы ДНК от гистонов на протяжении нескольких мегабаз по обе стороны от возникшего двуцепочечного разрыва; б) происходящие при этом конформационные изменения хроматина в местах хромосом, недоступных для прямого замещения фрагментами экзогенной ДНК, и возникающая при этом возможность прямого замещения гомологичных участков хромосом экзогенными фрагментами ДНК; в) многократно усиливающийся, постоянно протекающий в ядре гомологический обмен между экзогенными фрагментами ДНК и теми участками хроматина, которые упакованы таким образом, что они постоянно доступны для гомологического обмена; г) гомологическая рекомбинация между фрагментами экзогенной ДНК и интермедиатами, возникающими в районе кросс-линка в ходе репарации.
Фактически число химиотерапевтических процедур совместно с введением препарата фрагментированной ДНК определяется и контролируется по совокупности всех маркерных тестов, сопровождающих лечение каждого конкретного рака.
Воздействие химиотерапевтического цитостатика приводит к возникновению поперечных сшивок в молекуле ДНК. Это приводит к вынужденной (аварийной) остановке репликативной вилки, включению механизма репарации. Механизм репарации состоит из нескольких событий, при которых первоначально образуется двуцепочечный разрыв. После этого эксцизионная система репарации делает серию разрезов и оголяет одоцепочечный участок размером около 1 килобазы. В результате формирования таких структур многократно активируется система репаративной гомологической рекомбинации. В результате этого крайне рекомбиногенные структуры - двуцепочечные разрывы и одноцепочечный гэп - ищут и находят гомологичные последовательности, расположенные в ядре (гомологичная хромосома, сестринская хроматида), и совершается акт гомологическокой рекомбинационной рапарации. В результате этого восстанавливается целостность хроматина, ликвидируется дефект и на участке хромосомы, участвующей в рекомбинации, происходит замещение участка хроматина в пределах 1-6 килобаз на аллельные варианты, находящиеся в составе экзогенных фрагментов ДНК из ядерного пространства. Если в ядерном пространстве будут находиться терапевтические фрагменты ДНК, то они будут являться субстратом для репаративной гомологической рекомбинации.
В современной литературе отсутствуют указания на предлагаемый способ лечения онкологических пациентов с использованием одновременного воздействия кросс-линкирующих цитостатиков и препарата фргаментированной генетически здоровой ДНК, естественного механизма ее доставки, депонирования в межхромосомном пространстве и активации всей рекомбинационной системы клетки, приводящей к тому, что формируется открытая для рекомбинационной машины структура хроматина, создаются сайты репаративного гомологичного обмена в местах индукции кросс-линков и многократно усиливается рекомбинация, связанная с нахождением концевых гомологий экзогенных фрагментов по всему геному, включая ранее недоступный ввиду конформационных особенностей хроматин.
Следовательно, предложение отвечает критериям новизны и изобретательского уровня.
Ниже приводятся теоретические и экспериментальные данные, подтверждающие, что изобретение отвечает и критерию практической (промышленной) применимости.
На чертежах представлены:
на фиг.1 - электрофоретические характеристики экзогенной терапевтической ДНК плаценты человека, используемой для инъекций в организм опытных мышей (М - маркер молекулярного веса - BssT1I гидролизат фага λ (lambda DNA - BssT1I digest));
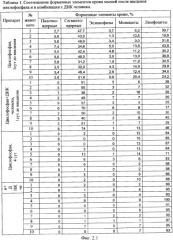
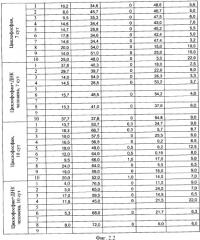
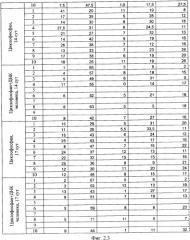
на фиг.2.-2.6 - таблицы (1, 2, 3, 4) соотношений и динамика количества форменных элементов крови после введения циклофосфана и в комбинации с препаратом фрагментированной ДНК человека;
на фиг.3, А - элаймент консенсусов повторяющихся последовательностей Alu человека и В1 мыши;
на фиг.3, В - последовательность фрагмента X-Alu (стрелками и жирным шрифтом выделены используемые в ПНР реакции праймеры);
на фиг.4 - ПЦР анализ геномной ДНК экспериментальных животных на присутствие в ней последовательностей человеческой ДНК. А) ПЦР анализ геномной ДНК экспериментальных мышей на присутствие специфических ПЦР фрагментов по подвижности совпадающих с ПЦР продуктами, выявляемыми при аналогичном анализе в геноме человека. Левый блок - электрофоретически фракционированные ПЦР фрагменты экспериментальных и конрольных животных. Правый блок - Саузерн-блот гибридизация этого же геля с ДНК 32Р ПЦР меченного X-Alu фрагмента. В) Повторная гибридизация позитивных образцов, специфические фрагменты которых (280 п.о. для человека и обеих мышей) в дальнейшем использовались для определения нуклеотидной последовательности. Левый блок - электрофоретически фракционированные ПЦР фрагменты, правый блок - Саузерн-блот гибридизация этого же геля с ДНК 32Р ПЦР меченного X-Alu фрагмента. Цифры слева от блоков (280 и 310) указывают на фрагменты, соответствующие двум мажорным ПЦР продуктам, выявляемым в геноме человека. 1-15 - номера образцов, bp - пары оснований. Human - человек, СВА - реципиентная линия мышей, m №1 и m №8 - экспериментальные мыши, М - маркеры молекулярных весов (100 bp лестница). +hDNA - образцы ДНК мышей, обработанных только человеческой ДНК; +CP+hDNA образцы ДНК мышей, обработанных совместно циклофосфамидом и человеческой ДНК.
на фиг.5, А - саузерн-блот анализ геномной ДНК экспериментальных мышей №1 и №8 на присутствие в ней последовательностей человеческой ДНК. М - маркеры молекулярных весов (HindIII гидролизат фага λ); 1-4 - BamHI+HindIII гидролизаты геномной ДНК: m №1 - экспериментальное животное №1, m №8 - экспериментальное животное №8, СВА -реципиентная линия мышей, human - человек. Левый блок электрофоретически фракционированная ДНК, гидролизованная BamHI+HindIII. Правый блок - геномный блот этого же геля после гибридизации с 32Р меченым фрагментом X-Alu. Стрелками для левого блока указаны маркерные фрагменты. Стрелками для правого блока указаны гибридизующиеся фрагменты геномов экспериментальных животных.
На фиг.5, В - определение копийности человеческого фрагмента X-Alu в геноме человека, реципиентной линии СВА и экспериментальных мышей. Гибридизация проводилась с ДНК 32Р ПЦР меченного X-Alu фрагмента. Цифрами над всеми блоками указано титрованное количество ДНК, нанесенное на мембрану. SS - ДНК спермы лосося; Alu - ДНК X-Alu; hDNA - ДНК человека; mouse №1, mouse №8 - ДНК экспериментальных мышей.
Предложенный способ лечения онкологических заболеваний реализуется следующим образом.
Способ лечения онкологических заболеваний основан на введении в организм пациента препаратов цитостатической группы, механизм действия которых основан на формировании межцепочечных сшивок в молекуле ДНК раковых и других активно пролиферирующих клеток организма. При этом, вместе с вводимым цитостатическим препаратом в организм вводится препарат фрагментированной ДНК с фрагментами, имеющими биологически активный размер и составляющими полный геном физиологически и генетически здорового донора.
Фрагменты терапевтической ДНК вводят пациенту за один час и через час после введении препарата цитостатической группы и далее каждые два часа до завершения полного репаративного цикла в количестве, равном или превышающем количество собственно ДНК плазмы крови и тканевых жидкостей пациента, но не более максимально допустимого количества, равного 30 мкг/мл крови. Полный реперативный цикл составляет 12 часов.
Фрагменты терапевтической ДНК являются субстратом для гомологической рекомбинации с однонитчатыми участками ДНК и областями двуцепочечных разрывов молекулы ДНК, возникающими при репарации межцепочечных сшивок, которые в силу химической природы цитостатика появляются в геноме статистически и место их локализации не зависит от структуры хроматина и связанных с этой структурой других факторов клетки.
Кроме того, фрагменты терапевтической ДНК, являясь субстратом для гомологической рекомбинации и не имея по происхождению онкомутаций, замещают в процессе гомологического обмена онколокусы генома раковых клеток пациента, если в непосредственной близости от которых или в них самих была индуцирована поперечная сшивка молекулы ДНК, тем самым, изменяя раковый статус таких клеток на не раковый.
При этом, фрагменты терапевтической ДНК, являясь субстратом для гомологической рекомбинации, участвуют в завершающем этапе репарации, формируя новую неповрежденную цепь ДНК на участках хромосом, не содержащих онкомутаций, подвергшихся атаке цитостатика как в раковых, так и во всех других активно пролиферирующих клетках (СКК, эпителиях, клеток волосяных фолликул), тем самым спасая их от апоптоза и сохраняя их функции. Важнейшим моментом одновременной терапии препаратом фрагментированной ДНК при лечении цитостатиками является момент искусственного создания неестественной для клетки рекомбиногенной активности. При этом рекомбинация происходит как по всему геному (вследствие естественного механизма гомологического замещения в районах хроматина, доступного для таких событий), так и в тех местах, где был индуцирован кросс-линк (практически в любом месте генома). Кросс-линк, в силу химической природы индукторов сшивки, возникает в любом месте генома независимо от его организации любого уровня и независимо от любой конформационной связи ДНК с белками.
Кроме того, в результате искусственно созданной рекомбиногенной ситуации в ядре запускаются несколько механизмов, определяющих скорость и эффективность заместительного терапевтического действия фрагментов экзогенной ДНК. К таким механизмам относятся: а) освобождение двойной цепи ДНК от гистонов на протяжении нескольких мегабаз по обе стороны от возникшего двуцепочечного разрыва; б) происходящие при этом конформационные изменения хроматина в местах хромосом, ранее недоступных для прямого замещения фрагментами экзогенной ДНК, и возникающая, одновременно многократно усиленная возможность прямого замещения гомологичных участков хромосом экзогенными фрагментами ДНК; в) многократно усиливающийся, постоянно протекающий в ядре гомологический обмен между экзогенными фрагментами ДНК и теми участками хроматина, которые упакованы таким образом, что они постоянно доступны для гомологического обмена; г) гомологическая рекомбинация между фрагментами экзогенной ДНК и интермедиатами, возникающими в районе кросс-линка в ходе репарации.
Фактически число химиотерапевтических процедур совместно с введением препарата фрагментированной ДНК донора определяется и контролируется по совокупности всех маркерных тестов, сопровождающих лечение каждого конкретного рака.
Полное замещение всех онкомутаций в геноме зависит от количества кросс-линков на геном, которые попали в места, содержащие онкомутаций, и изменили конформацию хроматина и эффективности механизма прямого гомологичного обмена между фрагментами экзогенной ДНК и соответствующими локусами хроматина, многократно усиливающимся при активации рекомбиногенной ситуации в ядре.
Пример реализации способа
Вместе с вводимым цитостатическим препаратом цисплатины для лечения больных с плоскоклеточным раком кожи туловища путем использования цисплатины в дозе 100 мг/м2 (I день), внутривенно капельно 30 мг/м2 1 раз в неделю, или 60-150 мг/м2 каждые 3-5 недель, или 20 мг/м2 ежедневно 5 дней с повторением каждые 4 недели, или 50 мг/м2 в 1-й и 8-й дни каждые 4 недели, или препаратом митомицин С для лечения больных раком желудка, кишечника, поджелудочной железы, мочевого пузыря, молочной железы, легкого, вульвы, предстательной железы (в составе лекарственных комбинаций), путем использования митомицина С внутривенно в дозе 10 мг/м2 1 раз в 3-4 недели (в составе лекарственных комбинаций) или также 2 мг/м2 с 1-го по 5-й и с 8-го по 12-й дни курса, суммарная доза 50 мг/м2, или препаратом дактиномицина для лечения больных с хориокарциномой матки, саркомой мягких тканей, злокачественных опухолей яичка, меланомы, лимфосаркомы, нейробластом путем использования дактиномицина внутривенно 350 мкг/м2 ежедневно в течение 5 дней каждые 3-5 недель или 1-2 раза в неделю в течение 3-5 недель, суммарная доза 3000 мкг в организм пациента вводится препарат фрагментированной ДНК донора с фрагментами, имеющими биологически активный размер и составляющими полный геном физиологически и генетически здорового донора, в количестве, равном или превышающем количество собственно ДНК плазмы крови и тканевых жидкостей пациента, но не более максимально допустимого количества, равного 30 мкг/мл крови, за один час и через час после введения цитостатика и далее каждые два часа до завершения полного репаративного цикла (12 часов).
Для подтверждения того, что предложенный способ позволяет достигнуть требуемого результата, приведем его теоретическое и экспериментальное обоснование.
Рассмотрим концепцию заместительной терапии препаратом фрагментированной ДНК донора.
Главным моментом заместительной терапии с использованием алогенной ДНК в форме фрагментов с размером, соответствующим фрагментам ДНК, образующимся естественным путем в результате нормально протекающего апоптоза и всегда присутствующих в плазме крови и других инцесциальных жидкостях, является либо создание искусственной общеклеточной рекомбиногенной ситуации в момент нахождения терапевтических фрагментов ДНК во внутриядерном пространстве, либо доставка терапевтических фрагментов в клетки, находящиеся в таком рекомбинационно активном состоянии.
Искусственно индуцированная рекомбиногенная ситуация в клетке возникает при индукции межцепочечных сшивок цитостатическими препаратами.
Действие цитостатических препаратов, используемых при терапии различных раков, основано на их свойстве образовывать двуцепочечные сшивки в произвольных местах генома.
Известно, что одного такого повреждения на клетку при отсутствии системы репарации достаточно, чтобы клетка погибла, вступив на путь апоптотического самоуничтожения. Для клетки гибельным оказывается цитостатический удар, при котором образуется 122 кросс-линка на клетку. При терапевтической дозе цитостатика в геноме клеток организма образуются до 2000 межцепочечных сшивок [8].
Для низших эукариот показано, что в покоящихся клетках (G1/G2 фазы клеточного цикла) репарация возникших межцепочечных сшивок идет за счет активности полимеразы ζ (Rev3), которая способна проходить такое повреждение. Однако использование клеткой этого пути репарации приводит к появлению нуклеотидных замен (мутаций) в последовательности ДНК в непосредственной близости от точки кросс-линка (сшивки), которые затем закрепляются входе репликативного цикла [5]. Кроме этого, как было указано выше, такой путь репарации характерен и для не делящихся клеток высших экуариот и занимает незначительный удельный вес в общей системе репарации межцепочечных сшивок [6, 7].
В активно пролиферирующих клетках, к которым относятся раковые клетки, стволовые клетки разного генеза, клетки волосяных фолликул, клетки различных эпителиев, при индукции поперечных сшивок в молекуле ДНК возникает смертельная для клетки ситуация. Репликативная вилка, которая формируется с частотой порядка одна на 50 т.п.о. (тысяч пар оснований), наталкивается на стерическое препятствие, которое репликативный ферментативный комплекс не в состоянии преодолеть. Репликативная вилка сталируется. Именно остановка репликативной вилки запускает каскад репаративных событий. Немедленно в месте сталирования репликативной вилки формируется эксцизионный комплекс.
Процесс репарации имеет три стадии, разбитых во времени. Первоначально в непосредственной близости к повреждению на уже реплицированной цепи ДНК возникают двуцепочечные разрывы [8, 9, 5], механизм появления которых до настоящего времени остается не изученным. Сразу после этого события активируется эксцизионный репаративный комплекс. Специфические эндонуклеазы делают одноцепочечные надрезы в непосредственной близости от сшивки. Гетеродимер XPF-ERCC1 в присутствии RPA репликативного белка А своей 3'-5' экзонуклеазной активностью гидролизует одну цепь ДНК, продвигаясь на большое расстояние от места сшивки, проходя повреждение насквозь [11, 12]. После завершения этих двух стадий репарации, а именно индукции двуцепочечных разрывов и эксцизионных действий специфических эндонуклеаз, в месте кросс-линка формируется продолжительный одноцепочечный участок, фланкированный двуцепочечным разрывом [10, 9, 7], - структура в высшей степени рекомбиногенная.
Для репарации такого интермедиата клетка использует механизм гомологической рекомбинации. При этом в качестве субстрата для гомологической рекомбинации используется либо сестринская хроматида, либо гомологическая хромосома [9]. После восстановления целостности хромосомы в месте сшивки вновь реассоциируется репликативная ферментативная машина, и репликация возобновляется.
Другой возможный вариант репарации интермедиата, состоящего из двуцепочечного разрыва, расположенного в непосредственной близости к месту формирования репликативной вилки (небольшого участка двуцепочечной ДНК, расположенного перед сайтом кросс-линка, и продолжительного одноцепочечного участка, сформированного в результате экзонуклеазного движения XPF-ERCC1 комплекса), - это двойной гомологический обмен. Вначале по механизму генной конверсии в районе одноцепочечного участка происходит спаривание гомологической последовательности и одноцепочечного участка, содержащего нуклеотид аддукт. После этого эксцизионный репаративный комплекс вырезает место, содержащее кросс-линк на противоположной цепи. Происходит обмен цепями, и брешь достраивается по вновь интегрированной матрице. Далее двуцепочечный разрыв репарируется по механизму кроссинговера с гомологичной последовательностью ДНК, как это было описано выше.
Рассмотрим, что происходит при множественных межцепочечных сшивках, индуцируемых противораковыми препаратами (псорален, цисплатина, митомицин С, мельфолан, нитроген мустард, циклофосфамид и т.п.).
В этом случае немедленно активируется репаративная система клетки. Однако, во-первых, клетка не в состоянии одновременно сформировать достаточное количество репарационных комплексов и в этом случае часть повреждений остается не обслуженной, что приводит к апоптозу всех таких клеток. Во-вторых, при привлечении в качестве субстрата для гомологической рекомбинации гомологической хромосомы или сестринской хроматиды при множественных индуцированных межцепочечных сшивках возникают стерические препятствия к одновременному синапсису нескольких поврежденных участков с несколькими гомологическими участками. Это также препятствует полной репарации всех межцепочечных сшивок и с неизбежностью приводит к апоптозу и гибели клетки. И, в-третьих, при использовании в качестве субстрата для репаративной гомологической рекомбинации гомолога или сестринской хроматиды генетическая мода клетки остается точно такой же, как и до появления сшивки. То есть, если цитостатический диаддукт возник в области гена, мутация в котором привела к ораковлению клетки, то репарация с использованием эндогенного клеточного субстрата не приведет к генетическому изменению мутировавшего гена. Это означает, что если в геноме были раковые мутации, то при такой репарации они сохраняются.
Следовательно, единственный путь избавиться от такой онкомутации - это убить раковую клетку, а заодно и все остальные активно делящиеся клетки организма, что и делают цитостатические препараты.
Препарат фрагментированной ДНК донора с размером фрагментов, соответствующим фрагментам ДНК, образующимся естественным путем в результате нормально протекающего апоптоза и всегда присутствующим в плазме крови и других инцесциальных жидкостях [13, 14, 15], присутствуя в ядерном пространстве в момент возникновения сшивок, становится субстратом для гомологической репаративной рекомбинации, спасая клетки от апоптоза и изменяя раковый статус клетки, как это было описано выше. Фрагменты ДНК принимают участие в завершающей стадии репаративного процесса при восстановлении сшитых между собой цепей ДНК. Известно, что в межхромосомном пространстве ядра могут присутствовать до 2% от гаплоидного генома экстраклеточной ДНК в виде фрагментов с размером, соответствующим размеру фрагментов ДНК, образующимся естественным путем в результате нормально протекающего апоптоза [16]. В результате индукции сшивок и произошедшего сталирования репликативных вилок возникает крайне рекомбиногенная ситуация и активируется рекомбинационная система клетки. Если в этот момент в ядре присутствуют фрагменты ДНК, имеющие гомологию с репарируемым местом и являющиеся субстратом для гомологической рекомбинации, то таковая непременно произойдет и произойдет не с дефектным эндогенным гомологом, а с экзогенной терапевтической ДНК, не содержащей мутации. Вновь интегрированная последовательность закрепится в результате клеточного деления и онкомутация будет ликвидирована.
Важнейшим моментом одновременной терапии препаратом фрагментированной ДНК при лечении цитостатиками является момент искусственного создания неестественной для клетки рекомбиногенной активности. При этом рекомбинация происходит как по всему геному (вследствие естественного механизма гомологического замещения в районах хроматина, доступного для таких событий), так и в тех местах, где был индуцирован кросс-линк (практически в любом месте генома). Кросс-линк, в силу химической природы индукторов сшивки, возникает в любом месте генома независимо от его организации любого уровня и независимо от любой конформационной связи ДНК с белками. В результате искусственно созданной рекомбиногенной ситуации, как было сказано, в ядре запускаются несколько механизмов, определяющих скорость и эффективность заместительного терапевтического действия фрагментов экзогенной ДНК. К таким механизмам относятся: а) освобождение двойной цепи ДНК от гистонов на протяжении нескольких мегабаз по обе стороны от возникшего двуцепочечного разрыва; б) происходящие при этом конформационные изменения хроматина в местах хромосом, недоступных для прямого замещения фрагментами экзогенной ДНК, и возникающая, одновременно многократно усиленная возможность прямого замещения гомологичных участков хромосом экзогенными фрагментами ДНК; в) многократно усиливающийся, постоянно протекающий в ядре гомологический обмен экзогенными фрагментами ДНК и теми участками хроматина, которые упакованы таким образом, что они постоянно доступны для гомологического обмена; г) гомологическая рекомбинация между фрагментами экзогенной ДНК и интермедиатами, возникающими в районе кросс-линка в ходе репарации.
Фактически число химиотерапевтических процедур совместно с введением препарата фрагментированной ДНК донора определяется и контролируется по совокупности всех маркерных тестов, сопровождающих лечение каждого конкретного рака.
Полное замещение всех онкомутаций в геноме зависит от количества кросс-линков на геном, которые попали в места, содержащие онкомутации, и изменили конформацию хроматина, и эффективности механизма прямого гомологичного обмена между фрагментами экзогенной ДНК и соответствующими локусами хроматина, многократно усиливающимся при активации рекомбиногенной ситуации в ядре.
Для определения возможности использования предложенного способа лечения для широкого класса представителей животного мира последний этап репарации межцепочечной сшивки, а именно интеграция экзогенной ДНК в реципиентный геном после обработки цитостатиком, был изучен на модели мышь - человеческая фрагментированная ДНК. В результате проведенных экспериментов удалось интегрировать в геном экспериментальных мышей Alu-повторы человека в области, содержащие гомологические последовательности, относящиеся к классу умеренных повторов мыши В1.
Аналогичным образом экзогенная ДНК воздействует и на здоровые клетки организма, подвергшиеся воздействию цитостатика. В этом случае фрагменты экзогенной терапевтической ДНК, участвуя в репарационных событиях в здоровых клетках, спасают эти клетки от апоптоза, чем способствуют сохранению клеточных популяций различных тканей - СКК, эпителия и т.д., облегчая тем самым протекание химиотерапии и позволяя более четко планировать последующие циклы обработки цитостатиком.
В современной научной литературе подробно изучен вопрос репарации межцепочечных сшивок, индуцированных кросс-линкирующими агентами. Однако нигде не поднимался вопрос об использовании фрагментов экзогенной экстрахромосомальной ДНК для гомологического обмена при завершающей стадии репарации сшивок. Ниже приводится экспериментальное доказательство участия экзогенных фрагментов ДНК в репарации рекомбиногенных структур - одноцепочечного участка и двуцепочечных разрывов индуцированных возникшим кросс-линком между цепями хромосомной ДНК.
В наших ранних работах [16, 17] была высказана гипотеза о существовании естественного механизма, который может влиять на генетическую составляющую клетки многоклеточных организмов, используя внеклеточную геномную ДНК из биологических жидкостей, как внешний геномный стандарт. Согласно предложенному механизму ДНК связывающие рецепторы, располагающиеся на клеточной поверхности, доставляют фрагменты геномной ДНК из внешней среды (плазма крови, межтканевая жидкость, лимфа), образовавшиеся в результате естественно протекающего апоптоза в ядро, и этот оборот непрерывен. В ядерном пространстве интернализированные фрагменты ДНК могут участвовать во всех описанных системах репарации, в которых наличие неповрежденной гомологичной последовательности является необходимым условием протекания процесса.
Согласно анализу литературных данных и приведенной выше концепции, если в кровяном русле организма, подвергающегося воздействию сильного кросс-линкирующего мутагена, будут присутствовать фрагменты ДНК, имеющие гомологию с геномными последовательностями реципиентного организма, то эти фрагменты будут использоваться как субстрат для гомологической рекомбинации при репарации индуцированных цитостатиком повреждений и одновременно как субстрат для прямого гомологичного обмена с соответствующими локусами хроматина, многократно усиливающийся при активации рекомбиноге