Синтез эфиров 2-хлорметил-6-метилбензойной кислоты
Иллюстрации
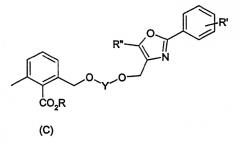
Показать всеИзобретение относится к новым соединениям формулы (I), в которой R означает Н, (С1-С12)-алкил или (С1-С4)-алкил-(С6-С12)-арил, причем в алкиле одна или несколько СН2-групп могут быть заменены на -О-, и к способу получения этих соединений, заключающемуся в том, что эфир диметилбензойной кислоты формулы (II), где R имеет вышеуказанное значение, вводят во взаимодействие с хлорирующим реагентом в инертном растворителе или без растворителя, при температуре выше 40°С и затем, в случае необходимости, подвергают очистке. Соединения формулы (I) представляют собой ценные промежуточные продукты при синтезе агонистов PPAR формулы (С), в которой R означает Н, (С1-С12)-алкил или (С1-С4)-алкил-(С6-С12)-арил, причем в алкиле одна или несколько СН2-групп могут быть заменены на -О; Y означает -(СН2)3-, 1,3-фенилен, 1,3-циклогександиил; R′ означает Н, F, Br, CF3, (С1-С6)-алкил, О-(С1-С6)-алкил, фенил; R′′ означает Н, (С1-С6)-алкил, (С1-С3)-алкилфенил, (С5-С6)-циклоалкил, фенил, CF3; получаемых взаимодействием соединения формулы (С1) с соединениями формулы (I) в толуоле, N-метилпирролидоне или других апротонных растворителях, в присутствии пригодного основания, при температуре от -78°С до +50°С с последующей экстрактивной обработкой и, в случае необходимости, кристаллизацией конечного продукта.
4 н. и 4 з.п. ф-лы.
Реферат
Производные 2-галогеналкилбензойной кислоты используют в качестве компонентов для синтеза фармацевтических биологически активных веществ. По разным причинам для использования нужно иметь желательные, стабильные при хранении соединения, которые к тому же можно простым образом получать и очищать. К этим причинам относят, например, обеспечение постоянного качества, избежание частых контрольных анализов веществ для протоколирования качества продукта, избежание необходимости хранений в холодильниках и/или использований хладотранспорта, легкое введение в промышленные установки, а также простую очистку используемых резервуаров.
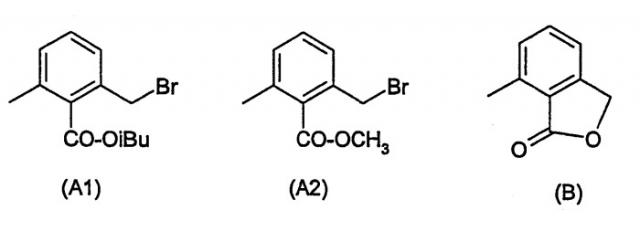
Эфиры 2-бромметил-6-метилбензойной кислоты (А1 и А2), например, известны из Международной заявки WO-00/64888 (R = изобутил (А1)) и Международной заявки WO-00/64876 (R = метил (А2)). Эти соединения нестабильны при комнатной температуре, так как они спонтанно циклизуются до лактона (В) и при этом, как известно, высвобождают мутагенные алкилбромиды в качестве побочного продукта.
Поэтому использование этих термонестабильных веществ в промышленном масштабе связано с риском в отношении гигиены труда, трудностями и дополнительными издержками.
Эфиры 2-бромметил-6-метилбензойной кислоты представляют интерес, в частности, в качестве исходных веществ для получения агонистов PPAR, как описывается, например, в Международных заявках WO-00/64888, WO-00/64876 и WO-03/020269. В данном случае в особенности следует назвать соединения формулы (С):
где
R означает Н, (С1-С12)-алкил, (С3-С8)-циклоалкил, (С6-С12)-арил, (С1-С4)-алкил-(С6-С12)-арил или (С5-С10)-гетероарил, и причем в алкиле и циклоалкиле одна или несколько СН2-групп могут быть заменены на -О- и алкил, циклоалкил и арил могут быть замещены галогеном;
Y означает -(СН2)3-, 1,3-фенилен, 1,3-циклогександиил;
R' означает H, F, Br, CF3, (С1-С6)-алкил, О-(С1-С6)-алкил, фенил;
R" означает Н, (С1-С6)-алкил, (С1-С3)-алкилфенил, (С5-С6)-циклоалкил, фенил, CF3.
Предпочтительно следует назвать соединения формулы (С), в которых фенильный цикл замещен радикалом R' в м- или п-положении.
Задачей изобретения является получение более стабильных соединений, чем (А1) и (А2), которые не обладают вышеописанными недостатками. Дополнительно, соединения, которые при их получении из исходного продукта также могут образовываться с еще недостаточной степенью чистоты, в противоположность соединениям формул (А1) и (А2) должны быть способными подвергаться очистке.
Этого достигают с помощью нижеописанных соединений формулы (I).
Объектом изобретения являются соединения формулы (I):
где
R означает Н, (С1-С12)-алкил, (С3-С8)-циклоалкил, (С6-С12)-арил, (С1-С4)-алкил-(С6-С12)-арил или (С5-С10)-гетероарил, и причем в алкиле и циклоалкиле одна или несколько СН2-групп могут быть заменены на -О- и алкил, циклоалкил и арил могут быть замещены галогеном.
Предпочтительны соединения формулы (I), где
R означает (С1-С8)-алкил, (С3-С6)-циклоалкил или (С1-С4)-алкил-(С6-С12)-арил, которые могут быть замещены галогеном, и причем одна или две СН2-группы могут быть заменены на -О-.
Особенно предпочтительны соединения формулы (I), где
R означает (С1-С6)-алкил или (С1-С4)-алкил-(С6-С12)-арил, которые могут быть замещены галогеном, и причем одна СН2-группа может быть заменена на -О-.
В высшей степени предпочтительны соединения формулы (I), где
R означает метил, этил, пропил, изопропил, трет-бутил, фенил, 2-метоксиэтил или бензил.
Алкил может быть разветвленным или неразветвленным. Галоген означает Cl, Br, I, предпочтительно Cl. Под гетероарилом понимают 5-10-членные ароматические циклы, которые содержат от одного до четырех одинаковых или разных гетероатомов из ряда N, O, S, как, например, пиррол, имидазол, пиразол, пиридин, пиразин, пиримидин, пиридазин, фуран, тиофен, оксазол, изоксазол, тиазол, изотиазол, триазол, тетразол, триазин, тетразин; предпочтительными являются пиррол, имидазол, оксазол, тиазол и пиридин.
Объектом изобретения, далее, является способ получения соединений формулы (I):
где
R означает Н, (С1-С12)-алкил, (С3-С8)-циклоалкил, (С6-С12)-арил, (С1-С4)-алкил-(С6-С12)-арил или (С5-С10)-гетероарил, и причем в алкиле и циклоалкиле одна или несколько СН2-групп могут быть заменены на -О- и алкил, циклоалкил и арил могут быть замещены галогеном,
отличающийся тем, что эфиры диметилбензойной кислоты формулы (II):
где R имеет вышеуказанное значение, вводят во взаимодействие с хлорирующим реагентом, как, например, сульфурилхлорид, N-хлорсукцинимид (NCS), 1,3-дихлор-5,5-диметилгидантоин (NDDH) или трихлоризоциануровая кислота [Org. Process Research and Development, 6, 384-393 (2002)], в инертном растворителе, как, например, CCl4, хлорбензол, или без растворителя, при температуре выше 40°С и, в случае необходимости, затем подвергают очистке.
Реакцию предпочтительно проводят при температуре 60-90°С. При более низких температурах, как 40°С, наблюдают хлорирование в ароматической части. Очистку осуществляют предпочтительно путем перегонки или путем фильтрации через силикагель.
Хлорсодержащие соединения формулы (I) недоступны или только очень малодоступны за счет хлорирования с раскрытием цикла лактонов (В), так как лактоновый скелет очень стабилен. Далее, производные 2-хлорметилбензойной кислоты неожиданно способны подвергаться перегонке, при этом их можно выделять с отличной с химической точки зрения степенью чистоты и при хранении они спонтанно не реагируют с образованием лактонов.
Превращение хлорсодержащих соединений формулы (I) в более реакционно-способные бром- или иодсодержащие соединения также может быть полезным для повышения реакционной способности этого структурного элемента молекулы при дальнейшем синтезе (например, для получения агонистов PPAR (C)). Эти соединения, однако, тогда обладают указанными во введении "техническими" недостатками. Превращение хлорсодержащего соединения в бром- или иодсодержащее соединение осуществляют с помощью галогенидов щелочных металлов в инертных растворителях, предпочтительно с помощью бромида или иодида натрия в ацетоне при температуре кипения с обратным холодильником. Альтернативно, перегалогенирование и дальнейший синтез можно осуществлять также в виде одностадийного способа при использовании каталитических или стехиометрических количеств алкилгалогенида, в пересчете на используемое хлорсодержащее соединение.
Объектом настоящего изобретения, далее, является способ получения соединений формулы (С):
где
R означает Н, (С1-С12)-алкил, (С3-С8)-циклоалкил, (С6-С12)-арил, (С1-С4)-алкил-(С6-С12)-арил или (С5-С10)-гетероарил, и причем в алкиле и циклоалкиле одна или несколько СН2-групп могут быть заменены на -О- и алкил, циклоалкил и арил могут быть замещены галогеном;
Y означает -(СН2)3-, 1,3-фенилен, 1,3-циклогександиил;
R' означает H, F, Br, CF3, (С1-С6)-алкил, О-(С1-С6)-алкил, фенил;
R" означает Н, (С1-С6)-алкил, (С1-С3)-алкилфенил, (С5-С6)-циклоалкил, фенил, CF3;
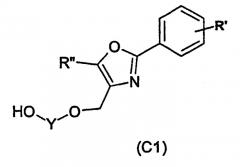
отличающийся тем, что соединения формулы (С1):
где Y, R' и R" имеют вышеуказанное значение, вводят во взаимодействие с соединениями формулы (I):
где R имеет вышеуказанное значение, в толуоле, N-метилпирролидоне или других апротонных растворителях, в присутствии пригодного основания, предпочтительно при использовании трет-бутилата калия, при температуре от -78°С до +50°С, предпочтительно при температуре от -30°С до +20°С, и затем подвергают экстрактивной обработке и, в случае необходимости, конечный продукт кристаллизуют.
Соединения формулы (I) отличаются высокой стабильностью по сравнению с соответствующими бромсодержащими соединениями. Если сравнивают стабильность метилового эфира 2-бромметил-6-метилбензойной кислоты со стабильностью аналогичного хлорсодержащего соединения, обнаруживают следующий результат: метиловый эфир 2-хлорметил-6-метилбензойной кислоты может перегоняться без разложения при температуре от 66°С до 77°С при давлении 0,1 мбар, лишь температура низа колонны выше 120°С приводит к значительному образованию лактона. При комнатной температуре они могут сохранять стабильность в течение нескольких месяцев. Стабильность при хранении метилового эфира 2-бромметил-6-метилбензойной кислоты четко отличается от этого. При комнатной температуре количество бромсодержащего соединения быстро уменьшается в течение нескольких дней, в течение недели от 92,6% до 81,0%, в течение 2 недель до 67,8% и в течение 2 месяцев до 7,8%. Одновременно увеличивается количество лактона от 1,9% до более 13,9% спустя 2 недели и до 89,5% за 2 месяца.
Ниже приводятся следующие примеры, не ограничивающие объема охраны изобретения:
Пример 1
Синтез метилового эфира 2-хлорметил-6-метилбензойной кислоты
11,9 г Метилового эфира 2,6-диметилбензойной кислоты в 50 мл хлорбензола при комнатной температуре смешивают с 8,2 г сульфурилхлорида и 40 мг азобисизобутиронитрила. Перемешивают в течение 2 часов при температуре 60-90°С. Затем смешивают с 80 мл насыщенного раствора NaHCO3. После разделения фаз органическую фазу промывают с помощью 100 мл 10%-ного раствора Na2SO3, органическую фазу сушат над сульфатом магния и хлорбензол отгоняют в вакууме. Получают 15,5 г бесцветной жидкости. Продукт перегоняют в высоком вакууме (0,1 мбар; 66-77°С). Выход: 10,2 г (71% от теории; чистота 95,2% по данным жидкостной хроматографии (ЖХ)).
Пример 2
Синтез изопропилового эфира 2-хлорметил-6-метилбензойной кислоты
19,2 г Изопропилового эфира 2,6-диметилбензойной кислоты в 100 мл тетрахлорида углерода при комнатной температуре смешивают с 13,3 г N-хлорсукцинимида и 200 мг азобисизобутиронитрила. Кипятят с обратным холодильником в течение 3 часов. После охлаждения отфильтровывают под вакуумом и сукцинимид промывают с помощью 20 мл тетрахлорида углерода. Фильтраты объединяют и тетрахлорид углерода отгоняют в вакууме. Получают 21,8 г бесцветной жидкости. Продукт перегоняют в высоком вакууме (0,05 мбар; 94-97°С). Выход: 13,9 г (61% от теории; чистота 93,6% по данным ЖХ).
Пример 3
Синтез 2-метоксиэтилового эфира 2-хлорметил-6-метилбензойной кислоты
10,4 г 2-Метоксиэтилового эфира 2,6-диметилбензойной кислоты при комнатной температуре смешивают с 5,4 г сульфурилхлорида и 40 мг азобисизобутиронитрила. Перемешивают в течение 1-2 часов при температуре 60-90°С. Затем смешивают с 20 мл воды, фазы разделяют и органическую фазу сушат над сульфатом магния. Продукт перегоняют в высоком вакууме (0,02 мбар; 95-103°С). Выход: 6,4 г (66% от теории; чистота 91,8% по данным ЖХ).
Пример 4
Синтез бензилового эфира 2-хлорметил-6-метилбензойной кислоты
12,0 г Бензилового эфира 2,6-диметилбензойной кислоты в 50 мл тетрахлорида углерода при комнатной температуре смешивают с 5,4 г сульфурилхлорида и 40 мг азобисизобутиронитрила. Перемешивают в течение 4-5 часов при температуре кипения с обратным холодильником. Затем смешивают с 40 мл насыщенного раствора NaHCO3. После разделения фаз органическую фазу промывают с помощью 50 мл 10%-ного раствора сульфита натрия и органическую фазу сушат над сульфатом магния. Содержащий продукт раствор фильтруют через силикагель и дополнительно промывают с помощью 20 мл тетрахлорида углерода. После отгонки растворителя в вакууме получают продукт в виде светло-желтого масла. Выход: 8,0 г (73% от теории; чистота 88,4% по данным ЖХ).
Пример 5
2-Метил-6-[3-(2-фенилоксазол-4-илметокси)пропоксиметил]-бензойная кислота
4,8 г Метилового эфира 2-хлорметил-6-метоксибензойной кислоты при комнатной температуре растворяют в 250 мл ацетона и смешивают с 35 г иодида натрия. Смесь кипятят с обратным холодильником в течение 6 часов. Затем растворитель удаляют в вакууме при температуре 0°С. Остаток анализируют путем жидкостной хроматографии с масс-спектрометрией (чистота метилового эфира 2-иодметил-6-метилбензойной кислоты 87,7% по данным анализа) и растворяют в 20 мл толуола. Раствор в течение 10 минут при температуре -20°С прикапывают к смеси 5,0 г 3-(2-фенилоксазол-4-илметокси)пропан-1-ола, 4,8 г трет-бутилата калия и 30 мл толуола. Затем перемешивают в течение 6 часов при температуре 20°С, разбавляют с помощью 100 мл воды и водную фазу отделяют. Органическую фазу смешивают с 40 мл N-метилпирролидона и 10 мл 32%-ного раствора гидроксида натрия и в течение 8 часов кипятят с обратным холодильником при использовании водоотделителя. После этого смешивают с 100 мл воды и экстрагируют два раза по 25 мл метил-трет-бутиловым эфиром. Водную фазу подкисляют с помощью 5 мл уксусной кислоты и экстрагируют два раза по 50 мл этилацетатом. После разделения фаз органическую фазу сушат над сульфатом магния и растворитель удаляют в вакууме. После кристаллизации из диизопропилового эфира получают 4,2 г 2-метил-6-[3-(2-фенилоксазол-4-илметокси)пропоксиметил]бензойной кислоты (50% от теории; чистота 99,2% по данным высокоэффективной жидкостной хроматографии).
1. Соединения формулы (I):
где R означает Н, (С1-С12)-алкил или (С1-С4)-алкил-(С6-С12)-арил, причем в алкиле одна или несколько СН2-групп могут быть заменены на -О-.
2. Соединения формулы (I) по п.1, где R означает (С1-С8)-алкил, или (С1-С4)-алкил-(С6-С12)-арил, причем одна или две СН2-группы могут быть заменены на -О-.
3. Соединения формулы (I) по п.1 или 2, где R означает (С1-С6)-алкил или (С1-С4)-алкил-(С6-С12)-арил, причем одна СН2-группа может быть заменена на -О-.
4. Соединения формулы (I) по п.1 или 2, где R означает метил, этил, пропил, изопропил, трет-бутил, 2-метоксиэтил или бензил.
5. Способ получения соединений формулы (I) по пп.1-4, отличающийся тем, что эфир диметилбензойной кислоты формулы (II)
где R имеет вышеуказанное значение, вводят во взаимодействие с хлорирующим реагентом в инертном растворителе или без растворителя, при температуре выше 40°С, и затем, в случае необходимости, подвергают очистке.
6. Способ получения соединений формулы (С)
где R означает Н, (С1-С12)-алкил или (С1-С4)-алкил-(С6-С12)-арил, причем в алкиле одна или несколько СН2-групп могут быть заменены на -О-;
Y означает -(СН2)3-, 1,3-фенилен, 1,3-циклогександиил;
R′ означает Н, F, Br, CF3, (С1-С6)-алкил, О-(С1-С6)-алкил, фенил;
R′′ означает Н, (С1-С6)-алкил, (С1-С3)-алкилфенил, (С5-С6)-циклоалкил, фенил, CF3;
отличающийся тем, что соединения формулы (С1)
где Y, R′ и R′′ имеют вышеуказанное значение, вводят во взаимодействие с соединениями формулы (I)
где R имеет вышеуказанное значение, в толуоле, N-метилпирролидоне или других апротонных растворителях, в присутствии пригодного основания, при температуре от -78 до 50°С и затем подвергают экстрактивной обработке и в случае необходимости конечный продукт кристаллизуют.
7. Способ получения соединений формулы (С) по п.6, где фенильный цикл замещен остатком R′ в м- или п-положении.
8. Применение соединений формулы (I) по пп.1-4 для получения агонистов PPAR общей формулы (С).