Аутологичные клетки моноцитарного происхождения, индуцирующие аутотолерантность, и их применение в фармацевтических препаратах
Иллюстрации
Показать всеНастоящее изобретение относится к медицине, а именно к иммунотерапии. Предложен способ получения и/или размножения аутологичных регуляторных Т-клеток моноцитарного происхождения, коэкспрессирующих на своей поверхности антигены CD3 и CD14. Клетки пригодны для профилактики и/или лечения заболеваний, обусловленных нарушением аутотолерантности, в частности, аутоиммунных заболеваний и аллергий, а также для производства фармацевтических препаратов. Данные клетки являются аутологичными для пациента, которому они должны быть введены. 10 н. и 28 з.п. ф-лы, 4 табл., 12 ил.
Реферат
Изобретение относится к аутологичным клеткам моноцитарного происхождения, способным индуцировать иммунную аутотолерантность у пациента. Указанные клетки далее обозначены как "STIC" (клетки, индуцирующие аутотолерантность). Изобретение относится также к применению STIC в фармацевтических препаратах для профилактики и/или лечения заболеваний, обусловленных нарушением аутотолерантности, таких как аутоиммунные и аллергические заболевания.
Применительно к настоящему изобретению термин "аутологичные клетки" означает, что STIC получены из моноцитов крови соответствующего пациента, которому должны быть введены указанные STIC.
Авторы настоящего изобретения установили, что клетки по изобретению способны индуцировать регуляторные Т-клетки (TregCD4+25+). Поэтому настоящее изобретение относится также к индукции и/или получению in vitro регуляторных Т-клеток.
Иммунная система защищает организм от потенциально патогенных антигенов, таких как, например, микроорганизмы, и при этом обычно не взаимодействует с элементами самого организма, то есть здоровая иммунная система толерантна к "аутоантигенам".
Нарушение аутотолерантности происходит тогда, когда специфические адаптивные (приобретенные) иммунные реакции направлены против аутоантигенов.
Нормальным следствием адаптивной иммунной реакции против чужеродного антигена является удаление данного антигена их организма. Однако при возникновении адаптивной иммунной реакции против аутоантигенов механизмы иммунных эффекторов не могут полностью элиминировать данный антиген, в результате чего возникает постоянная реакция. Вследствие этого эффекторные пути иммунитета вызывают хроническое воспалительное поражение тканей, которое может оказаться летальным (см. публикацию Immuno Biology 5, The Immune System In Health and Disease, Garland Publishing 2001, Chapter 13, pages 501-522).
Адаптивные иммунные реакции возникают в результате активации антигенспецифических Т- и/или В-клеток, при этом считается, что аутоиммунитет инициируется аналогичным образом (Immuno Biology, loc. cit. p. 501).
Один из предпочтительных вариантов осуществления изобретения относится к лечению и/или профилактике аутоиммунных заболеваний с использованием фармацевтических препаратов, содержащих STIC.
Можно выделить две основные группы аутоиммунных заболеваний. Заболевания, в которых аутоиммунитет ограничен определенными органами организма, известны как "органспецифические" аутоиммунные заболевания, в то время как в случае "системных" аутоиммунных заболеваний поражаются многие ткани организма. Примеры органспецифических аутоиммунных заболеваний включают хронический лимфоматозный тиреоидит и болезнь Грейвса, которые поражают главным образом щитовидную железу, и инсулинзависимый сахарный диабет типа I, который поражает панкреатические островки. Примеры системных аутоиммунных заболеваний включают системную красную волчанку и первичный ксеродерматоз, которые могут поражать разные ткани, такие как кожа, почки и головной мозг (см. публикацию Immuno Biology, loc.cit, page 503).
Существуют аутоиммунные заболевания, которые, как считается, опосредованы главным образом Т-клетками, в частности, инсулинзависимый сахарный диабет, ревматоидный артрит и рассеянный склероз, при этом в других заболеваниях главную роль играет образование антител к антигенам поверхности клеток или матриксу, как, например, в случае аутоиммунной гемолитической анемии, аутоиммунной тромботической пурпуры, синдрома Гудпастура, обыкновенной пузырьчатки или острой ревматической атаки; еще одну группу заболеваний составляют смешанные иммунные заболевания, опосредованные как Т-клетками, так и В-клетками, какими, например, являются смешанная цироглобулиномия, системная красная волчанка или ревматоидный артрит (см. публикацию Immuno Biology, loc. cit, Fig. 13.1 on page 502).
Другой вариант осуществления изобретения относится к лечению аллергический заболеваний при помощи клеток STIC по настоящему изобретению, которые входят в состав фармацевтических препаратов.
Недавно было сделано предположение, что регуляторные Т-клетки играют важную роль в регулировании иммунного гомеостаза, то есть общей иммунной реакции, возникающей на любую инфекционную или антигенную мишень, включая иммунную аутотолерантность; см. публикации Takeshi Takahashi and Shimon Sakaguchi, International Review of Cytology, 225, 1-32 (2003); Shimon Sakaguchi, Vox Sang 83, 151-153 (2002), Kathryn J. Wood and Shimon Sakaguchi, Nature Reviews Immunology, 3, 199-210 (2003).
Как указано в публикации Takahashi et al., loc. cit. page 1, Abstract, "накопленные данные показывают, что опосредуемый Т-клетками доминирующий контроль за аутореактивными Т-клетками способствует сохранению иммунной аутотолерантности, и ее нарушение может вести к возникновению аутоиммунного заболевания. Усилия, направленные на трансдифференцировку популяций таких регуляторных Т-клеток, показали, что регуляторной активностью обладают CD 25+ клетки в популяции CD4+ клеток здоровых незараженных животных, включая человека. CD25+ и CD4+ регуляторные Т-клетки продуцируются здоровым тимусом в виде функционально отличной субпопуляции Т-клеток. Указанные клетки играют важную роль не только в предотвращении аутоиммунитета, но также в регулировании разных иммунных реакций".
Помимо аутоиммунных заболеваний, опосредованных Т-клетками, В-клетки иммунной системы могут активировать аутоагрессивные заболевания, обусловленные продуцированием антител против аутоантигенных клеток (включая мастоциты), тканей и органов.
Хорошо известно, что активация В-клеток зависит от Т-клеток и выражается в том, что Т-клетки-хелперы стимулируют клональную экспансию В-клеток в результате представления специфических антигенов. Указанные антигены могут быть выделены из фрагментированных аллергенов и затем процессированы в Т-клетках с образованием низкомолекулярных пептидов. После чего происходит представление таких антигенов при помощи главного комплекса гистосовместимости (МНС) для стимуляции антигенспецифической активации.
Для предотвращения неконтролируемой или избыточной активации В-клеток, вызываемой специфическими аллергенами, которая, с одной стороны, ведет к возникновению аллергических заболеваний, и, с другой стороны, может индуцировать нарушение аутотолерантности (см. выше), регуляторные Т-клетки обладают способностью препятствовать обусловленной Т-клетками активации В-клеток и предотвращать избыточное и неконтролируемое продуцирование антител.
Поэтому подобно аутоиммунным заболеваниям аллергические заболевания можно контролировать, увеличивая количество регуляторных Т-клеток (CD4+/CD25+ Т-клетки). В частности, было установлено, что у мышей, страдающих ЕАЕ ("экспериментальный аллергический энцефаломиелит"), болезнь ослабевает через две недели после введения указанным животным CD4+ Т-клеток, при этом выздоровление ассоциировано с устойчивостью к любой последующей индукции заболевания (Bach, J.F. "Regulatory T Cells under Scrutiny" Nature Reviews Immunology 3: 189-198 (2003); Land, Z et al. "Effect of cyclophosphamide on suppressor-cell activity in mice unresponsive to EAE" J. Immunol. 123: 21556-2160 (1979)). Указанные воздействия аналогичны воздействиям, продемонстрированным для мышей NOD, у которых развитие аутоиммунного диабета можно остановить благодаря введению CD4+ клеток, которые защищают указанных мышей от новых вспышек аутоиммунного заболевания (Bach, J.F., loc. cit.).
Примеры аллергических заболеваний, которые могут быть ассоциированы с аутоиммунными реакциями, включают все типы аллергий, индуцированных чужеродными белками, органическими и неорганическими веществами, попадающими в организм. Особое значения в данной связи имеют аллергии, вызываемые пыльцой, такие как, например, сенная лихорадка, и аллергии, вызываемые такими аллергенами как лекарственные средства, химические вещества, вирусы, бактерии, грибы, бытовая пыль, пищевые компоненты, металлы, газ, элементы тела животных, такие как шелушение кожи или шерсть, и испражнения животных.
В настоящее время отсутствуют эффективные терапевтические методы для профилактики и/или лечения заболеваний, возникающих вследствие нарушения аутотолерантности.
Для лечения органспецифических аутоиммунных заболеваний применяют заместительную терапию, трансплантацию или симптоматическую терапию противовоспалительными средствами, такими как кортизон. Для лечения системных аутоиммунных заболеваний часто используют иммуносупрессивные средства. Очевидно, что такие "методы лечения" являются проблематичными во многих отношениях и характеризуются серьезными побочными эффектами.
Известно, что до 5% населения страдают аутоиммунными заболеваниями (Sakagushi, loc. cit., page 151, left column). Поэтому существует насущная потребность в эффективных средствах профилактики и/или лечения заболеваний, обусловленных нарушением аутотолерантности, которые просты в применении, не вызывают опасные для здоровья побочные эффекты и позволяют снизить затраты, связанные с использованием известных в настоящее время методов и средств для лечения таких заболеваний.
Настоящее изобретение решает проблему получения усовершенствованных средств для профилактики и/или лечения заболеваний, обусловленных нарушением аутотолерантности.
Для решения данной проблемы авторы настоящего изобретения предлагают использовать аутологичные клетки моноцитарного происхождения, индуцирующие аутотолерантность (STIC), полученные у позвоночных, в частности, у млекопитающих и более предпочтительно у человека. Указанные клетки получают способом, описанным в настоящем изобретении, в результате осуществления которого создают модифицированные клетки, способные увеличивать количество регуляторных Т-лимфоцитов (CD4+/CD25+ Т-клеток) в организме пациента. При введении в количестве около 105 клеток/кг массы тела указанные клетки могут служить для профилактики и/или лечения заболеваний, обусловленных нарушением аутотолерантности.
Краткое описание чертежей
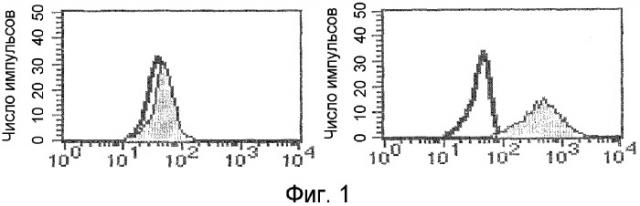
Фиг.1. Определение методом проточной цитометрии способности GM-7 связываться с исходными моноцитами до (график с левой стороны) и после (график с правой стороны) модификации клеток по настоящему изобретению. На оси Х указано число связанных клеток.
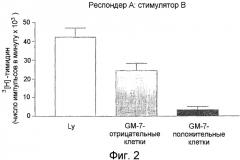
Фиг.2. Смешанная культура лимфоцитов, содержащая CD14+ моноциты, полученные у пациента В (GM-7-: столбец серого цвета; GM-7+: столбец черного цвета), клетки-респондеры, полученные у МНС-дискордантного донора А, и облученные клетки, полученные у донора В, и используемая для сравнения супрессорной активности CD14+/GM-7+ и CD14+/GM-7- клеток.
Фиг.3. Определение методом проточной цитометрии числа CD14+ моноцитов и CD2+ лимфоцитов во фракции моноцитов, а также числа CD-14+/CD3+ клеток, эффективно действующих в качестве TAIC, для выявления влияния процесса очистки клеток, используемых для увеличения числа моноцитов, в начале культивирования на образование иммуносупрессорных CD14+/CD3+ клеток.
Фиг.4. Смешанная культура лимфоцитов, содержащая РНА-стимулированные лимфоциты (PhaLy) и TAIC ("Mo+Ly" или "Mo"), предварительно инкубированная в двух экспериментах с ингибитором (1-МТ) индоламин-2,3-диоксигеназы (IDO) для определения влияния 1-МТ на супрессорную активность TAIC.
Фиг.5. Определение методом проточной цитометрии экспрессии GM-7 в крови оперированных пациентов до (левая фигура) и после (правая фигура) инъекции TAIC для выявления влияния TAIC на экспрессию GM-7 in vivo в клетках крови.
Фиг.6. Окрашивание Н&Е срезов ободочной кишки мышей, страдающих хроническим колитом, вызванным декстрансульфатом натрия (DSS), иллюстрирующее состояние ободочной кишки у животного в группе 3, не получавшего никакого лечения (фиг. 6А/В), у животного в группе 1, которому вводили STIC в день +1 после прекращения воздействия DSS (фиг. 6С/D), у животного в группе 4, которому вводили "контрольные клетки" в день +1 (фиг. 6Е), и у животного, которому вводили STIC в день +7 (фиг. 6F). (2,5-кратное увеличение на фиг. 6А/C/E; 10-кратное увеличение на фиг. 6В/D/F).
Фиг.7. Изменения массы тела мышей, страдающих хроническим колитом, вызванным декстрансульфатом натрия (DSS), на протяжении 3 недель после прекращения воздействия DSS. Животным в группе 1 вводили STIC в день +1, животным в группе 2 (▴) вводили STIC в день +7, животные в группе 3 (▾) не получали никакого лечения, в то время как животным в группе 4 (●) вводили "контрольные клетки" в день +1. Приведенные величины являются средними значениями, полученными у 5-7 мышей в группе, стандартное отклонение всегда меньше ±15%.
Фиг.8. Результаты балльной оценки гистохимически окрашенных срезов ободочной кишки у мышей, страдающих хроническим колитом, вызванным декстрансульфатом натрия (DSS). Животным в группе 1 вводили STIC в день +1, животным в группе 2 вводили STIC в день +7, животные в группе 3 не получали никакого лечения, в то время как животным в группе 4 вводили "контрольные клетки" в день +1. (оценка 0 = отсутствие колита; оценка 1 = минимальный колит; оценка 2 = колит средней тяжести; оценка 3 = тяжелый колит; и оценка 4 = язвенный колит, сопровождающийся разрушением всей слизистой оболочки).
Фиг.9. Изменения массы тела мышей в модели хронического экспериментального колита, вызванного переносом CD62L+/CD4+ лимфоцитов мышам с тяжелым комбинированным иммунодефицитом (SCID), по сравнению с массой тела мышей через 6 недель после начала эксперимента, когда их подвергали воздействию клеточной терапии. Животным в группе 1 вводили STIC через 6 недель, животные в группе 2 не получали никакого лечения и животным в группе 3 (▴) вводили "контрольные клетки" через 6 недель. Приведенные величины являются средними значениями, полученными у 6 мышей в группе, стандартное отклонение всегда меньше ± 15%.
Фиг.10. Измерение длины ободочной кишки (фиг. 10А) и массы селезенки (фиг. 10В) у мышей, которым вводили STIC (группа 1), у контрольных мышей, не получавших никакого лечения (группа 2), и у мышей, которым вводили "контрольные клетки" (группа 3), в модели хронического экспериментального колита, вызванного переносом CD62L+/CD4+ лимфоцитов мышам с SCID. Приведенные величины являются средними значениями ± стандартная ошибка среднего.
Фиг.11. Балльная оценка гистохимически окрашенных срезов ободочной кишки у мышей в модели хронического экспериментального колита, вызванного переносом CD62L+/CD4+ лимфоцитов мышам с SCID, через шесть недель после переноса клеток. Животным в группе 1 вводили STIC, животные в группе 2 не получали никакого лечения и им не инъецировали клетки, в то время как животным в группе 3 вводили "контрольные клетки". Приведенные величины являются средними значениями ± стандартная ошибка среднего. (оценка 0 = отсутствие колита; оценка 1 = минимальный колит; оценка 2 = колит средней тяжести; оценка 3 = тяжелый колит; и оценка 4 = язвенный колит, сопровождающийся разрушением всей слизистой оболочки).
Фиг.12. Окрашивание Н&Е срезов ободочной кишки у мышей в модели хронического экспериментального колита, вызванного переносом CD62L+/CD4+ лимфоцитов мышам с SCID, иллюстрирующее состояние ободочной кишки у двух животных в группе 2, не получавших никакого лечения (фиг. 12А/В), у двух животных в группе 3, которым вводили "контрольные клетки" (фиг. 12С/D), и у двух животных в группе 1, которым вводили STIC (фиг. 12Е/F) (100-кратное увеличение).
Сущность изобретения
Основные стадии способа получения аутологичных клеток моноцитарного происхождения, индуцирующих аутотолерантность (STIC), включают:
(а) выделение моноцитов из крови соответствующего пациента, которому должны быть введены указанные клетки;
(b) размножение моноцитов в приемлемой культуральной среде, содержащей фактор колониеобразования макрофагов (далее именуемый М-CSF) в качестве стимулятора роста;
(с) стимуляцию моноцитов γ-интерфероном (далее именуемым γ-IFN); и
(d) получение клеток, индуцирующих аутотолерантность, образовавшихся на стадии с), путем отделения клеток от культуральной среды.
Аналогичный способ описан в заявке на патент Германии DE 10231655.4 и в заявке на международный патент РСТ/EP03/07551. В вышеуказанных более ранних заявках на патент полученные таким образом клетки именуются "клетками, индуцирующими приживаемость трансплантата" (TAIC). Указанные клетки используют для индукции приживаемости аллогенной донорской ткани у реципиента. Важно отметить, что клетки TAIC, описанные в заявке DE 10231655.4 и в заявке РСТ/EP03/07551, выделяют из моноцитов донора и вводят реципиенту для индукции приживаемости трансплантата. Из вышеизложенного следует, что клетки TAIC являются аллогенными для пациента, подлежащего лечению TAIC.
В отличие от этого в основе настоящего изобретения лежит концепция "аутологичного лечения"; то есть пациенту, страдающему нарушением аутотолерантности, в частности аутоиммунными заболеваниями и/или аллергиями, вводят клетки, индуцирующие аутотолерантность (STIC), которые выделяют из аутологичных моноцитов.
Поэтому, хотя TAIC и STIC выделяют из моноцитов по существу одинаковым способом, TAIC являются аллогенными клетками для подлежащего лечению пациента, в то время как STIC являются аутологичными клетками.
Установлено, что при осуществлении способа продуцирования STIC стимуляция γ-IFN является решающей стадией (см. пример 2).
В контексте настоящего изобретения термин "клетки моноцитарного происхождения, индуцирующие аутотолерантность (STIC)" означает популяцию клеток, получаемую на стадии (d) вышеописанного способа. Указанная популяция клеток помимо клеток, выделенных из моноцитов и позволяющих эффективно индуцировать аутотолерантность, содержит также лимфоциты (см. пример 4) и необязательно другие клетки, выделенные из фракции мононуклеарных клеток, например гранулоциты. Число клеток, выделенных из моноцитов, в популяции STIC предпочтительно составляет 50-90%, более предпочтительно 60-70% от общего числа клеток.
В контексте настоящего изобретения термин "общее число клеток" означает число жизнеспособных клеток в рассматриваемой популяции клеток. Указанное число можно определить "методом исключения при помощи трипанового синего", так как данный краситель позволяет отличить жизнеспособные клетки от нежизнеспособных клеток оптическими средствами.
STIC обычно можно использовать для индукции аутотолерантности в количестве 104-106 клеток на килограмм массы тела, предпочтительно в количестве 105 клеток на килограмм массы тела. Можно производить повторное введение STIC.
Было установлено, что для STIC по настоящему изобретению не характерен риск образования злокачественного новообразования как при испытании на животных, так и в культуре; такой результат, который вряд ли можно ожидать в любом другом случае, достигнут благодаря происхождению исходных моноцитов, из которых выделены клетки по настоящему изобретению.
Как будет подробно описано ниже, из фракции клеток, присутствующих в STIC, выделенных из моноцитов, можно получить другие субпопуляции клеток, обладающих оптимизированными свойствами индукции аутотолерантности.
В результате культивирования in vitro и стимуляции исходных клеток (моноцитов) γ-интерфероном образуются клетки STIC, которые содержат субпопуляцию клеток (см. пример 3), связывающих моноклональное антитело GM-7, экспрессируемое линией клеток гибридомы DSM ACC2542. Моноклональное антитело GM-7 является антителом иммуноглобулина изотипа IgG2а, легкая цепь которого представляет собой каппа-изотип. Отличительным свойством данного антитела является сильная способность связываться с моноцитами, модифицированными в условиях культивирования по настоящему изобретению, так как вышеуказанное антитело не узнает исходные моноциты, то есть не связывается с исходными клетками (см. пример 3). Кроме того, с участием 20 добровольцев было установлено, что GM-7 не связывается с клетками человека в периферической крови (см. фиг.5).
Как описано в заявке РСТ/EP03/075551, данное антитело было получено в результате иммунизации мышей клетками TAIC (соответствующими STIC), выделенными из моноцитов человека методами, известными специалистам в данной области (Davis, W.C. "Methods in Molecular Biology: Monoclonal Antibody Protocols", New York: Humana Press Inc. Totowa, 1995). Линия клеток гибридомы была получена в результате слияния В-клетки, образующей данное антитело, с миеломной клеткой, полученной у мыши. Методы, используемые для получения таких линий клеток, известны в данной области (Davis, W.C. "Methods in Molecular Biology: Monoclonal Antibody Protocols", New York: Humana Press Inc. Totowa, 1995; Kohler, G., Milstein, C. "Continuous cultures of fused cells secreting antibody of predefined specificity", Nature 256, 495-497 (1975)). Линия клеток гибридомы, продуцирующая антитело GM-7, было депонирована на основании правил Будапештского соглашения в депозитарий DSMZ (Deutsche Sammlung von Mikroorganismen und Zellkultur GmbH, Braunschweig, Germany) под номерами доступа DSM ACC2542.
На фиг.1 показана определенная проточной цитометрией способность GM-7 связываться с моноцитами после модификации in vitro по настоящему изобретению. Как можно видеть на данной фигуре, CD14-положительные моноциты, непосредственно полученные из фракции мононуклеарных клеток, не связывают антитело GM-7 (участок серого цвета соответствует незакрашенному контрольному антителу). В отличие от этого после культивирования в присутствии M-CSF и стимуляции γ-IFN часть моноцитов экспрессирует антиген, который распознается моноклональным антителом GM-7. Моноклональное антитело GM-7 является изотипом к-IgG2а. Таким образом, способ по настоящему изобретению вызывает изменение фенотипического паттерна экспрессии антигена на клеточной мембране модифицированных моноцитов (фиг.1).
Моноклональное антитело GM-7 специфически связывается с данной популяцией клеток, которая наряду с клетками, полученными способом по настоящему изобретению, содержит наиболее эффективные клетки, индуцирующие аутотолерантность (см. фиг.5).
Поэтому предпочтительный вариант осуществления изобретения относится к таким клеткам STIC, которые способны связывать антитело GM-7. Указанные клетки далее именуются STICGM7.
Таким образом, антитело GM-7 по настоящему изобретению является чрезвычайно эффективным и простым в обращении агентом, служащим для отбора и очистки клеток, индуцирующих аутотолерантность (STIC). С помощью данного антитела способом по настоящему изобретению можно создать гомогенную и высокоэффективную популяцию клеток STIC.
В соответствии с предпочтительным вариантом осуществления изобретения клетки, индуцирующие аутотолерантность, полученные на стадии с) вышеописанного способа по настоящему изобретению, которые экспрессируют антиген, связывающийся с антителом GM-7, можно отобрать непосредственно из культуральной среды после выполнения стадии с), либо их можно выделить из популяции клеток, полученной после отделения клеток от культуральной среды на стадии d) вышеуказанного способа по настоящему изобретению, путем связывания с антителом GM-7, продуцируемым линией клеток гибридомы DSM ACC2542.
Чтобы произвести отбор STIC по настоящему изобретению, указанное антитело вводят в соприкосновение с образцом в условиях, при которых происходит связывание антитела с индуцирующими аутотолерантность клетками, присутствующими в образце. Комплексы, образующиеся в результате реакции связывания, затем отделяют от образца. Для данной цели антитело может быть иммобилизовано на носителе до контактирования с образцом; например, оно может быть связано с матрицей, пригодной для выполнения хроматографии, или с так называемыми "магнитными гранулами". Вышеописанным способом можно отделить и сконцентрировать клетки, индуцирующие аутотолерантность, из образца большого объема.
Для получения клеток, индуцирующих аутотолерантность, после отделения комплекса от образца разъединяют связь, существующую между антителом и клетками, индуцирующими аутотолерантность. Связь можно разъединить методами, хорошо известными в данной области, такими как, например, конкурентное замещение или промывка солевыми растворами. Соответствующие методы описаны, например, в публикации Utz U. et al. ("Analysis of the T-cell Receptor repertoire of human T-cell leukemia virus type-1 (HTLV-1) Tax-specific CD8+ Cytotoxic T Lymphocytes from patients with HTLV-1 associated disease: Evidence for the oligoclonal expansion" J. of Virology Feb. 1996, 843-851).
Кроме того, моноклональное антитело GM-7 позволяет произвести качественное и количественное обнаружение in vitro клеток моноцитарного происхождения, индуцирующих аутотолерантность, по настоящему изобретению в образцах крови и/или ткани пациента. Образование в образце комплексов, свидетельствующих о наличии и количестве клеток, индуцирующих аутотолерантность, можно определить известными методами.
Комплексы можно обнаружить, связав ("пометив") антитело GM-7 с детектируемой молекулой, которая, например, ковалентно связана с антителом. Приемлемые детектируемые молекулы описаны во многих научных публикациях в области молекулярной диагностики и включают наряду с прочими флуоресцентные красители, такие как изотиоцианат флуоресцеина или тетраметилродамин-5-изотиоцианат, люминесцентные красители, молекулы, меченные радиоактивным изотопом, и ферменты, такие как пероксидазы (см. публикацию Lottspeich, F., Zorbas, H. "Bioanalytik", Spektrum Akademischer Verlag GmbH, Heidelberg-Berlin, 1998).
Методы обнаружения антитела зависят от молекулы, выбранной для мечения антитела. В настоящем изобретении антитело GM-7 было связано с флуоресцентной молекулой изотиоцианата флуоресцеина (FITC), благодаря чему антитело можно было обнаружить методом проточной цитометрии и/или флуоресцентной микроскопии. Методы мечения антител при помощи FITC известны специалистам, работающим в данной области.
Альтернативно комплекс можно также обнаружить двухстадийным методом с использованием вторичных антител. В данной связи немеченное антитело GM-7 можно обнаружить в комплексе при помощи другого меченого антитела (см. публикацию Lottspeich, F., Zorbas, H. "Bioanalytik", Spektrum Akademischer Verlag GmbH, Heidelberg-Berlin, 1998). Вышеуказанный двухстадийный метод обнаружения является гораздо более чувствительным, чем прямое обнаружение связывания антитела по настоящему изобретению, так как с одним антителом GM-7 можно связать несколько меченых вторичных антител (амплификация сигнала).
Кроме того, с помощью антитела GM-7 можно обнаружить STIC в периферической крови пациента, которому были введены клетки STIC, например, путем "мониторинга", в процессе которого определяют число клеток в периферической крови через определенные промежутки времени.
Как должно быть очевидно специалисту в данной области, можно получить моноклональные антитела против STIC из моноцитов позвоночных, отличных от человека, в частности из моноцитов приматов и свиней, модифицированных в соответствии с настоящим изобретением. При этом иммунизацию соответствующих животных-хозяев и образование соответствующей линии клеток гибридомы выполняют способом, описанным выше для STIC человека.
Особенно предпочтительный вариант осуществления изобретения относится к субпопуляции STIC по данному изобретению, которая коэкспрессирует антигены CD3 и CD14 на поверхности клеток. Указанные клетки далее именуются STICCD3+/CD14+. Как будет более подробно описано ниже, установлено, что такие клетки индуцируют образование регуляторных Т-лимфоцитов.
STIC, коэкспрессирующие поверхностные антигены CD3 и CD14, могут быть непосредственно отобраны из клеток, индуцирующих аутотолерантность, которые образуются на стадии с) вышеописанного способа по настоящему изобретению, могут быть отобраны из популяции клеток, полученной после отделения клеток от культуральной среды на стадии d) вышеописанного способа по данному изобретению, или могут быть альтернативно отобраны из популяции STICGM7.
Кроме того, на примере клеток TAIC, описанных в заявке РСТ/EP03/07551, было продемонстрировано, что клетки, полученные способом по настоящему изобретению, в большом количестве экспрессируют гены Foxp3, CTLA4 и интегрин αЕβ7 (см. пример 6, который соответствует примеру 12 в заявке РСТ/EP03/07551). В отличие от этого исходные моноциты не экспрессируют указанные гены или экспрессируют их в небольшом количестве. Поэтому увеличение экспрессии генов Foxp3, CTLA4 и интегрина αЕβ7 является отличительным признаком клеток STICCD3+/CD14+.
Как показано в примере 6, экспрессия маркеров Foxp3, CTLA4 и интегрина αЕβ7 ранее была описана только для регуляторных Т-лимфоцитов. Т-лимфоциты, коэкспрессирующие поверхностные антигены CD4 и CD25, представляют собой субпопуляцию регуляторных Т-лимфоцитов, которые именуются также "супрессорными клетками". Их функция заключается в подавлении иммунной реакции организма. В частности, установлено, что Foxp3 является специфическим фактором транскрипции, который служит в качестве гена, контролирующего образование регуляторных Т-клеток, и специфически экспрессируется указанными клетками. В соответствии с настоящим изобретением желательно, чтобы клетки STICCD3+/CD14+ экспрессировали по крайней мере 1×10-9, более предпочтительно по крайней мере 5×10-9 и особенно предпочтительно по крайней мере 1×10-8 мкг РНК Foxp3 на мкг общей РНК.
CTLA4 аналогичным образом считается маркером для обнаружения регуляторной функции Т-лимфоцитов, в частности CD4/CD25-положительных Т-лимфоцитов (см. литературу, приведенную в примере 6). В соответствии с настоящим изобретением клетки STICCD3+/CD14+ должны предпочтительно экспрессировать по крайней мере 5×10-7, более предпочтительно по крайней мере 3×10-6 и особенно предпочтительно по крайней мере 5×10-6 мкг РНК CTLA4 на мкг общей РНК.
Интегрин αЕβ7, узнающий кадгерин эпителия, был недавно описан в публикации Lehmann et al., in PNAS 99, pages 13031-13036 (2002) в качестве нового маркера для субпопуляции сильнодействующих регуляторных Т-лимфоцитов, взаимодействующих с эпителием. Экспрессия РНК интегрина αЕβ7 должна по настоящему изобретению составлять в клетках STICCD3+/CD14+ предпочтительно по крайней мере 1×10-12, более предпочтительно по крайней мере 1×10-11, особенно предпочтительно по крайней мере 1×10-10 и наиболее предпочтительно по крайней мере 1×10-9 мкг на 1 мкг общей РНК.
Как показано в таблице, приведенной в примере 6, прямое сокультивирование клеток по данному изобретению с лимфоцитами вызывает значительное увеличение числа регуляторных Т-лимфоцитов, в частности, CD4+/CD25+ клеток в популяции лимфоцитов с сильно увеличенной экспрессией генов Foxp3, CTLA4 и интегрина αЕβ7. В данном примере далее показано, что такой эффект не наблюдается в том случае, если клетки по настоящему изобретению сокультивируют с лимфоцитами непрямым методом.
Полученные результаты показывают, что стимуляция образования и/или размножения регуляторных Т-клеток клетками по настоящему изобретению имеет непосредственное отношение к индукции аутотолерантности указанными клетками.
Пример 7 (соответствующий примеру 13 в заявке РСТ/EP03/07551) подтверждает гипотезу об участии клеток по настоящему изобретению в индукции подавления иммунной реакции со ссылкой на клетки TAIC, описанные в заявке РСТ/EP03/07751 (см. выше). В указанном примере лимфоциты, полученные у животных-реципиентов, инкубировали in vitro с иммуносупрессорными клетками, полученными у соответствующих животных-доноров. Для индукции толерантности лимфоциты реципиента, которые предварительно инкубировали с TAIC донора, инъецировали животным вместо TAIC. Подобным образом можно было индуцировать донор-специфическую толерантность, в то время как у животных, которым вводили лимфоциты реципиента, которые не сокультивировали с TAIC, полученными у донора, не возникала толерантность.
STIC по настоящему изобретению можно использовать как есть или в виде фармацевтического препарата. Клетки, полученные на стадии d) вышеописанного способа по настоящему изобретению, можно использовать сразу. Примерно 10-50% от общего числа клеток в популяциях, полученных таким образом, образованы лимфоцитами и гранулоцитами, присутствующими в изоляте исходных моноцитов (фракция мононуклеарных клеток). Указанные клетки поддерживают образование STIC по настоящему изобретению, выделенных из моноцитов, на стадии культивирования (см. пример 4); они не препятствуют индукции аутотолерантности, если STIC по настоящему изобретению используются в виде фармацевтического препарата.
Однако в соответствии с другими предпочтительными вариантами осуществления изобретения субпопуляции STICGM7 и/или STICCD3+/CD14+ могут быть выделены из всей популяции STIC, полученной при осуществлении способа по настоящему изобретению (см. выше), и использованы для индукции аутотолерантности.
Клетки STIC, STICGM7 и/или STICCD3+/CD14+ могут находиться в культуральной среде (см. пример 2) в течение по крайней мере 48 часов, не утрачивая при этом способность индуцировать аутотолерантность.
При использовании в качестве фармацевтического препарата клетки STIC, субпопуляции STICGM7 и/или STICCD3+/CD14+, суспендированные, например, в АВ0-совместимой сыворотке человека (универсально пригодной для применения), можно вводить внутривенно в виде кратковременного вливания.
В данном контексте фармацевтические препараты могут содержать STIC по настоящему изобретению в комбинации с известными противовоспалительными средствами и/или известными иммуносупрессантами, такими как стероиды, в частности кортизон, метотрексат, циклофосфамид, азатиоприн, 5-аминосалициловая кислота (5-ASA), антитела к TNF-α, α-интерферон и В-клеточные антитела, такие как, например, ритуксимаб, для лечения органспецифических или системных аутоиммунных заболеваний.
Кроме того, STIC по настоящему изобретению можно использовать для лечения аллергических заболеваний в комбинации с антигистаминными средствами, препаратами теофиллина, β-миметическими средствами, стероидами, такими как кортизон, и хромоглициновой кислотой.
Подробное описание изобретения
Исходными клетками для осуществления способа по настоящему изобретению являются аутологичные моноциты крови, то есть моноциты, выделенные из крови соответствующего пациента, которому должны быть введены клетки по данному изобретению. Аутологичные моноциты предпочтительно выделяют из крови человека. Моноциты могут быть получены любым способом, в частности лейкаферезом, или из фракции мононуклеарных клеток цельной крови (лейкоцитная пленка). Лейкаферез является особенно предпочтительным способом.
Лейкаферез является общим названием многостадийного способа, выполняемого при помощи коммерчески доступного аппарата для афереза, в котором происходит отбор цельной крови из организма человека, разделение ее на фракции и возврат в организм пациента всех фракций за исключением фракции мононуклеарных клеток. Указанный способ может быть выполнен, например, в соответствии с подробным описанием, приведенным в европейском патенте № 0591194 В1.
Альтернативно кровь, обработанную антикоагулянтом, сначала разделяют на плазму, лейкоциты и эритроциты методами, известными в данной области, предпочтительно центрифугированием. После центрифугирования плазма находится в супернатанте; под супернатантом расположен слой, полностью содержащий лейкоциты. Данный слой определяется также как лейкоцитная пленка. Под указанным слоем находится фаза, содержащая эритроциты (гематокрит).
В соответствии со способом по настоящему изобретению сначала выделяют и разделяют фракцию мононуклеарных клеток для получения моноцитов, например, производя центрифугирование известными методами. В соответствии с предпочтительным вариантом осуществления способа по настоящему изобретению фракцию мононуклеарных клеток помещают на среду для отделения лимфоцитов (фиколл-гипак) и центрифугируют (см. пример 1). В примере 1 описан предпочтительный вариант осуществления изобретения, в котором эритроциты и мертвые клетки, которые все еще могут находиться во фракции мононуклеарных клеток, отделяют центрифугированием, при этом лейкоциты, включающие моноциты, находятся в виде изолята на разделяющей среде. Затем фазу лейкоцитов можно осторожно удалить пипеткой и несколько раз центрифугировать и промывать для обогащения моноцитов в изоляте. В процессе выполнении данного способа моноциты накапливаются в основании центри