Применение 9-оксоакридин-10-уксусной кислоты и/или ее соли в комбинации с антиэстрогеном и/или прогестином для лечения эстрогензависимых опухолей, способ лечения и наборы
Иллюстрации
Показать всеИзобретение, включающее 4 объекта, относится к медицине, а именно к онкологии и гинекологии. Способ лечения эстрогензависимых рецептор-позитивных опухолей рака тела матки и рака молочной железы заключается в том, что вводят 9-оксоакридин-10-уксусную кислоту (А) и/или ее фармацевтически приемлемую соль в комбинации с антиэстрогеном и/или прогестином в количестве, эффективном для потенцирования действия указанного антиэстрогена и/или прогестина. При этом (А) и/или ее соль, и/или сложный эфир в комбинации с антиэстрогеном и/или прогестином могут быть использованы в виде препарата или в виде наборов. Использование А и/или ее солей, и/или сложных эфиров обеспечивает подавление белка NF-kappaB и, как следствие, усиление чувствительности клеток рака тела матки или молочной железы к антипролиферативному действию антиэстрогена и/или прогестина. 4 н. и 13 з.п. ф-лы, 1 ил., 5 табл.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к медицине и касается способа лечения рака опухолей женской репродуктивной сферы, а именно рака молочной железы (РМЖ) и рака тела матки (РТМ).
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Рак молочной железы и рак тела матки являются одними из хорошо изученных злокачественных новообразований, рост и развитие которых контролируется эндокринными факторами. Злокачественные новообразования этих локализаций являются одной из основных причин смертности от рака. Поскольку в основном эти опухоли являются гормонозависимыми, их гормональная терапия сравнительно эффективна. Считается, однако, что развитие вторичной или наличие первичной гормонорезистентности является основной проблемой в гормонональной терапии РМЖ и РТМ. Это особенно характерно для распространенных опухолей. В клинической практике при рецептор-негативном статусе опухоли, опухоль классифицируется как гормон-резистентная. В клинической практике пациентам с распространенной опухолью молочной железы или тела матки проводят последовательную гормональную терапию и/или полихимиотерапию в целях сохранения контроля над ростом опухоли в течение как можно большего промежутка времени. Особенностью этого типа рака является то, что в любом случае у большинства пациентов наблюдается снижение способности опухоли отвечать на химиотерапию или гормональную терапию.
Общепринятой является тактика проведения так называемой «эшелонированной терапии», когда пациентке назначается сначала «первая линия» гормональной терапии, затем после начала прогрессирования - «вторая линия терапии», а затем - «третья линия». При этом препаратами первой линии выступают для РМЖ, как правило, антиэстрогены, второй и третьей линии терапии - прогестины.
Недавно проведенный мета-анализ показал, что в 12% случаев наблюдается успех комбинированной терапии, но в большинстве случаев лечения распространенного рака такое лечение не приводило к увеличению выживаемости (Horton J. 1995 Oxford Breast Cancer Overview-Preliminary Outcomes. Cancer Control: JMCC. 1996; vol.3, No 1, pp 78-79). Основным препятствием для успеха гормональной терапии распространенного рака молочной железы и матки считается наличие рецептор-негативного статуса опухоли, при этом отсутствие рецепторов эстрогенов и прогестинов считается молекулярной основой резистентности к гормональной терапии.
В соответствии с этими представлениями тактика фармакологического воздействия сконцентрирована на восстановлении экспрессии рецепторов эстрогенов и прогестинов в опухолях молочной железы и матки, обладающих рецептор-негативным статусом.
В патенте РФ №2126253 описывается применение сложных эфиров и солей 9-оксоакридин-10-уксусной кислоты для повышения уровня экспрессии прогестиновых и эстрогеновых рецепторов в гормон-зависимых тканях с низким уровнем экспрессии рецепторов. На основе этого изобретения разработан способ лечения рецептор-негативного гормон-резистентного рака молочной железы. Эффект солей СМА как средства, преодолевающего резистентность рака молочной железы к тамоксифену, описан для группы пациенток с рецептор-негативным статусом опухоли (Сурков К.Г. и др., Индуктор интерферонов неовир: новое применение в онкологии - преодоление резистентности к тамоксифену, Вопросы онкологии, 1996, №6, с.28-32). Для натриевой соли СМА показана способность к увеличению экспрессии эстрогеновых рецепторов в ткани рака тела матки (Цырлина Е.В. и другие, Влияние неоадъювантной терапии неовиром на содержание рецепторов стероидных гормонов в тканях рака тела матки, Вопросы Онкологии, 2001, том 47, №2, с.214-217).
В то же время, в отношении рецептор-положительных вариантов РМЖ была показана возможность первичной резистентности к антиэстрогенам (Baum, М. Use of aromatase inhibitors in the adjuvant treatment of breast cancer. Endocrine-Related Cancer, 1999, vol.6, No 2, pp.231-234).
При этом точный механизм резистентности к антиэстрогенам остается неясным. Существуют несколько вариантов формирования резистентности, в том числе за счет проявления частичной эстрогенной активности некоторых антиэстрогенов, что приводит в последующем к стимуляции опухолевого роста. Популярна теория, согласно которой мутация рецепторов эстрогенов в конечном итоге индуцирует стимулируемый эстрогенами рост опухолей молочной железы. Кроме уже известных рецепторов эстрогенов (ERα и ERβ) существует немалое число коактиваторов и корепрессоров рецепторов, точная роль которых в развитии резистентности пока не ясна.
В последнее время получены данные о наличии у больных РМЖ, резистентных к антиэстрогенам, повышенной экспрессии трансформирующего фактора роста-бета (TGF-β). Это косвенно свидетельствует о «переходе» опухоли на аутокринную регуляцию у больных, резистентных к антиэстрогенам. Очень важно то, что этот эффект в принципе обратим, как показано в эксперименте с помощью нейтрализующих TGF-b антител (Arteaga С., Koli К., Dugger Т. et a1. Reversal of tamoxifen resistance of human breast carcinomas in vivo by neutralizing antibodies to transforming growth factor-beta. Journal of National Cancer Institute, 1999. vol.91, pp.46-53).
В качестве вероятных механизмов развития резистентности к антиэстрогенам рассматривается так называемая метаболическая толерантность с неадекватной внутриопухолевой концентрацией антиэстрогена. В этом случае наблюдается значительное уменьшение внутриопухолевой концентрации антиэстрогена в рецидивных опухолях без какого-либо изменения его уровня в плазме (Lykkesfeldt A.E. Mechanisms of tamoxifen resistance in the treatment of advanced breast cancer, Acta Oncology, 1996, vol.35 Suppl. No 5, pp.9-14).
Таким образом, на основании имеющихся данных можно сделать вывод, что резистентность клеток эстрогенчувствительных новообразований к терапии антиэстрогенами не связана только с рецепторным статусом опухоли и имеет сложную природу.
Хорошо известно, что цитотоксическое воздействие химиопрепаратов на опухолевую клетку приводит среди прочего к активации белка NFкВ, который способствует выживанию раковой клетки через различные механизмы, в частности через подавление апоптоза, стимуляцию пролиферации, усиление подвижности и способности к инвазии (Nakanishi. С,, Toi M., Nature Reviews. Cancer, 2005, vol.5 №4, pp.297-309).
Семейство белков NFкВ у млекопитающих состоит из пяти членов: р50 (NFкВ1), р52 (NFкВ2), р65 (relA), c-rel and relB. Все они содержат консервативную N-концевую последовательность Rel (гомологичную белку, кодируемому птичьим онкогеном v-Rel), содержащую 300 аминокислотных остатков. Эти белки отвечают за димеризацию, ядерную транслокацию, связывание с ДНК и связывание с ингибиторными белками IкВ.
Белки семейства Rel существуют в виде гомо- или гетеродимеров, хотя в целом преобладает форма внутриклеточного белка NFкВ, распознаваемого как р50/р65 гетеродимер. В клетках, находящихся в фазе покоя клеточного цикла,NFкВ изолирован в цитоплазме в латентной (неактивной) форме. В этой неактивной форме NFкВ связан с одним или более белков семейства IkB (IкВα, IкВβ, IкВε, IкВγ, Bcl-3), и прекурсором семейства белков Rel-белками р100 и р105.
Различные воздействия на клетку (например, ФНО-альфа, CD 40, IL-1, TRANCE, ЭФР, форболовые эфиры, пероксиды, ионизирующая радиация) индуцируют цитоплазматическое фосфорилирование (через активацию IкВ - киназного комплекса) и последующую деградацию ингибирующего протеина IкВ. При этом NFкВ активируется с транслокацией в ядро, где он связывается с промотор - специфическими кВ - связывающими элементами и регулирует транскрипцию NFкВ - зависимых генов.
Имеются определенные данные, показывающие, что потеря ответа на гормональную терапию связана с увеличением активности NFкВ.
Таким образом, поиск путей усиления эффективности гормональной терапии РМЖ и РТК является актуальной проблемой.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Заявленное изобретение основано на неожиданном обнаружении того факта, что 9-оксоакридин-10-уксусная кислота или, по-другому, 10-(карбоксиметил)-9(10Н)акридон и/или ее фармацевтические соли оказались способны значительно увеличивать чувствительность к гормональной терапии клеток именно рецептор-позитивных злокачественных опухолей молочной железы и матки, а комбинация 9-оксоакридин-10-уксусная кислоты и/или ее солей с прогестинами и/или антиэстрогенами в лечении больных с рецептор-позитивными опухолями обладает выраженной клинической эффективностью.
При этом данный эффект никак не связан со способностью 9-оксоакридин-10-уксусной кислоты и/или ее солей влиять на уровень рецепторов стероидных гормонов.
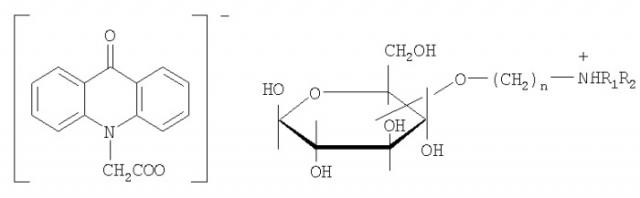
9-оксоакридин-10-уксусная кислота представляет собой соединение, имеющее следующую структурную формулу:
По другой номенклатуре она также может быть названа как 10-(карбоксиметил)-9(10H)акридон, в базе CAS имеет номер 38609-97-1, международное непатентованное название - криданимод (cridanimod).
9-оксоакридин-10-уксусная кислота и ее соли были предложены в 1971 году сотрудниками компании Хоффман Ла Рош Инк в качестве мощных противовирусных средств (патент США №3,681,360).
В настоящее время препараты на основе 9-оксоакридин-10-уксусной кислоты и ее фармацевтически приемлемых солей предлагаются для лечения и профилактики широкого круга заболеваний. В частности, известны такие ее свойства как: иммуномодулирующие, интерфероногенные, антибактериальные, антипромоторные и радиопротективные.
Авторами данного изобретения неожиданно было обнаружено, что применение препаратов 9-оксоакридин-10-уксусной кислоты и ее фармацевтически приемлемых солей при лечении эстрогензависимых рецептор-позитивных злокачественных опухолей позволяет резко усилить эффективность гормонотерапевтических средств.
Несмотря на то что 9-оксоакридин-10-уксусная кислота не обладает какой-либо значительной собственной цитостатической активностью, в опытах установлено, что торможение роста рецептор-позитивных злокачественных опухолей молочной железы и матки с помощью обычной для таких случаев гормонотерапии в присутствии 9-оксоакридин-10-уксусной кислоты и ее солей является более эффективным, чем в их отсутствие.
Таким образом, авторами данного изобретения обнаружено новое свойство 9-оксоакридин-10-уксусной кислоты, механизм которого до конца не ясен, однако связан с тем, что 9-оксоакридин-10-уксусная кислота и/или ее фармацевтически приемлемые соли обладают способностью снижать уровень активного белка NFкВ в клетках рака, обладающих рецептор-позитивным статусом.
Указанные свойства 9-оксоакридин-10-уксусной кислоты и/или ее соединений открывают новую область для их применения. А именно, при гормональной терапии опухолей, обладающих рецептор-позитивным статусом, 9-оксоакридин-10-уксусная кислота и/или ее фармацевтически приемлемые соли позволяют резко усилить эффективность указанной гормональной терапии.
Также неожиданно обнаружено, что когда 9-оксоакридин-10-уксусную кислоту и/или ее фармацевтически приемлемые соли вводят перед началом гормональной терапии у пациентов с рецептор-позитивными опухолями, это позволяет резко усилить чувствительность опухоли к последующей гормональной терапии, причем этот эффект сохраняется и после прекращения введения 9-оксоакридин-10-уксусной кислоты или ее соли.
9-оксоакридин-10-уксусная кислота, как и многие органические кислоты, может образовывать соли с основаниями.
В контексте настоящей заявки, если отдельно не оговорено другого, принимаются следующие термины и их определения:
«Распространенный рак» - гистологически верифицированный рак стадии Т3 или Т4 в классификации TNM или рецидив опухоли, не поддающиеся оперативному и хирургическому лечению.
«Эстрогензависимые опухоли» - опухоли, рост и прогрессирование которых частично или полностью зависимы от эстрогенных гормонов. К таким опухолям относятся, в частности, рак молочной железы и рак эндометрия.
«Паллиативная терапия» - лечение, направленное на облегчение симптомов, вызванных раковой опухолью. Паллиативная терапия не изменяет течения основного заболевания, но улучшает качество жизни больного.
«Рецептор-позитивный статус опухоли» - опухоль считается рецептор-позитивной при содержании рецепторов эстрогенов и/или прогестинов в цитозоле более 10 фмоль/мг общего белка.
«Рецептор-негативный статус опухоли» - опухоль считается рецептор-негативной при содержании рецепторов эстрогенов и/или прогестинов в цитозоле менее 10 фмоль/мг общего белка.
«Несостоятельность терапии» - наличие прогрессии злокачественной опухоли, несмотря на проводимую химио- и/или гормональную терапию опухоли при отсутствии всякого временного улучшения; отсутствие объективного ответа опухоли после проведения одного или нескольких циклов лечения; частичный ответ с последующей прогрессией опухоли во время проведения терапии; значительная токсичность терапии или достижение максимальной кумулятивной дозы, что может препятствовать дальнейшему лечению.
«Терапевтически эффективное количество» - количество лекарства, которое нужно ввести для получения требующегося терапевтического эффекта.
«Гормональная терапия» - (синонимы: гормонотерапия, гормональное лечение, эндокринная терапия) - использование средств и методов воздействия, применяемых с целью уменьшения симптомов, замедления развития или индукции регрессии опухоли или с целью снижения побочных эффектов противоопухолевой терапии, и направленных либо на дополнительное увеличение соответствующего гормона (гормонов) в организме, или напротив, направленных на блокирование эффектов гормонов или на снижение уровня гормонов в организме (то есть, абляционная гормонотерапия). К средствам абляционной гормонотерапии также можно отнести хирургическое удаление (полностью или частично) ткани (органа) продуцирующего гормоны, например, овариэктомия.
«Химиотерапия» - использование одного или нескольких химических или биохимических агентов природного или искусственного происхождения с целью уменьшения симптомов, и/или замедления роста или обратного развития опухоли, оказывающих прямое цитотоксическое (цитостатическое, цитолитическое) действие на опухолевые клетки, приводящее опухолевые клетки к гибели.
«Химиогормонотерапия» - одновременное или последовательное применение гормонотерапии и химиотерапии.
"Гормонорезистентный рак" - рак, не отвечающий на гормональную терапию.
Термин "лечить" или "лечение" в данном описании определен как применение или введение (назначение) состава или вида лечения (например, хирургического лечения) субьекту (например, человеку, например, пациенту или человеку с риском возникновения патологии, например, страдающему злокачественной опухолью или имеющему риск ее возникновения). В целом, лечение обеспечивают субьекту, имеющему патологию (например, гормонозависимое новообразование, как описано в данной заявке), симптом патологии, повышенный риск патологии, или предрасположенность патологии, с целью вылечить, исцелить, облегчить, уменьшить, изменить, исправить, повысить качество, чтобы улучшить течение или повлиять на патологию, признаки патологии или предрасположенность к патологии. Лечение может включать назначение или применение одного агента (или средства) в комбинации со вторым агентом (или средством). Термин "в комбинации" в этом контексте означает, что различные агенты или воздействие (а именно, в контексте данной заявки СМА и средство гормонотерапии) применяют одновременно или последовательно. Если агенты (или средства) применяются последовательно, в момент начала применения второго агента (или средства), в области воздействия в эффективных концентрациях предпочтительно обнаруживается первый из двух агентов или его действие еще сохраняется к моменту применения второго агента (средства).
Термин «фармацевтически приемлемая соль» относится к солям, которые сохраняют вышеописанные свойства 9-оксоакридин-10-уксусной кислоты и которые не являются биологически или каким-либо иным образом неприемлемыми. Фармацевтически приемлемые соли, полученные присоединением оснований, могут быть получены с неорганическими или органическими основаниями.
Соли с неорганическими основаниями включают в себя, например, соли натрия, калия, лития, аммония, кальция и магния.
Соли с органическими основаниями без ограничения включают: соли первичных, вторичных, третичных и четвертичных аминов, такие как амины, замещенные одним, двумя или тремя заместителями, такими как: алкил, алкенил, циклоалкил, циклоалкенил, арил, гетероарил или гетероциклил, которые в свою очередь могут быть замещенными; смешанные ди- и триамины, где по меньшей мере один из заместителей на амине отличается от других заместителей и выбран из группы, включающей в себя алкил, замещенный алкил, алкенил, замещенный алкенил, циклоалкил, замещенный циклоалкил, циклоалкенил, замещенный циклоалкенил, арил, гетероарил, гетероциклил и т.п. Сюда также включают амины, у которых два или три заместителя вместе с атомом азота, к которому они присоединены, образуют гетероциклил или гетероарил.
Конкретные примеры подходящих аминов включают, в частности, изопропиламин, триметиламин, диэтиламин, три(изопропил)амин, три(н-пропил)амин, этаноламин, 2-диметиламиноэтанол, трометамин, лизин, аргинин, гистидин, кофеин, прокаин, холин, бетаин, этилендиамин, глюкозамин, N-алкилглюкамин, теобромин, пурины, пиперазин, пиперидин, морфолин, N-этилпиперидин и тому подобное.
Примером соли 9-оксоакридин-10-уксусной кислоты со щелочным металлом является натриевая соль:
Примером соли с аминосоединением является соль с 1-дезокси-1-(метиламино)-D-глюцитолом (меглюмином):
Другими примерами солей с различными сложными четвертичными аммониевыми основаниями являются соли с амино-замещенными углеводами, например с 2-дезокси-2-амино (или 2-алкиламино)-D-глюкозой, где R представляет собой Н или низший алкил:
с 1-дезокси-1-метиламино-D-глюкозой:
а также соли с различными сложными эфирами углеводов и алифатических аминоспиртов, например
где R1, R2 представляют собой независимо алкил, арил, гетерил.
Примерами подходящих катионов также являются, в частности, катионы: 3-O-(N,N-диметиламино-н-пропил)-1,2:5,6-ди-O-изопропилиден-α,D-глюкофуранозы:
а также катионы:
1-дезокси-1-(этиламино)-D-глюцитола (то есть, эглюмина),
1-дезокси-1-(пропиламино)-D-глюцитола,
1-дезокси-1-(бутиламино)-D-глюцитола,
1-дезокси-1-(метиламино)-L-глюцитола,
1-дезокси-1-(этиламино)-L-глюцитола,
1-дезокси-1-(пропиламино)-L-глюцитола и
1-дезокси-1-(бутиламино)-L-глюцитола.
Следует указать, что под аббревиатурой СМА в контексте данной заявки, если отдельно не указано иного, или это не следует из контекста, понимается как сама 9-оксоакридин-10-уксусная кислота, так и ее фармацевтически приемлемые соли.
Согласно настоящему изобретению предлагается способ лечения распространенного рака молочной железы и эндометрия у пациентов, имеющих рецептор-позитивную опухоль, который заключается в введении эффективных количеств СМА или ее солей с последующим или одновременным применением гормонотерапии, а именно антиэстрогенов, прогестинов или их комбинаций.
Дополнительно, согласно настоящему изобретению на фоне гормонотерапии и введения СМА предлагается вводить химиопрепараты.
Мы обнаружили, что СМА и/или ее фармацевтически приемлемые соли проявляют репрессорные свойства в отношении белка NFкВ в клетках рака, обладающих рецептор-позитивным статусом. При этом в присутствии гормональных препаратов этот эффект СМА резко усиливается. При этом также возрастает противоопухолевая активность дополнительно назначенных к такой комбинации (СМА и гормональный препарат) химиотерапевтических препаратов.
Введение пациентам, имеющим распространенный рецептор-позитивный рак молочной железы или матки, препаратов СМА и/или ее фармацевтически приемлемых солей позволяет резко усиливать воздействие гормонотерапии и химиогормонотерапии. Это открывает новые возможности для лечения распространенного рецептор-позитивного рака молочной железы и матки.
Далее согласно изобретению для реализации заявленного способа лечения в качестве указанных фармацевтических солей СМА как предпочтительные предлагается применять соли натриевую, меглюминовую, эглюминовую и соль с 3-O-(N,N-диметиламино-н-пропил)-1,2:5,6-ди-O-изопропилиден-α,D-глюкофуранозой.
Дополнительно, гормональную терапию можно сочетать с химиотерапией.
В качестве средств гормонального воздействия для реализации изобретения можно применять различные гормонотерапевтические средства и методы, включая, но не ограничиваясь: антиэстрогены, прогестины, овариэктомия. В качестве антиэстрогенов для реализации изобретения можно использовать различиные вещества и препараты на их основе, обладающие антиэстрогенной активностью, включая, но не ограничиваясь: тамоксифен, торемифен, дролоксифен, идоксифен, ралоксифен, фазлодэкс (ICI 182, 780).
В качестве прогестинов для реализации изобретения можно использовать различные вещества и препараты на их основе, обладающие прогестагенной активностью, включая, но не ограничиваясь: медроксипрогестерона ацетат, мегестрола ацетат, гидроксипрогестерон (или, что тоже самое, оксипрогестерона капронат).
Дополнительно, в качестве цитостатического (химиотерапевтического) воздействия для реализации изобретения можно использовать антрациклиновые антибиотики, таксаны, препараты платины, антиметаболиты. Из препаратов антрациклинового ряда для реализации способа можно использовать, включая, но не ограничиваясь: доксорубицин. Из препаратов, относящихся к классу таксанов для реализации изобретения можно использовать, включая, но не ограничиваясь: доцетаксел, паклитаксел.
Из препаратов, относящихся к классу антиметаболитов, для реализации способа можно использовать, включая, но не ограничиваясь: 5-фторурацил, гемцитабин.
Возможно также сочетание двух или нескольких химиотерапевтических препаратов (полихимиотерапия), а также сочетание двух или нескольких средств или способов гормональной терапии.
Согласно одному примеру реализации настоящего изобретения при комбинации средств или способов гормонотерапии можно сочетать, например, прогестины с антиэстрогенами, например, путем одновременного приема, а также применять прогестины с антиэстрогенами последовательно, то есть за курсом лечения антиэстрогенами может следовать курс лечения прогестинами и наоборот.
Далее согласно изобретению в одном из примеров реализации заявленного способа 9-оксоакридин-10-уксусная кислота и/или ее фармацевтически приемлемые соли вводят курсом в суточной дозе от 3 до 500 мг/кг веса в пересчете на остаток 9-оксоакридин-10-уксусной кислоты.
При этом согласно изобретению 9-оксоакридин-10-уксусная кислота и/или ее фармацевтически приемлемые соли могут ввводится через день или ежедневно.
Далее согласно изобретению курсы могут повторяться от 2 до 10 раз с интервалом 10-60 дней.
Далее согласно изобретению 9-оксоакридин-10-уксусная кислота и/или ее фармацевтически приемлемые соли применяются перед проведением гормональной терапии.
Далее согласно изобретению 9-оксоакридин-10-уксусная кислота и/или ее фармацевтически приемлемые соли применяются одновременно с проведением гормональной терапии.
Согласно изобретению заявляется применение 9-оксоакридин-10-уксусной кислоты или ее соли для получения лекарственного препарата для лечения эстрогензависимых опухолей с рецептор-позитивным статусом совместно с антиэстрогеном и/или прогестином.
Далее согласно изобретению заявляется применение 9-оксоакридин-10-уксусной кислоты и/или ее соли для получения лекарственного препарата для лечения эстрогензависимых опухолей с рецептор-позитивным статусом в комбинации с лечением антиэстрогеном и/или прогестином.
Наряду с применением 9-оксоакридин-10-уксусной кислоты и/или ее соли для получения такого лекарственного препарата в качестве других компонентов могут применяться различные наполнители, вспомогательные вещества, в том числе солюбилизаторы, например аминосахара (или аминоспирты) и их сложные эсриры, циклодекстраны, например гидроксипропил-β-циклодекстрин, эмульгаторы, например твины; загустители; светофильтры; например метиленовый сисний; комплексообразователи; стабилизаторы, например трилон Б; пролонгаторы, например микроцеллюлоза или поливинилпирролидон; корригенты, например сорбит; красители; консерванты, а также буферные системы на основе неорганических и органических веществ, обеспечивающие поддержание определенного рН. Такой препарат может быть приготовлен в виде раствора для парентерального введения, или таблеток, или таблеток, покрытых кишечно-растворимым покрытием, или порошка или гранулята, в капсулах или пакетах, или в виде суппозиториев, или в виде аэрозоля или раствора для ингаляций, или в виде пролонгированной формы с замедленным высвобождением активного вещества, например в виде пролонгированной формы для перорального введения или полостного введения на основе твердой или полутвердой полимерной матрицы.
Согласно настоящему изобретению предпочтительные соли 9-оксоакридин-10-уксусной кислоты для получения лекарственного препарата для лечения эстрогензависимых опухолей с рецептор-позитивным статусом в комбинации с лечением антиэстрогеном и/или прогестином выбирают из группы, включающей натриевую, меглюминовую, эглюминовую и соль с 3-O-(N,N-диметиламино-н-пропил)-1,2:5,6-ди-O-изопропилиден-α,D-глюкофуранозой.
Далее согласно изобретению дополнительно заявляется набор для лечения эстрогензависимых опухолей с рецептор-позитивным статусом, включающий 9-оксоакридин-10-уксусную кислоту и/или ее соль в терапевтически эффективном количестве, и, по меньшеей мере, один антиэстроген.
В качестве предпочтительных антиэстрогенов предлагаются торемифен; тамоксифен.
При этом в наборе соотношение (массовое) разовых, суточных или курсовых доз 9-оксоакридин-10-уксусной кислоты и/или ее соли (в пересчете на остаток 9-оксоакридин-10-уксусной кислоты) к соответственно разовой, суточной или курсовой дозе антиэстрогена составляет от 1:100 до 100:1, более предпочитительно от 1:10 до 10:1.
Один из вариантов набора может, например, содержать дозированные лекарственные формы 9-оксоакридин-10-уксусной кислоты и/или соответствующей соли СМА (содержащие от 125 до 500 мг в пересчете на остаток 9-оксоакридин-10-уксусной кислоты) и дозированные лекарственные формы тамоксифена, например таблетки для перорального приема, содержащие 10-60 мг активного вещества каждая. При этом дозированные лекарственные формы 9-оксоакридин-10-уксусной кислоты и/или ее солей в наборе могут быть в виде стерильного ампулированного раствора для инъекций, таблеток, капсул или свечей.
Далее согласно изобретению дополнительно заявляется набор для лечения эстрогензависимых опухолей с рецептор-позитивным статусом, включающий: 9-оксоакридин-10-уксусную кислоту и/или ее соль в терапевтически эффективном количестве, и, по крайней мере, один прогестин.
В качестве предпочтительных прогестинов предлагаются медроксипрогестерона ацетат, мегестрола ацетат.
При этом в наборе предпочтительное массовое соотношение разовых, суточных или курсовых доз 9-оксоакридин-10-уксусной кислоты и/или ее соли (в пересчете на остаток 9-оксоакридин-10-уксусной кислоты) к соответственно разовой, суточной или курсовой дозе прогестина составляет от 1:100 до 100:1, более предпочитительно от 1:10 до 10:1.
Один из вариантов набора может, например, содержать дозированные лекарственные формы 9-оксоакридин-10-уксусной кислоты или соответствующей соли 9-оксоакридин-10-уксусную кислоты (в дозе от 125 до 500 мг в пересчете на остаток 9-оксоакридин-10-уксусной кислоты), например, в виде стерильного ампулированного раствора для инъекций, таблеток, капсул или свечей, и дозированные лекарственные формы медроксипрогестерона ацетата (например, таблетки для перорального приема по 100-500 мг активного вещества каждая).
Предпочтительно в заявленных наборах соли 9-оксоакридин-10-уксусной кислоты выбраны из группы, включающей натриевую, меглюминовую, эглюминовую и соль с 3-O-(N,N-диметиламино-н-пропил)-1,2:5,6-ди-O-изопропилиден-α,D-глюкофуранозой.
Некоторые варианты наборов описаны в нижеприведенных примерах, но конкретное массовое содержание каждого активного компонента в единичной дозированной форме, а также количество единичных дозированных форм не ограничивается примерами и может быть определено специалистом на основе описания изобретения.
Единичные дозированные лекарственные формы в наборах могут быть представлены таблетками, каспсулами или суспензиями для перорального приема; ампулами или шприц-тюбиками, содержащими стерильный раствор для инъекций; свечами для ректального или интравагинального введения; порошками для приготовления суспензий и растворов.
Материалы и методы
В процессе работы над изобретением авторами были исследованы, в том числе, образцы эксплантов ткани рака эндометрия и рака молочной железы.
Эстрогенорецепторный (РЭ) и прогестинорецепторный (РП) статус образцов определяли с помощью метода связывания меченого лиганда цитозольным рецепторным белком с последующей адсорбцией несвязавшегося гормона на угле, покрытом декстраном. Образцы ткани опухоли молочной железы с содержанием рецепторов эстрадиола, меньшим, чем 10 фмоль/мг белка, считали РЭ-негативными. Образцы ткани опухоли тела матки, содержащие рецепторы прогестина менее 10 фмоль/мг белка, считали РП-негативными.
Первичную культуру опухолевых эксплантов получали следующим образом: образцы опухолевой ткани взвешивали, промывали фосфатным забуференным солевым раствором (рН 7,4) и разрезали на кусочки объемом 2-4 кубических миллиметра и затем помещали на поверхность желатиновой губки.
Экспланты инкубированы в среде РПМИ с 5% телячьей сыворотки в атмосфере 5% CO2 в течение 4 дней в присутствии эстрадиола (1×10-7 М) как стимулятора роста эстрогензависимых тканей.
Для изучения прямого действия тестируемых веществ и их комбинаций в отдельных опытах эстрадиол не добавлялся.
Для оценки соответствующего воздействия на ткани в среду культивирования добавлялось то или иное испытуемое (тестируемое) вещество или их комбинация или растворитель/носитель (контроль).
После этого образцы отмывали фосфатным солевым раствором и инкубировали в свежей культуральной среде с меченым [Н3]-тимидином в концентрации 2 микроКи/мл и образцы инкубировали 3 часа с последующей трехкратной отмывкой, растворением образцов в формамиде и определении радиоактивности. Удельная радиоактивность образцов, инкубированных с растворителем/носителем (контроль), принималась за 100%.
При работе над настоящим изобретением в проведенных экспериментах и клинических исследованиях использовали, в том числе, коммерческие препараты солей СМА, представленные на рынке. Использовались, например, натриевая соль СМА (препарат Неовир, Фармсинтез, Россия), меглюминовая соль СМА (препарат Циклоферон, НТФФ Полисан, Россия), а также коммерчески доступная СМА (Sigma, США, кат №17927, каталог 2005 года), препарат соли СМА с 3-O-(N,N-диметиламино-н-пропил)-1,2:5,6-ди-O-изопропилиден-α,D-глюкофуранозой (препарат Анандин, Медитэр, Россия). Другие соли СМА были синтезированы известными, сравнительно простыми методами (см. например: Inglot A.D. et al., Archivum Immunologiae et Therapiae Experimentalis, 1985, vol.33, pp.275-285; патент РФ №2135474; патент РФ №2036198; патент РФ №2033413). В отдельных случаях, например, для введения per rectum в клинике готовились свечи, содержащие СМА или ее фармацевтически приемлемую соль, на основе широко применяемых для этих целей суппозиторных масс, таких как Витепсол (Witepsol W 35, Е 75).
В клинике использовали коммерчески доступные фармацевтические препараты антиэстрогенов и прогестинов. В экспериментах использовались коммерческие химически чистые прогестины, эстрогены и антиэстрогены (Sigma-Aldrich, Fluka, США).
ПРИМЕР 1. Влияние солей СМА в комбинации с антиэстрогеном и прогестином на рост рака молочной железы человека
В первой серии экспериментов изучено шесть опухолевых эксплантов, полученных, соответственно, из биоптатов опухолей от 3 женщин, страдающих раком молочной железы с рецептор-позитивным статусом.
Методика проведения экспериментов описана в тексте.
После эксплантации одна половина эксплантатов инкубировалась с эглюминовой солью СМА (3,6×10-12 М), а вторая - без нее. В качестве антиэстрогена использовался тамоксифен в виде цитрата (ТАМ), в качестве прогестина использовался медроксипрогестерона ацетат (МПА).
Данные о воздействии и результатах экспериментов приведены в таблице 1 (в присутствии стимулирующего фактора (эстрогена)) и в таблице 2 (в отсутствие гормонального стимулирущего фактора).
| Таблица 1.Подавление синтеза ДНК в ткани опухоли молочной железы человека в присутствии эстрогенной стимуляции путем комбинированного воздействия соли СМА и антиэстрогена и/или прогестина | ||||||
| Носитель/среда | СМА (3,6×10-12 М) в виде натриевой соли | |||||
| ТАМ | МПА | ТАМ+МПА | ТАМ | МПА | ТАМ+МПА | |
| ВС1* | 50% | 75% | 33% | 22% | 43% | 15% |
| ВС2 | 75% | 68% | 32% | 21% | 54% | 10% |
| BC3 | 50% | 78% | 25% | 36% | 34% | 14% |
| Примечание: контроль (100%) - удельная радиоактивность метки в присутствии эстрогена.*ВС - образец ткани рака молочной железы, цифра - номер пациента. |
| Таблица 2.Подавление синтеза ДНК в ткани рака молочной железы человека в отсутствие эстрогенной стимуляции путем комбинированного воздействия соли СМА и антиэстрогена и/или прогестина | ||||||
| Носитель/среда | СМА (3,6×10-12 M) в виде натриевой соли | |||||
| ТАМ | МПА | ТАМ+МПА | ТАМ | МПА | ТАМ+МПА | |
| ВС1* | 73% | 69% | 44% | 33% | 53% | 23% |
| ВС2 | 80% | 50% | 33% | 54% | 53% | 19% |
| BC3 | 48% | 78% | 56% | 27% | 64% | 26% |
| Примечание: контроль (100%) - удельная радиоактивность метки вне гормональных воздействий.*ВС - образец ткани рака молочной железы, цифра - номер пациента. |
Из данных, представленных в таблицах 1 и 2, следует, что СМА резко увеличивает чувствительность ткани опухоли к антиэстрогенам, прогестинам и особенно к комбинации «антиэстроген + прогестин».
Комбинация СМА + комбинированное гормональное воздействие (антиэстроген плюс прогестин) обладает резко выраженным ингибирующим воздействием на ростовые свойства ткани опухоли.
При этом сила обнаруженного эффекта СМА слабо зависит от присутствия или отсутствия стимулирующего фактора (эстрогена), а сама СМА не ингибирует рост опухолевой ткани. То есть указанное синергетическое действие СМА и антиэстрогена не зависит от наличия или отсутствия эстрогенного стимула и обусловлено наличием иных (внерецепторных) механизмов регуляции роста опухоли, которые напрямую не связаны с ее рецепторным статусом.
ПРИМЕР 2. Влияние солей СМА в комбинации с антиэстрогеном и прогестином на рост рака эндометрия человека
В первой серии экспериментов изучено шесть эксплантов полученных, соответственно, из биоптатов опухолей от 3 женщин, страдающих рецептор-позитивным раком эндометрия.
Методика проведения экспериментов описана в тексте.
После эксплантации половина эксплантов инкубировалась с меглюминовой солью СМА (3,6×10-12 М), а вторая - без нее.
В качестве антиэстроена использовался фульвестрант (фазлодекс) (ФУЛ), в качестве прогестина - мегестролацетат (МЕГ).
Данные о воздействии и результатах экспериментов приведены в таблице 3 (в присутствии стимулирующего фактора (эстрогена)) и в таблице 4 (в отсутствие стимулирущего фактора).
| Таблица 3.Подавление синтеза ДНК в ткани рака эндометрия человека в присутствии эстрогенной стимуляции путем комбинированного воздействия соли СМА и антиэстрогена и/или прогестина | |||
| Носитель/среда | СМА (3,6×10-12 М) в виде меглюминовой соли | ||
| ФУЛ | МЕГ | Ф |