Способ селективного разрушения меланомы
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к наномедицине и онкологии, и может быть использовано для селективного разрушения меланомы. Способ включает введение до облучения внутривенно раствора химического соединения аминокислоты L-фенилаланина с золотыми или серебрянными наночастицами. При этом минимальная концентрация наночастиц 108 см-3 и максимальная концентрация 1012 см-3. Плазменный резонанс наночастиц имеет спектральный максимум в области прозрачности биотканей на длине волны 750-1200 нм. Данные наночастицы представляют собой золотые или серебрянные нанооболочки с ядром из двуокиси кремния или наностержни. Облучение меланомы проводят не менее чем через 1 час и не более, чем через 4 часа после введения раствора, лазерным пучком с длиной волны излучения, совпадающей со спектральным максимумом поглощения плазменного резонанса наночастиц. При этом облучение производят последовательностью лазерных импульсов с длительностью лазерного импульса в диапазоне 10 мкс - 100 нс при минимальной скважности три и более, при плотности энергии не менее 20 Дж/см2, но не более 200 Дж/см2. Способ позволяет локально проводить разрушение меланомы при минимальном разрушении окружающих здоровых клеток. 10 ил.
Реферат
Изобретение относится к области биомедицинских технологий, в частности к созданию неинвазивного селективного лазерного фототермолиза злокачественных клеток меланомы на основе технологии плазмонно-резонансных золотых или серебрянных наночастиц. При лечении таких новообразований как меланома у теплокровных животных или людей традиционными способами хирургии не всегда возможен из-за особенностей локализации опухоли (например, в области твердого неба или глотки), а также, даже если иссекается более трех сантиметров здоровой ткани от границы опухоли, в большинстве случаев возникают метастазы, а при химиотерапии возникает много осложнений (Руководство по химиотерапии опухолевых заболеваний, под. ред Н.И.Переводчиковой. М. Практическая медицина. 2005, с.581-657; Уайт Р. Онкологические заболевания мелких домашних животных. М.: Аквариум, 2003).
Известен способ близкофокусной рентгенотерапии с суммарной очаговой дозой 100-120 Гр и дистанционной гамма-терапии при лучевом разрушении злокачественных клеток меланомы с суммарной очаговой дозой 30-40 Гр (Ш.Х.Ганцев. Онкология. М.: Медицинское информационное агентство. 2004, с.190-204; Stephen J., Withrow E., MacEwen G. Smal animal clinical oncology - 2001, p.305-308).
Однако данный способ, несмотря на распространенность, обладает следующими недостатками. При лечении меланомы с помощью дистанционной гамма-терапии даже в сочетании с иммунотерапией, как показывает опыт, приводит к 75-90% рецидиву опухолей, а через 2-6 месяцев возникают метастазы.
Известен способ фотодинамического разрушения опухолей, включающий внутривенное введение фотосенсибилизатора и облучение опухоли непрерывным лазерным излучением с длиной волны, совпадающей с полосой поглощения фотосенсибилизатора (Photodynamic therapy /Ed.T.J.Dougherty/ J. Clin. Laser Med Surg. 1996, Vol.14, P.219-348; Патент РФ №2184578, МПК A61N 5/06; Странадко. Анализ непосредственных результатов ФДТ злокачественных новообразований. Новые достижения лазерной медицины. - М. - СПб., 1993, с.218). Селективный фотодинамический механизм разрушения раковых клеток основан на более высокой плотности (контрастности) накопления фотосенсибилизатора в опухолевых клетках по сравнению с обычными, что связано с большей плотностью кровеносных сосудов в опухоли по сравнению со здоровой биотканью.
Однако этот контраст для различных опухолей не превышает двух-трех раз. При поглощении лазерного излучения фотосенсибилизатором молекулы красителя переходят в возбужденное электронное состояние и при столкновении с молекулами кислорода, растворенного в биоткани, переводят его из невозбужденного в возбужденное электронное синглетное состояние, с типичным временем жизни несколько микросекунд. За это время молекулы синглетного кислорода, пройдя характерный путь, соизмеримый с размерами клеток при взаимодействии с плазматической мембраной клетки, повреждают ее, и клетка гибнет вследствие некроза. Таким образом, разрушение клеток происходит лишь во время воздействия лазерного излучения в пространственной области облучения лазерным пучком.
Фотодинамический способ при разрушении клеток меланомы имеет ряд недостатков. Коэффициент поглощения меланина достигает 104-3 см-1 в ультрафиолетовой и фиолетовой области и спадает до 102 см-1 в красной области, поэтому глубина проникновения лазерного излучения менее сотен микрон. Используемые в практике фотосенсибилизаторы - фталационины, порфирины, хлорины имеют полосы поглощения фотосенсибилизаторов в ультрафиолетовой или видимой области спектра, и используемые лазеры не могут эффективно проникать в меланому. Кроме того, фотодинамический способ обладает малой контрастностью накопления фотосенсибилизаторов в раковых клетках.
Наиболее близким к предлагаемому способу является нейтрон-захватный способ селективного разрушения меланомы (В.Н.Митин, Н.Г.Козловская, A.M.Арнопольская. Нейтрон-захватная терапия опухолей ротовой полости у собак. Всероссийский ветеринарный журнал. 2006. №1, с.9-10).
Способ включает введение в кровь внутривенно L-борфенилаланина, который селективно накапливается в определенной опухоли-меланоме, так как L-фенилаланин является незаменимой аминокислотой, из которой вырабатывается меланин, образующий меланоциты, содержащиеся в клетках меланомы. Таким образом, происходит селективное накопление L-борфенилаланина в клетках меланомы. При облучении пространственной зоны, соизмеримой с опухолью, содержащей L-борфенилалан пучком медленных нейтронов, получаемых по нейтроноводу из ядерного реактора, происходит разрушение клеток меланомы, вследствие индуцированного вторичного локального излучения бора.
Однако данный способ обладает следующими недостатками.
1. Радиационное облучение пациентов, которое лишь частично уменьшается при использовании литиевого защитного фартука.
2. Сложная и очень дорогая установка, включающая компактный ядерный реактор, требующий для обслуживания квалифицированных специалистов немедицинского профиля, в частности физиков-ядерщиков.
3. Длительное время облучения пациентов в течение часа при мониторинге сердечно-сосудистой системы.
4. Применение общей анестезии.
Задачей настоящего изобретения является повышение локальности способа селективного разрушения меланомы при минимальном разрушении окружающих здоровых клеток биоткани.
Технический результат заключается в эффективности повреждения злокачественных клеток меланомы при проведении операции без общей анестезии.
Поставленная задача решается тем, что в способе селективного разрушения меланомы, включающем внутривенное введение раствора аминокислоты L-фенилаланина и облучение меланомы, согласно решению в качестве раствора используют химическое соединение аминокислоты L-фенилаланина с золотыми или серебрянными наночастицами, представляющими собой золотые или серебрянные нанооблочки или наностержни при минимальной концентрации 108 см-3 и максимальной концентрации 1012/см-3 с плазменным резонансом, имеющим спектральный максимум в области прозрачности биотканей на длине волны 750-1200 нм, облучение меланомы проводят лазерным пучком с длиной волны излучения, совпадающей с спектральным максимумом поглощения плазменного резонанса наночастиц, при этом для локального разрушения клеток меланомы облучение производят последовательностью лазерных импульсов с длительностью лазерного импульса в диапазоне 10 мкс - 100 нс при минимальной скважности три и более при плотности энергии не менее 20 Дж/см2, но не более 200 Дж/см2.
Изобретение поясняется чертежами.
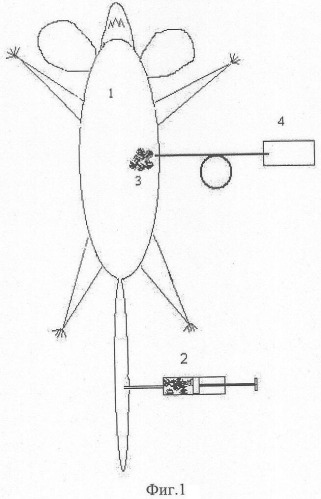
На фиг.1 показана блок-схема эксперимента по разрушению меланомы лабораторной крысы in vivo на основе импульсного лазерного фототермолиза при использовании технологии плазмонно-резонансных золотых или серебрянных наночастиц, где 1 - лабораторная крыса, 2 - химическое соединение L-фенилаланина с золотыми или серебряными плазмонно-резонансными наночастицами, состоящими из нанооболочек или наностержней; 3 - злокачественная опухоль - меланома; 4 - импульсный инфракрасный (750-1200 нм) полупроводниковый лазер с волоконно-оптическим световодом.
На фиг.2 - изображение золотых наночастиц, полученное с помощью электронного микроскопа: (а) - наносферы диаметром 5 нм, (б) - золотые нанооболочки диаметром 90 нм с ядром из двуокиси кремния, (в) - золотые наностержни с диаметром 15 нм и длиной 50 нм.
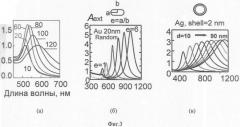
На фиг.3 - зависимость коэффициента экстинкции (поглощение и рассеяние света) от длины волны (нм) при изменении геометрических параметров наночастиц: (а) - золотые наносферы, (б) - золотые наностержни с отношение длины к диаметру от 1 до 6; (в) - золотые оболочки с толщиной 2 нм с диаметром ядра из двуокиси кремния от 10 до 90 нм.
На фиг.4 - термограмма эффективности нагрева золотых плазмонно-резонансных нанооболочек при воздействии непрерывного и импульсного лазерного излучения с длиной волны 810 нм при одинаковой средней оптической мощности 2 Вт и времени облучения 1 минута.
На фиг.5 - экспериментальная термограмма неравномерности нагрева по глубине кюветы при облучении лазерным пучком плазмонно-резонансных золотых нанооболочек с различной концентрацией: (а) - N=5·109 мл-1, (б) - N/8=0.61·109 мл-1.
На фиг.6 представлена фотография лабораторной крысы при воздействии излучения полупроводникового лазера, используемого для нагрева плазмонно-резонансных наночастиц с помощью непрерывного (крестики) и импульсного режима (точки) при одинаковой средней плотности лазерной энергии.
На фиг.7 представлена термограмма эффективности лазерного фототермолиза биотканей с введенными на разную глубину золотыми плазмонно-резонансными наночастицами: (а) - контроль без наночастиц; (б) - внутимышечное введение объема 0.1 мл SiO2/Au на глубину 5 мм; (в) подкожное введение; (г) внутрикожное введение.
На фиг.8 - гистологический срез биоткани лабораторной крысы после внитримышечного введения плазмонно-резонансных нанооболочек на глубину 5 мм при последующем воздействии излучением полупроводникового лазера с длиной волны 810 нм в течение 30 секунд, мощностью 2 Вт в непрерывном режиме, (а) - снимок в темном поле, (б) - снимок в проходящем свете.
На фиг.9 - гистологический срез от эпидермиса до мышечной ткани после внитримышечного введения золотых плазмонно-резонансных нанооболочек на глубину 5 мм при воздействии излучения полупроводникового лазера с длиной волны 810 нм в течение 10 секунд: (а) - импульсный режим, длительность импульса 1 мс, скважность 5; (б) - непрерывный режим с одинаковой лазерной энергией 20 Дж.
На фиг.10 - разрушение меланомы слизистой ротовой полости у собаки при лазерном фототермолизе на основе технологии плазмонно-резонансных наночастиц: (а) - фотография (б) - термограмма.
Способ осуществляется следующим образом.
Человеку или животному внутривенно, например, лабораторной крысе 1 в хвостовую вену с помощью инсулинового шприца вводится раствор, состоящий из химического соединения 2 L-фенилаланина с золотыми или серебряными плазмонно-резонансными нанооболочками или наностержнями (биоконъюгат) при концентрации не менее 108 см-3 и не более 1012 см-3, растворенном в физиологическом растворе, не менее чем через 1 час и не более чем 4 часа, соответствующих оптимальному накоплению наночастиц в злокачественной опухоли - меланоме 3, производят облучение меланомы импульсным полупроводниковым лазером 4 с длиной волны, совпадающей с максимумом плазменного резонанса наночастиц, лежащим в области прозрачности биотканей (750-1200 нм), в течение времени, которое определяется соответствующим уровнем плотности энергии воздействующего лазерного пучка не менее 20 Дж/см2 и не более 200 Дж/см2. Следует отметить, что в качестве импульсного лазера с микро- и наносекундной длительностью может быть использован твердотельные лазеры на алюмоиттриевом гранате с неодимом с длиной волны 960 и 1064 нм.
Нижний предел плотности энергии используемых лазеров определяется температурой нагрева биоткани, содержащей наночастицы, вызывающий некроз клеток опухоли, а верхний предел определяется уровнем плотности лазерной энергии, не вызывающей патологических изменений биоткани, в которой не содержатся плазмонно-резонансные наночастицы.
В лаборатории размерных наносенсоров ИБФРМ РАН авторами заявки разработана технология и реально изготавливаются плазмонно-резонансные наночастицы с возможностью управления спектральным положением плазмонного резонанса золотых или серебряных наночастиц при изменении геометрических параметров наночастиц как показано на фиг.4 (Н.Г.Хлебцов, В.А.Богатырев, Л.А.Дыкман, Б.Н.Хлебцов. Золотые наноструктуры с плазменным резонансом для биомедицинских исследований // Российские нанотехнологии. 2007. Т.2. №3-4. С.69-86; Khiebtsov N.G., Trachuk L.A., Melnikov A.G. Proc. SPIE, 2004. V.5475, 1-11).
Из сравнения лазерного нагрева кюветы с плазмонно-резонансными золотыми нанооболочками объемом 2 мл (фиг.5) при непрерывном (максимальная температура нагрева 57,4°С) и импульсном (максимальная температура нагрева 40,7°С) (длительность лазерных импульсов 2 мс и временное расстояние между импульсами 14 мс, скважность 7) облучении при одинаковой средней энергии лазерного излучения 150 Дж (в непрерывном режиме лазерная мощность 2,5 Вт в течение 1 минуты). Нетрудно видеть, что при импульсном воздействии кювета нагревается на 17°С меньше по сравнению с непрерывным нагревом, что экспериментально доказывает локальность нагрева плазмонно-резонансных золотых нанооболочек, обусловленною конечностью времени установления температуры.
Концентрация плазмонно-резонансных золотых или серебряных наночастиц должна находиться в определенном диапазоне. Максимальное значение концентрации плазмонно-резонансных золотых или серебряных наночастиц определяется процессами образования кластеров и уширения плазменного резонанса. Нижняя граница концентрации плазмонно-резонансных золотых или серебряных наночастиц определяется эффективностью лазерного нагрева. На фиг.5. показана экспериментальная термограмма неравномерности нагрева плазмонно-резонансных золотых нанооболочек по глубине при облучении лазерным пучком при различных концентрациях. Пробирка типа Эппендорф с золотыми плазмонно-резонансными нанооболочками, растворенными в физрастворе объемом 2 мл с разной концентрацией наночастиц 5·109 мл-1 (а) и 0.61·109 мл (отличающихся в 8 раз) при воздействии непрерывного лазерного излучения с длиной волны 810 нм, совпадающей с максимумом поглощения наночастиц при одинаковой средней лазерной мощности 2 Вт и времени облучения 2 минуты.
При этом, как показали контрольные эксперименты, проведенные по облучению биотканей лабораторных крыс с введенными в опухоль золотыми плазмонно-резонансными наночастицами (фиг.6) и последующим гистологическим анализом (фиг.8) были определены режимы лазерного облучения, в частности, длительность оптических импульсов, временное расстояние между ними и плотность лазерной энергии, вызывающий при фототермолизе биотканей локальный некроз клеток меланомы (см. статью I.L.Maksimova, G.G.Akchurin, B.N.Khiebtsov, G.S.Terentyuk, G.G.Akchurin, I.A.Ermolaev, A.A.Skaptsov, E.P.Soboleva, N.G.Khiebtsov and V.V.Tuchin. Near-infrared laser photothermal therapy of cancer by using gold nanoparticles:computer simulations and experiment. Medical Laser Application, 2007, V.22).
Как показано на фиг.8 в результате лазерого фототермолиза на основе технологии плазмонно-резонансных наночастиц по данным гистологического исследования наблюдается деструкция и фрагментация поперечно-полосатой мышцы, незначительный отек. На снимке в темном поле отчетливо видны наночастицы, расположенные в области исчерченности поперечно-полосатой мышцы.
Результаты сравнения лазерного фототермолиза при импульсном и непрерывном лазерном облучении представлены на фиг.9, где показан гистологический срез от эпидермиса до мышечной ткани после внутримышечного введения золотых плазмонно-резонансных нанооболочек на глубину 5 мм. При воздействии излучения полупроводникового лазера с длиной волны 810 нм в течение 10 секунд: (а) - импульсный режим, длительность импульса 1 мс, скважность 5; (б) - непрерывный режим с одинаковой лазерной энергией 20 Дж, следует, что при импульсном воздействии наблюдается лишь отек и разрыхление соединительной ткани, клеточная инфильтрация, свидетельствующая о воспалительном процессе. При непрерывном воздействии (б), в результате лазерного фототермолиза возникают очаги дестукции в дерме в виде гомогенизации и набухания основного вещества и коллагеновых волокон.
При импульсном нагреве золотых наночастицей длительность лазерного импульса определяет локальность нагрева наночастиц окружающей биоткани. Оценки показывают, что при облучении наносекундными импульсами эффективный радиус нагрева окружающей биоткани составляет не более 1 микрона (Khlebtsov B.N., Zharov V.P., Melnikov A.G., Tuchin V.V., Khlebtsov N.G. Optical amplification of photothermal therapy with gold nanoparticles and nanoclusters. Nanotechnology, 2006; 17, 5267-5179).
Однако обнаруженный эффект дефрагментации плазмонно-резонансных золотых нанооболочек при энергии одиночного лазерного импульса более 2 мДж и длительности 4 нс, вызывающих разрушение нанооболочек или локальное оплавление наностержней приводит к ограничению на интенсивность лазерного излучения сверху и его минимальную длительность. (G.Akchurin, В.Khlebtsov, G.Akchurin, V.Tuchin, V.Zharov, N.Khiebtsov. Laser-induced phonodestruction of silica/gold nanoshells under single nanosecond pulses. Nanothechnology, 2007, V.18).
Таким образом, параметры лазерного импульсного воздействия определялись экспериментально на фантомах биоткани и in vivo на спонтанных опухолях животных, при последующем гистологическом анализе и минимальная длительность лазерного импульса ограничивалась условием, указанным в формуле изобретения.
Проведенный по патентуемой методике лазерный фототермолиз на основе технологии плазмонно-резонансных золотых нанооболочек меланомы слизистой рта у собак и кошек вызвал рубцевание ткани без ремиссии и метастаз уже в течение от нескольких месяцев до одного года.
Способ селективного разрушения меланомы, включающий облучение меланомы, отличающийся тем, что дополнительно, до облучения, внутривенно вводят раствор химического соединения аминокислоты L-фенилаланина с золотыми или серебряными наночастицами, представляющими собой золотые или серебряные нанооболочки с ядром из двуокиси кремния или наностержни при минимальной концентрации 108 см-3 и максимальной концентрации 1012 см-3 с плазменным резонансом, имеющим спектральный максимум в области прозрачности биотканей на длине волны 750-1200 нм, облучение меланомы проводят не менее чем через 1 ч и не более чем через 4 ч после введения раствора лазерным пучком с длиной волны излучения, совпадающей со спектральным максимумом поглощения плазменного резонанса наночастиц, при этом облучение производят последовательностью лазерных импульсов с длительностью лазерного импульса в диапазоне 10 мкс - 100 нс при минимальной скважности три и более, при плотности энергии не менее 20 Дж/см2, но не более 200 Дж/см2.