Способы лечения коагулопатий с использованием сульфатированных полисахаридов
Иллюстрации
Показать всеИзобретение относится к лекарственным средствам и касается применения неантикоагулянтного сульфатированного полисахарида (NASP) для лечения индивидуума, нуждающегося в повышении свертываемости крови. Описанные NASP могут быть введены как самостоятельные средства или в сочетании с другими лекарственными средствами (такими как факторы VIII и VIIIa) для обеспечения гемостаза. Также раскрыт способ лечения индивидуума, нуждающегося в повышении свертываемости крови, предусматривающий введение указанному индивидууму терапевтически эффективного количества композиции, содержащей неантикоагулянтный сульфатированный полисахарид (NASP). Изобретение направлено на создание прокоагулянтного средства, обладающего широким диапазоном применения. 7 н. и 12 з.п. ф-лы, 8 ил., 13 табл.
Реферат
Изобретение относится к лечению коагулопатий, включающих в себя врожденные нарушения свертываемости крови, приобретенные нарушения свертываемости крови и травму, приводящую к геморрагическим состояниям. В частности, изобретение относится к применению неантикоагулянтных сульфатированных полисахаридов (NASP) для улучшения свертываемости крови и гемостаза при гемофилических состояниях.
Уровень техники
Свертывание крови в норме представляет собой комплекс физиологических и биохимических процессов, включающих в себя активацию каскада факторов свертывания крови, что приводит к образованию фибрина и агрегации тромбоцитов наряду с местной вазоконстрикцией (обзор Davie et al., Biochemistry 30:10363, 1991). Каскад свертывания крови состоит из "внешнего" пути, который, как полагают, является первичным средством стимуляции нормального свертывания крови, и "внутреннего" пути, обеспечивающего более распространенный коагуляционный ответ. В норме ответ на кровотечение включает в себя активацию внешнего пути. Активация внешнего пути начинается с контакта крови с тканевым фактором (TF), кофактором для фактора VII, который становиться доступным или экспрессируется в тканях после повреждения. TF образует комплекс с FVII, который способствует продукции FVIIa. Затем FVIIa ассоциирует с TF и преобразует FX в сериновую протеазу FXa, которая является основным компонентом протромбиназного комплекса. Преобразование протромбина в тромбин с помощью комплекса FXa/FVa/кальций/фосфолипид стимулирует образование фибрина и активацию тромбоцитов, что является необходимым для нормального свертывания крови. Гемостаз в норме дополнительно усиливается факторами внутреннего пути IXa и VIIIa, которые также преобразуют FX в FXa.
При коагулопатиях, которые могут возникать вследствие врожденных нарушений свертываемости крови, приобретенных нарушений свертываемости крови или геморрагических состояний, вызванных травмой, нарушается свертывание крови. Кровотечение является одним из наиболее серьезных и значительных проявлений заболевания и может возникать местно или генерализованно. Местное кровотечение может быть опосредовано повреждением и может дополнительно осложняться из-за поврежденного механизма гемостаза. Врожденное или приобретенное отсутствие любого из факторов свертывания может опосредовать склонность к кровотечениям. Врожденные нарушения свертываемости крови включают в себя гемофилию, рецессивное сцепленное с X-хромосомой нарушение, включающее в себя дефицит фактора свертывания VIII (гемофилия A) или фактора IX (гемофилия B), и болезнь фон Виллебранда, которая является редкой коагулопатией, вызванной тяжелым дефицитом фактора фон Виллебранда. Приобретенные нарушения свертываемости крови могут возникать у индивидуумов без возникавших ранее кровотечений в анамнезе, как результат патологического процесса. Например, приобретенные нарушения свертываемости крови могут быть вызваны ингибиторами или аутоиммунной реакцией против факторов свертывания крови, таких как фактор VIII, фактор фон Виллебранда, факторы IX, V, XI, XII и XIII; или нарушениями гемостаза, такими как нарушения, вызванные заболеваниями печени, которые могут быть связаны со снижением синтеза фактора свертывания. Как правило, при дефиците фактора свертывания лечение проводят замещением фактора, что является дорогостоящим, неудобным (внутривенное введение) и не всегда эффективным. Не менее чем у 20% пациентов, получающих длительную заместительную терапию, могут образовываться нейтрализующие антитела против замещающих факторов.
Таким образом, остается необходимость в новых терапевтических подходах для лечения коагулопатий. Единое фармацевтическое средство, которое является безопасным, удобным и эффективным при различных коагулопатиях, могло бы оказаться благоприятным в клинической практике.
Сущность изобретения
Настоящее изобретение относится к способам и композициям для лечения коагулопатий с использованием в качестве прокоагулянтов неантикоагулянтных сульфатированных полисахаридов (NASP). NASP можно вводить в качестве единственного средства, или в сочетании с еще одним NASP, или с другими гемостатическими средствами. В частности, описано использование NASP для лечения коагулопатий, включая врожденные нарушения свертываемости крови, приобретенные нарушения свертываемости крови и травму, приводящую к геморрагическим состояниям.
В одном из аспектов изобретение относится к способу лечения индивидуума, нуждающегося в повышении свертываемости крови, предусматривающему введение индивидууму терапевтически эффективного количества композиции, содержащей неантикоагулянтный сульфатированный полисахарид (NASP). В некоторых вариантах осуществления изобретение относится к способу лечения индивидуума, страдающего коагулопатией, предусматривающему введение индивидууму терапевтически эффективного количества композиции, содержащей NASP. В некоторых вариантах осуществления NASP выбран из группы, состоящей из N-ацетилгепарина (NAH), N-ацетил-де-O-сульфатированного гепарина (NA-de-o-SH), де-N-сульфатированного гепарина (De-NSH), де-N-сульфатированного ацетилированного гепарина (De-NSAH), оксидированного йодной кислотой гепарина (POH), химически сульфатированного ламинарина (CSL), химически сульфатированной альгиновой кислоты (CSAA), химически сульфатированного пектина (CSP), декстрансульфата (DXS), полученных из гепарина олигосахаридов (HDO), пентозанполисульфата (PPS) и фукоидана.
В других вариантах осуществления NASP выбран из группы, состоящей из низкомолекулярных фрагментов перечисленных выше соединений. В предпочтительных вариантах осуществления фрагмент NASP снижает время свертывания крови в анализе dPT. В одном из вариантов осуществления NASP представляет собой фрагмент фукоидана, который снижает время свертывания в анализе dPT.
В дополнительных вариантах осуществления NASP можно вводить совместно с одним или несколькими различными NASP и/или в сочетании с одним или несколькими другими терапевтическими средствами.
В некоторых вариантах осуществления NASP вводят индивидууму для лечения коагулопатий, выбранных из группы, состоящей из гемофилии A, гемофилии B, болезни фон Виллебранда, идиопатической тромбоцитопении, дефицита одного или нескольких факторов контакта, таких как фактор XI, фактор XII, прекалликреин и высокомолекулярный кининоген (HMWK), дефицита одного или нескольких факторов, опосредованного выраженными клиническими кровотечениями, таких как фактор V, фактор VII, фактор VIII, фактор IX, фактор X, фактор XIII, фактор II (гипопротромбинемия) и фактор фон Виллебранда, дефицита витамина К, нарушения фибриногена, включающего афибриногенемию, гипофибриногенемию и дисфибриногенемию, дефицита альфа2-антиплазмина и обильного кровотечения, такого как кровотечение, вызванное заболеванием печени, заболеванием почек, тромбоцитопенией, тромбоцитарной дисфункцией, гематомы, внутреннего кровотечения, гемартрозов, хирургической операции, травмы, гипотермии, менструации и беременности.
В некоторых вариантах осуществления NASP вводят индивидууму для лечения врожденного нарушения свертываемости или приобретенного нарушения свертываемости, вызванных дефицитом факторов крови. Дефицит фактора крови может быть вызван дефицитом одного или нескольких факторов, включающих в себя, но ими не ограничиваясь, фактор V, фактор VII, фактор VIII, фактор IX, фактор XI, фактор XII, фактор XIII и фактор фон Виллебранда.
В некоторых вариантах осуществления индивидууму, страдающему коагулопатией, вводят терапевтически эффективное количество композиции, содержащей NASP в сочетании с другим терапевтическим средством. Например, индивидууму можно вводить терапевтически эффективное количество композиции, содержащей NASP и один или несколько факторов, выбранных из группы, состоящей из фактора XI, фактора XII, прекалликреина, высокомолекулярного кининогена (HMWK), фактора V, фактора VII, фактора VIII, фактора IX, фактора X, фактора XIII, фактора II, фактора VIIa и фактора фон Виллебранда. Кроме того, лечение может предусматривать введение прокоагулянта, такого как тромбин; активатор внутреннего пути свертывания крови, включая фактор Xa, фактор IXa, фактор XIa, фактор XIIa и VIIa, прекалликреин и высокомолекулярный кининоген; или активатор внешнего пути свертывания крови, включая тканевой фактор, фактор VIIa, фактор Va и фактор Xa. Терапевтические средства, используемые для лечения индивидуума, страдающего коагулопатией, можно вводить в виде одной или различных композиций одновременно, до или после введения NASP.
В другом аспекте изобретение относится к способу обратного эффекта антикоагулянта у индивидуума, способу, предусматривающему введение индивидууму терапевтически эффективного количества композиции, содержащей неантикоагулянтный сульфатированный полисахарид (NASP). В некоторых вариантах осуществления индивидуум может получать лечение антикоагулянтом, включая, но не ограничиваясь ими, гепарин, производное кумарина, такое как варфарин или дикумарол, ингибитор пути тканевого фактора (TFPI), антитромбин III, волчаночный антикоагулянт, антикоагулянтный пептид нематод (NAPc2), фактор VIIa (фактор VIIai) с заблокированным активным центром, ингибиторы фактора IXa, ингибиторы фактор Xa, включая фондапаринукс, идрапаринукс, DX-9065a и разаксабан (DPC906), ингибиторы факторов Va и VIIIa, включая активированный протеин C (APC) и растворимый тромбомодулин, ингибиторы тромбина, включая гирудин, бивалирудин, аргатробан и ксимелагатран. В некоторых вариантах осуществления антикоагулянтом, вводимым индивидууму, могут быть антитела, которые связываются с фактором свертывания, включая, но не ограничиваясь ими, антитела, которые связываются с фактором V, фактором VII, фактором VIII, фактором IX, фактором X, фактором XIII, фактором II, фактором XI, фактором XII, фактором фон Виллебранда, прекалликреином или высокомолекулярным кининогеном (HMWK).
В некоторых вариантах осуществления для обратного эффекта антикоагулянта у пациента можно вводить NASP совместно с одним или несколькими различными NASP и/или в сочетании с одним или несколькими другими терапевтическими средствами. Например, индивидууму можно вводить терапевтически эффективное количество композиции, содержащей NASP и один или несколько факторов, выбранных из группы, состоящей из фактора XI, фактора XII, прекалликреина, высокомолекулярного кининогена (HMWK), фактора V, фактора VII, фактора VIII, фактора IX, фактора X, фактора XIII, фактора II, фактора VIIa и фактора фон Виллебранда. Кроме того, лечение может предусматривать введение прокоагулянта, такого как активатор внутреннего пути свертывания крови, включая фактор Xa, фактор IXa, фактор XIa, фактор XIIa, и VIIIa, прекалликреин и высокомолекулярный кининоген; или активатор внешнего пути свертывания крови, включая тканевой фактор, фактор VIIa, фактор Va и фактор Xa. Терапевтические средства, используемые в сочетании с NASP для обратного эффекта антикоагулянта у пациента можно вводить в виде одной или различных композиций одновременно, до или после введения NASP.
В другом аспекте изобретение относится к способу лечения индивидуума, перенесшему хирургическую или инвазивную процедуру, когда улучшение свертываемости крови было бы желательным, предусматривающему введение индивидууму терапевтически эффективного количества композиции, содержащей неантикоагулянтный сульфатированный полисахарид (NASP). В некоторых вариантах осуществления NASP можно вводить совместно с одним или несколькими различными NASP и/или в сочетании с одним или несколькими другими терапевтическими средствами индивидууму, перенесшему хирургическую или инвазивную процедуру. Например, индивидууму можно вводить терапевтически эффективное количество одного или нескольких факторов, выбранных из группы, состоящей из фактора XI, фактора XII, прекалликреина, высокомолекулярного кининогена (HMWK), фактора V, фактора VII, фактора VIII, фактора IX, фактора X, фактора XIII, фактора II, фактора VIIa и фактора фон Виллебранда. Кроме того, лечение может предусматривать введение прокоагулянта, такого как активатор внутреннего пути свертывания крови, включая фактор Xa, фактор IXa, фактор XIa, фактор XIIa и VIIIa, прекалликреин и высокомолекулярный кининоген; или активатор внешнего пути свертывания крови, включая тканевой фактор, фактор VIIa, фактор Va и фактор Xa. Терапевтические средства, используемые для лечения индивидуума, перенесшего хирургическую или инвазивную процедуру, можно вводить в виде одной или различных композиций одновременно, до или после введения NASP.
В другом аспекте изобретение относится к способу ингибирования активности TFPI у индивидуума, к способу, предусматривающему введение индивидууму терапевтически эффективного количества композиции, содержащей NASP.
В другом аспекте изобретение относится к способу ингибирования активности TFPI в биологическом образце, к способу, предусматривающему объединение биологического образца (например, крови или плазмы) с достаточным количеством неантикоагулянтного сульфатированного полисахарида (NASP) для ингибирования активности TFPI.
В другом аспекте изобретение относится к композиции, содержащей NASP. В некоторых вариантах осуществления NASP выбран из группы, состоящей из N-ацетилгепарина (NAH), N-ацетил-де-O-сульфатированного гепарина (NA-de-o-SH), де-N-сульфатированного гепарина (De-NSH), де-N-сульфатированного ацетилированного гепарина (De-NSAH), оксидированного йодной кислотой гепарина (POH), химически сульфатированного ламинарина (CSL), химически сульфатированной альгиновой кислоты (CSAA), химически сульфатированного пектина (CSP), декстрансульфата (DXS), полученных из гепарина олигосахаридов (HDO), пентозанполисульфата (PPS) и фукоидана. В других вариантах осуществления NASP выбран из группы, состоящей из низкомолекулярных фрагментов перечисленных выше соединений. Кроме того, в некоторых вариантах осуществления композиция может содержать фармацевтически приемлемый эксципиент. В некоторых вариантах осуществления композиция может дополнительно содержать один или несколько различных NASP и/или одно или несколько терапевтических средств и/или агентов. Например, композиция может дополнительно содержать один или несколько факторов, выбранных из группы, состоящей из фактора XI, фактора XII, прекалликреина, высокомолекулярного кининогена (HMWK), фактора V, фактора VII, фактора VIII, фактора IX, фактора X, фактора XIII, фактора II и фактора фон Виллебранда, тканевого фактора, фактора VIIa, фактора Va и фактора Xa, фактора IXa, фактора XIa, фактора XIIa и VIIIa; и/или один или несколько агентов, выбранных из группы, состоящей из агента APTT, тромбопластина, фибрина, TFPI, яда гадюки Рассела, микроизмельченных частиц диоксида кремния, эллаговой кислоты, сульфатидов и каолина.
В другом аспекте изобретение относится к способу определения ускорения свертывания крови под действием NASP в биологическом образце, к способу, предусматривающему:
a) объединение биологического образца с композицией, содержащей NASP,
b) измерение времени свертывания биологического образца,
c) сравнение времени свертывания биологического образца с временем свертывания соответствующего биологического образца, который не подвергали воздействию NASP, где снижение времени свертывания биологического образца, который подвергали воздействию, если оно наблюдается, означает, что NASP ускоряет свертывание.
В некоторых вариантах осуществления для определения времени свертывания к биологическому образцу можно добавлять один или несколько различных NASP, и/или терапевтических средств, и/или агентов. Например, могут быть добавлены один или несколько факторов, включая, но не ограничиваясь ими, фактор XI, фактор XII, прекалликреин, высокомолекулярный кининоген (HMWK), фактор V, фактор VII, фактор VIII, фактор IX, фактор X, фактор XIII, фактор II и фактор фон Виллебранда, тканевой фактор, фактор VIIa, фактор Va и фактор Xa, фактор IXa, фактор XIa, фактор XIIa и VIIIa; и/или один или несколько агентов, включая, но не ограничиваясь ими, агент APTT, тканевой фактор, тромбопластин, фибрин, TFPI, яд гадюки Рассела, микроизмельченные частицы диоксида кремния, эллаговую кислоту, сульфатиды и каолин.
Эти и другие варианты осуществления настоящего изобретения будут понятны специалисту в данной области, из приведенного здесь описания.
Краткое описание чертежей
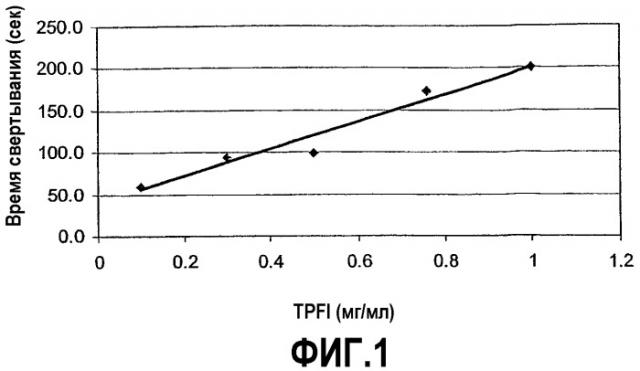
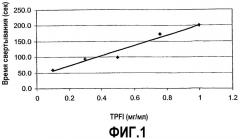
На фиг.1 представлено повышение времени свертывания гемофильной A плазмы (Hem-A) в присутствии ингибитора пути тканевого фактора (TFPI), определенное в анализе dPT. График зависимости времени свертывания (секунды) от концентрации TFPI (мкг/мл) показывает, что время свертывания повышается линейно с увеличением дозы TFPI.
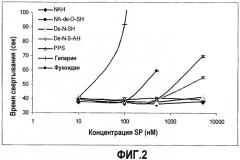
На фиг.2 представлено сравнение антикоагулянтной активности потенциальных NASP, N-ацетилгепарина (NAH), N-ацетил-де-O-сульфатированного гепарина (NA-de-O-SH), де-N-сульфатированного гепарина (De-N-SH), де-N-сульфатированного ацетилированного гепарина (De-N-SAH), пентозанполисульфата (PPS), фукоидана и гепарина. Выбранные полисахариды тестировали в различных концентрациях в плазме Hem-A. На фиг.2 представлен график зависимости времени свертывания (секунды) от концентрации (нМ). Показанные на графике точки представляют собой средние значения повторных измерений.
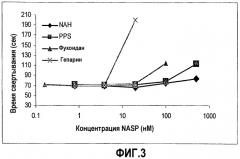
На фиг.3 представлено сравнение эффектов NAH, PPS, фукоидана и гепарина на время свертывания плазмы Hem-A, содержащей 1,25% плазмы FACT, определяемых с использованием анализа aPTT. На фиг.3 представлен график зависимости времени свертывания (секунды) от концентрации NASP (нМ). Показанные точки на графике представляют собой средние значения повторных измерений.
На фиг.4 показано, что NASP, включая NAH, PPS и фукоидан, ускоряют свертывание плазмы Hem-A, содержащей рекомбинантный TFPI. Перед добавлением в плазму NASP в течение короткого периода времени преинкубировали с TFPI. Время свертывания определяли с использованием анализа dPT. Представлен график зависимости времени свертывания (секунды) от концентрации NASP (нМ). Показанные точки на графике представляют собой средние значения повторных измерений. Ингибирование активности TFPI с помощью NASP приводит к снижению времени свертывания плазмы.
На фиг.5 показано, что NASP, включая NAH, PPS и фукоидан, ускоряют свертываемость гемофильной B плазмы (Hem-B), содержащей рекомбинантный TFPI. Перед добавлением в плазму NASP в течение короткого периода времени преинкубировали с TFPI. Время свертывания определяли с использованием анализа dPT. Представлен график зависимости времени свертывания (секунды) от концентрации NASP (нМ). Показанные точки на графике представляют собой средние значения повторных измерений. Ингибирование активности TFPI посредством NASP приводит к снижению времени свертывания плазмы.
На фиг.6 показано, что NAH, PPS и фукоидан ускоряют свертывание плазмы Hem-A, содержащей TFPI, без преинкубации TFPI с NASP перед добавлением TFPI в плазму. Представлен график зависимости времени свертывания (секунды) от концентрации NASP (нМ). Время свертывания определяли с использованием анализа dPT. Показанные точки на графике представляют собой средние значения повторных измерений.
На фиг.7 показано, что PPS и фукоидан ускоряют свертывание плазмы Hem-A в отсутствие экзогенного добавления TFPI. Эффект дозы NASP на усиление активации внешнего пути сравнивали с положительным контролем, фактором VIIa. На фиг.7 представлен график зависимости времени свертывания (секунды) от концентрации NASP (нМ). Время свертывания определяли с использованием анализа dPT. Показанные точки на графике представляют собой средние значения повторных измерений.
На фиг.8 показано, что при анализе dPT фукоидан и PPS ускоряют свертывание плазмы, дефицитной по фактору VII. Время свертывания измеряли после преинкубации плазмы, дефицитной по фактору VII, с различными концентрациями фукоидана или PPS. На фиг.8 представлен график зависимости времени свертывания (секунды) от концентрации NASP (нМ). Показанные точки на графике представляют собой средние значения повторных измерений.
Подробное описание изобретения
Для осуществления настоящего изобретения будут использованы, если нет иных указаний, обычные способы фармакологии, химии, биохимии, технологии свертывания, рекомбинантных ДНК и иммунологии в рамках области техники. Такие технологии подробно описаны в литературе. См., например, Handbook of Experimental Immunology, Vols.I-IV (D.M. Weir and C.C. Blackwell eds., Blackwell Scientific Publications); A.L. Lehninger, Biochemistry (Worth Publishers, Inc., current addition); Sambrook, et al., Molecular Cloning: A Laboratory Manual (2-nd Edition, 1989); Methods In Enzymology (S. Colowick and N. Kaplan eds., Academic Press, Inc.).
I. Определения
В описании настоящего изобретения будут использованы следующие термины, и они предназначены для обозначения следующего.
Следует заметить, что, как используется в этом описании и прилагаемой формуле изобретения, формы единичного числа "некоторый" и "этот" включают в себя обозначение множественного числа, если в содержании явно не указано иное. Таким образом, например, упоминание "NASP" включает в себя смесь двух или более таких средств и т.п.
Как используется в настоящем описании, термин "NASP" относится к сульфатированному полисахариду, который обладает антикоагулянтной активностью в анализах свертываемости по протромбиновому времени с разведенным тромбопластином (dPT) или по активированному частичному тромбопластиновому времени (aPTT), которая составляет не более одной трети и предпочтительно менее одной десятой молярной антикоагулянтной (статистически значимое повышение времени свертывания) активности нефракционированного гепарина (ММ в диапазоне от 8000 до 30000; в среднем 18000 дальтон). NASP могут быть очищенными и/или могут быть модифицированы из природных источников (например, бурые водоросли, древесная кора, ткани животных) или могут быть синтезированы de novo, и их молекулярная масса может находиться в диапазоне от 100 дальтон до 1000000 дальтон. NASP могут быть использованы в способах по настоящему изобретению для улучшения гемостаза при лечении коагулопатий, в частности таких коагулопатий, которые связаны с дефицитом факторов свертывания, или для обратного эффекта антикоагулянтов. Способность NASP стимулировать свертывание и уменьшать кровотечение легко определить с помощью различных анализов свертываемости in vitro (например, анализов dPT и aPTT) и в моделях кровотечения in vivo (например, надрез хвоста, поперечный разрез, время свертывания цельной крови или определение времени кровотечения из эпонихия у мышей и собак с гемофилией). Смотри, например, PDR Staff. Physicians' Desk Reference. 2004, Anderson et al. (1976) Thromb. Res. 9:575-580; Nordfang et al. (1991) Thromb Haemost. 66:464-467; Welsch et al. (1991) Thrombosis Research 64: 213-222; Broze et al. (2001) Thromb Haemost 85:747-748; Scallan et al. (2003) Blood. 102:2031-2037; Pijnappels et al. (1986) Thromb. Haemost. 55:70-73; и Giles et al. (1982) Blood 60:727-730.
Как используется в настоящем описании термин "прокоагулянт" относится к любому фактору или агенту, способному стимулировать или ускорять образование тромба. Прокоагулянт по настоящему изобретению включает в себя любой активатор внутреннего или внешнего пути свертывания, такой как фактор свертывания, выбранный из группы, состоящей из фактора Xa, фактора IXa, фактора XIa, фактора XIIa и VIIIa, прекалликреина, высокомолекулярного кининогена, тканевого фактора, фактора VIIa и фактора Va. Другие агенты, которые обеспечивают свертывание, включают в себя калликреин, инициатор APTT (т.е. агент, содержащий фосфолипид и контактный активатор), яд гадюки Рассела (время RVV) и тромбопластин (для dPT). Контактные активаторы, которые могут использоваться в способах по настоящему изобретению в качестве прокоагулянтных агентов, включают в себя микроизмельченные частицы диоксида кремния, эллаговую кислоту, сульфатиды, каолин или тому подобное, известные специалистам в данной области. Прокоагулянты могут быть получены из неочищенных природных экстрактов, крови или образца плазмы, могут быть выделенными и по существу очищенными, синтетическими или рекомбинантными. Прокоагулянты могут включать в себя природные факторы свертывания или их фрагменты, варианты или ковалентно модифицированные производные, которые сохраняют биологическую активность (т.е. обеспечивают свертывание). Оптимальные концентрации прокоагулянта могут быть определены специалистами в данной области.
Как используется в настоящем описании термин "полисахарид" относится к полимеру, содержащему множество (т.е. два или более) ковалентно связанных остатков сахаридов. Связи могут быть природными или неприродными. Природные связи включают в себя, например, гликозидные связи, а неприродные связи могут включать, например, группы, связанные со сложным эфиром, амидом или оксимом. Полисахариды могут обладать любым из широкого диапазона значением средней молекулярной массы (ММ), но, как правило, оно составляет по меньшей мере приблизительно 100 дальтон. Например, полисахариды могут иметь молекулярную массу по меньшей мере приблизительно 500, 1000, 2000, 4000, 6000, 8000, 10000, 20000, 30000, 50000, 100000, 500000 дальтон или даже выше. Полисахариды могут иметь неразветвленную или разветвленную структуру. Полисахариды могут включать в себя фрагменты полисахаридов, образованные при деградации (например, гидролизе) более крупных полисахаридов. Деградацию можно достичь любым из множества способов, известных специалистам в данной области, включая обработку полисахаридов кислотой, основанием, нагреванием или ферментами, с получением деградированных полисахаридов. Полисахариды могут быть химически изменены и могут иметь модификации, включая, но не ограничиваясь ими, сульфатацию, полисульфатацию, этерификацию и метилирование.
Термин "полученный из" используется в настоящем описании для определения исходного источника молекулы, но он не предназначен для ограничения способа, которым получена эта молекула, который может представлять собой химический синтез или рекомбинантные способы.
Термины "вариант", "аналог" и "мутеин" относятся к биологически активным производным указанной молекулы, которые сохраняют желательную активность, такую как активность в отношении свертывания крови при лечении указанных здесь коагулопатий. Как правило, в случае полипептида (например, фактора свертывания) термины "вариант" и "аналог" относятся к соединениям с последовательностью и структурой нативного полипептида, имеющим одно или несколько аминокислотных добавлений, замещений (как правило, консервативных по своей природе) и/или делеций в нативной молекуле, при условии, что модификации не нарушают биологическую активность, и соединения являются "по существу гомологичными" указанной молекуле, как определено ниже. Как правило, аминокислотная последовательность таких аналогов будет обладать высокой степенью гомологии с указанной последовательностью при выравнивании двух последовательностей, например, гомология аминокислотной последовательности может составлять более 50%, как правило, более 60-70%, еще более конкретно 80-85% или более, как, например, по меньшей мере 90-95% или более. Зачастую аналоги включают в себя такое же количество аминокислот, но имеют замены, как объясняется в данном описании. Кроме того, термин "мутеин" включает в себя полипептиды с одной или несколькими молекулами, подобными аминокислотам, включая, но не ограничиваясь ими, соединения, содержащие только амино и/или имино молекулы, полипептиды, содержащие один или несколько аналогов аминокислот (включая, например, неприродные аминокислоты и тому подобное), полипептиды с замещенными связями, а также другие модификации, известные в данной области, и природные и неприродные (например, синтетические), циклизованные, разветвленные молекулы и тому подобное. Термин также включает в себя молекулы, содержащие один или несколько N-замещенных остатков глицина ("пептоид") и другие синтетические аминокислоты или пептиды. (Описание пептидов смотри, например, в патентах США № 5831005; 5877278 и 5977301; Nguyen et al., Chem Biol. (2000) 7:463-473; и Simon et al., Proc. Natl. Acad. Sci. USA (1992) 89:9367-9371). Предпочтительно аналог или мутеин обладает по меньшей мере такой же активностью в отношении свертывания крови, как и нативная молекула. Способы получения аналогов полипептидов и мутеинов известны в данной области и дополнительно описаны ниже.
Как указано выше, аналоги, как правило, включают в себя замены, которые по своей природе являются консервативными, т.е. такие замены, которые осуществляются в пределах семейств аминокислот, которые сходны по своим боковым цепям. Конкретно, как правило, аминокислоты разделяют на четыре семейства: (1) кислотные - аспартат и глутамат; (2) основные - лизин, аргинин, гистидин; (3) неполярные - аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) незаряженные полярные - глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируют как ароматические аминокислоты. Например, можно предположить, что отдельное замещение лейцина на изолейцин или валин, аспартата на глутамат, треонина на серин, или сходная консервативная замена аминокислоты на сходную по структуре аминокислоту, не окажет значительного влияния на биологическую активность. Например, интересующий полипептид может включать в себя до приблизительно 5-10 консервативных или неконсервативных аминокислотных замен или даже до приблизительно 15-25 консервативных или неконсервативных аминокислотных замен или любое число между 5 и 25, при условии, что желательная функция молекулы остается интактной. Специалист в данной области может легко определить участки интересующей молекулы, в которых может быть допущено изменение, обратившись к схемам Hopp/Woods и Kyte-Doolittle, хорошо известным в данной области.
Под термином "производное" подразумевают любую подходящую модификацию указанной интересующей молекулы или ее аналога, такую как сульфатация, ацетилирование, гликозилирование, фосфорилирование, конъюгация с полимером (такая как с полиэтиленгликолем) или другими присоединениями неродственных групп, при условии сохранения желательной биологической активности (например, активность в отношении свертывания, ингибирование активности TFPI). Например, могут быть получены производные полисахаридов с одной или несколькими органическими или неорганическими группами. Примеры включают в себя полисахариды, замещенные по меньшей мере по одной гидроксильной группе другой группой (например, сульфатной, карбоксильной, фосфатной группами, аминогруппой, нитрильной группой, гало, силильной, амидной, ацильной, алифатической, ароматической группой или группой сахарида), или где кислород кольца замещен серой, азотом, группой метилена и тому подобное. Полисахариды могут быть химически изменены, например, для улучшения прокоагулянтной функции. Такие модификации могут включать в себя, но не ограничиваются ими, сульфатацию, полисульфатацию, этерификацию и метилирование. Способы получения аналогов и производных, как правило, доступны в данной области.
Под термином "фрагмент" подразумевают молекулу, содержащую только часть интактной полноразмерной последовательности и структуры. Фрагмент полисахарида может быть образован путем деградации (например, гидролиз) более крупного полисахарида. Активные фрагменты полисахарида, как правило, включают в себя по меньшей мере приблизительно 2-20 сахаридных элементов полноразмерного полисахарида, предпочтительно, по меньшей мере приблизительно 5-10 сахаридных элементов полноразмерной молекулы или любое число между 2 сахаридными элементами и полноразмерной молекулой, при условии, что рассматриваемый фрагмент сохраняет биологическую активность, такую как активность в отношении свертываемости и/или способность ингибировать активность TFPI. Фрагмент полипептида может включать в себя C-концевую делецию, N-концевую делецию и/или внутреннюю делецию в нативном полипептиде. Активные фрагменты конкретного белка, как правило, включают в себя по меньшей мере приблизительно 5-10 смежных аминокислотных остатков полноразмерной молекулы, предпочтительно по меньшей мере приблизительно 15-25 смежных аминокислотных остатков полноразмерной молекулы и наиболее предпочтительно по меньшей мере приблизительно 20-50 или более смежных аминокислотных остатков полноразмерной молекулы или любое число между 5 аминокислотами и полноразмерной последовательностью, при условии, что рассматриваемый фрагмент сохраняет биологическую активность, такую как активность в отношении свертывания, как определено в настоящем документе.
Термин "по существу очищенный", как правило, относится к выделению вещества (например, сульфатированного полисахарида), так чтобы в образце, в котором вещество находится, оно содержалось в наибольшем проценте. Как правило, по существу очищенный компонент в образце составляет 50%, предпочтительно 80-85%, более предпочтительно 90-95% образца. Технологии очистки интересующих полисахаридов, полинуклеотидов и полипептидов хорошо известны в данной области и включают в себя, например, ионообменную хроматографию, аффинную хроматографию и седиментацию по плотности.
В случае полисахарида или полипептида под термином "выделенный" подразумевают, что указанная молекула выделена и отделена от целого организма, в котором молекула обнаруживается в природе, или присутствует по существу в отсутствие других биологических макромолекул того же типа.
Термин "гомология" относится к проценту идентичности между двумя полинуклеотидными или двумя полипептидными группами. Последовательности двух нуклеиновых кислот или двух полипептидов являются "по существу гомологичными" друг другу, если последовательности по меньшей мере приблизительно на 50%, предпочтительно по меньшей мере приблизительно на 75%, более предпочтительно по меньшей мере приблизительно на 80-85%, предпочтительно по меньшей мере приблизительно на 90% и наиболее предпочтительно по меньшей мере приблизительно на 95-98% идентичны на протяжении определенной длины молекулы. Как используется в настоящем описании, к по существу гомологичным также относятся последовательности, обладающие полной идентичностью с указанной последовательностью.
Как правило, термин "идентичность" относится к точному нуклеотид-нуклеотидному или аминокислотно-аминокислотному соответствию последовательностей двух полинуклеотидов или полипептидов соответственно. Процентная идентичность может быть определена непосредственным сравнением информации последовательностей двух молекул (контрольная последовательность и последовательность с неизвестной % идентичностью контрольной последовательности) посредством выравнивания последовательностей, подсчета точного количества совпадений между двумя выровненными последовательностями, делением на длину контрольной последовательности и умножением полученного результата на 100. Для облегчения анализа доступны компьютерные программы, такие как ALIGN, Dayhoff, M.O. в Atlas of Protein Sequence and Structure M.O. Dayhoff ed., 5 Suppl. 3:353-358, National biomedical Research Foundation, Washington, DC, которые адаптируют алгоритм локальной гомологии Smith и Waterman Advances in Appl. Math. 2:482-489, 1981 для пептидного анализа. Программы для определения идентичности нуклеотидных последовательностей являются доступными в Wisconsin Sequence Analysis Package, Version 8 (доступна от Genetics Computer Group, Madison, WI) например, программы BESTFIT, FASTA и GAP, которые также основаны на алгоритме Smith и Waterman. Эти программы легко использовать со стандартными параметрами, рекомендованными изготовителем и описанными в Wisconsin Sequence Analysis Package, указанной выше. Например, процентная идентичность конкретной нуклеотидной последовательности контрольной последовательности может быть определена с использованием алгоритма гомологии Smith и Waterman со стандартной оценочной таблицей и штрафом за делецию шесть нуклеотидных позиций.
Другой способ определения процента идентичности в контексте настоящего изобретения представляет собой использование комплекта программ MPSRCH с охраняемым авторским правом University of Edinburgh, разработанного John F. Collins и Shane S. Sturrok, и распространяемого IntelliGenetics, Inc. (Mountain View, CA). Из этого набора комплектов можно использовать алгоритм Smith-Waterman, где стандартные параметры используются для оценочной таблицы (например, штраф за внесение делеции размером 12, штраф на продолжение делеции размером один и делеция шести). Данные, формирующие уровень "совпадения", отражают "идентичность последовательностей". Другие программы, которые можно использовать для вычисления процентной идентичности или сходства между последовательностями, как правило, являются известными в данной области, например, другой программой для выравнивания является BLAST, используемый со стандартными параметрами. Например, мож