Функционально реконструированные вирусные мембраны, содержащие адъювант
Иллюстрации
Показать всеНастоящее изобретение относится к области медицины и касается функционально реконструированных вирусных мембран, содержащих адьювант. Сущность изобретения включает реконструированную вирусную мембрану, липидный бислой которой содержит слитой белок вируса и амфифильный адьювант, в качестве которого используют липопептид. Далее, изобретение относится к способам получения реконструированных вирусных мембран, проявляющих активность слитой мембраны, которые являются липидными двухслойными мембранами, предпочтительно содержащими природные липиды вируса, вирусный слитый белок, необязательно, один или более дополнительных антигенов и амфифильные адъюванты. Изобретение также относится к фармацевтическим композициям, содержащим такие реконструированные вирусные мембраны. Преимущество изобретения заключается в усилении иммунного ответа. 3 н. и 10 з.п. ф-лы, 1 табл., 10 ил.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к вакцинам, направленным против антигенов, таких как мембранные белки патогенов или опухолевых клеток. Далее, изобретение относится к способам получения реконструированных вирусных мембран с активностью слитых мембран, представляющих собой мембраны липидного бислоя, содержащие природные липиды вируса, амфифильные антигены и амфифильные адъюванты, а также к фармацевтическим композициям, содержащим такие реконструированные вирусные мембраны.
Предшествующий уровень техники
Традиционно вакцины против оболочечных вирусов содержат либо убитые, либо живые аттенуированные вирусы, либо препараты на основе их составных частей (например, препараты расщепленного вируса или субъединичные препараты). Для вакцинации эти препараты, как правило, вводят с помощью инъекции. После инъекции вирусы или белки, представленные в этих вакцинах, поглощаются антигенпрезентирующими клетками иммунной системы, такими как дендритные клетки или макрофаги, с последующей презентацией антигенных частей вакцин эффекторным клеткам иммунной системы. Вакцины являются эффективными при инъекции, так как антигенпрезентирующие клетки наиболее многочисленны именно под кожей. Однако в настоящее время установлено, что сходные клетки имеются и в слизистой оболочке, например в слизистой оболочке носа (Ogra et al., 2001). Для индукции фагоцитов, присутствующих в слизистой оболочке, с целью усиления иммунного ответа требуется более сильная стимуляция, чем для фагоцитов, находящихся под кожей (Janeway et al., 2001).
Несмотря на то, что инъекция некоторых вирусов или белков, содержащихся в вакцинах, например, вируса гриппа или вируса кори, вызывает иммунный ответ, который является достаточно сильным для защиты от последующего инфекционного заболевания, вызванного этим же вирусом, во многих других случаях такая защита не возникает, например, в случае респираторно-синцитиального вируса. Предприняты многочисленные попытки усиления иммунного ответа с помощью физических или химических средств. Наиболее важными принципами, извлеченными из таких экспериментов, являются следующие: 1) в отношении физической стимуляции - необходимость сборки множественных копий вирусных белков в частицы, где частицы могут представлять собой целые вирусы, реконструированные вирусные мембраны или белки на носителях из микрочастиц, причем частицы стимулируют иммунную систему лучше, чем отдельные субъединицы (Ogra et al., 2001; Janeway et al., 2001); 2) в отношении химической стимуляции - требование, чтобы фагоциты или эффекторные клетки иммунной системы получали определенные сигналы через рецепторы, представленные на поверхности антигенпрезентирующей клетки, например, с помощью адъювантов - химических соединений, распознаваемых этими рецепторами.
С помощью дополнительной физико-химической стимуляции вирусные белки вызывают сильный иммунный ответ даже при введении в мембраны слизистой оболочки, например носа (Ogra et al., 2001). Большинство современных способов и композиций для стимуляции иммунного ответа, основанных на применении химических или физических средств, или комбинаций этих двух принципов, имеют существенные недостатки, изложенные ниже.
Специалистами разработан особый тип вакцинной композиции, известной как «виросомы», которые представляют собой липидные бислои, содержащие вирусные гликопротеины. Виросомы могут содержать реконструированные вирусные мембраны, обычно получаемые путем экстракции мембранных белков и липидов из оболочечных вирусов с помощью детергента, с последующим добавлением липидов и удалением указанного детергента из экстрагированных вирусных мембранных белков и липидов. В результате формируются характеристические липидные бислои с выступающими из них белками (Stegmann et al., 1987). Виросомы могут также содержать мембраны, сформированные из очищенных вирусных белков и синтетических или природных липидов, или другие вещества, формирующие бислой. Характерной особенностью виросом является имитация в высокой степени состава, поверхностной структуры и функциональной активности нативной вирусной оболочки. В частности, важным свойством указанных виросом является сохранение рецептор-связывающей активности и активности слитых мембран природной вирусной оболочки, что позволяет виросомам входить в те же клетки, что и вирус, и быть представленными этими же клетками иммунной системе. Сохранение рецептор-связывающей активности и активности слитой мембраны необходимо для проявления полноценных иммуногенных свойств этих виросом (Arkema, 2000; Bungener, 2002).
В отношении некоторых вирусных антигенов виросомы вызывают защитные иммунные ответы, которые могут быть сильными даже в случае интраназальной доставки вакцины (как описано в патентах WO 88/08718 и WO 92/19267). Однако другие виросомные композиции проявляют лишь крайне слабое повышение иммуногенности по сравнению с препаратами убитых вирусов или субъединичными препаратами (как описано Glück et al., 1994). В данном цитируемом примере виросомы были получены с помощью протокола на основе добавления экзогенных липидов, причем установлено, что полученный состав виросом и поверхностная структура отличаются от таковых в нативной вирусной оболочке. Специалистам известно, что различная структура поверхности влияет на свойства слитой мембраны генерированных виросом и, следовательно, на их иммуногенность.
Для усиления иммунного ответа допускается интраназальное введение этой вакцины; адъювантный белок из Escherichia coli (лабильный к нагреванию токсин) смешивали с содержащей липиды виросомой противогриппозной вакцины (EP 0538437). Клинические испытания показали, что добавление токсина абсолютно необходимо для индукции титров сывороточных антител, эквивалентных введенной вакцине (Glück et al., 1994). Несмотря на то, что добавление токсина усиливает иммуногенность этой вакцины, оно также индуцирует тяжелый побочный эффект, известный как паралич Белла - временный паралич мимических мышц. Хотя адъювантное действие токсина происходит благодаря узнаванию антигенпрезентирующей клеткой, нет уверенности в том, что в данном случае токсин и вирусный белок будут контактировать в одной и той же клетке, и поэтому для обеспечения активации каждой клетки необходима относительно высокая концентрация токсина, что повышает вероятность узнавания антигенов активированной клеткой. Таким образом, данный тип препарата виросом с добавлением липидов имеет ряд недостатков.
Виросомы также готовят из очищенных гриппозных антигенов, смешанных с производными мурамилдипептида (EP 0205098 и EP 0487909). В этом случае производное мурамилдипептида формирует мембрану. Хотя мурамилдипептид является адъювантом, и состав действительно усиливает иммунный ответ на гриппозные антигены, мурамилдипептиды вызывают повышение температуры (Kotani et al., 1976; Dinarello et al., 1978), быстрое выведение виросом из организма после инъекции и локальную токсичность, вызывающую гранулему и воспаление (Ribi et al., 1979; Kohashi et al., 1980). Кроме того, виросомы имеют ограниченный срок годности при нейтральном pH (Powell et al., 1988); оптимальный pH для поддержания их структурной целостности является слишком низким, чтобы получить состав вакцины вместе со слитым белком вирусов, которые входят в клетку с помощью рецептор-опосредованного эндоцитоза, например, гемагглютинином вируса гриппа. Кроме того, такие синтетические мембраны являются недостаточно хорошими имитаторами природной вирусной мембраны, и, следовательно, вызванный иммунный ответ будет отличаться от такового, генерируемого против вируса.
В качестве альтернативы специалистами получены комплексные антигены, отличающиеся от реконструированных вирусных мембран, такие как «иммуностимуляторные комплексы» (ISCOM, Morein et al., 1984), содержащие вирусные белки в комплексе с адъювантами, такими как сапонины, подобные Quil A®(EP 0231039B1; EP 0109942A1; EP 0180564A1), большинство из которых выделено из коры Quillaia saponaria Molina. Смешанные с антигеном и липидами, такими как холестерин, эти адъюванты формируют клеткоподобные структуры размером 30-40 нм, представляя антигенную частицу, в то же время действуя как адъювант. Хотя ISCOM используются в ряде ветеринарных вакцин и усиливают иммуногенность вирусных мембранных белков, разработка таких вакцин для человека не проводится из-за их токсичности и сложного состава смеси (Cox et al., 1998).
Позже была разработана протеосома вакцин гриппа (США, заявка № 20010053368), содержащая нековалентные комплексы очищенной наружной мембраны белков бактерий, таких как менингококки, смешанные с антигенными белками, например гемагглютинином вируса гриппа или гликопротеином оболочки вируса иммунодефицита человека. Хотя эти многочисленные бактериальные белки могут действовать в качестве адъювантов, сложная природа таких смесей, состоящих из многочисленных белков, будет регулировать их продукцию. Кроме того, иммунный ответ направлен на все белки и другие антигены, представленные в растворе, и менее специфичен в отношении вирусных белков.
Другая композиция, разработанная компанией Biovector Therapeutics, содержит внутренний кор углевода, окруженный липидной оболочкой, содержащей антигены. При использовании гемагглютинина вируса гриппа в качестве антигена замечено некоторое усиление иммунного ответа, но не достаточное для оправдания дальнейшей разработки.
В качестве интраназальных вакцин разработаны живые аттенуированные варианты респираторных вирусов, таких как адаптированный к холоду штамм вируса гриппа с минимальным уровнем репликации в дыхательных путях. Эти вакцины характеризуются явным преимуществом в индукции иммунных ответов, которые аналогичны природному иммунитету, индуцированному заражением вирусом дикого типа. В случае гриппа такие вакцины известны, начиная с 1980-х годов, и в настоящее время завершается их подготовка к серийному выпуску. Задержка вызвана способностью многих вирусов быстро мутировать, что вызывает у аттенуированных вирусов частичную или полную реверсию к вирусу дикого типа, и, в действительности, может вызвать заболевание, которое они должны предотвращать.
В силу вышеупомянутых доводов специалисты признают, что хотя для индукции иммунных ответов на патогены, которые сами по себе не индуцируют сильного иммунного ответа, а также для интраназального и других способов применения на слизистой разработаны такие составы как ISCOM и протеосомы, все еще существует необходимость в глубоком изучении вакцинных композиций, которые индуцируют сильный иммунный ответ, не содержат живых вирусов и имеют низкую токсичность.
Сущность изобретения
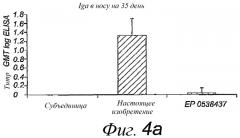
В настоящем изобретении предлагаются новые средства и способы, разрешающие ряд вышеописанных проблем и трудностей. В изобретении предлагается реконструированная вирусная мембрана, содержащая амфифильный адъювант и антиген, где указанные адъювант и антиген взаимодействуют посредством гидрофобных взаимодействий и представлены в сочетании с липидной двухслойной мембраной на основе реконструированных вирусных мембран, где реконструированная вирусная мембрана имеет активность слияния, превосходящую таковую виросом, приготовленных в соответствии с патентом EP 0538437. Далее, реконструированная вирусная мембрана в высокой степени имитирует состав, поверхностную структуру и функциональные свойства вирусной оболочки, из которой получают реконструированную вирусную мембрану. В изобретении предлагается способ получения таких реконструированных вирусных мембран, включающий в себя следующие стадии: i) разрушение вируса в соответствующем детергенте; ii) удаление вирусного генетического материала и коровых белков; iii) контакт одной или более амфифильных молекул, имеющих адъювантную активность, и антигена в растворе, содержащем детергент; и iv) удаление детергента в условиях, обеспечивающих перестройку мембраны.
Кроме того, в изобретении предлагается фармацевтический препарат, содержащий реконструированные вирусные мембраны в соответствии с изобретением, фармацевтически приемлемый носитель и способ применения таких реконструированных вирусных мембран или фармацевтического препарата в соответствии с изобретением для лечения или профилактики заболеваний посредством интраназальной, пероральной или парентеральной доставки.
Описание изобретения
В первом аспекте настоящее изобретение относится к реконструированной вирусной мембране. Реконструированная вирусная мембрана предпочтительно содержит: (a) липидный бислой; (b) слитый белок вируса; (c) амфифильный адъювант; и (d) необязательно, дополнительный антиген. Предпочтительно, в реконструированной вирусной мембране липидный бислой имеет липидный состав, совместимый со слиянием, как индуцированная слитым белком вирусная мембрана клетки-хозяина, природного вирусного хозяина. Предпочтительно, липидный состав совместим со слиянием при оптимальном pH слияния. Предпочтительно, слитый белок, амфифильный адъювант и, необязательно, дополнительный антиген взаимодействуют с гидрофобной внутренней частью липидного бислоя, например, ассоциированы с ним, интегрированы в него и/или включены в бислой вирусной мембраны посредством гидрофобных взаимодействий с липидами бислоя и/или друг с другом. Другое преимущество состоит в том, что слитый белок и амфифильный адъювант нековалентно связаны. Предпочтительно, чтобы амфифильный адъювант и дополнительный антиген также были связаны нековалентной связью. Вирусные мембраны согласно изобретению предпочтительно представляют собой функционально реконструированные вирусные мембраны, содержащие липиды, предпочтительно природные липиды вируса, амфифильный адъювант, вирусный слитый белок и один или несколько антигенов, где амфифильный адъювант, липиды вирусных слитых белков и антигены взаимодействуют сначала посредством гидрофобных взаимодействий, где гидрофобная часть амфифильного адъюванта преимущественно формирует внутреннюю часть липидной двухслойной мембраны, причем бислой включает в себя слитый белок, антиген или антигены и липиды. Функциональная реконструкция означает, что реконструированная мембрана имеет активность слитой мембраны. Предпочтительно, если реконструированная вирусная мембрана находится в виде везикул.
Под слитым белком вируса здесь подразумевают интегральный мембранный белок вируса, обычно оболочечного вируса, который при экспрессии на поверхности соответствующей клетки млекопитающего (или птицы) может индуцировать слияние клетки при соответствующем pH с клетками, которые являются природными хозяевами вируса (см., например, Hernandez et al., 1996). Примерами вирусных слитых белков, предназначенных для включения в реконструированную вирусную мембрану, являются белок E1 вируса леса Семлики, белок гемагглютинина (HA) вируса гриппа, белки gp120/gp41 HIV, F-белки парамиксовирусов. Два типа слияния, индуцированного вирусным слитым белком, могут различаться. Первый тип слияния, индуцированный, например, белками gp120/gp41 HIV, происходит при нейтральном pH на поверхности адресной клетки-хозяина. Второй тип слияния, индуцированный, например, белком гемагглютинина (HA) вируса гриппа, происходит в результате интернализации при более низком pH (5,0-6,5) в эндосомном компартменте клетки-хозяина. Оба типа слияния входят в композицию согласно настоящему изобретению.
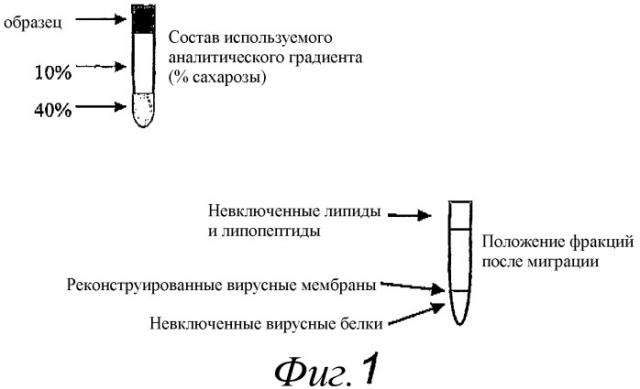
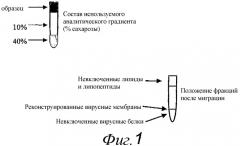
Способность реконструированных вирусных мембран согласно изобретению сливаться с клеткой-хозяином зависит от присутствия соответствующего вирусного слитого белка. Однако эта способность также зависит от липидного состава бислоя реконструированной вирусной мембраны, так как виросомы, содержащие синтетические липиды и вирусные слитые белки, описанные в научной литературе, не способны к слиянию. Поэтому липидный состав реконструированных вирусных мембран предпочтительно выбирать таким образом, чтобы мембраны были способны к слиянию с соответствующими клетками-хозяевами при определенном pH. Способность реконструированных вирусных мембран к слиянию может быть оценена с помощью способа слияния теней эритроцитов, как, например, описано здесь в примере 3. Для реконструированных вирусных мембран, содержащих гемагглютинин вируса гриппа, предпочтительная активность слияния в этом способе индуцирует слияние не менее 30% реконструированных вирусных мембранных везикул с тенями эритроцитов через 1 мин, при смешивании 1 мкМ виросом с 50 мкМ фосфолипидной мембраны теней эритроцитов при pH, оптимальном для гемагглютинина.
Предпочтительной активностью слияния для других реконструированных вирусных мембран, которые не могут быть тестированы с помощью вышеуказанного способа, является слияние с добавлением реконструированных вирусных мембран в клетки, способные заражаться вирусом, из которого получают эти слитые белки. Реконструированные мембраны должны обеспечивать слияние по меньшей мере 10% клеток, которые сливаются с помощью вируса, из которого получены эти слитые белки.
Предпочтительным липидным составом, обеспечивающим реконструированные вирусные мембраны активностью слияния, является липидный состав, содержащий природные липиды вируса. Термин «природные липиды вируса» здесь означает, что эти липиды представлены в мембране вируса, растущего на клетках, предпочтительно клетках млекопитающих, или на оплодотворенных яйцеклетках. Природные липиды вируса предпочтительно получают или выделяют из растущих вирусных частиц, в отличие от синтетических липидов. Однако функционально реконструированные вирусные мембраны согласно изобретению кроме природных липидов могут содержать очищенные липиды из других источников, например синтетические липиды. Таким образом, липидный состав для реконструированных вирусных мембран с активностью слияния предпочтительно является составом, полученным из природных вирусных мембран. К липидным составам, применяемым в настоящем изобретении, относятся составы, содержащие исключительно природные липиды вируса, составы, содержащие природные липиды вируса с добавлением липидов из других источников, а также составы, содержащие липиды из различных источников, которые имитируют липидный состав природной вирусной мембраны.
Применяемые здесь адъюванты содержат любое вещество или соединение, которое при использовании в комбинации с антигеном, для иммунизации человека или животного, стимулирует иммунную систему, тем самым вызывая или усиливая иммунный ответ или облегчая проявление иммунного ответа против антигена, предпочтительно без генерации специфического иммунного ответа к самому адъюванту. Предпочтительно, адъюванты усиливают иммунный ответ против данного антигена по меньшей мере в 1,5; 2; 2,5; 5; 10 или 20 раз по сравнению с иммунным ответом, генерируемым против антигена в тех же условиях, но в отсутствие адъюванта. Разработаны тесты для определения статистического среднего показателя усиления иммунного ответа против данного антигена, продуцируемого адъювантом в группе животных или у человека, по сравнению с соответствующей контрольной группой. Предпочтительно, чтобы адъювант усиливал иммунный ответ против не менее двух различных антигенов. Адъювант согласно изобретению обычно представляет собой соединение, чужеродное для млекопитающих, что, тем самым, исключает иммуностимуляторные соединения, которые являются эндогенными для млекопитающих, такие как интерлейкины, интерфероны и другие гормоны. Адъюванты, включаемые в состав функционально реконструированных вирусных мембран согласно изобретению, преимущественно являются амфифильными адъювантами.
Термин «амфифильный адъювант» относится к любому адъюванту, в том числе к соединениям, подобным липопептидам или гликолипидам, имеющим гидрофобную мембрану, встроенную и ориентированную полярными (головная группа) частями в окружающую среду, которые предпочтительно сами могут ассоциироваться с везикулами липидного бислоя или мицеллами в воде, или, что более предпочтительно, встраиваться в везикулы бислоя или мицеллы в воде. Этот термин также означает любой амфифильный адъювант, стабильно включенный в липидные бислои (содержащие природные липиды вируса) со своей гидрофобной частью, контактирующей с внутренней, гидрофобной областью двухслойной мембраны и частью полярной головной группы, ориентированной на внешнюю, полярную поверхность мембраны. Однако из тематики согласно изобретению не исключаются более гидрофобные адъюванты, имеющие менее выраженную амфифильность, например, у них отсутствуют части полярной головной группы или имеются только части слабой полярной головной группы, ассоциированные с везикулами липидного бислоя или интегрированные в них. Используемые здесь «амфифильные адъюванты» с адъювантной активностью представляют собой природные или (частично) синтетические адъюванты, способные формировать реконструированную вирусную мембрану вместе с одним или несколькими желательными антигенами и природными липидами вируса в водной среде в условиях, обеспечивающих формирование реконструированной вирусной мембраны.
В предпочтительном варианте осуществления изобретения амфифильный адъювант, представленный в реконструированной вирусной мембране, является фармацевтически приемлемым для введения человеку, в отличие от, например, Quil A™ или других сапонинов, которые являются амфифилами с изученной адъювантной активностью. Амфифильные адъюванты согласно изобретению предпочтительно нековалентно связаны с антигенами, но представлены вместе в липидном бислое реконструированной мембраны. Отсутствие ковалентной связи антигена и адъюванта обеспечивает процессинг антигена и презентацию его эпитопов в иммунной системе, которые высокоидентичны таковым природного белка, что обеспечивает хорошее узнавание белка, представленного на природном патогене. С другой стороны, гидрофобное взаимодействие антигена и адъюванта с липидным бислоем (или друг с другом) обеспечивает распределение адъюванта и антигена на реконструированных вирусных мембранах в препарате. Тем самым, большинство мембранных везикул в препарате содержит как антиген, так и адъювант в одной везикуле; более предпочтительно, не менее 60, 70, 80, 90 или 95% везикул содержат как антиген, так и адъювант. Комбинация антигена и адъюванта в отдельной мембране или везикуле позволяет доставлять антиген в антигенпрезентирующую клетку, которая активируется с помощью адъюванта, что вызывает усиление терапевтической и/или профилактической эффективности реконструированных вирусных мембран.
В предпочтительном варианте осуществления изобретения указанный амфифильный адъювант узнается Toll-подобным рецептором (TLR), представленным на антигенпрезентирующих клетках. Специалистам известны различные соединения, узнаваемые TLR, в том числе липопептиды, липополисахариды, пептидогликаны, лиоптехоевые кислоты, липопротеины (выделенные из микоплазм, микобактерий или спирохет), двунитевая РНК (поли I:C), неметилированная ДНК, липоарабиноманнан, флагеллин, CpG-содержащая ДНК и имидазохинолины. Не все TLR-узнаваемые соединения могут быть использованы как адъюванты, например, из-за токсичности липополисахаридов грамотрицательных бактерий дикого типа, которая является слишком высокой для их применения в качестве адъювантов, или из-за отсутствия фармацевтической приемлемости при использовании для человека. В качестве адъювантов могут быть использованы другие TLR-узнающие соединения. Эти TLR-узнающие адъюванты могут быть амфифильными адъювантами сами по себе или, в качестве альтернативы, могут быть модифицированы в амфифильный адъювант, например, путем сопряжения гидрофобных соединений (см. ниже) с полярным лигандом TLR. Альтернативно, амфифильные адъюванты могут быть мишенями других рецепторов. Предпочтительным амфифильным адъювантом является липопептид, который может быть получен синтетически или полусинтетически. Предпочтительно, липопептид, используемый в качестве амфифильного адъюванта, имеет адъювантную активность и является фармацевтически приемлемым при использовании для человека. Липопептид согласно изобретению представляет собой молекулу, обычно содержащую один или несколько (олиго)пептидов, ковалентно связанных с одним или более гидрофобных соединений, выбранных из группы, содержащей жирные кислоты, липиды, церамиды, плазмалогены, алкильные или алкеновые цепи или стерины. В общем, липопептиды, используемые в настоящем изобретении, предпочтительно состоят из 3, 4, 5, 6, 7 или 8 аминокислот, предпочтительно пептидов, содержащих 40-70% положительно заряженных аминокислот, из которых лизин и аргинин являются предпочтительными; и, предпочтительно, пептиды содержат один или более серинов и/или цистеинов. Особенно предпочтительные липопептиды представлены в таблице 1.
В другом варианте осуществления изобретения указанный амфифильный адъювант является гликолипидом. Предпочтительный гликолипид для применения в качестве амфифильного адъюванта имеет адъювантную активность и фармацевтически приемлем при использовании для человека. Гликолипиды представляют собой липиды (или другие гидрофобные соединения), ковалентно связанные с одним или несколькими сахарами. В наиболее предпочтительном варианте осуществления изобретения предлагаются реконструированные вирусные мембраны, в которых гликолипидом является α-галактозилцерамид или фосфатидилинозитманнозид. Термины «α-галактозилцерамид» и «фосфатидилинозитманнозид» означают любое производное этих соединений. Производные этих молекул, имеющие адъювантную активность и применяемые в контексте настоящего изобретения, описаны в патентах США №№ 5936076 и 4542212 соответственно. Другими подходящими гликолипидными адъювантами, применяемыми в настоящем изобретении, являются модифицированные формы эндотоксических липополисахаридов (LPS) грамотрицательных бактерий, проявляющие пониженную токсичность части липида A LPS, но сохраняющие (частично) адъювантную активность. Модифицированные LPS получают из генетически модифицированных грамотрицательных патогенов, как описано в патенте WO 02/09746.
Модифицированные LPS, используемые в настоящем изобретении в качестве амфифильного адъюванта, имеют модифицированную часть липида A со сниженной токсичностью. Токсичность модифицированного LPS предпочтительно меньше токсичности соответствующего LPS дикого типа, более предпочтительно, токсичность модифицированного LPS на 90, 80, 60, 40, 20, 10, 5, 2, 1, 0,5 и 0,2% меньше токсичности LPS дикого типа. Токсичность LPS дикого типа и различных модифицированных форм со сниженной токсичностью определяют с помощью любого общеизвестного способа. Предпочтительным способом определения токсичности, например биологической активности модифицированных LPS, является тест WEHI, основанный на индукции TNF-α в клеточной линии MM6 макрофагов (Espevik and Niessen, 1986, J.Immunol.Methods 95: 99-105; Zeigler-Heitbrock et al., 1988, Int.J.Cancer 41: 456-461). С другой стороны, модифицированный LPS со сниженной токсичностью проявляет значительную иммуностимулирующую активность, например адъювантную активность. Модифицированный LPS со сниженной токсичностью обладает не менее 10, 20, 40 ,80, 90 или 100% иммуностимулирующей активности по сравнению с соответствующим LPS дикого типа. Иммуностимулирующая активность может быть определена in vivo на лабораторных животных, как описано выше или в примерах, или in vitro, например, по определению созревания дендритных клеток, стимулированных путем инкубации с LPS, которые тестируют посредством измерения продукции не менее одного цитокина (например, одного из IL-12, IL-10, TNF-α, IL-6 и IL-1-β) в LPS-стимулированных дендритных клетках, или путем измерения экспрессии не менее одной костимуляторной молекулы (например, CD40 или CD86) на LPS-стимулированных дендритных клетках.
В другом аспекте настоящего изобретения амфифильный адъювант, представленный в виросоме согласно изобретению, является пептидом, предпочтительно амфифильным пептидом. Предпочтительно, пептид, применяемый в качестве амфифильного адъюванта, имеет адъювантную активность и является фармацевтически приемлемым для человека. Пептиды, в частности полярные пептиды, с адъювантной активностью могут быть превращены в амфифильные адъюванты путем (ковалентного) связывания их с соответствующим гидрофобным соединением (см. выше). В качестве альтернативы амфифильные пептиды могут включать в себя гидрофобное растяжение аминокислот, такое как трансмембранная последовательность, как описано ниже. Предпочтительный пептид содержит последовательность из Notch-лиганда Jagged-1 (Weijzen et al., 2002; Genbank инвентарный № AAC 52020) или последовательность белка A Staphylococcus aureus. Пептиды, имеющие последовательности Jagged-1 или белка A, предпочтительно ковалентно связаны с соответствующим гидрофобным соединением (см. выше) и/или содержат трансмембранную последовательность (см. ниже). Полярная часть пептидов, происходящих от Jagged-1 или белка A, которая выступает из липидного бислоя, содержит не более 3, 4, 5, 6, 7 или 8 аминокислот.
Реконструированные вирусные мембраны согласно изобретению пригодны как для парентерального, так и для мукозального (например, интраназального или перорального) введения. Важным аспектом настоящего изобретения является то, что реконструированные вирусные мембраны могут применяться для интраназальной доставки антигенов, которые в норме не обеспечивают достаточный иммунный ответ при интраназальной доставке субъекту для защиты от последующего инфицирования патогенным организмом, содержащим антиген.
Реконструированные вирусные мембраны согласно изобретению содержат слитый вирусный белок и, необязательно, дополнительный антиген. Следует учитывать, что реконструированные вирусные мембраны, содержащие только вирусный слитый белок и не содержащие дополнительный антиген, также являются частью изобретения. В таких реконструированных вирусных мембранах вирусный слитый белок функционирует как антиген в добавление к своей функции слитого белка. С другой стороны, реконструированные вирусные мембраны могут также содержать один или более дополнительных антигенов в добавление к вирусному слитому белку.
В соответствии с изобретением антигены, которые являются частью реконструированной вирусной мембраны, имеют гидрофобную часть, которая способна встраиваться в мембрану липидного бислоя реконструированной вирусной мембранной везикулы. Многие патогены, такие как вирусы, бактерии, дрожжи и паразиты, несут в своем капсиде, клеточной стенке или мембране белки, которые вызывают иммунный ответ у хозяина. Примерами антигенов, имеющих гидрофобные элементы, такие как трансмембранные сегменты, и пригодных в качестве составной части реконструированной вирусной мембраны, в соответствии с изобретением являются белки, представленные в мембране (в случае вирусов также называемые оболочкой) патогена. Предпочтительно, антигеном, представленным в реконструированных вирусных мембранах согласно изобретению, является интегральный мембранный белок. Антигенные белки в реконструированных вирусных мембранах настоящего изобретения ориентированы таким же образом, как и на вирусной или клеточной мембране; они могут представлять эпитопы, которые в норме частично или временно спрятаны, когда присутствуют в мембранном липидном бислое. Стимуляция иммунной системы этими антигенпрезентирующими реконструированными вирусными мембранами может происходить вследствие комбинации этих специфических узнаваний клетками иммунной системы, их определенными свойствами, презентацией белка и раскрытием спрятанных эпитопов. Предпочтительно, антигенные белки, используемые в реконструированных вирусных мембранах согласно изобретению, содержат один или более защитных эпитопов, например эпитопов, способных вызвать иммунный ответ у млекопитающих, где эпитопы обеспечивают защиту от инфекции, вызванной патогеном, от которого происходит антиген, или который обеспечивает защиту от опухолевой экспрессии антигена.
В предпочтительном варианте осуществления изобретения указанные антигены получают из вируса, паразита, гриба или бактерии. Особенно предпочтительны реконструированные вирусные мембраны, в которых указанный антиген получают из вируса гриппа. Предпочтительными белками вируса гриппа, которые могут быть использованы в реконструированных вирусных мембранах настоящего изобретения, являются белок гемагглютинина (HA), белок нейраминидазы (NA) и/или белок M2, отдельно или в комбинации.
Антигены, применяемые для формирования реконструированных вирусных мембран, могут быть получены из всех видов вирусов, не ограничивающими примерами таких вирусов являются: Retroviridae, например, вирус иммунодефицита человека (HIV); рубеллавирус; Paramyxoviridae, например, вирусы парагриппа, кори, эпидемического паротита, респираторно-синцитиальный вирус, метапневмовирус человека; Flaviviridae, например, вирус желтой лихорадки, вирус денге, вирус гепатита C (HCV), вирус японского энцефалита (JEV), вирус клещевого энцефалита, вирус энцефалита Сент-Луис или вирус Западного Нила; Herpesviridae, например, вирус простого герпеса, цитомегаловирус, вирус Эпштейна-Барр; Bunyaviridae; Arenaviridae; Hantaviridae, например, вирус Хантаан; Coronaviridae, например, коронавирус человека; Papovaviridae, например, папилломавирус человека; Rhabdoviridae, например, вирус бешенства; Alphaviridae; Arteriviridae; Filoviridae, например, вирус Эбола; Poxviridae, например, вирус натуральной оспы и вирус африканской лихорадки свиней. Эти антигены также могут быть получены из патогенных бактерий, грибов, (включая дрожжи) или паразитов. К этим антигенам относятся бактериальные антигены, такие как антигены Helicobacter, например, H. pylori; Neisseria, например, N. mengitidis; Haemophilus, например, H. influenza; Bordetella, например, B. pertussis; Chlamydia; Streptococcus, например, Streptococcus sp.серотипа A; Vibrio, например, V. cholera; грамотрицательные кишечные патогены, такие как Salmonella, Shigella, Campylobacter и Escherichia, а также антигены бактерий, вызывающих сибирскую язву, проказу, туберкулез, дифтерию, болезнь Лайма, сифилис, брюшной тиф и гонорею. Антигены паразитов включают в себя антигены простейших, таких как Babeosis bovis, Plasmodium, Leishmania spp., Toxoplasmagondii, Trypanosoma, например, T. cruzi. Грибковые антигены могут включать в себя антигены грибов, таких как Aspergillus sp., Candida albicans, Cryptococcus, например, C. neoformans и Histoplasma capsulatum.
Хотя вакцинация, в общем, применяется для профилактической защиты от патогенов или для лечения заболеваний, вызванных патогенной инфекцией, специалисты используют вакцины для терапии опухолей. Кроме того, увеличивается число опухолеспецифических белков, которые могут быть адресованы посредством гуманизированных антител или через человека. Такие опухолеспецифические белки также являются предметом настоящего изобретения. Специалистам известно большое число опухолеспецифических антигенов. В предпочтительном варианте осуществления изобретения предлагаются реконструированные вирусные мембраны, содержащие опухолеспецифический антиген. Подходящие опухолеспецифические антигены включают онкофетальный антиген, простата-специфичный мембранный антиген, простата-специфичный антиген, белок MZ2E, полиморфный эпителиальный муцин (PEM), фолат-связывающий белок LK26, укороченный рецептор фактора роста эпидермиса (EGRF), антиген Томсена-Фриденрайха (T), ганглиозиды GM-2 и GD-2, Ep-CAM, муцин-1, эпителиальный гликопротеин-2 и специфичный для толстой кишки антиген.
Предпочтительными антигенами этих патогенов являются интегральные мембранные белки. Однако немембранные белковые антигены или их части, содержащие защитные эпитопы, также могут быть модифицированы для применения в настоящем изобретении путем слияния их с трансмембранной последовательностью. Трансмембранные последовательности или заякоренные на мембране последовательности, хорошо известные специалистам, основаны на генетической геометрии трансмембранных молекул млекопитающих. Трансмембранная последовательность, как правило, имеет протяженность 10-30, в среднем 20 аминокислот, большинство из которых имеет гидрофобные боковые цепи. Трансмембранные последовательности известны для большого числа разновидностей белков, и любые из них могут быть использованы. Примерами заякоренных на мембране последовательностей,