(1r*2s*4r*)-4-(4-аминофенил)-циклогексан-1,2-дикарбоновая кислота
Иллюстрации
Показать всеИзобретение относится к области органической химии. Предлагается новое соединение, а именно (1R*2S*4R*)-4-(4-аминофенил)-циклогексан-1,2-дикарбоновая кислота формулы I, которая может быть использована в химической промышленности для получения полиимидов. Такие полиимиды находят применение в производстве жидких кристаллов, оптически нелинейных буферных слоев, материалов с низкой диэлектрической проницаемостью. 3 табл.
Реферат
Изобретение относится к области получения новых полуароматических аминодикарбоновых кислот, которые могут быть использованы в химической промышленности для получения гомополиконденсацией, а также сополиконденсацией неописанных ранее полиимидов. Такие полиимиды находят применение в производстве жидких кристаллов, оптически нелинейных буферных слоев, материалов с низкой диэлектрической проницаемостью.
Известны полиимиды на основе диангидридов цис- и транс-1,2,3,4-циклогексантетракарбоновой кислоты и ароматических диаминов.
Все полученные полиимиды термически устойчивы при температуре более 415°С (5% потеря веса). Полиимидные пленки имеют модуль растяжения 2,1-3,6 гПа, прочность на разрыв 42-116 мПа, полностью бесцветны, транс-полиимиды имеют более низкие температуры стеклования (Frang X. et al. Polymer. 2004. Vol.45. P.2539-2549).
Необходимым условием образования высокомолекулярных полимеров при линейной полимеризации является эквивалентность реагирующих между собой исходных соединений.
Задачей, решаемой настоящим изобретением, является получение (1R*2S*4R*)-4-(4-аминофенил)-циклогексан-1,2-дикарбоновой кислоты как мономера для получения полуароматических полиимидов, содержащей в своей структуре различные функциональные группы, способные взаимодействовать друг с другом. Цвиттер-ионная структура мономера позволяет проводить высокотемпературную поликонденсацию без выделения промежуточных преполимеров, что существенно упрощает технологическую схему производства полиимидов.
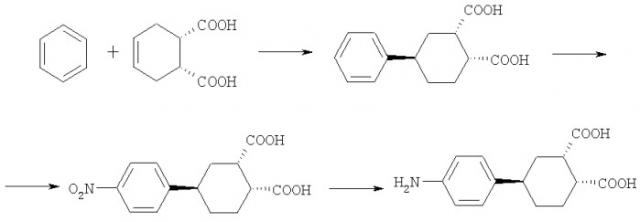
Заявляется (1R*2S*4R*)-4-(4-аминофенил)-циклогексан-1,2-дикарбоновая кислота формулы:
Данное соединение получают реакцией алкилирования бензола (1R*2S*)-4-циклогексен-1,2-дикарбоновой кислотой, нитрованием полученной (1R*2S*4R*)-4-фенилциклогексан-1,2-дикарбоновой кислоты или смеси (1R*2S*4R*) и (1R*2S*4S*)-4-фенилциклогексан-1,2-дикарбоновых кислот, получающейся после алкилирования, азотной кислотой с последующим восстановлением образующейся (1R*2S*4R)-4-(4-нитрофенил)-циклогексан-1,2-дикарбоновой кислоты по схеме:
Алкилирование бензола (1R*2S*)-4-циклогексен-1,2-дикарбоновой кислотой проводят в присутствии безводного хлористого алюминия при 45-75°С. Нитрование (1R*2S*4R*)-4-фенилциклогексан-1,2-дикарбоновой кислоты или смеси (1R*2S*4R*) и (1R*2S*4S*)-4-фенилциклогексан-1,2-дикарбоновых кислот, получающейся после алкилирования, проводится 100%-ной азотной кислотой в ледяной уксусной кислоте при температуре 70°С. Восстановление (1R*2S*4R*)-4-(4-нитрофенил)-циклогексан-1,2-дикарбоновой кислоты проводят гидразином на катализаторе Ni-Ренея.
Изобретение иллюстрируется следующими примерами.
Пример 1. К 50 г (0,64 моль) осушенного бензола прибавляют при комнатной температуре 17 г (0,1 моль) (1R*2S*)-4-циклогексен-1,2-дикарбоновой кислоты и 33,5 г (0,25 моль) безводного хлористого алюминия и нагревают в течение трех часов при 45°С при постоянном перемешивании. Затем к реакционной массе при охлаждении прибавляют 50 мл соляной кислоты (1,098 г/см3) и отгоняют бензол с водяным паром. Выпавшую кислоту фильтруют и промывают несколько раз холодной водой. Высушенный осадок представляет собой смесь (1R*2S*4R*) и (1R*2S*4S*)-4-фенилциклогексан-1,2-дикарбоновых кислот, которая без дополнительной очистки может быть использована для получения (1R*2S*4R*)-4-(4-нитрофенил)-циклогексан-1,2-дикарбоновой кислоты. Для получения чистой (1R*2S*4R*)-4-фенилциклогексан-1,2-дикарбоновой кислоты смесь кристаллизуют из 70% водной уксусной кислоты. Выпавший осадок фильтруют, несколько раз промывают небольшими количествами 70% уксусной кислоты и сушат при температуре 70-80°С. Получают 16,3 г (0,066 моль) (1R*2S*4R*)-4-фенилциклогексан-1,2-дикарбоновой кислоты. Выход 66%.
Температура плавления 173-176°С.
1Н ЯМР ([2Н6] ДМСО) δ, J (Гц): 1,4 (1Н, m); 1,7 (2Н, m); 2,0 (2Н, m); 2,2 (1Н, m); 2,6 (1Н, m); 3,1 (1Н, m); 3,4 (1Н, m); 7,2 (2Н, t, J=8); 7,3 (3H, d, J=8); 12,1 (2Н, s).
ИК, см-1: 2648, 2575 (ОН), 1710, 1698 (С=O), 1598, 1493, 1450 (Ar), 1255 (C-O), 937 (ОН), 743 (Ar).
Примеры 2-4. Алкилирование бензола (1R*2S*)-4-циклогексен-1,2-дикарбоновой кислотой осуществляют аналогично примеру 1. Условия и результаты реакций приведены в таблице 1.
Пример 5. К 38 мл ледяной уксусной кислоты прибавляют 12 мл азотной кислоты (d=1,513 г/см3) и перемешивают в течение одной минуты, при этом смесь разогревается до 40°С. Вносят 2,5 г (0,01 моль) (1R*2S*4R*)-4-фенилциклогексан-1,2-дикарбоновой кислоты, нагревают до 70°С и перемешивают в течение шести часов. Затем реакционную массу охлаждают. Выпавший осадок фильтруют и промывают на фильтре 10 мл ледяной уксусной кислоты и 100 мл воды. Полученный осадок растворяют в 200 мл 1% водного раствора гидроксида калия, нагревают до 50°С и фильтруют от нерастворившегося осадка. Фильтрат нагревают до 90°С и добавляют 5 мл соляной кислоты (1,198 г/см3). Выпавший осадок фильтруют горячим (80-90°С), промывают горячей водой и сушат при 50-60°С.
Получают 1,96 г (0,0067 моль) (1R*2S*4R*)-4-(4-нитрофенил)-циклогексан-1,2-дикарбоновой кислоты. Выход 67%.
Температура плавления 203-205°С.
1Н ЯМР ([2Н6] ДМСО) δ, J (Гц): 1,52 (1Н; qd; J1=12,8 Hz; J2=3,66), 1,83-2,04 (4Н; m), 2,17 (1Н; d; J=13,4), 2,54 (1Н; m), 2,67 (1Н; t; J=12,2), 3,21 (1Н; s), 7,52 (2Н; d; J=8,54), 8,17 (2Н; d; J=8,54), 12,8 (2H; br s).
ИК, см-1: 2666 (ОН), 1696 (С=0), 1595 (Ar), 1516 (NO2), 1345 (NO2), 1260 (C-O), 939 (OH).
Примеры 6-13. Нитрование (1R*2S*4R)-4-фенилциклогексан-1,2-дикарбоновой кислоты осуществляют аналогично примеру 5. Условия и результаты реакций приведены в таблице 2.
Пример 14. К 39 мл ледяной уксусной кислоты прибавляют 11 мл азотной кислоты (d=1,513 г/см3) и перемешивают в течение одной минуты, при этом смесь разогревается до 40°С. Вносят 5 г (0,02 моль) смеси (1R*2S*4R*) и (1R*2S*4S*)-4-фенилциклогексан-1,2-дикарбоновых кислот, получающейся после алкилирования, нагревают до 70°С и перемешивают в течение пяти часов. Затем реакционную массу охлаждают. Выпавший осадок фильтруют и промывают на фильтре 10 мл ледяной уксусной кислоты и 100 мл воды. Полученный осадок растворяют в 150 мл 1% водного раствора гидроксида калия, нагревают до 50°С и фильтруют от нерастворившегося осадка. Фильтрат нагревают до 90°С и добавляют 4 мл соляной кислоты (1,198 г/см3). Выпавший осадок фильтруют горячим (80-90°С), промывают горячей водой и сушат при 50-60°С. Получают 1,11 г (0,0038 моль) (1R*2S*4R*)-4-(4-нитрофенил)-циклогексан-1,2-дикарбоновой кислоты. Выход 38%.
Примеры 15-19. Нитрование смеси (1R*2S*4S*) и (1R*2S*4R*)-4-фенилциклогексан-1,2-дикарбоновых кислот осуществляют аналогично примеру 14. Условия и результаты реакций приведены в таблице 3.
Пример 20. В 100 мл воды растворяют 4,78 г (0,085 моль) гидроксида калия и 10 г (0,034 моль) (1R*2S*4R*)-4-(4-нитрофенил)-циклогексан-1,2-дикарбоновой кислоты и фильтруют от не растворившегося осадка. Фильтрат переносят в колбу и нагревают до 60°С. Реакцию проводят в течение трех часов, периодически добавляя по 0,5 г катализатора Ni-Ренея и 2 мл 70%-ного раствора гидразингидрата. Затем смесь охлаждают и фильтруют от катализатора. Полученный раствор подкисляют 5% раствором HCl до тех пор, пока выпавший продукт не начнет растворяться. Выпавший осадок быстро фильтруют и сушат на воздухе в течение суток. Полученный продукт растворяют в минимальном количестве соляной кислоты (d=1,018 г/см3) и фильтруют от не растворившегося осадка. Фильтрат подщелачивают 10%-ным раствором ацетата натрия до нейтрализации всей соляной кислоты. Осадок сушат при температуре 50°С. Получают 7,78 г (0,03 моль) (1R*2S*4R*)-4-(4-аминофенил)-циклогексан-1,2-дикарбоновой кислоты. Выход 87%.
Температура плавления >300°С.
1Н ЯМР ([2Н6] ДМСО) δ, J (Гц): 1,37 (1Н, qd, J1=12,8; J2=4,27), 1,69 (1Н, td, J1=13,4; J2=5,49), 1,77 (1H, d, J=12,8), 1,83-1,98 (2H, m), 2,09 (1H, d, J=12,8), 2,29 (1H, d, J=12,2), 2,38-2,45 (1H, m), 3,14 (1H, s), 6,49 (2H, d, J=7,23), 6,84 (2H, d, J=7,93).
ИК, см-1: 3378, 3303 (NH2), 2622 (OH), 1717 (C=O), 1626 (NH2), 1513 (Ar), 1191 (C-O), 933 (OH), 821 (Ar).
| Таблица 1 | ||||
| Получение (1R*2S*4R*)-4-фенилциклогексан-1,2-дикарбоновой кислоты | ||||
| № опыта | Концентрация (1R*2S*)-4-циклогексен-1,2-дикарбоновой кислоты, моль/л | Время реакции, с | Температура реакции, °С | Выход, моль % |
| 2 | 2,0 | 7200 | 55 | 60 |
| 3 | 2,0 | 1800 | 65 | 54 |
| 4 | 2,0 | 900 | 75 | 43 |
| Таблица 2 | ||||
| Получение (1R*2S*4R*)-4-(4-нитрофенил)-циклогексан-1,2-дикарбоновой кислоты из (1R*2S*4R*)-4-фенилциклогексан-1,2-дикарбоновой кислоты | ||||
| № опыта | Концентрация (1R*2S*4R*)-4-фенилциклогексан-1,2-дикарбоновой кислоты, моль/л | Концентрация азотной кислоты, моль/л | Время реакции, с | Выход, моль % |
| 6 | 0,2 | 6,2 | 21600 | 70 |
| 7 | 0,2 | 6,7 | 21600 | 67 |
| 8 | 0,15 | 5,3 | 21600 | 68 |
| 9 | 0,15 | 5,8 | 18000 | 64 |
| 10 | 0,15 | 6,2 | 18000 | 62 |
| 11 | 0,1 | 4,8 | 18000 | 64 |
| 12 | 0,1 | 5,3 | 14400 | 63 |
| 13 | 0,1 | 5,8 | 14000 | 61 |
| Таблица 3 | ||||
| Получение (1R*2S*4R*)-4-(4-нитрофенил)-циклогексан-1,2-дикарбоновой кислоты из смеси (1R*2S*4R*) и (1R*2S*4S*)-4-фенилциклогексан-1,2-дикарбоновых кислот, получающейся после алкилирования | ||||
| № опыта | Концентрация 4-фенилциклогексан-1,2-дикарбоновой кислоты, моль/л | Концентрация азотной кислоты, моль/л | Время реакции, с | Выход, моль % |
| 15 | 0,8 | 4,8 | 10800 | 28 |
| 16 | 0,4 | 4,8 | 10800 | 33 |
| 17 | 0,4 | 5,3 | 10800 | 41 |
| 18 | 0,4 | 5,8 | 10800 | 43 |
| 19 | 0,2 | 5,8 | 21600 | 47 |
(1R*2S*4R)-4-(4-аминофенил)-циклогексан-1,2-дикарбоновая кислота формулы