Ингибиторы киназы
Иллюстрации
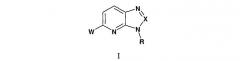
Показать всеИзобретение относится к новым соединениям формулы I:
где W представляет собой
, , , ,
, или ;
Х представляет собой N или C-R1; R представляет собой С1-С7алкил, С3-С7циклоалкил, (С1-С7алкилен)-(С3-С7циклоалкил), -SO2-(C1-C7алкин) или -SO2-NR5R6; R1 представляет собой водород, амино, метил или -N=CH(NMe)2; R2 представляет собой фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из галогена; R3 представляет собой водород, С1-С7алкил, С3-С7циклоалкил или фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из галогена и трифторметила; R4 представляет собой водород или С1-С7алкил; R5 и R6 независимо выбраны из группы, состоящей из С1-С7алкила; или к его фармацевтически приемлемым солям. Изобретение также относится к фармацевтической композиции, а также к применению. Технический результат - получение новых биологически активных соединений, обладающих ингибирующим действием в отношении киназы р-38. 4 н. и 6 з.п. ф-лы.
Реферат
Уровень техники
Киназа р-38 является митогенактивированной протеинкиназой (МАР-киназой), которая принадлежит к суперсемейству серин/треонинкиназ. Эта киназа активируется внеклеточными стрессами, такими как нагрев, УФ-свет, и осмотическим стрессом, а также воспалительными стимулами, такими как липополисахарид. При активации киназа р-38 фосфорилирует внутриклеточные белковые субстраты, которые регулируют биосинтез провоспалительных цитокинов, фактора α некроза опухоли (TNF-α) и интерлейкина-1β (IL-1β). Эти цитокины принимают участие в патологии ряда хронических воспалительных нарушений (Lee et al., Ann. N.Y. Acad. Sci., 696, 149-170 (1993); Muller-Ladner, Curr. Opin. Rheumatol., 8, 210-220 (1996)), сердечно-сосудистых нарушений и нарушений центральной нервной системы (Salituro et al., Current Medicinal Chemistry, 6, 807-823 (1999)) и аутоиммунных нарушений (Pargellis et al., Nature Structural Biology, 9(4), 268-272 (2002)).
Ряд соединений со структурными формулами пиридинилимидазола (WO 9621452, WO 9725045, US 5656644, US 5686455, US 5717100, WO 9712876, WO 9821957, WO 9847892, WO 99903837, WO 9901449, WO 0061576, WO 0172737) и пиримидинилимидазола (WO 9725048, WO 9901452, WO 9725046, WO 9932121, WO 9901131, WO 9901130, WO 9901136, WO 9807452, WO 9747618, WO 9856788, WO 9857996) были идентифицированы как ингибиторы киназы р-38 или как ингибиторы цитокинов. Известно, что селективные ингибиторы киназы р-38 подавляют экспрессию TNF-α и IL-1β (McKenna et al., J. Med. Chem., 45 (11), 2173-2184 (2002)). Описана противовоспалительная активность для соединений со структурной формулой пиримидинилимидазола (Lantos et al., J. Med. Chem., 27, 72-75 (1984)), и ряд ингибиторов киназы р-38 находится в процессе активного исследования для лечения различных нарушений (Boehm and Adams, Exp. Opin. Ther. Patents, 10(1), 25-37 (2000)). По-прежнему сохраняется потребность в соединениях для лечения в этой области, которые являются цитокинсупрессивными лекарственными средствами, т.е. соединениями, которые способны ингибировать киназу р-38.
Настоящее изобретение предлагает новые ингибиторы киназы р-38, пригодные для лечения состояний, являющихся результатом избыточного продуцирования цитокинов.
Краткое содержание сущности изобретения
Настоящее изобретение предлагает соединения формулы I:
где
W представляет собой
Х представляет собой N или C-R1;
R представляет собой С1-С7алкил, С3-С7циклоалкил, (С1-С7алкилен)-(С3-С7циклоалкил), -SO2-(С1-С7алкил) или -SO2-NR5R6;
R1 представляет собой водород, амино, метил или -N=CH(NMe)2;
R2 представляет собой фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из галогена;
R3 представляет собой водород, С1-С7алкил, С3-С7циклоалкил или фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из галогена и трифторметила;
R4 представляет собой водород или С1-С7алкил,
R5 и R6 независимо выбраны из группы, состоящей из С1-С7алкила; или их фармацевтически приемлемых солей.
Настоящее изобретение предлагает способ ингибирования киназы р-38 у млекопитающего, включающий в себя введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли.
Настоящее изобретение предлагает также способ подавления продуцирования фактора α некроза опухоли (TNF-α) у млекопитающего, включающий в себя введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли.
Настоящее изобретение предлагает также способ подавления продуцирования интерлейкина-1β (IL-1β) у млекопитающего, включающий в себя введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли.
Настоящее изобретение предлагает также способ лечения состояний, являющихся результатом избыточного продуцирования цитокинов у млекопитающего, включающий в себя введение млекопитающему, нуждающемуся в таком лечении, подавляющее цитокины количество соединения формулы I или его фармацевтически приемлемой соли.
Настоящее изобретение предлагает также способ лечения восприимчивой опухоли у млекопитающего, включающий в себя введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли.
Настоящее изобретение предлагает также способ ингибирования метастаза у млекопитающего, включающий в себя введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли.
Настоящее изобретение предлагает также способ лечения ревматоидного артрита у млекопитающего, включающий в себя введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли.
Настоящее изобретение предлагает также фармацевтический препарат, включающий в себя соединение формулы I или его фармацевтически приемлемую соль в комбинации с фармацевтически приемлемым носителем, разбавителем или эксципиентом.
Настоящее изобретение предлагает также применение соединения формулы I или его фармацевтически приемлемой соли для изготовления лекарственного средства для ингибирования киназы р-38. Кроме того, настоящее изобретение предлагает соединение формулы I или его фармацевтически приемлемую соль для применения при ингибировании киназы р-38 у млекопитающих. Кроме того, данное изобретение предлагает фармацевтическую композицию, адаптированную для ингибирования киназы р-38, включающую в себя соединение формулы I или его фармацевтически приемлемую соль в комбинации с одним или несколькими его фармацевтически приемлемыми эксципиентами, носителями или разбавителями. Изобретение предлагает также применение соединения формулы I для изготовления лекарственного средства для лечения заболевания или состояния, способного улучшаться или предотвращаться ингибированием киназы р-38.
Настоящее изобретение предлагает также применение соединения формулы I или его фармацевтически приемлемой соли для изготовления лекарственного средства для подавления продуцирования фактора α некроза опухоли (TNF-α). Кроме того, данное изобретение предлагает соединение формулы I или его фармацевтически приемлемую соль для применения при подавлении продуцирования фактора α некроза опухоли (TNF-α) у млекопитающих. Кроме того, данное изобретение предлагает также фармацевтическую композицию, адаптированную для подавления продуцирования фактора α некроза опухоли (TNF-α), включающую в себя соединение формулы I или его фармацевтически приемлемую соль в комбинации с одним или несколькими фармацевтически приемлемыми эксципиентами, носителями или разбавителями. Изобретение предлагает также применение соединения формулы I для изготовления лекарственного средства, для лечения заболевания или состояния, способного улучшаться или предотвращаться подавлением продуцирования фактора α некроза опухоли (TNF-α).
Данное изобретение предлагает также применение соединения формулы I или его фармацевтически приемлемой соли для изготовления лекарственного средства для подавления продуцирования интерлейкина-1β (IL-1β). Кроме того, данное изобретение предлагает соединение формулы I или его фармацевтически приемлемую соль для применения при подавлении продуцирования интерлейкина-1β (IL-1β) у млекопитающих. Кроме того, данное изобретение предлагает фармацевтическую композицию, адаптированную для подавления продуцирования интерлейкина-1β (IL-1β), включающую в себя соединение формулы I или его фармацевтически приемлемую соль в комбинации с одним или несколькими фармацевтически приемлемыми эксципиентами, носителями или разбавителями. Изобретение предлагает также применение соединения формулы I для изготовления лекарственного средства для лечения заболевания или состояния, способного улучшаться или предотвращаться подавлением продуцирования интерлейкина-1β (IL-1β).
Настоящее изобретение предлагает также применение соединения формулы I или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения состояний, являющихся результатом избыточного продуцирования цитокинов. Кроме того, данное изобретение предлагает соединение формулы I или его фармацевтически приемлемую соль для применения при лечении состояний, являющихся результатом избыточного продуцирования цитокинов у млекопитающих. Кроме того, данное изобретение предлагает фармацевтическую композицию, адаптированную для лечения состояний, являющихся результатом избыточного продуцирования цитокинов, включающую в себя соединение формулы I или его фармацевтически приемлемую соль в комбинации с одним или несколькими фармацевтически приемлемыми эксципиентами, носителями или разбавителями. Изобретение предлагает также применение соединения формулы I для изготовления лекарственного средства для лечения заболевания или состояния, способного улучшаться или предотвращаться подавлением избыточного продуцирования цитокинов.
Настоящее изобретение предлагает также применение соединения формулы I или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения восприимчивой опухоли. Кроме того, настоящее изобретение предлагает также соединение формулы I или его фармацевтически приемлемую соль для применения при лечении восприимчивой опухоли у млекопитающих. Кроме того, данное изобретение предлагает фармацевтическую композицию, адаптированную для лечения восприимчивой опухоли, включающую в себя соединение формулы I или его фармацевтически приемлемую соль в комбинации с одним или несколькими фармацевтически приемлемыми эксципиентами, носителями или разбавителями.
Настоящее изобретение предлагает также применение соединения формулы I или его фармацевтически приемлемой соли для изготовления лекарственного средства для ингибирования метастаза. Кроме того, данное изобретение предлагает соединение формулы I или его фармацевтически приемлемую соль для применения при ингибировании метастаза у млекопитающих. Кроме того, данное изобретение предлагает фармацевтическую композицию, адаптированную для ингибирования метастаза, включающую в себя соединение формулы I или его фармацевтически приемлемую соль в комбинации с одним или несколькими фармацевтически приемлемыми эксципиентами, носителями или разбавителями.
Данное изобретение предлагает также применение соединения формулы I или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения ревматоидного артрита. Кроме того, данное изобретение предлагает соединение формулы I или его фармацевтически приемлемую соль для применения при лечении ревматоидного артрита. Кроме того, данное изобретение предлагает фармацевтическую композицию, адаптированную для лечения ревматоидного артрита, включающую в себя соединение формулы I или его фармацевтически приемлемую соль в комбинации с одним или несколькими фармацевтически приемлемыми эксципиентами, носителями или разбавителями.
Подробное описание изобретения
Общие химические термины, применяемые в приведенных выше формулах, имеют свои обычные значения. Например, термин "С1-С7алкил" включает в себя радикалы метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил и гептил. Термин "С1-С7алкилен" включает в себя радикалы метилен, этилен, пропилен, изопропилен, бутилен, изобутилен, втор-бутилен, трет-бутилен, пентилен, гексилен и гептилен. "С3-С7циклоалкил" включает в себя радикалы циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Термин "(С1-С7алкилен)-(С3-С7циклоалкил)" применяют для обозначения С3-С7циклоалкила, присоединенного через С1-С7алкиленовый мостик. Термин "галоген" включает в себя фтор, хлор, бром и иод.
Термин "киназа р-38" применяют для обозначения изоформ р-38α- и/или р-38β-киназы.
Термин "подавление продуцирования TNF-α (цитокина IL-1β)" применяют для обозначения снижения избыточных уровней in vivo TNF-α, IL-1β или другого цитокина у млекопитающего до нормальных или субнормальных уровней. Это можно достичь ингибированием in vivo высвобождения TNF-α, IL-1β или другого цитокина всеми клетками, в том числе макрофагами; негативной регуляцией, на геномном уровне, избыточных уровней in vivo TNF-α, IL-1β или другого цитокина у млекопитающего до нормальных или субнормальных уровней; ингибированием синтеза TNF-α, IL-1β или другого цитокина как послетравматического случая, или негативной регуляцией TNF-α, IL-1β или другого цитокина на трансляционном уровне.
Термин "минимальная эффективная доза (MED)" применяют для обозначения наименьшей дозы, которая вызывает действие, которое статистически значимо отличается от действия, наблюдаемого в группе контроля с наполнителем.
Термин "пороговая эффективная доза (TED)" применяют для обозначения дозы, требуемой для достижения определенной пороговой активности. Например, TED50 является дозой, требуемой для достижения 50% восприимчивости.
Термин "пороговая минимальная эффективная доза (TMED)" применяют для обозначения наименьшей дозы, которая гарантирует статистически значимое действие, которое также обеспечивает пороговый уровень активности. Например TMED50 является наименьшей дозой, которая обеспечивает 50% восприимчивость и является обычно статистически значимо отличной от группы контроля с наполнителем.
Термин "эффективное количество" применяют для обозначения дозы соединения формулы I, необходимой для достижения требуемого фармакологического действия.
Квалифицированному специалисту в данной области будет понятно, что некоторые соединения формулы I содержат, по меньшей мере, один хиральный центр. Настоящее изобретение включает в себя все индивидуальные энантиомеры или диастереомеры, а также смеси энантиомеров и диастереомеров этих соединений, включая рацематы. Предпочтительно, чтобы соединения формулы I, содержащие, по меньшей мере, один хиральный центр, присутствовали в виде индивидуальных энантиомеров или диастереомеров. Индивидуальные энантиомеры или диастереомеры можно получить с применением исходных хиральных реагентов или стереоселективными или стереоспецифическими синтетическими способами. В альтернативном случае, индивидуальные энантиомеры или диастереомеры можно выделить из смесей стандартными хиральными хроматографическими способами или способами хиральной кристаллизации.
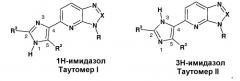
Квалифицированному специалисту в данной области будет также понятно, что, когда символ "W" обозначает имидазол (i) и R4 представляет собой водород, кольцо имидазола существует в следующих двух таутомерных формах:
Хотя таутомеры I и II являются структурно различными, квалифицированному специалисту в данной области будет понятно, что они существуют в равновесии и способны к легкому и быстрому взаимопревращению в общепринятых условиях (см.: March, Advanced Organic Chemistry, Third Edition, Wiley Interscience, New York, New York (1985), pages 66-70; и Allinger, Organic Chemistry, Second Edition, Worth Publisher, New York, New York (1976), page 173). Как таковое, представление соединения формулы I, где символ "W" означает имидазол (i) и R4 представляет собой водород, в одной таутомерной форме включает в себя обе таутомерные формы кольца имидазола. Подобно этому, название соединения формулы I, где "W" представляет собой имидазол (i) и R4 представляет собой водород, либо как 1Н-имидазол, либо как 3Н-имидазол, включает в себя обе таутомерные формы кольца имидазола. В частности, название 5-[2-трет-бутил-5-(4-фторфенил)-1Н-имидазол-4-ил]-3-(2,2-диметилпропил)-3Н-имидазо[4,5-b]пиридин-2-иламин включает в себя молекулу либо в 1Н-имидазол-4-ил-, либо 3Н-имидазол-4-илформе. Аналогично этому, когда термин "W" означает триазол (iv), триазольная часть существует в трех таутомерных формах, и представление или название одной таутомерной формы включает в себя все три таутомерные формы кольца триазола.
Квалифицированному специалисту в данной области будет понятно, что соединения настоящего изобретения способны образовывать соли. Во всех случаях фармацевтически приемлемые соли всех соединений включены в их названия. Соединения настоящего изобретения являются аминами и в соответствии с этим взаимодействуют с любой из числа неорганических и органических кислот с образованием фармацевтически приемлемых кислотно-аддитивных солей. Предпочтительными фармацевтически приемлемыми солями являются соли, образованные с малеиновой кислотой, фумаровой кислотой, янтарной кислотой, хлористоводородной кислотой и метансульфоновой кислотой. Особенно предпочтительными являются соли соединений формулы I с двумя молекулами метансульфоновой кислоты.
Некоторые классы соединений формулы I являются предпочтительными ингибиторами р-38-киназы. В нижеследующих абзацах описываются такие предпочтительные классы:
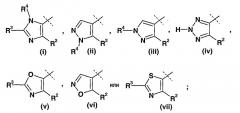
а) W представляет собой
b) W представляет собой
c) Х представляет собой C-R1;
d) Х представляет собой C-NH2;
e) R2 представляет собой фенил, 4-фторфенил или 2,4-дифторфенил;
f) R2 представляет собой фенил;
g) R2 представляет собой 4-фторфенил;
h) R2 представляет собой 2,4-дифторфенил;
i) R4 представляет собой водород;
j) W представляет собой Х представляет собой C-R1, R2 представляет собой фенил, 4-фторфенил или 2,4-дифторфенил, и R4 представляет собой водород;
k) W представляет собой Х представляет собой C-NH2, R2 представляет собой фенил, 4-фторфенил или 2,4-дифторфенил, и R4 представляет собой водород;
l) W представляет собой Х представляет собой C-R1, R представляет собой С1-С7алкил, R2 представляет собой фенил, 4-фторфенил или 2,4-дифторфенил, R3 представляет собой С1-С7алкил или фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из галогена и трифторметила, и R4 представляет собой водород;
m) W представляет собой Х представляет собой C-NH2, R представляет собой С1-С7алкил, R2 представляет собой фенил, 4-фторфенил или 2,4-дифторфенил, R3 представляет собой С1-С7алкил или фенил, необязательно замещенный одним или двумя заместителями, независимо выбранными из галогена, и R4 представляет собой водород.
n) Соединение формулы I является свободным основанием.
о) Соединение формулы I является солью.
р) Соединение формулы I является метансульфонатной солью.
q) Соединение формулы I является диметансульфонатной солью.
Предпочтительные варианты осуществления настоящего изобретения включают в себя все комбинации абзацев а)-q).
Особенно предпочтительными подтипами соединений в объеме формулы I являются соединения формулы I':
где
R' представляет собой 2,2-диметилпропил или 1,2,2-триметилпропил;
R2' представляет собой фенил, 4-фторфенил или 2,4-дифторфенил;
R3' представляет собой трет-бутил, 2-хлор-6-фторфенил, 2-фтор-6-трифторметилфенил, 2,6-дихлорфенил или 2,6-дифторфенил, или их фармацевтически приемлемые соли.
Наиболее предпочтительными соединениями формулы I являются соединения, у которых:
1. R' представляет собой 2,2-диметилпропил, R2' представляет собой 4-фторфенил, и R3' представляет собой 2-фтор-6-трифторметилфенил;
2. R' представляет собой 2,2-диметилпропил, R2' представляет собой 4-фторфенил, и R3' представляет собой 2,6-дихлорфенил;
3. R' представляет собой 2,2-диметилпропил, R2' представляет собой 4-фторфенил, и R3' представляет собой трет-бутил;
4. R' представляет собой 2,2-диметилпропил, R2' представляет собой фенил, и R3' представляет собой 2-хлор-6-трифторфенил;
5. R' представляет собой 2,2-диметилпропил, R2' представляет собой 2,4-дифторфенил, и R3' представляет собой трет-бутил;
6. R' представляет собой 1,2,2-триметилпропил, R2' представляет собой 4-фторфенил, и R3' представляет собой трет-бутил; и
7. R' представляет собой 1,2,2-триметилпропил, R2' представляет собой 4-фторфенил, и R3' представляет собой 2,6-дифторфенил.
Предпочтительно также, чтобы каждое из этих соединений присутствовало в виде метансульфонатной, сукцинатной, фумаратной, дималеатной, дигидрохлоридной или диметансульфонатной соли. Особенно предпочтительно, чтобы каждое из этих соединений присутствовало в виде диметансульфонатной соли.
Соединения формулы I являются ингибиторами киназы р-38. Таким образом, настоящее изобретение предлагает также способ ингибирования киназы р-38 у млекопитающего, который включает в себя введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения формулы I. Предпочтительно, чтобы млекопитающим, которого подвергают лечению введением соединений формулы I, был человек.
В качестве ингибиторов киназы р-38 соединения настоящего изобретения являются применимыми для подавления продуцирования провоспалительных цитокинов, фактора α некроза опухоли (TNF-α) и интерлейкина-1β (IL-1β) и, следовательно, для лечения нарушений, являющихся результатом избыточного продуцирования цитокинов. Считается, что соединения формулы I являются пригодными при лечении воспалительных заболеваний, включая экзему, атопический дерматит, ревматоидный артрит, остеоартрит, воспалительное заболевание кишечника и синдром токсического шока. Считается, что соединения настоящего изобретения являются пригодными при лечении сердечно-сосудистых нарушений, таких как острый инфаркт миокарда, хроническая сердечная недостаточность, атеросклероз, вирусный миокардит, отторжение сердечного аллотрансплантата и связанная с сепсисом сердечная дисфункция. Кроме того, считают, что соединения настоящего изобретения являются также применимыми для лечения нарушений центральной нервной системы, таких как менингококковый менингит, болезнь Альцгеймера, болезнь Паркинсона и рассеянный склероз.
Большинство солидных опухолей повышаются в массе посредством пролиферации опухолевых клеток и относящихся к строме клеток, включая эндотелиальные клетки. Чтобы опухоль росла больше, чем 2-3 миллиметра в диаметре, она должна образовывать сосудистую сеть, процесс, известный как ангиогенез. Описано, что подавление индуцированного опухолью ангиогенеза ангиостатином и эндостатином приводит к противоопухолевой активности (O'Reilly et al., Cell, 88, 277-285 (1997)). Обнаружено, что селективный ингибитор р-38 киназы SB22025 ингибирует ангиогенез (J.R. Jackson et al., J. Pharmacol. Exp. Therapeutics, 284, 687 (1998)). Поскольку ангиогенез является критическим компонентом увеличения массы большинства солидных опухолей, разработка новых ингибиторов киназы р-38 для ингибирования данного процесса представляет собой надежный подход для противоопухолевой терапии. Этот подход к противоопухолевой терапии может иметь недостатком токсичные побочные действия или вызывающие резистентность к лекарственному средству свойства общепринятой химиотерапии (Judah Folkman, Endogenous Inhibitors of Angiogenesis, The Harvey Lectures, Series 92, pages 65-82, Wiley-Liss Inc., (1998)).
В качестве ингибиторов киназы р-38 соединения настоящего изобретения, следовательно, являются применимыми при ингибировании роста восприимчивых опухолей. Schultz, R.M. Potential of p38 MAP kinase inhibitors in the treatment of cancer. In: E. Jucker (ed.), Progress in Drug Research, 60, 59-92, (2003). Определено, что восприимчивой опухолью является опухоль, которая зависит от киназы р-38 для ее выживания, роста или метастаза. Восприимчивые опухоли включают в себя опухоли головного мозга, мочеполового тракта, лимфатической системы, желудка, гортани и легких (патент США #5717100). Предпочтительно, термин "восприимчивые опухоли", применяемые в настоящей заявке, включает в себя раковые заболевания человека, включающие в себя немелкоклеточную карциному легких человека (A. Greenberg et al., Am. J. Respir. Cell Mol. Biol., 26, 558 (2002)), карциному молочной железы (J. Chen et al., J. Biol. Chem., 276, 47901 (2001); B. Salh et al., Int. J. Cancer, 98, 148 (2002); и S. Xiong, et al., Cancer Res., 61, 1727 (2001)), карциному желудка (Y.D. Jung et al., Proc. Am. Assoc. Cancer Res., 43, 9 (2002)), колоректальные карциномы (S. Xiong et al., Cancer Res., 61, 1727 (2001)), карциномы простаты (J-I Park et al., Oncogene, 22, 4314-4332 (2003); L. Chen et al., Cancer Lett., 215, 239-247 (2004); и A.R. Uzgara et al., Prostate, 55, 128-139 (2003)), злокачественную меланому (C. Denkert et al., Clin. Exp. Metastasis, 19, 79 (2002)) и множественную миелому (Hideshima et al., Oncogene advance online publication, 1-11, (11 October 2004); и Hideshima et al., Blood, 101 (2), 703 (2003)).
Описано также, что ингибирование ангиогенеза подавлением TNF-α является применимым при ингибировании или профилактике метастаза (патент США #6414150, патент США #6335336). Кроме того, подавление TNF-α показано для лечения и профилактики кахексии, синдрома истощения, испытываемого приблизительно половиной всех раковых пациентов (T. Yoneda, et al., J. Clin. Invest., 87, 977 (1991)).
Кроме того, ингибирование киназы р-38 может быть эффективным при лечении некоторых вирусных состояний, таких как грипп (K. Kujime, et al., J. Immunology, 164, 3222-3228 (2000)), состояние, вызванное риновирусом (S. Griego, et al., J. Immunology, 165, 5211-5220 (2000)), и состояние, вызванное ВИЧ (L. Shapiro, et al., Proc. Natl. Acad. Sci. USA, 95, 7422-7426, (1998)).
Соединения настоящего изобретения можно получить различными методиками, некоторые из которых иллюстрированы в приведенных ниже схемах. Специалист в данной области поймет, что отдельные стадии в нижеследующих схемах могут быть изменены для обеспечения получения соединений формулы I. Конкретный порядок стадий, требуемых для получения соединений формулы I, зависит от конкретного соединения, которое синтезируют, исходного соединения и относительной лабильности замещенных остатков. Некоторые заместители были исключены в нижеследующих схемах для ясности и никоим образом не предназначены для ограничения объяснения схем.
Соединения формулы I, где W представляет собой имидазол (i), можно получить, как показано на нижеследующей схеме, где R, R1, R2 и R3 имеют значения, указанные ранее.
Схема I
Дикетон (а) подвергают взаимодействию с ацетатом аммония и подходящим альдегидом в подходящем растворителе, предпочтительно, уксусной кислоте, получая при этом соответствующий нитропиридинилимидазол (b). Нитрогруппу восстанавливают в стандартных условиях гидрирования или химического восстановления с получением соответствующего диамина (с). Этот диамин затем либо подвергают взаимодействию с бромидом циана с получением 3-замещенного-5-(имидазол-4-ил)-2-аминопиридинилимидазола (Ia), с подходящим ортоформиатом с получением 3-замещенного-5-(имидазол-4-ил)пиридинилимидазола (Ib), либо с подходящим нитритом с получением 3-замещенного-5-(имидазол-4-ил)пиридинилтриазола (Ic).
Требуемые дикетоны (а) можно получить, как описано в нижеследующей схеме, где R и R2 имеют значения, указанные ранее.
Схема II
2,5-Дихлорнитропиридин (d) и подходящий амин или производное амина нагревают вместе в подходящем растворителе с получением соответствующего 2-амино-6-хлор-3-нитропиридина (е), который затем сочетают с подходящим образом замещенным ацетиленом, получая при этом соответствующий 1,2-дизамещенный ацетилен (f). Этот ацетилен окисляют с получением требуемого дикетона (а).
Соединения формулы I, где W представляет собой пиразол (ii) или (iii), получают, как описано на нижеследующей схеме, где X, R, R1 и R2 имеют значения, указанные ранее.
Схема III
Ацетилен (f) обрабатывают оксидом ртути (II) в водной серной кислоте с получением кетона (g). Этот кетон подвергают взаимодействию с диметилацеталем диметилформамида или трис(диметиламино)метаном в подходящем растворителе, обычно диметилформамиде, получая при этом енаминокетон (h). Енаминокетон затем обрабатывают гидразином в подходящем растворителе, обычно этаноле или метаноле, с получением фенилпиразола (j). Остаток имидазо- или триазолопиридина вводят, как ранее описано для получения соединений формулы Id.
Соединения формулы I, где W представляет собой [1,2,3]триазол (iv), можно получить, как описано в нижеследующей схеме, где символы Y, R и R2 имеют указанные ранее значения.
Схема IV
Ацетилен (f) подвергают взаимодействию с источником азида, обычно азидом натрия, в подходящем растворителе, таком как диметоксиэтан, получая при этом триазол (k). Остаток имидазо- или триазолопиридина вводят, как ранее описано, с получением соединений формулы Ie.
Соединения формулы I, где W представляет собой триазол (v) или оксазол (vii), можно получить, как описано в нижеследующей схеме, где символы Х, R, R2 и R3 имеют значения, указанные ранее, и Y представляет собой О или S.
Схема V
α-Бромкетон (I) подвергают взаимодействию с подходящим амидом (m, Y=O) или тиоамином (m, Y=S) в подходящем растворителе, получая при этом соответствующий оксазол или тиазол (n). Оксазол (n, Y=O) затем обрабатывают бромом в подходящем растворителе с получением соответствующего бромированного гетероцикла (о, Y=O). Триазол (n, Y=S) обрабатывают н-бутиллитием и образовавшийся анион подвергают взаимодействию с трибутилоловохлоридом, получая при этом соответствующее производное олова (о, Y=S). Подходящим образом замещенный гетероцикл (о) подвергают взаимодействию с подходящей бороновой кислотой (р) в присутствии подходящего катализатора, как ранее описано, получая при этом соединения формулы If.
Необходимые α-бромкетоны либо являются коммерчески доступными, либо их можно получить в стандартных условиях из соответствующего карбонильного соединения, например, как описано House (H.O. House, Modern Synthetic Reactions, W.A. Benjamin, Inc., Menlo Park, California (1972), pages 459-478) и Larock (R.C. Larock, Comprehensive Organic Transformations, VCH Publishers, Inc., New York (1989), pages 369-471, 755). Необходимые амиды и тиоамиды либо являются коммерчески доступными, либо их можно получить стандартными способами, известными квалифицированному специалисту.
Дополнительные соединения формулы I, где W представляет собой имидазол (i) или изоксазол (vi), можно получить в стандартных условиях сочетания с применением палладия, как описано в нижеследующей схеме, где W' представляет собой имидазол (i) или изоксазол (vi), и Х и R имеют значения, указанные ранее.
Схема VI
Подходящим образом замещенный галогенгетероарил (q) сочетают с подходящим образом замещенной бороновой кислотой (p) в присутствии палладиевого катализатора, обычно бис(трифенилфосфин)палладий(II)хлорида, в подходящем растворителе, получая при этом требуемое соединение формулы Ie. Необходимые исходные вещества либо являются коммерчески доступными, либо их можно получить способами, хорошо известными среднему специалисту в данной области.
Многие из соединений настоящего изобретения являются не только применимыми в качестве ингибиторов киназы р-38, но также являются применимыми промежуточными продуктами для получения дополнительных соединений настоящего изобретения. Например, первичные и вторичные амины можно ацилировать, алкилировать или сочетать с карбоновыми кислотами или аминокислотами в стандартных условиях сочетания пептидов. Кроме того, остатки сложных эфиров можно восстановить в соответствующие спирты или превратить в амиды в стандартных условиях. Спирты можно активировать и заменять рядом нуклеофилов для получения других соединений изобретений. Такие уходящие группы включают в себя, но не ограничиваются перечисленным, галогениды, оксониевые ионы, алкилперхлораты, аммониоалкансульфонатные эфиры, алкилфторсульфонаты, нонафлаты, трезилаты, трифлаты и эфиры сульфоновых кислот, предпочтительно, мезилат или тозилат. Методики введения этих групп также хорошо известны квалифицированному специалисту в данной области; см., например, March, Advanced Organic Chemistry, 5th Ed. John Wiley and Sons, New York, pg. 445-449 (2001). Кроме того, 2-аминогруппу кольца бензимидазола можно диазотировать и заменить для получения дополнительных соединений изобретения в стандартных условиях.
Квалифицированному специалисту будет также понятно, что не все заместители в соединениях формулы I могут проявлять устойчивость в некоторых условиях реакции, применяемых для синтеза соединений. Эти остатки можно вводить в подходящей точке синтеза или их можно защитить и затем снять защиту, как необходимо или желательно. Квалифицированному специалисту будет понятно, что защитные группы можно удалить в любой подходящей точке синтеза соединений настоящего изобретения. Методы введения и удаления защитных групп азота и кислорода являются хорошо известными в данной области; см., например, Greene and Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley and Sons, New York, Chapter 7 (1999). Кроме того, квалифицированному специалисту будет понятно, что во многих случаях порядок, которым вводят остатки, не является критическим. Конкретный порядок стадий, требуемых для получения соединений формулы I, зависит от конкретного соединения, которое синтезируют, исходного соединения и относительной лабильности замещенных остатков.
Аббревиатуры, символы и термины, применяемые в примерах и анализах, имеют следующие значения: АсОН = уксусная кислота; ДМФА = N,N-диметилформамид; ДМСО = диметилсульфоксид; Et2O = диэтиловый простой эфир; EtOAc = этилацетат; EtOH = этанол; ч = час(ы); МеОН = метанол; мин = минута(ы); МТВЕ = метил-трет-бутиловый простой эфир; Pd(OAc)2 = ацетат палладия; к.т. = комнатная температура; ТГФ = тетрагидрофуран; VO(асас)2 = ванадилацетилацетонат.
Получение 1
[6-(2-трет-Бутил-5-фенил-3Н-имидазол-4-ил)-3-нитропиридин-2-ил]-(2,2-диметилпропил)амин
(6-Хлор-3-нитропиридин-2-ил)-(2,2-диметилпропил)амин
Неопентиламин (18 мл, 150 ммоль) добавляют к суспензии 2,6-дихлор-3-нитропиридина (20 г, 103 ммоль) и Na2СО3 (18,5 г, 175 ммоль) в EtOH (1,6 мл/ммоль) при к.т. и смесь перемешивают на протяжении ночи. Образовавшуюся суспензию концентрируют и разбавляют водой (100 мл) и медленно нейтрализуют концентрированной HCl (приблизительно 40 мл) до рН 7. Суспензию охлаждают при 0°С в течение 1 ч и твердое вещество собирают вакуумным фильтрованием. Твердое вещество промывают ледяной водой (4×50 мл) и сушат на воздухе на протяжении ночи. Перекристаллизация вещества из EtOAc и гексанов дает указанное в заголовке соединение в виде желтого твердого вещества (21,23 г, 84%).
МС (ES): m/z = 244 [M+H].
(2,2-Диметилпропил)-(3-нитро-6-фенилэтинилпиридин-2-ил)амин
(6-Хлор-3-нитропиридин-2-ил)-(2,2-диметилпропил)амин (7,3 г, 30,0 ммоль), фенилацетилен (5,0 мл, 45 ммоль) и трифенилфосфин (1,5 ммоль, 0,39 г) растворяют в триэтиламине (10 мл/г) в высушенной в сушильном шкафу круглодонной колбе, колбу с раствором промывают азотом и три раза вакуумом откачивают из нее газ. Добавляют Pd(OAc)2 (0,10 г, 0,45 ммоль) и цикл промывка азотом/откачка газа повторяют (3×). Смесь нагревают при 70-80°С с перемешиванием в атмосфере азота в течение 1-3 ч, затем охлаждают до к.т. в течение 2 ч. Смесь концентрируют и распределяют между водой (25 мл) и EtOAc (150 мл). Отделяют органический слой и промывают его водой (4×25 мл), насыщенным водным NaCl (25 мл), сушат MgSO4, фильтруют и концентрируют. Неочищенное твердое вещество очищают перекристаллизацией из смеси EtOAc/гексаны, получая при этом указанный в заголовке продукт в виде ярко-оранжевого твердого вещества (6,5 г, 21,2 ммоль, 71%).
МС (ES): m/z = 310 [M+H]; т.пл. 90-92°С.
1-[6-(2,2-Диметилпропиламино)-5-нитропиридин-2-ил]-2-фенилэтан-1,2-дион
Смесь (2,2-диметилпропил)-(3-нитро-6-фенилэтинилпиридин-2-ил)амина (3,11 г, 10 ммоль), NaHCO3 (0,420 г, 5,0 ммоль), MgSO4 (2,40 г, 20 ммоль) в ацетоне (85 мл) и воде (25 мл) охлаждают до 0°С. К охла