Способ получения нанокомпозитных полимерных материалов с биологической активностью и нанокомпозитные полимерные материалы, полученные этим способом
Иллюстрации
Показать всеИзобретение относится к способу получения нанокомпозитных полимерных материалов с биологической активностью. Описывается способ получения нанокомпозитных биологически активных полимерных материалов, включающий формирование наноструктурированной поверхности (НСП) на подложке из биосовместимого полимерного материала посредством обработки поверхности подложки потоками ионов химически активных и инертных газов с последующим модифицированием сформированной НСП путем нанесения на нее пленки из углеродсодержащего материала, при этом параметры рельефа НСП регулируют с возможностью получения свойств НСП, определяющих заданную биологическую активность материала. Предложенный способ позволяет создавать новые классы материалов, обладающих широким спектром биологической активности, и использования их в качестве лекарственных средств внутренней адресной доставки. 3 н. и 22 з.п. ф-лы, 7 ил., 6 табл.
Реферат
Изобретение относится к области нанотехнологии и наноструктурированным полимерным биоматериалам и может быть использовано в биотехнологии, медицине, пищевой промышленности и других областях для разработки средств различного назначения с антибактериальными и лечебными свойствами, в частности для создания лечебных повязок и медицинских средств нового поколения, в том числе трансдермальных лечебных форм и средств адресной доставки лекарственных препаратов.
Известен способ получения материалов медицинского применения (Патент РФ №2153887, МПК А61L 27/30, оп.2000 г.), включающий нанесение на поверхность полимера углеродсодержащей наноструктурированной модифицирующей пленки.
Однако полученные известным способом структуры не обладают собственной биологической активностью.
Известны способы получения наноструктурированных углеродных полимеров (Патент РФ №2282583, МПК С01 В 31/00, оп.2005 г.) и наноструктурированных алмазоподобных углеродных пленок для медицинских применений [R.J.Narayan, Mat.Sci.Eng., С 25, 405 (2005)], которые обладают высокой гемосовместимостью, низким коэффициентом трения и тромборезистетнтными свойствами, обусловленными их биоинертностью. Однако они также не проявляют биологической активности, а потому не находят применения при создании непосредственно лечебных средств.
Известны наноструктурные материалы с биоцидными свойствами (Патент РФ №2195473, МПК С09D 05/14, оп.2002 г), содержащие в качестве бактерицидного компонента наноструктурные частицы металлов, в частности серебра. Такие материалы используются преимущественно для защитных покрытий различных объектов и, поскольку не обладают биосовместимостью, не применимы в медицине и биотехнологиях, для использования их в качестве лечебных средств, например в виде антимикробных материалов, соприкасающихся с телом человека.
В то же время биология и медицина представляют собой широкие области использования наноструктурных материалов для создания медицинских препаратов и лечебных систем, например, известны нанокомпозитные материалы («Нанотехнология в ближайшем десятилетии. Прогноз и направление исследований», под. ред. М.К.Роко и др., М., Мир, 2002 г.) с наночастицами алмаза, которые, проникая в раковые клетки, разрушают их.
Наиболее близким к описываемому изобретению является способ получения нанокомпозитных биологически активных полимерных материалов (В.М.Елинсон, В.В.Слепцов, А.Н.Лямин, В.В.Потрясай, Л.Н.Костюченко, А.Д.Мусина. «Барьерные свойства углеродных пленок, нанесенных на полимерную основу в условиях агрессивной окружающей среды», Труды V Международной научно-технической конференции «Высокие технологии в промышленности России». Москва, МГТУ им.Н.Э.Баумана, 1999 г., стр.419-426), включающий формирование наноструктурированной поверхности (НСП) на подложке из биосовместимого полимерного материала посредством обработки поверхности подложки потоками ионов химически активных или инертных газов, или их смеси с последующим модифицированием сформированной НСП путем нанесения на нее пленки на основе углерода.
Полученные известным способом материалы биосовместимы, обладают бактериостатическими и гипоаллергенными свойствами, высокой химической стойкостью по отношению к биосфере человека и рекомендованы для применения в таких медицинских изделиях как зонды различных типов, катетеры, дренажные трубки, полимерные контактные линзы, контейнеры для контактных линз.
Однако известный способ не позволяет формировать НСП с шероховатостью Rq, превышающей 1-2 нм, при этом наносимые углеродные покрытия имеют толщину более 200 нм, что не дает возможности создавать матричные структуры и ограничивает их использование в качестве биологически активных элементов изделий медицинского назначения.
Кроме того, биологическая активность известных материалов недостаточна для создания лекарственных средств селективного действия, например с выраженной антимикробной или противоопухолевой активностью, а потому известные материалы предполагают крайне ограниченную область применения.
Таким образом, технический результат, получаемый от использования настоящего изобретения, состоит в обеспечении возможности создания нового класса материалов, безопасных в применении, обладающих широким спектром биологической активности, в расширении области применения этих материалов, включая возможность использования их в качестве лекарственных средств внутренней адресной доставки, а также возможность создания трансдермальных лечебных форм и биологически активных систем селективного действия на различные клеточные структуры.
Кроме того, технический результат, получаемый от использования настоящего изобретения, состоит в повышении технологичности и экологической безопасности производства таких материалов.
Указанный технический результат достигается тем, что в способе получения нанокомпозитного биологически активного полимерного материала, включающем формирование наноструктурированной поверхности (НСП) на подложке из биосовместимого полимерного материала посредством обработки поверхности подложки потоками ионов химически активных и инертных газов с последующим модифицированием сформированной НСП путем нанесения на нее пленки из углеродсодержащего материала, параметры рельефа НСП регулируют с возможностью получения свойств НСП, определяющих заданную биологическую активность материала.
При этом параметры рельефа НСП можно избирательно регулировать путем изменения формы и размеров ее элементов, а также расстояния между ними посредством изменения режимов обработки исходной поверхности потоками ионов газов и/или выбора их состава.
Целесообразно для получения полимерного нанокомпозитного материала с антимикробной активностью обработку исходной поверхности потоками ионов газов осуществляют в условиях средней энергии ионов 500-3000 эВ при плотности тока ионов 0,5-5 мА/см2 и времени обработки потоком ионов от 1 до 30 мин с возможностью образования наноструктурированной поверхности подложки со среднеквадратичной шероховатостью (Rq) 5,0-200 нм при радиусе основания выступов (R) 80-230 нм и высоте выступов Н в интервале 10-200 нм.
Для обработки поверхности подложки потоками ионов газов могут быть использованы химически активные и/или инертные газы, и/или их смеси.
Предпочтительно в качестве химически активных газов использовать активную смесь кислорода и азота (воздушную смесь), кислород, тетрафторметан и др.
В качестве инертных газов могут быть использованы неон, аргон криптон, ксенон.
Модифицирование НСП целесообразно производить путем нанесения пленок на основе углеродсодержащего материала методом ионно-стимулированного осаждения из газовой фазы паров углеводородов, содержащих в молекуле частично или полностью sp3-гибридизованные атомы углерода, например, циклогексана.
При этом параметры рельефа НСП можно избирательно регулировать путем изменения толщины пленки из углеродсодержащего материала посредством управления временем осаждения модифицирующего или изменяя фазовый и кластерный состав пленки углерода путем управления энергией ионов и/или использования различных углеводородов.
Целесообразно в качестве биосовместимого полимерного материала использовать синтетические полимеры, например полиэтилентерефталат и политетрафторэтилен и др.
В качестве биосовместимого полимерного материала могут быть использованы биодеградируемые природные полимеры, например хитозаны, ацетилцеллюлоза, полиоксиалканоаты и др.
При этом для получения материалов селективного действия наноструктурированная поверхность полимерного материала может быть дополнительно модифицирована органическими производными фуллерена.
Целесообразно использовать фуллереновые модификаторы с фрагментами гетероциклических соединений, состав которых соответствует заданному свойству.
Нанесение органических производных фуллерена на НСП может быть осуществлено методом осаждения spin coating.
Для получения выраженной антимикробной активности и противогрибковой активности в составе производного фуллерена предпочтительно использовать хинолин или индол.
Для получения выраженной противоопухолевой активности в качестве фуллеренового модификатора предпочтительно использовать диаду фуллерен-порфирин.
Указанный технический результат достигается также тем, что в нанокомпозитном полимерном материале, обладающем биологической активностью и включающем биосовместимый полимерный материал с наноструктурированной поверхностью (НСП), последняя представляет собой двухслойную матричную систему, содержащую пленку на основе углерода, которая расположена не менее чем на 60% на выступах, сформированных на поверхности полимера в результате обработки ее потоками ионов.
При этом нанокомпозитный полимерный материал, обладающий противомикробной активностью, должен иметь величину среднеквадратичной шероховатости поверхности (Rq) не менее 5,0 нм, соотношение площадей поверхности с высоким (не менее 50 В) и низким (не более 20 В) потенциалом не менее 0,5, а соотношение дисперсного и полярного компонентов полной поверхностной энергии составляет 5-40.
Предпочтительно, чтобы радиус (R) основания выступов на поверхности НСП составлял 80-230 нм, а их высота (Н) 10-50 нм.
Целесообразно, чтобы нанокомпозитный полимерный материал, обладающий противоопухолевой активностью, имел среднеквадратичную шероховатость поверхности материала 25-70 нм, соотношение площадей поверхности с высоким (не менее 50 В) и низким (не более 20 В) потенциалом - не менее 0,5, а соотношение дисперсного и полярного компонентов полной поверхностной энергии - не менее 5.
При этом радиус выступов НСП нанокомпозитного полимерного материала, обладающего противоопухолевой активностью, выполнен не менее 500 нм, их высота составляет не менее 500 нм.
Целесообразно в качестве биосовместимого полимерного материала использовать синтетические полимеры, например полиэтилентерефталат или политетрафторэтилен, или биодеградируемые природные полимеры, например хитозаны, ацетилцеллюлозу, полиоксиалканоаты и др.
Указанный технический результат достигается также тем, что в нанокомпозитном полимерном материале, обладающем биологической активностью и включающем биосовместимый полимерный материал с сформированной наноструктурированной поверхностью (НСП) в виде двухслойной матричной системы, содержащей пленку на основе углерода, содержится слой органических производных фуллерена, осажденный на НСП.
В качестве органических производных фуллерена целесообразно использовать диады, содержащие фуллерен-фармакофорный фрагмент.
В качестве органических производных фуллерена могут быть использованы
1-метил-2-(индолил-3)фуллеропирролидин (диада фуллерен-индол),
1-метил-2-(хинолинил-2)фуллеропирролидин (диада фуллерен-хинолин) или
диада фуллерен-порфирин.
Установлено, что биологическая активность нанокомпозитных материалов зависит от свойств наноструктурированной поверхности, которые, в свою очередь, определяются технологическими факторами процесса получения НСП, что создает предпосылки для создания нанокомпозитных материалов с различным лечебным действием путем изменения режимов проведения операций по обработке исходной поверхности и ее модификации с применением методов ионно-плазменной технологии.
При этом различные формы и геометрические размеры наноструктуры в целом, а также различные формы и размеры ее элементов, например форма выступов, их радиус и высота, а также расстояния между ними, выраженные в таких характеристиках как шероховатость НСП, соотношение площадей поверхности с высоким и низким потенциалом и соотношение дисперсного и полярного компонентов полной поверхностной энергии определяют тот или иной вид биологической активности.
Как показали эксперименты, предварительная обработка поверхности полимеров, толщина покрытия, энергия частиц существенно влияют на изменение заряда поверхности полимеров. В процессе нанесения углеродного слоя пленки биосовместимого полимерного материала приобретают избыточный положительный заряд порядка до нескольких мкКл/м2. При этом, например, предварительная обработка поверхности пленок в смесях Ar+О2 и воздушной смеси приводит к более эффективной зарядке поверхности образца в сравнении с обработкой в плазме CF4.
Исследования материалов, полученных по способу в соответствии с изобретением, показали, что воспроизводимость, например, антимикробных свойств биосовместимых полимерных материалов может быть надежно достигнута, если среднеквадратичная шероховатость поверхности материала находится в интервале 5,0-200 нм, соотношение площадей поверхности с высоким (не менее 50 В) и низким (не более 20 В) потенциалом составляет не менее 0,5, а соотношение дисперсного и полярного компонентов полной поверхностной энергии составляет не менее 5-40.
В случае получения материала с противоопухолевой активностью воспроизводимость свойств наблюдается при среднеквадратичной шероховатости в интервале 25-70 нм, соотношение площадей поверхности с высоким (не менее 50 В) и низким (не более 20 В) потенциалом составляет не менее 0,5, а соотношение дисперсного и полярного компонентов полной поверхностной энергии составляет не менее 5.
Обнаружено, что посредством управления режимами технологического процесса по получению нанокомпозитных материалов и оптимизации процессов обработки поверхности полимерных материалов направленными потоками ионов химически активных и инертных газов или их смесей можно воспроизводимо получать НСП с различными свойствами.
Таким образом, появляется возможность придавать одному и тому же полимеру, выбранному в качестве исходного материала, различные функциональные характеристики и заданные лечебные свойства.
При использовании же в качестве исходного биосовместимого полимера биодеградируемых природных полимеров, какими являются хитозаны, ацетилцеллюлоза, полиоксиалканоаты и др., способ в соответствии с изобретением дает возможность получать также и материалы в виде лекарственных средств внутренней доставки.
Кроме того, выявлена возможность дополнительной модификации материалов с НСП производными фуллерена, что позволяет увеличивать биомедицинские возможности получаемых материалов, а следовательно, значительно расширять круг их применения. Так, в зависимости от состава фрагмента, присоединенного к фуллереновому сфероиду модифицированный производными фуллерена нанокомпозитный материал приобретает селективно выраженную антимикробную, или противоопухолевую, или другую биологическую активность. Такими фрагментами могут быть, например, порфирин, индол, хинолин и др.
Исследования биологической активности различных производных фуллерена позволили подтвердить, что помимо уже достаточно широко известных электрофизических, оптических, адсорбционных и других полезных технических свойств производных фуллерена, особое место занимает возможность их применения в биологической и медицинской химии. Такая возможность обусловлена тем, что размер, гидрофобность, трехмерность и электронные свойства фуллерена очень привлекательны для медицинской химии.
Имеются сведения о перспективах применения производных фуллерена для лечения нейродегенеративных заболеваний, фотодинамической терапии рака, ВИЧ-инфекций, а также антибактериальной активности по отношению к грамотрицательным и грамположительным бактериям, резистентным к другим антимикробным средствам.
Упомянутые биологические свойства производных фуллерена являются предпосылкой для создания новых биологически активных соединений в соответствии с описываемым изобретением, в частности путем осаждения производных фуллерена на НСП.
В результате экспериментов подтверждена возможность нанесения производных фуллерена на НСП с различными поверхностными характеристиками, а проведенные микробиологические испытания влияния разнообразных фуллереновых компонентов в матрицах показали выраженное и избирательное ингибирование роста тест-организмов (различных бактерий и патогенных грибков) при модифицировании НСП производными фуллеренов.
Исследования биологической активности материалов с различными производными фуллерена позволяют подтвердить, что селективная биологическая активность может изменяться при использовании фуллереновых модификаторов с различными гетероциклическими фрагментами.
Конкретную селективно выраженную биологическую активность получают путем присоединения к фуллереновому сфероиду фрагментов с соответствующим заданному свойству составом, например:
- для получения выраженной антимикробной активности в качестве фармакофорного фрагмента используют хинолин или индол,
- для получения выраженной противоопухолевой активности в качестве фармакофорного фрагмента используют порфирин.
Полученные описываемым способом материалы характеризуются уникальными биомедицинскими свойствами, которые обусловлены совокупностью физико-химических свойств этих материалов.
При этом указанные свойства достигаются изменением степени дисперсности поверхности биосовместимых материалов с НСП, сформированными ионно-плазменной обработкой, с последующим нанесением пленок на основе углерода и дополнительной модификацией гетероциклическими производными фуллерена.
Способ получения нанокомпозитного полимерного материала согласно настоящему изобретению содержит следующие этапы.
1. Обработка поверхности полимера потоком ионов инертных и химически активных газов. Создание рельефа с заданными характеристиками.
2. Нанесение пленки на основе углерода на поверхность полимера с заданным рельефом. Создание пленки на основе углерода толщиной от 5 нм позволяет с высокой точностью регулировать параметры матричной структуры и получать рельеф НСП с заданными свойствами.
3. Нанесение слоя синтезированных органических производных фуллерена с различным типом фармакофорного модификатора (порфирин, хинолин, индол и др.) на поверхность биополимера с заданным рельефом.
В качестве исходного материала для обеспечения указанных свойств выбирают биосовместимые полимеры, например широко используемые в биологии и медицине полиэтилентерефталат (ПЭТФ) и политетрафторэтилен (ПТФЭ). В случае получения материалов для лекарственных средств внутренней адресной доставки в качестве биосовместимого полимерного материала используют биодеградируемые природные полимеры, например хитозаны, ацетилцеллюлозу или полимеры бактериального происхождения (полиоксиалканоаты и др.).
Наноструктурированную поверхность на основе биосовместимого полимерного материала формируют путем обработки его поверхности потоком ионов инертных и/или химически активных газов, или их смеси. Наиболее доступной химически активной смесью является смесь O2+N2 (воздух), однако, могут быть использованы и кислород, тетрафторметан (CF4), неон, аргон, криптон, ксенон, и др.
Обработку потоками ионов осуществляют, например, с помощью ионного источника ИИ-4-0,15 на вакуумной установке для ионного и ионно-химического травления металлов, полупроводников и диэлектриков.
Создание рельефа с заданными характеристиками осуществляют путем оптимизации параметров технологического процесса для получения материала с заданной биологической активностью. С этой целью предварительно разрабатывают технологические схемы и их аппаратурную реализацию, настроенную на условия, соответствующие формированию НСП с той или иной биологической активностью.
Управление свойствами формируемой поверхности для получения различной биологической активности осуществляют путем изменения ее рельефа, заряда и химического состава поверхности при ионной бомбардировке. Получение заданных свойств осуществляют в соответствии с выбранным оптимальным режимом обработки за счет изменения условий формирования направленного пучка ионов, а также состава газовой смеси.
Так, например, для получения материала с антимикробным действием обеспечивают шероховатость поверхности Rq 5,0-200 нм при радиусе основания выступов R 80-230 нм и высоте выступов Н в интервале 10-50 нм и с этой целью обработку поверхности полимера потоком ионов газовой смеси O2+N2 (по составу эквивалентную составу воздуха) производят при средней энергии ионов 500-3000 эВ, плотности тока ионов 0,5-5 мА/см2 в течение 1-30 мин.
В то же время для получения материала с противоопухолевым действием шероховатость поверхности Rq создают не менее 25 нм при радиусе выступов не менее 500 нм и их высоте также не менее 500 нм и для этого обработку поверхности осуществляют в течение 1-30 мин ионами большой молекулярной массы.
Следующим этапом получения нанокомпозитного материала является модифицирование сформированной НСП путем нанесения на нее пленок из направленных ионно-плазменных потоков, например, паров углеводородов. В этом случае получают пленки на основе углерода толщиной 1-500 нм. Управление свойствами полученной модифицированной НСП осуществляют за счет регулирования фазового и кластерного состава пленки на основе углерода и толщины пленки.
Плазмообразующий газ (углеводород), тип гибридизации которого влияет на структуру и свойства получаемых пленок, а следовательно, и на свойства НСП в целом, выбирают, преимущественно исходя из условий высокого процентного содержания алмазной фазы в углеродной пленке, которая влияет как на электрофизические, так и на механические характеристики покрытий. Таким образом, в качестве углеводородов выбирают, как правило, вещества с достаточно высоким давлением насыщенных паров, при том, что их молекулы должны содержать полностью или частично sp3-гибридизованные атомы углерода. Например, в качестве такого углеводорода используют циклогексан, у которого все атомы углерода имеют sp3-гибридизацию связей в молекуле, что является предпосылкой наличия высокого процентного содержания алмазной фазы в углеродной пленке. Могут быть использованы также смеси углеводородов с инертными или другими газами.
На предварительно очищенную поверхность полимера с заданным рельефом наносят пленку на основе углерода из направленного ионно-плазменного потока частиц посредством, например, ионного источника ИИ-4-0,15 на вакуумной установке при соответствующих ускоряющем напряжении и токе разряда. Время осаждения устанавливают в соответствии с заданной толщиной получаемого покрытия.
В каждом конкретном случае регулируют условия проведения осаждения, варьируют соотношение компонентов углеродсодержащего материала, ускоряющее напряжение, ток разряда, продолжительности процесса, изменяя тем самым состав и свойства получаемого покрытия.
При этом фазовый и кластерный состав пленки углерода изменяют одновременно с изменением толщины пленок путем изменения энергии ионов и использования различных углеводородов и тем самым получают НСП с заданным рельефом и составом поверхности.
Толщину слоя регулируют путем управления временем осаждения модифицирующего агента и в зависимости от толщины пленки получают НСП с различной степенью биологической активности. Оптимальная толщина углеродной пленки составляет 1-500 нм.
Для получения материалов селективного действия на наноструктурированную поверхность полимерного материала наносят органические производные фуллерена, например, содержащие фрагменты порфирина, хинолина, индола и др.
Модификация НСП производными фуллерена может быть осуществлена методами простой адгезии путем осаждения из растворов.
Нанесение фуллереновых модификаторов на образцы полимеров с наноструктурированной поверхностью осуществляют также методом осаждения spin coating с использованием центрифуги.
Процесс состоит в 20-кратном нанесении капли раствора (концентрации 0,6 мг/мл) фуллереновых соединений в хлороформе на подложку при вращении 3000 об/мин. Затем образец высушивают на воздухе от остатков растворителя. Такая методика обеспечивает нанесение порядка 30 монослоев.
Для модификации НСП производными фуллерена могут быть использованы и такие технологии, как метод Ленгмюра-Блоджетт. Этот метод характеризуется хорошей воспроизводимостью, а возможность регулирования ориентации молекул в монослое при нанесении, а также числа наносимых монослоев позволяет дополнительно воздействовать на поверхностные характеристики НСП, а следовательно, и на биологическую активность получаемых материалов.
Контроль электрофизических свойств и топологии НСП осуществляют методом электронной микроскопии, методом сканирующей зондовой микроскопии и методом исследования краевого угла смачивания.
Методом электронной микроскопии проводят панорамный анализ исследуемых образцов и выявляют структуру как поверхности, так и среза образца.
Методом сканирующей зондовой микроскопии (СЗМ) проводят как панорамный, так и количественный анализ поверхности. При этом на основе регистрируемых в СЗМ массивов данных сканирования определяют целый спектр характеристик поверхности, в том числе параметры шероховатости, принятые международными стандартами, фрактальные параметры и другие свойства поверхности.
Проведение исследований в режиме атомно-силовой микроскопии в условиях высокого разрешения позволяет наблюдать и контролировать сам процесс роста непосредственно in situ: формирование рельефа поверхности, образование пленки, скорость роста и ее зависимость от направления на уровне отдельных молекул. Для каждого из рассматриваемых образцов получают изображения поверхности в разных точках и при различном увеличении. Размер сканов берут от 10 до 0,2 мкм. На основе данных сканирования для каждого скана определяют совокупность характеристик микрорельефа поверхности. Основными определяемыми параметрами являются характерные горизонтальный размер R и высота пика H (находимые по профилям поверхности), периметр L (находимый выделением линии уровня) особенностей рельефа поверхности, шероховатость поверхности (среднеквадратичное отклонение Rq, рассчитываемое по всем точкам скана), площадь участка поверхности S, а также фрактальная размерность поверхности DF.
Для определения химической неоднородности твердой поверхности, контроля ее качества и стандартизации полученного материала используют метод исследования краевого угла смачивания (КУС), который является экспериментальным проявлением изменения поверхностной энергии материала. На основе измерения углов смачивания по отношению к двум жидкостям и расчете работы адгезии можно получить удельную полную энергию поверхности и ее полярный и дисперсионный компоненты σs, σd, σp.
Химический состав поверхности определяют путем регистрации ИК-спектра с помощью Фурье-спектрометра Bruker Equinox 50S в области от 400 до 4000 см-1 с 500-кратным накоплением при шаге сканирования 2 см-1.
Измерение заряда поверхности производилось методом динамического конденсатора. Этот метод дает интегральную величину удельного заряда. Для получения данных о распределении поверхностного потенциала материала используется также метод АСМ.
Экспериментальную оценку биомедицинских свойств полученных материалов осуществляют следующим образом.
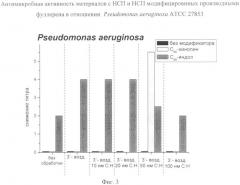
Антимикробную активность композитных материалов проводят с использованием музейных штаммов грамположительных, грамотрицательных бактерий и грибов (в частности, были использованы штаммы: Staphylococcus aureus ATCC 29213, Escherichia coli ATCC 54383, Pseudomonas aeruginosa ATCC 27853, Candida albicans), предварительную подготовку которых осуществляют следующим образом.
Суспендируют 3-4 колонии 20-часовой культуры исследуемых микроорганизмов в 2 мл физиологического раствора. Полученную суспензию доводят до стандарта мутности по шкале McFarland (1,5×108 кое/мл). Базовую суспензию разводят в физиологическом растворе методом серийных разведений. После разведения базовой суспензии получают 6 пробирок для каждого вида микроорганизмов с концентрациями 1,5×107, 1,5×106, 1,5×104, 1,5×103, 1,5×102 кое/мл.
Полученные в соответствии с описываемым способом материалы с биологической активностью и отличающиеся друг от друга в зависимости от режимов технологии изготовления и химического строения фуллереновых модификаторов исследуют по следующей методике.
Исследуемые материалы разрезают на фрагменты размером 1×1 см. По 2 фрагмента из каждой серии помещают в пробирку с жидкой питательной средой для контроля стерильности покрытий. Для каждого из исследуемых микроорганизмов используют 2 ряда фрагментов по 4 в каждом. Из пробирок с концентрациями 1,5×105, 1,5×104, 1,5×103, 1,5×102 кое/мл дозатором забирают по 25 мкл суспензии микроорганизма. Каждую концентрацию наносят параллельно на 2 одинаковых фрагмента полимерной подложки с биоцидным покрытием (или без покрытий для контрольных исследований). Первый ряд из четырех покрытий с четырьмя разными концентрациями микроорганизмов смывают 1 мл бульона Мюллер-Хинтона сразу же после нанесения бактериальной суспензии и производят высев 0,1 мл на дифференциально-диагностические плотные среды. Для стафилококков на желточно-солевой агар, для Escherichia coli и Pseudomonas aeruginosa на агар Эндо, для Candida albicans на агар Сабуро. Второй ряд из четырех покрытия с инокулянтами инкубируют во влажной камере в термостате 2 ч при 37°С. После инкубации фрагменты покрытий отмывают в 1 мл бульона и также по 0,1 мл высеивают на плотные, соответствующие каждому виду микроорганизма среды. Все чашки инкубируют в термостате при 37°С в течение 48, а для грибов 72 ч.
Учет результатов проводят визуально по наличию роста и подсчета колоний микроорганизмов, выросших на дифференциально-диагностических твердых питательных средах, для первого ряда (без инкубации во влажной камере) и второго ряда (с инкубацией во влажной камере) покрытий.
По разности количества выросших колоний на первом и втором рядах чашек высчитывают снижение титра обсемененности (если это происходило). Результативный титр снижения обсемененности для каждого из исследованных микроорганизмов берут как среднее значение по снижению обсемененности во всех четырех разведениях. Снижение титра обсемененности считают фактом, подтверждающим наличие биоцидной активности у исследуемых материалов.
Испытания противоопухолевой активности проводили на перевивной клеточной линии рака молочной железы человека, полученной из американской коллекции типовых клеточных структур (АСТСС). Подсчитывали отношение фракции выживших клеток в зависимости от времени культивирования на исследуемых образцах полимерных материалов к фракции выживших клеток на культуральном пластике (полистироле).
Ниже представлены конкретные примеры реализации описываемого изобретения, где в примерах 1-9 приведены варианты осуществления способа получения нанокомпозитных полимерных материалов и результаты оценки биомедицинских свойств полученных материалов.
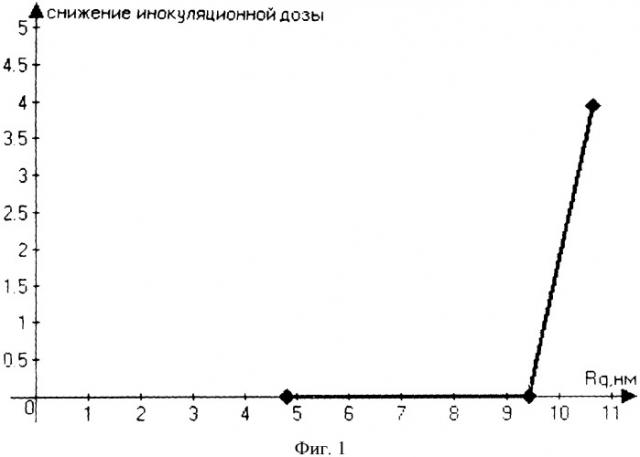
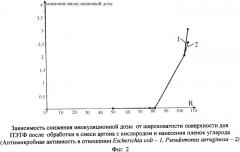
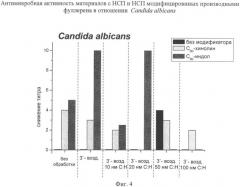
На диаграммах фиг.1-6 представлены зависимости антимикробной, а на фиг.7 - противоопухолевой активности от параметров микрорельефа и/или вида модификатора полученных в соответствии с описываемым изобретением материалов с НСП.
Пример 1. Подложку из полиэтилентерефталата (ПЭТФ) помещают на вращающийся барабан-подложкодержатель вакуумной установки с ионным источником ИИ-4-0,15. Камеру вакуумной установки откачивают турбомолекулярным насосом (ТМН-500) до давления (5÷6)×10-3 Па. В качестве рабочего газа используют воздушную смесь, представляющую собой смесь азота и кислорода в соотношении 4:1, которую с помощью натекателя впускают в ионный источник до давления 10-1 Па. Обработку поверхности ПЭТФ производят при величине энергии ионов 700±100 эВ и плотности ионного тока ≈2,0±0,3 мА/см2 в течение 3 минут.
Затем ионно-плазменным методом наносят пленку алмазоподобного углерода. Нанесение покрытий производят методом ионно-стимулированного осаждения из газовой фазы циклогексана с помощью второго ионного источника при ускоряющем напряжении от 2 до 4кВ, токе в катушке соленоида (Iс) 2 А и токе разряда от 100 до 300 мА. Время осаждения варьируют от 5 до 10 мин в соответствии с заданной толщиной покрытия, которую контролируют по свидетелю с помощью микроскопов МИИ-4 и МИИ-11. В результате получают пленки алмазоподобного углерода толщиной соответственно 50 и 100 нм.
Измерения параметров НСП проводят методом АСМ и путем измерения КУС по отношению к двум разным жидкостям - воде и этиленгликолю - и на основе полученных данных рассчитывают удельную энергию поверхности и ее полярный и дисперсионный компоненты σs, σd, σp.
Измерение заряда, проведенное методом динамического конденсатора, показало наличие заряда 280 нКл/м2.
Высокий поверхностный потенциал составляет 55 В, а низкий 22 В, соотношение площадей с высоким и низким потенциалом составляет 0,51.
Результаты измерения параметров полученных НСП и исследования антимикробной активности, представленные в таблице 1 и на графике (фиг.1) зависимости снижения инокуляционной дозы от шероховатости поверхности НСП, показывают наличие биоцидной активности только при определенных параметрах НСП и отсутствие ее в контрольном образце, что свидетельствует о влиянии режимов обработки и толщины наносимой углеродной пленки на состояние биологической активности полученного материала. При этом имеет место пороговая зависимость снижения инокуляционной дозы от параметров НСП на ПЭТФ, в частности от величины среднеквадратичной шероховатости поверхности. Из представленных данных можно сделать вывод о возможности управления биологической активностью материалов, а именно антимикробной активностью, путем изменения степени дисперсности поверхности материала.
Пример 2. Обработку поверхности ПЭТФ и нанесение пленки углерода производят аналогично описанному в примере 1, но ионную обработки поверхности в воздушной смесью проводят в течение 10 мин.
Исследование параметров рельефа методом АСМ, распределение поверхностного потенциала методом АСМ и определение удельной поверхностной энергии и ее полярного и дисперсионного компонентов проводились по методикам, описанным в примере 1.
Параметры полученных НСП и результаты исследования антимикробной активности, представленные в таблице 2, наглядно свидетельствуют, что степень дисперсности НСП и условия ее модификации определяют ее антимикробную активность. Следовательно, управляя условиями формирования НСП на поверхности биосовместимых полимерных материалов, создается возможность селективно воздействовать на различные виды микроорганизмов (грамположительных и грамотрицательных).
Пример 3. Обработку поверхности ПЭТФ и нанесение пленки углерода производят аналогично способу, описанному в примере 1, но для ионной обработки поверхности используют в качестве рабочего газа тетрафтометан (CF4), который с помощью натекателя впускают в ионный источник до давления 10-1 Па. Обработку ионным потоком проводят в течение 10 минут.
Исследование параметров рельефа методом АСМ, распределение поверхностного потенциала методом АСМ и определение удельной поверхностной энергии и ее полярного и дисперсионного компонентов проводились по методикам, описанным в примере 1.
Параметры полученных НСП и результаты исследования антимикробной активности, представленные в таблице 3, демонстрируют зависимость состояния биологической активности от состава рабочего газа для ионной обработки поверхности и свойств НСП.
Пример 4. Обработку поверхности ПЭТФ и нанесение пленки углерода производят аналогично способу, описанному в примере 1, но для ионной обработки поверхности используют смесь аргона с кислородом в соотношении 1:1.
Измерение распределения поверхностного потенциала методом АСМ показало, что максимальный потенциал составлял 75 В, а минимальный 25 В. Соотношение потенциалов составляло 3,0, а соотношение площадей с высоким и низким потенциалом составляет 0,5.
Параметры полученных НСП представлены в таблице 4.