Способ коррекции структурных перестроек сосудов в эксперименте
Иллюстрации
Показать всеПредлагаемое изобретение относится к экспериментальной медицине, а именно к кардиологии может быть использовано в экспериментальной биологии и медицине для коррекции структурных перестроек сосудистой стенки в постреперфузионном периоде. Для коррекции структурных перестроек магистральных сосудов в эксперименте используют мексидол, который вводят после реанимации внутривенно в течение первого часа дробно через каждые 20 минут в дозе 25 мг/кг. Изобретение позволяет расширить арсенал действующих средств для коррекции и предупреждения реперфузионных осложнений магистральных сосудов и уменьшить объем соединительно-тканных элементов в сосудистых стенках. 2 табл. 7 ил.
Реферат
Изобретение относится к лекарствам и медикаментам для терапевтических целей и может быть использовано в экспериментальной биологии и медицине для коррекции структурных перестроек сосудистой стенки в постреперфузионном периоде.
Процесс последовательных компенсаторно-приспособительных +труктурных перестроек тканей определяется термином «ремоделирование». Ремоделирование сосудистой стенки включает трансформацию структуры с миграцией, пролиферацией и трансформацией ГМК, макрофагов, фибробластов, разрастанием элементов соединительной ткани. Результатом изменений является утолщение стенки, увеличение жесткости, а также инициация или значительное ускорение механизмов атеросклероза.
Пусковым моментом, инициирующим цепь адаптационных реакций в сосудистой стенке при разных воздействиях, является повреждение эндотелия. Эндотелий - это активный барьер, весьма интенсивно участвующий в поддержании тонуса и структуры сосудов, локального гомеостаза и пролиферации клеток сосудистой стенки (Dzau V., Bernstein К.., Celermaier D. et al. The relevance of tissue angiotensin-converting enzyme: manifestations in mechanistic and endpoint data // Am J Cardiol. - 2001. - №88. - P.1-20. Эндотелиальные клетки испытывают постоянное воздействие со стороны кровотока, тромбоцитарных факторов, нейрогормонов.
В последние годы выделяются и активно изучаются реперфузионные изменения, развивающиеся в сосудистом бассейне после тотальной ишемии (Петрищев Н.Н., Власов Т.Д. Функциональное состояние эндотелия при ишемии-реперфузии (обзор литературы) // Российский физиологический журнал имени И.М.Сеченова. - 2000. - №2. - С.148-163).
Это определяет актуальность проблемы и ее значимость, так как в настоящее время доказано, что реперфузия после гипоксии или ишемии часто лишь усугубляет первичную гипоксию (Долгих В.Т., Русаков В.В., Корпачева О.В., Мордык А.В. Ведущие патогенетические факторы постреанимационной кардиодепрессии // Теоретические и клинические проблемы современной реаниматологии. Материалы междунар. симпоз., посвящ. 90-летию акад. В.А.Неговского. - М., 1999. - С.56).
Повреждение сосудистой стенки при ишемии и последующей реперфузии, вероятно, ведет к нарушению баланса внутриклеточных регуляторных систем, запуску этапов ремоделирования. Взаимное усиление действия ишемического/реперфузионного фактора с факторами развития атеросклероза или механического повреждения сосудистой стенки может приводить к многократному ускорению развития ремоделирования (Фитилева Е.Б., Серов Р.А., Юрпольская Л.А. Роль реперфузионного синдрома в механизме развития рестенозов // Ангиология и сосудистая хирургия. - 1998. - №3-4. - С.18-22), увеличению механической "жесткости" и выраженному нарушению функций стенки магистральных артерий (London C.M., Guerin A.P., Marchais S.J. et al. Cardiac and arterial interactions in end-stage renal disease // Kidney Int. - 1996 - Vol.50. - P.600-608).
Одним из важнейших аспектов предупреждения реперфузионных осложнений, является разработка мероприятий, связанных с коррекцией постреперфузионных перестроек в сосудистой стенке.
В имеющемся на сегодняшний день арсенале фармакологических средств, применяемых для коррекции или предупреждения развития ремоделирования сосудов, преобладают препараты, направленные на устранение эндотелиальной дисфункции. Под дисфункцией эндотелия понимают дисбаланс между выделяющимися эндотелием медиаторами, обеспечивающими в норме оптимальное течение всех эндотелийзависимых процессов. Нарушение продукции и действия эндотелиальных вазоактивных факторов наблюдаются одновременно с аномальной сосудистой реактивностью, изменениями в структуре и росте сосудов, которым сопутствуют сосудистые заболевания.
Лекарственные препараты, потенциально способные воздействовать на функцию эндотелия, можно разделить на 4 основные категории:
- замещающие естественные протективные эндотелиальные субстанции (стабильные аналоги PGI2, нитровазодилататоры, r-tPA);
- ингибиторы или антагонисты эндотелиальных констрикторных факторов (ингибиторы ангиотензинпревращающего фермента (АПФ), антагонисты ангиотензин II-рецепторов, ингибиторы ТхА2-синтетазы и антагонисты ТхФ2-рецепторов);
- цитопротективные вещества: свободнорадикальные скавенгеры супероксиддисмутазы и пробукол, лазароидный ингибитор продукции свободных радикалов;
- гиполипидемические препараты.
1. Замещающие естественные протективные эндотелиальные субстанции.
В настоящее время жизненно важными для кардиологических больных являются три органических нитрата: нитроглицерин; изосорбида динитрат; изосорбида 5-мононитрат.
Внутри гладкомышечной клетки сосуда, в том числе коронарной артерии, нитраты, поступающие в организм, взаимодействуют с SH-группами (нитратными рецепторами), образуя оксид азота (NO), который структурно соответствует физиологическому эндотелиальному расслабляющему (релаксирующему) фактору. У больных ИБС продукция эндотелиального расслабляющего фактора (NO) коронарными и другими артериями значительно снижена, нитраты восполняют этот недостаток.
Таким образом, нитраты устраняют коронароспазм, расширяют коронарные артерии, улучшают коронарный коллатеральный кровоток.
Однако применение данных препаратов имеет ряд побочных эффектов:
- умеренно выраженные: несильная головная боль (обусловлена вазодилатацией и затруднением оттока венозной крови из головного мозга), ощущение распирания в голове, шум в ушах, покраснение лица, тахикардия, жжение под языком;
- значительно выраженные: сильная головная боль, головокружение, значительная артериальная гипотензия.
2. Ингибиторы ангиотензинпревращающего фермента (АПФ).
Среди известных ингибиторов АПФ наибольшее сродство к тканевой ренин-ангиотензин альдостероновой системы (РААС) имеет квинаприлат (активный метаболит квинаприла), который по показателю тканевой аффинности в 2 раза превосходит периндоприлат, в 3 раза - рамиприлат и в 15 раз - эналаприлат. Положительный эффект квинаприла на дисфункцию эндотелия связан не только с модулирующим его влиянием на метаболизм брадикинина и улучшением функции В2-рецепторов, но также со способностью этого препарата восстанавливать нормальную деятельность мускариновых (М) рецепторов эндотелия, что приводит к опосредованной дилатации артерий за счет рецепторзависимого увеличения синтеза эндотелиального фактора релаксации (ЭФР-NO). В настоящее время существуют доказательства того, что квинаприл оказывает прямое модулирующее влияние на синтез ЭФР-NO (Белоусов Ю.В., Григорьев В.Ю., Мирошенков П.В., Карпов О.И. Клинико-экономическая оценка применения квинаприла // Качественная Клиническая Практика. - 2004. - №1. - С.46-56).
Таким образом, прием ингибиторов АПФ нивелирует вазоконстрикторные эффекты, предотвращает или замедляет ремоделирование стенок сосудов, сердца.
Однако кроме положительного эффекта, были выявлены существенные недостатки применения ингибиторов АПФ:
- отсутствие параллелизма между концентрацией и выраженностью клинического эффекта;
- повышение концентрации альдостерона в процессе долгосрочной терапии;
- отрицательное действие на центральную нервную систему и увеличение активности натрийуретического фактора (Сидоренко Б.А., Преображенский Д.В. Новое в лечении сердечно-сосудистых заболеваний и тромбозов. Кардиология. 1999. №4. С.86-96).
3. Гиполипидемические препараты.
В настоящее время наиболее популярна теория, в соответствии с которой атеросклероз рассматривается как реакция на повреждение сосудистой стенки (прежде всего - эндотелия). В качестве наиболее важного повреждающего фактора выступает гиперхолестеринемия.
Так статины, оказывая гиполипидемическое действие, обладают прямым противосклеротическим эффектом: было обнаружено, что флувастатин и симвастатин уменьшали пролиферацию миоцитов, а симвастатин, кроме того, еще и миграцию гладкомышечных клеток в интиму сосудов, причем это действие не зависело от величины гиполипидемического эффекта. Статины воздействуют и на иммунные механизмы атерогенеза (в частности, на метаболизм макрофагов).
Недостаток данных препаратов заключается в том, что применяют их уже после возникающих изменений в сосудистой стенке.
4. Антиоксиданты.
Одним из наиболее известных антиоксидантов является витамин Е - альфа-токоферол. Проведен целый ряд исследований, в которых продемонстрировано, что витамин Е в дозе 400-800-1000 ME в день (100 ME соответствует 100 мг токоферола) снижает чувствительность ЛПНП к окислению и защищает от развития эндотелиальной дисфункции и прогрессирования атеросклероза - ИБС (Nunes G.L., Robinson К, Kalynych A, King S.B. III, Sgoutas D.S., Berk B.C. Vitamins С and E inhibit Ch - production in the pig coronary artery // Circulation. - 1997. - Vol.96. - P.3593-3601).
Особо следует выделить антиоксидантные свойства пробукола. В крови он связывается с липопротеидами, в том числе с ЛПНП, защищая их от перекисной модификации, чем снижает риск развития атеросклероза (Sasahara M, Raines E.W., Chait A, et al. Inhibition of hypercholesterolemia-induced atherosclerosis in the nonhuman primate by probucol. I. Is the extent of atherosclerosis related to resistance of LDL to oxidation? // J Clin Invest. - 1994. - Vol.94. - P.155-164).
Таким образом, данные препараты применяют уже после возникающих изменений в сосудистой стенке и дальнейшей коррекции их.
К тому же вышеперечисленные фармакологические средства имеют следующие недостатки:
- отсутствие параллелизма между концентрацией и выраженностью клинического эффекта;
- повышение концентрации альдостерона в процессе долгосрочной терапии;
- отрицательное действие на центральную нервную систему и увеличение активности натрийуретического фактора;
- умеренно выраженные: несильная головная боль (обусловлена вазодилатацией и затруднением оттока венозной крови из головного мозга), ощущение распирания в голове, шум в ушах, покраснение лица, тахикардия, жжение под языком;
- значительно выраженные: сильная головная боль, головокружение, значительная артериальная гипотензия.
Задачей предлагаемого изобретения является расширение арсенала действующих средств для коррекции и предупреждения реперфузионных осложнений магистральных сосудов и уменьшение объема соединительно-тканных элементов в сосудистых стенках.
Поставленная задача решается тем, что в известном способе коррекции структурных перестроек сосудов в эксперименте, включающем введение лекарственных препаратов, в качестве средства для коррекции структурных перестроек магистральных сосудов используют мексидол, который вводят после реанимации внутривенно в течение первого часа дробно через каждые 20 минут в дозе 25 мг/кг.
Предлагаемое изобретение отвечает критериям изобретения «новизна» и «изобретательский уровень», так как проведенные патентно-информационные исследования не выявили источников научно-технической и патентной информации, которая порочила бы новизну предлагаемого способа. Исследование показали отсутствие технических решений с существенными признаками предлагаемого способа.
В настоящее время сосудистое ремоделирование - это морфологический эквивалент патогенеза различных заболеваний и патологических состояний - гипертензии, атеросклероза, тромбоза, рестеноза. Именно поэтому является актуальной и остается одной из важнейших в медицине проблема коррекции морфологических перестроек в сосудистой стенке.
На данный момент при длительной гипертензии коррекция ремоделирования направлена на устранение эндотелиальной дисфункции, так как выяснено, что пусковым механизмом ремоделирования является повреждение эндотелия за счет увеличения напряжения сдвига.
Мексидол (сукцинат-2-этил-3-метил-3-оксипиридин) - белый или белый с кремоватым оттенком кристаллический порошок. Легко растворим в воде. По химической структуре мексидол является соответствующей эмоксипину солью янтарной кислоты (сукцинатом) (Михайлов И.Б. Клиническая фармакология. СПб.: Фолиант, 2000. - 525 с.).
Мексидол сочетает антиоксидантные свойства основания (производное 3-оксипиридина) с антигипоксической активностью сукцината (Bergeron M., Ferriero D.M., Vreman H.J. Hypoxia-ischemia, but not hypoxia alone, induces the expression of heme oxygenase-1 (HSP32) in new born rat brain // Cerebral blood flow and metabolism. - 1997. - Vol.17. - №36. - P.647-658). Применение органических производных сукцината способствует более хорошему проникновению его через биологические мембраны. При этом после поступления вещества в клетку происходит его диссоциация или отщепление молекулы сукцината, которая используется непосредственно дыхательной цепью в качестве энергетического субстрата. При этом усиливается сукцинатоксидазный путь (Головачева Т.В., Дудаева Н.Г., Павлюк А.В., Долгова М.А. Применение мексидола в комбинированной терапии с традиционными антигипертензивными средствами у больных артериальной гипертензией с признаками хронической церебрально-сосудистой недостаточности // Пат. физиолол. - 2003. - №4. - С.11-13).
Мексидол назначают внутримышечно или внутривенно. Оксиметилэтилпиридина сукцинат быстро распределяется по органам и тканям. Определяется в плазме крови на протяжении 4-9 ч. Метаболизируется в печени путем глюкуронирования с образованием фосфат-3-оксипиридина, глюкуронконъюгатов. Быстро выводится с мочой, в основном в виде метаболитов и в незначительном количестве - в неизменном виде (Пашина И.В. Исследование действия нитроглицерина на ишемизированный миокард при совместном применении с мексидолом: Автореф. дисс.... канд. мед. наук. Курск, 1997. - 45 с.).
Лекарственный препарат мексидол эффективно применяется в различных областях клинической медицины: неврологии, психиатрии, кардиологии, офтальмологии, хирургии, стоматологии, эндокринологии и др. Препарат может быть использован как с целью быстрого достижения терапевтического эффекта, так и с целью снижения частоты побочных реакций и сокращения сроков пребывания в стационаре (Абрамченко В.В. Антиоксиданты и антигипоксанты в акушерстве (оксидативный стресс в акушерстве и его терапия антиоксидантами и антигипоксантами). - С-Пб., 2001. - 400 с.).
Мексидол обеспечивает гораздо более мощные антиоксидантные и антигипоксические свойства среди других препаратов. Сочетая в себе все положительные эффекты влияния на обменные процессы и кровоснабжение, мексидол заслуживает внимания еще и благодаря хорошей переносимости, а также минимуму противопоказаний и побочных эффектов (Утешев Д.Б. Мексидол как антиоксидант // Экспериментальная и клиническая фармакология. - 1997. - №2. - С.83-88).
В то же время, в литературе отсутствуют данные о применении фармакологических средств для предупреждения или коррекции ремоделирования магистральных сосудов в условиях, связанных с кратковременным воздействием таких патологических факторов, как ишемия и реперфузия.
Для подтверждения положительного эффекта проведены эксперименты на 60 половозрелых (5 месяцев) белых нелинейных крысах - самцах массой 200-250 г, содержащиеся на стандартном рационе вивария.
В экспериментах использовалась модель тотальной ишемии путем пережатия сердечно-сосудистого пучка в течение 10 мин по Корпачеву В.Г. с последующими традиционными реанимационными мероприятиями и восстановлением сердечной деятельности, кровообращения и дыхания (Корпачев В.Г., Лысенков С.П., Тель Л.З. Моделирование клинической смерти и постреанимационной болезни у крыс // Патол. физиология и эксперим. терапия. - 1982. - №3. - С.78-80).
Мексидол вводили после реанимации внутривенно в течение первого часа дробно (через каждые 20 минут) в дозе 25 мг/кг.
Все животные были разделены на 3 группы:
1 группа - интактные,
2 группа - постреперфузионный период 60 суток (контроль),
3 группа - введение мексидола после реанимации, постреперфузионный период 60 суток.
Биохимический, гистологический и электронно-микроскопический анализ ткани магистральных сосудов и определение биохемилюминесценции крови проводили на 60 сутки после тотальной ишемии.
Для морфологических исследований участки сосудов забирались по принятой схеме. Фрагменты сосудов не более 1 мм фиксировались в нейтральном формалине и глутаровом альдегиде и обезвоживались в спиртах. Приготовленные на микротоме и ультратоме срезы окрашивались гематоксилином и эозином, по Ван-Гизону, фукселином по Вейгерту (Микроскопическая техника / Под ред. Д.С.Саркисова, Ю.Л.Петрова. - М.: Медицина, 19967. - 544 с.) и уранилацетатом и цитратом свинца по методу Reynolds (Reynolds E.S / The use of lead citrate at high pH as an electronopaque stain in electron microscopy / J.Cell.BioL - 1963. - Vol.l7. - P.208-212). Гистологические препараты изучали с помощью светового микроскопа Leica DMLS, ультратонкие срезы просматривали в электронном микроскопе Morgagni 268D фирмы FEI.
Для определения интенсивности свободно-радикального окисления (СРО) и антиоксидантной активности (АОА) плазмы крови, использовалось измерение хемилюминесценции (ХЛ) на биохемилюминометре БХЛ-06 (Владимиров Ю.А., Шерстнев М.П. Хемилюминесценция клеток животных // Биофизика. - 1989. - Т.24. - С.176).
Анализ содержания малонового диальдегида в тканях сосудов проводился по реакции с тиобарбитуровой кислотой (ТБК) (Ланкин В.З, Герасимова Е.Н., Касаткин Л.Б. Перекиси липидов и атеросклероз. Ферментативная детоксикация перекисей липидов в крови больных ишемической болезнью сердца, обусловленной атеросклерозом коронарных артерий. // Кардиология. - 1979. - №6. - С.71-75).
Статистическую обработку полученных данных проводили на ПК с помощью пакетов прикладных программ Statistica 5.5 для Windows 98. Парные внутригрупповые и межгрупповые сравнения средних определяли по критериям Уилкоксона, Манна-Уитни. Различия считали достоверными при уровне значимости p<0,05.
Проведение исследований максимальной интенсивности свечения плазмы крови (по данным биохемилюминесценции) в отдаленном постреперфузионном периоде (60 суток) выявило достоверное увеличение свободнорадикальной активности плазмы в 2,14 раза в контроле относительно уровня интактных животных и снижение общей антиоксидантной активности (АОА) плазмы по показателю светосуммы биохемилюминесценции в 2,04 раза (табл.1).
При введении мексидола выявлено достоверное увеличение общей АОА плазмы в 1,74 раза в отдаленном постреперфузионном периоде. Сравнение с интактными животными показало, что мексидол приблизил значения активности про- и антиоксидантной системы плазмы к норме.
Содержание вторичного продукта перекисного окисления липидов МДА в ткани артериальных сосудов в контроле было достоверно выше уровня интактных животных в 4,4 раза. При введении мексидола концентрация МДА снизилась относительно контрольной серии в 2,17 раза, что соответствовало уровню интактных животных (табл.1).
| Таблица 1Влияние мексидола на показатели биохемилюминесценции плазмы крови и содержание МДА в ткани артериальных сосудов в отдаленном постреперфузионном периоде (М±m) | |||
| Группы животных | Imax, mV | S, mV | МДА, нМоль/г ткани |
| Интактные | 1,89±0,18 | 19,48±1,64 | 1,66±0,212 |
| Контроль | 4,05±0,25* | 39,75±1,71* | 5,63±0,14* |
| Мексидол | 2,67±0,24** | 22,91±1,85** | 2,59±0,32** |
| Примечание: * - достоверность различий с интактным уровнем, р<0,05 ** - достоверность различий с контролем, p<0,05 |
Таким образом, на 60 сутки постреперфузионного периода наблюдалось увеличение уровня свободнорадикального окисления в плазме крови на фоне сниженной мощности антиоксидантных систем по данным биохемилюминесценции плазмы крови. Зафиксированная в ткани артериальных сосудов в данном периоде повышенная активность перекисного окисления липидов, о чем свидетельствовал высокий уровень МДА, говорит о нарушенных процессах обмена липидов даже через два месяца после кратковременной тотальной ишемии и реперфузии.
Наши исследования показали, что мексидол, вводимый сразу же после реанимации, достоверно снижал показатели максимальной интенсивности свечения и светосуммы БХЛ практически до уровня интактных животных в отдаленном периоде на 60 сутки. Результаты свидетельствуют об том, что применяемые концентрации мексидола были эффективными и безопасными в плане предупреждения нарушения баланса про- и антиоксидантных систем в отдаленном постреперфузионном периоде.
Нами было установлено, что введение мексидола после реанимации предупреждает увеличение в отдаленном постреперфузионном периоде концентрации МДА в ткани артериальных сосудов крыс. Это подтверждает сведения о способности препарата тормозить процессы ПОЛ и повышать резистентность клеточных мембран.
Таким образом, мексидол существенно корректирует метаболизм ткани артериальных сосудов и плазмы крови крыс в условиях реперфузии, что предупреждает нарушение баланса про- и антиоксидантной активности организма и, в частности, ткани магистральных сосудов, в отдаленном постреперфузионном периоде. Положительные эффекты препарата связаны с ингибированием свободнорадикальных процессов при активации антиоксидантной ферментативной системы.
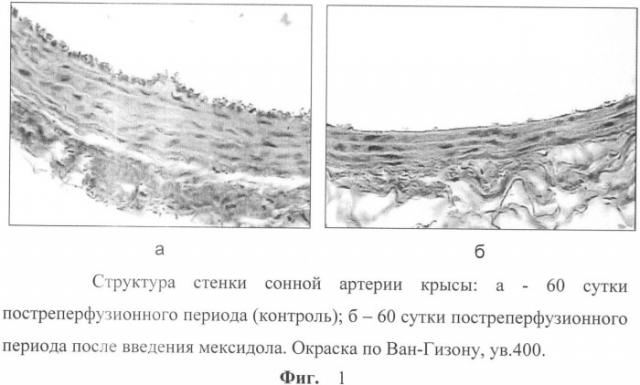
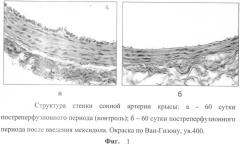
Микроскопическое изучение влияния мексидола на структуру аорты, сонной и бедренной артерий в отдаленном постреперфузионном периоде на 60 сут выявило ряд морфологических особенностей (Фиг.1б).
Было зафиксировано уменьшение выраженности соединительнотканных структур в структуре медии и в подэндотелиальном слое. В отличие от контрольной серии в серии с введением мексидола не было выявлено образование волокнистыми структурами единой сети по всей толще сосуда от интимы до адвентиции. Также не было отмечено нарушения четкой строго послойной структуры расположения волокон во всех магистральных сосудах, отсутствовали дополнительные соединительные пучки коллагеновых волокон. Это дало повод предположить о наличии свойств у мексидола, предупреждающих развитие процесса активного ремоделирования сосуда в отдаленном постреперфузионном периоде за счет разрастания соединительной ткани в толще артерий.
1. Ультраструктура интимы сосудистой стенки.
Изменение интимы аорты, сонной и бедренной артерий как в контрольной, так и в серии с введением мексидола показало схожие результаты: восстановление значительной части эндотелиального пласта и некоторая мозаичность клеточных элементов. Следует отметить, что восстановление структуры эндотелиального пласта бедренной артерии происходила медленнее ввиду, видимо, максимального повреждения во время реперфузии.
2. Люминальная поверхность и состояние межклеточных контактов
Микроворсины и микровыросты были отмечены на всей поверхности эндотелия в обычном количестве. Межклеточные контакты эндотелия были достаточно плотными, местами умеренно расширенными. На внутренней поверхности некоторых ЭК отмечены выпячивания цитоплазмы в просвет сосуда.
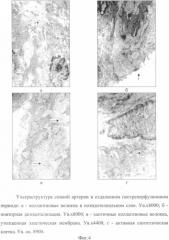
В группе с мексидолом, в отличие от контроля, не встречались элементы повторной деэндотелизации (Фиг.4б; 6г).
3. Структура эндотелиальных клеток
Цитоплазма. Большая часть ЭК в контроле и при введении мексидола имели плотную цитоплазму. Пиноцитозные везикулы в большом количестве присутствовали в большей части клеток у люминальной и базальной сторон. В отличие от контроля, в серии с мексидолом отсутствовали клетки с вакуолями, что можно объяснить более полноценным восстановлением этих клеток.
4. Энергетический аппарат.
Митохондрии обеих серий мало отличались по размерам и структуре от митохондрий интактных клеток. Матрикс в большинстве митохондрий плотный, просветления отмечены крайне редко.
5. Синтетический аппарат активен в большинстве ЭК обеих серий.
В некоторых молодых клетках отмечена интенсификация и синтетических процессов и секреторной функции - у плазматической мембраны элементы экзоцитоза с электронно-плотным содержимым. Несколько увеличенное количество рибосом и полисом, ЭПС умеренно расширена.
6. Ядерный аппарат
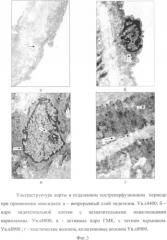
Ядра большинства ЭК в обеих сериях нормальной вытянутой формы. Площадь ядер обычная, в некоторых фрагментация и инвагинация клеток (Фиг.3б). Перинуклеарное пространство и ядерные поры расширены в клетках со значительным усилением синтетической активности.
Подэндотелиальный слой
В группе с введением мексидола объем подэндотелиального слоя за счет волокон и аморфного вещества менее выражен, по сравнению с контролем (Фиг.2б; 4а). Внутренняя эластическая мембрана более равномерная, без утолщений и дополнительных отростков (Фиг.5б). В серии с мексидолом отсутствуют в подэндотелии миофибробласты и мигрировавшие из кровотока лейкоцитарные клетки.
Ультраструктура медии сосудистой стенки.
В отличие от контроля, в группе с введением мексидола на 60 сутки постреперфузионного периода в медии аорты, сонной и бедренной артерий не отмечалось значительного увеличения числа синтетических клеток и объема волокнистых структур соединительной ткани, что являлось ключевым звеном сосудистого ремоделирования в контроле.
В обеих группах в медии сосудов идентифицировались следующие клеточные элементы - синтетические ГМК отросчатой формы, сократительные ГМК веретенообразной формы, единичные фибробласты. Отростчатые ГМК чаще были отмечены в части медии, примыкающей к интиме. Распространение отростков в сторону эндотелиоцитов шло через места разрывов фрагментированной внутренней эластической мембраны. Реже встречались отросчатые углубления части цитоплазмы эндотелиоцитов в сторону гладкомышечных клеток. Часто сократительные ГМК имели признаки гладкомышечной клетки - миофиламенты, овальное ядро и признаки фибробласта - отросчатая форма, диффузные пузырьки в цитоплазме. Такие клетки идентифицировались как миофибробласты и преобладали в контрольной серии по сравнению с серией с применением мексидола. Также, отмечены единичные пролиферирующие клетки, идентифицируемые как фибробласты с редукцией миофиламентов. Секретирующие фибробласты в контроле обнаруживались в сонной артерии несколько чаще, чем в аорте. Чаще, чем в аорте, идентифицировались миофибробласты. Клетки с наличием миелиновых фигур в серии с введением мексидола, в отличие от контроля, встречались крайне редко.
Структура гладких миоцитов
Цитоплазма. Структура цитоплазмы ГМК в отдаленном реперфузионном периоде была плотной, без признаков гидратации (Фиг.2г). Плотность цитоплазмы в отросчатых клетках синтетического типа была выше, чем в сократительных. Цитоплазматические пузырьки располагались по-разному в клетках разного типа. В клетках сократительного типа большое количество пузырьков было распределено по внутренней поверхности цитоплазматической мембраны и меньше в цитоплазме. В синтетических ГМК пузырьки располагались диффузно в цитоплазме и около ЭПС, с минимальной концентрацией около цитоплазматической мембраны. Также в цитоплазме разных клеток было разное количество миофиламентов. В сократительных веретенообразных клетках было максимальное количество миофиламентов, обычное для клеток данного типа. В отросчатых синтетических клетках число данных структур было меньшим, и в единичных фибробластах они отсутствовали. В группе с введением мексидола крайне редко встречались единичные темные дегенеративные формы ГМК, содержащие вакуоли с наличием миелиновых фигур.
Энергетический аппарат. Митохондрии гладкомышечных клеток в обеих сериях были разного размера, преимущественно с четкими кристами. В отросчатых ГМК часть митохондрий гиперплазированы, в единичных немного набухшие. Площадь митохондрий и крист близка к нормальной Матрикс плотный и структурный (Фиг.5г).
Синтетический аппарат. Ключевое отличие ГМК разного типа - синтетическая функция была выражена по-разному в клетках синтетического и сократительного типов. Синтезирующие фибробласты, отросчатые ГМК и клетки переходной формы - миофибробласты имели увеличенное по сравнению с сократительными ГМК количество свободных и прикрепленных рибосом и полирибосом с прилегающими цепями волокон. В отличие от контрольной серии гладкий и шероховатый ЭПС был менее расширен и увеличен. Синтез волокон отмечен на всех этажах, часть эластических и коллагеновых волокон в промежуточной стадии сборки находилась на выходе из расширенного ЭПС (Фиг.2б, в, г; 4а, в, г; 6б). Наиболее активный синтез волокон в клетках, по морфологии занимающих переходное состояние между ГМК и фибробластами, был отмечен в контроле, но не в группе с введением мексидола.
Ядерный аппарат. В синтетических ГМК были активные ядра, содержащие четкие ядрышки, уплотненную кариоплазму, увеличение маргинального хроматина. Форма ядер неправильная, некоторые ядра инвагинированы. Ядерные поры открыты, перинуклеарное пространство умеренно расширенно. В сократительных клетках ядра округлой продолговатой формы с плотной кариоплазмой. Ядерные поры открыты в меньшей степени (Фиг.3в; 7а). В серии с введением мексидола, в отличие от контроля, не встречались клетки с увеличенными гиперхромными ядрами и расширенным перинукеарным пространством, маргинацией хроматина, с вакуолями и миелиновыми фигурами в цитоплазме (Фиг.6б).
Структура межклеточного вещества
В контроле процесс ремоделирования проявлялся в резкой активации синтетической функции ГМК и фибробластов и синтезе ими элементов соединительной ткани с развитием фиброза стенки сосуда.
В аорте отмечено утолщение и неравномерность эластических мембран, имеющих нечеткие границы. В их толще присутствовали фибробласты, плотно окруженные коллагеновыми волокнами, - как бы погружены в соединительную ткань. Межклеточное вещество аорты было представлено хаотичными коллагеновыми и эластическими волокнами, по количеству превосходящими основное вещество. В толще медии волокна распределялись практически равномерно, с некоторым превалированием волокнистых структур во внутренних слоях. За счет большого количества соединительной ткани миоциты казались разрозненными (Фиг.2).
В состоянии межклеточного вещества медии сонной артерии в контрольной серии также отмечено закономерное увеличение объема волокнистого компонента (Фиг.4).
В бедренной артерии в отдаленном постреперфузионном периоде, учитывая мышечный тип строения данного сосуда и минимальное, по сравнению с аортой и сонной артерией, количество соединительно-тканных элементов в структуре стенки, увеличение количества соединительной ткани в контрольной серии было максимально заметным. Зафиксированы синтетические ГМК отросчатой формы и сократительные ГМК веретенообразной формы. Классические фибробласты не обнаруживались, а были отмечены переходные формы - клетки отросчатой формы без миофиламентов с инвагинированный ядром и развитым синтетическим аппаратом. По направлению к адвентиции количество волокон несколько уменьшалось.
В группе с применением мексидола в структуре магистральных сосудов количество волокон не превосходило количество основного вещества.
Таким образом, в сериях с мексидолом в аорте, сонной и бедренной артериях на 60 сутки постреперфузионного периода по сравнению с контрольной серией явления сосудистого ремоделирования менее выражены: снижен синтез и, как следствие, объем волокнистых структур соединительной ткани. Следовательно, положительный эффект мексидола заключается в предупреждении образования соединительно-тканных элементов в сосудистых стенках.
Предлагаемый способ осуществляют следующим образом.
Крысу наркотизируют внутрибрюшинным введением нембутала в дозе 25 мг/кг с целью интубации трахеи полиэтиленовым катетером. Тотальную ишемию производят путем полного пережатия сосудистого пучка сердца внутриторакально без вскрытия грудной клетки и без пневмоторакса специальным Г-образным крючком, изготовленным из иглы для инъекций. Крючок вводят в средостение на уровне третьего межреберья справа по парастернальной линии после предварительного прокола кожи, межреберных мышц и париетальной плевры острым концом прижимающей части крючка. Затем держатель поворачивают в положение, перпендикулярное оси позвоночника. Во время этой манипуляции изгиб крючка заходил в плевральную полость. Далее крючок опускают вниз к позвоночнику до легкого упора и производят поворот держателя против часовой стрелки на 100-110°, а прижимающую часть зажима подводят под сосудистый пучок сердца. На следующем этапе крючок поднимают перпендикулярно вверх, прижимая нижнюю полую и безымянные вены, легочную артерию и аорту к грудине. Грудину от смещения вверх удерживают пальцем. Трахея при этом не пережимается, а кровообращение полностью прекращается - это начало тотальной ишемии. Через 3 мин 30 с - 4 мин крючок извлекают из грудной клетки в обратной последовательности, а животное продолжает находиться в таком состоянии до начала реанимации в течение 10 минут с момента включения секундомера.
Реанимацию проводят с помощью наружного массажа сердца и искусственной вентиляции легких. Перед началом реанимации эндотрахеально вводят 0,1 мл 0,1% раствора адреналина. Наружный массаж сердца осуществляют ударами указательного и среднего пальцев по грудине на уровне четвертого межреберья с частотой 200 ударов в минуту. Искусственную вентиляцию легких осуществляют подключением к эндотрахеальному катетеру аппарата искусственного дыхания по открытому контуру с частотой 60 в минуту. Эффективность реанимационных мероприятий отслеживают посредством мониторирования ЭКГ во II стандартном отведении.
Мексидол вводят однократно внутрибрюшинно в течение первого часа (дробно через каждые 20 минут) после реанимации в дозе 25 мг/кг.
Конкретный пример дан в виде выписки из эксперимента
Взяли половозрелую (5 месяцев) белую нелинейную крысу - самца массой 249 г, содержащегося на стандартном рационе вивария.
Тотальную ишемию моделировали путем пережатия сердечно-сосудистого пучка в течение 10 мин по Корпачеву В.Г. с последующими традиционными реанимационными мероприятиями и восстановлением сердечной деятельности, кровообращения и дыхания (Корпачев В.Г., Лысенков С.П., Тель Л.З. Моделирование клинической смерти и постреанимационной болезни у крыс // Патол. физиология и эксперим. терапия. - 1982. - №3. - С.78-80).
Мексидол вводили после реанимации внутривенно в течение первого часа дробно (через каждые 20 минут) в дозе 25 мг/кг.
Биохимический, гистологический и электронно-микроскопический анализ ткани магистральных сосудов и определение биохемилюминесценции крови проводили на 60 сутки после тотальной ишемии.
Для морфологических исследований участки сосудов забирались по принятой схеме. Фрагменты сосудов не более 1 мм. фиксировались в нейтральном формалине и глутаровом альдегиде и обезвоживались в спиртах. Приготовленные на микротоме и ультратоме срезы окрашивались гематоксилином и эозином, по Ван-Гизону, фукселином по Вейгерту и уранилацетатом и цитратом свинца по методу Reynolds. Гистологические препараты изучали с помощью светового микроскопа Leica DMLS, ультратонкие срезы просматривали в электронном микроскопе Morgagni 268D фирмы FEI.
Для определения интенсивности свободнорадикального окисления (СРО) и антиоксидантной активности (АОА) плазмы крови использовалось измерение хемилюминесценции (ХЛ) на биохемилюминометре БХЛ-06 (Владимиров Ю.А., Шерстнев М.П. Хемилюминесценция клеток животных // Биофизика. - 1989. - Т.24. - С.176).
Анализ содержания малонового диальдегида в тканях сосудов проводился по реакции с тиобарбитуровой кислотой (ТБК) (Панкин В.З, Герасимова Е.Н., Касаткин Л.Б. Перекиси липидов и атеросклероз. Ферментативная детоксикация перекисей липидов в крови больных ишемической болезнью сердца, обусловленной атеросклерозом коронарных артерий. // Кардиология. - 1979. - №6. - С.71-75).
Показатели биохемилюминесценции плазмы крови и содержание МДА в ткани артериальных сосудов представлены в таблице 2.
| Табл.2. | ||
| Imax, mV | S, mV | МДА, нМоль/г ткани |
| 2,46 | 22,23 | 2,15 |
Гистологические исследования стенки магистральных сосудов: отмечается сохранность эндотелиального слоя, единичные агрегаты, состоящие из клеток крови, уменьшение выраженности соединительнотканных структур в медии и в подэндотелиальном слое (Фиг.1б).
Ультраструктура интимы сосудистой стенки магистральных сосудов.
Межклеточные контакты эндотелия были достаточно плотными, местами умеренно расширенными. ЭК в основном имели плотную цитоплазму. Большинство митохондрий клеток находилось в состоянии физиологической нормы. Матрикс в большинстве митохондрий плотный, просветления отмечены крайне редко. ЭПС умеренно расширена. Ядро богато хроматином. Контуры ядра с неглубокими и