Конъюгаты антрациклин-антитело
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к иммунотерапии. Предложен конъюгат антрациклинового лекарственного средства и антитела, связанные посредством линкера, содержащего дважды замещенное непланарное циклогексановое кольцо. Антитело в составе коньюгата связывается с антигеном CD74, высокоэкспрессированным на В-клеточных лимфомах, меланомах и других опухолях. Коньюгат интернализуется клетками-мишенями и затем вновь экспрессируется на клеточной поверхности. Предложен также способ получения данного коньюгата путем коньюгирования антрациклинового средства с линкером, а затем с тиолвосстановленным моноклональным антителом. Конъюгат может быть введен больным при необходимости проведения иммунотерапии. 2 н. и 9 з.п. ф-лы, 5 ил.
Реферат
Область изобретения
Изобретение относится к терапевтическим конъюгатам, которые могут быть нацелены на различные антигены. Конъюгаты содержат нацеливающий фрагмент и химиотерапевтическое лекарственное средство. Нацеливающий фрагмент и химиотерапевтическое лекарственное средство связываются посредством линкера, содержащего фрагмент, расщепляемый внутри клетки.
Предшествующий уровень техники
В течение многих лет задачей ученых, работающих в области терапии лекарственными средствами, направленными на определенные мишени, являлось использование антител с целью специфической доставки химиотерапевтических лекарственных средств к злокачественным опухолям человека. Осуществление такой задачи может способствовать в конечном счете верному решению проблемы химиотерапии рака. Значительный успех в достижении данной цели был достигнут с появлением в 1975 метода гибридом, авторы Köhler и Milstein, и с последующей возможностью производить моноклональные антитела (mAb). В течение последних 25 лет mAb были получены против многих антигенных мишеней, которые в избытке экспрессируются на раковых клетках. Многие антитела, либо в индивидуальном виде, либо в виде конъюгатов лекарственных средств, токсинов, радионуклидов или других терапевтических агентов прошли предварительные клинические и позже клинические испытания. Вообще применение mAb как таковых, часто называемых «голыми mAb», не привело к достижению нормального состояния в течение продолжительного периода времени у больных с солидными опухолями, хотя увеличение продолжительности жизни было достигнуто в последнее время при лечении посредством mAb против рака молочной железы и рака ободочной кишки (mAb против HER2-neu и 17-1А, соответственно). Лучшие результаты были достигнуты в отношении злокачественных заболеваний крови у больных, которых лечили голыми mAb, в особенности относительно В-клеточной лимфомы (mAb против CD20 и CD22 на поверхности В-клеток).
Однако очевидно, что использование конъюгатов mAb, ассоциированных с опухолью, и подходящих токсических агентов должно быть более эффективным, чем использование голых mAb против наиболее выраженных случаев рака. В этом случае mAb специфически переносит токсический агент к патологической ткани вдобавок к той токсичности, которая может иметь место в силу природных или воссозданных эффекторных функций, обусловленных Fc-белком mAb, таких как связывание комплемента и ADCC (зависимая от антитела цитотоксичность клетки), которые приводят в действие механизмы, результатом которых может быть лизис клетки. Однако возможно, что Fc-белок не требуется для осуществления терапевтического действия, как в случае фрагментов mAb, и другие механизмы, такие как апоптоз, ингибирование ангиогенеза, ингибирование метастатической активности и/или воздействие на адгезию опухолевой клетки могут вступить в действие. Токсический агент является лекарственным средством, наиболее часто применяемым в химиотерапии, излучающим частицы радионуклидом или бактериальны, или растительным токсином. Каждый тип конъюгата имеет свойственные ему отдельные преимущества. Проникающие радионуклиды и бактериальные, и растительные токсины являются очень токсичными, обычно токсичность на порядки величин выше, чем величины токсичности стандартных химиотерапевтических лекарственных средств. Этот факт способствует использованию первого из двух указанных выше агентов с mAb, поскольку в клиническом случае попадание mAb в патологическую ткань является крайне низким. Низкое попадание mAb в опухоль в клинической практике и относительно низкий профиль токсичности химиотерапевтических лекарственных средств, направленных против злокачественных опухолей, вместе взятые представляют собой главную причину того, почему конъюгаты mAb-лекарственное средство до настоящего времени не оказывали воздействия соответственно их перспективным возможностям.
В предварительных клинических работах на моделях ксенотрансплантатов на животных, предназначенных для изучения злокачественных опухолей человека, было описано много конъюгатов с mAb, которые проявляли способность полностью подавлять рост опухолей или даже излечивать животных от их опухолей. Однако поглощение опухолью конъюгатов mAb во многих из этих животных моделей ксенотрансплантатов составляет часто 10-50% инъецируемой дозы на грамм тканевой области, тогда как в клинических условиях поглощение опухолью 0,1-0,0001% инъецируемой дозы на грамм ткани является более нормальным. Неудивительно, что конъюгаты mAb, образованные с более токсичными радионуклидами и токсинами, обычно достигают в некоторой степени лучших результатов клинически, чем соответствующие конъюгаты mAb-лекарственное средство со стандартными химиотерапевтическими лекарственными средствами. Однако конъюгаты радионуклидов и mAb часто могут проявлять большую токсичность из-за наличия большого избытка циркулирующей, распадающейся радиоактивности по сравнению с локализованной в опухоли активностью. Конъюгаты токсина с mAb страдают двумя недостатками - обширным повреждением здоровой ткани и высокой иммунореактивностью по сравнению с растительным или бактериальным белком, который обычно используют. Несмотря на то, что mAb теперь могут быть получены в человеческой или гуманизированной форме (с переносом области, определяющей комплементарность), деиммунизация токсиновой части любого конъюгата, вероятно, останется значительным препятствием на пути к прогрессу.
Несмотря на отсутствие должной эффективности, наблюдаемое до настоящего времени в клинических условиях, конъюгаты mAb-лекарственное средство все еще имеют привлекательные теоретические преимущества. Лекарственное средство как таковое является хорошо изученным в структурном отношении, но находится в изоформах и может связываться с белком mAb посредством очень хорошо установленных для конъюгирования химических характеристик, часто на специфических участках, удаленных от антигенсвязывающих областей mAb. Конъюгаты mAb-лекарственное средство могут быть получены с большей воспроизводимостью, чем химические конъюгаты, содержащие mAb и токсины, и как таковые в большей степени подвергаются развитию в коммерческих целях и регулируемому спросу. По этой причине интерес к конъюгатам mAb с лекарственными средствами остается, несмотря на трудности, с которыми приходится сталкиваться. В некоторых случаях в последнее время результаты предварительно проведенных клинических испытаний оказывались весьма многообещающими. Ввиду продолжающегося прогресса в области химии конъюгирования и в способности устранять или снижать иммуногенные свойства mAb перспектива использования конъюгатов mAb-лекарственное средство вновь рассматривается в плане клинической терапии рака.
Ранее проведенная работа по конъюгатам mAb-лекарственное средство, определяемым в предварительных клинических испытаниях in vitro и in vivo, показала, что часто применяемые для связывания компонентов конъюгатов химические средства приводят к потере активности лекарственного средства. Таким образом, уже много лет назад были получены данные, свидетельствующие о том, что лекарственное средство должно высвобождаться в его первоначальном виде, затем сразу поглощаться клеткой-мишенью посредством компонента mAb, с тем, чтобы оказать полезное терапевтическое действие. Исследования в течение 1980-х и в начале 1990-х годов были сконцентрированы в основном на природе химического линкера между лекарственным средством и mAb. В частности, были созданы конъюгаты с помощью линкеров, расщепляемых слабой кислотой, на основании наблюдения, свидетельствующего о том, что значение рН внутри опухолей часто оказывалось ниже нормальных физиологических значений рН (патенты США No. 4542225; 4569789; 4618492 и 4952394). Указанный подход достиг своей кульминации в поворотной статье Trail et al. (Science 261:212-215 (1993)), в которой описано, что конъюгаты mAb-доксорубицин (DOX), приготовленные с помощью соответствующих линкеров, могут быть использованы в предклинических испытаниях при лечении мышей, несущих ряд ксенотрансплантатов человека. Этот многообещающий результат был достигнут с помощью антитела (названного BR96), а также благодаря большому числу рецепторов на опухолевых клетках-мишенях, конъюгат mAb-лекарственное средство был высокозамещенным (6-8 остатков DOX на единицу mAb) и конъюгат давали в больших дозах на основе повторных введений.
В клинических условиях поглощение mAb опухолью должно быть намного ниже, и поскольку это поглощение в некоторой степени изменчиво и его надо регулировать, то более токсичные лекарственные средства должны быть использованы для достижения терапевтического эффекта. Более токсичные лекарственные средства были использованы при разработке нескольких отдельных конъюгатов mAb-лекарственное средство (патенты США No. 5208020; 5416064; 5877296 и 6015562). Попытки использовать лекарственные средства, такие как производные мейтансиноидов и калихеамицина, которые также являются очень токсичными, были предприняты в стандартной химиотерапии. Конъюгирование с mAb дает возможность направлять на опухоль большие количества лекарственного средства с учетом неспецифического клеточного и белкового связывания, наблюдаемого при химиотерапии только. Сильная токсичность лекарственных средств, таких как упомянутые выше, может превысить наблюдаемые клинически низкие уровни направленного на опухоль mAb вследствие низкого уровня антигенсвязывающих участков, обычно наблюдаемых на опухолях-мишенях. В предклинических испытаниях наблюдали излечивание мышей, несущих опухолевые ксенотрансплантаты человека, при дозах конъюгата mAb-лекарственное средство, которые были намного ниже доз, ранее используемых с конъюгатами mAb-лекарственное средство, в которые включены стандартные лекарственные средства, такие как DOX (Liu et al., Proc. Natl. Acad. Sci. USA 93:8616-8623 (1996) и Hinman et al., Cancer Res. 53:3336-3342 (1993)). В случае конъюгатов мейтансиноид-mAb (Liu) количество требуемого для терапии конъюгата было более чем в 50 раз ниже того количества, которое требовалось ранее в случае конъюгатов с DOX (Trail, как указано выше).
В ходе развития этих конъюгатов исследователи сделали предположение, что линкер между лекарственным средством и mAb является критическим для сохранения хорошей противоопухолевой активности как in vitro, так и in vivo. Описанные конъюгаты были приготовлены с фрагментом, расщепляемым внутри клетки (гидразон), и лабильной в восстановительной среде связью (дисульфид) между лекарственным средством и mAb. Хотя гидразоновая связь является довольно стабильной в условиях сыворотки in vivo, было найдено, что нормальные дисульфидные связи недостаточно стабильны для практического использования. Были получены конъюгаты, в которых стандартная дисульфидная связь была заменена на затрудненную (двойной диметил) дисульфидную связь в случае калихеамицинов или на метилдисульфид в случае мейтансиноидов. Хотя данная работа была завершена, отдельное исследование продолжалось на новых конъюгатах антрациклин-замещенное mAb. В исследованиях новых конъюгатов DOX и mAb было обнаружено, что при включении гидразона в качестве расщепляемого элемента и присоединении DOX к mAb через тиоэфирную группу вместо дисульфида (патент США No.5708146) можно достичь превосходных результатов. При связывании таким способом и также при использовании разветвленного линкера, способного к удвоению числа единиц DOX на участке замещения mAb, было достигнуто приблизительно на порядок бóльшая эффективности новых конъюгатов DOX-mAb (King et al., Bioconjugate Chem. 10:279-288, (1999)).
Сущность изобретения
Настоящее изобретение направлено на новые интернализирующие конъюгаты антитела и антрациклиновых лекарственных средств. Отдельные аспекты проиллюстрированы примерами конъюгатов доксорубицина (DOX), эпирубицина, морфолинодоксорубицина (морфолино-DOX), цианоморфолинодоксорубицина (цианоморфолино-DOX) и 2-пирролинодоксорубицина (2-PDOX). 2-PDOX является особенно токсичным, в его структуре находится енамин, который действует не только как интеркалятор и ингибитор топоизомеразы, но также и как алкилирующий реагент, обладающий повышенной токсичностью. Подобно DOX, 2-PDOX имеет относительно хорошую растворимость в воде, что свидетельствует о том, что он может быть соединен с mAb в многократно замещенных количествах без преципитации mAb. Лекарственные средства, описанные более детально ниже, являются по существу замещенными в среднем 8 (обычно 7-9) фрагментами лекарственных средств на молекулу mAb. Количество лекарственных средств, однако, может изменяться от 6 до 10 молекул на молекулу mAb.
В одном аспекте, изобретение относится к иммуноконъюгату, содержащему нацеливающий фрагмент, антрациклиновое лекарственное средство и линкер, связывающий нацеливающий фрагмент через тиоловую группу, а антрациклиновое химиотерапевтическое лекарственное средство - через внутриклеточно расщепляемый фрагмент.
В предпочтительном аспекте настоящего изобретения направляющим фрагментом является mAb, антрациклиновым химиотерапевтическим лекарственным средством является DOX, 2-PDOX, морфолино-DOX и морфолиноциано-DOX, а внутриклеточно расщепляемым фрагментом является гидразон.
В другом аспекте, изобретение относится к иммуноконъюгату, содержащему антитело, направленное на заболевание, и антрациклиновое химиотерапевтическое лекарственное средство. Много сотен примеров антрациклиновых лекарственных средств было синтезировано в течение приблизительно последних 30-40 лет, и они обсуждены подробно в других работах (см. Anthracycline Antibiotics; New Analogs, methods of Delivery, and Mechanisms of Action, Waldemar Priebe, Editor, ACS Symposium Series 574, American Chemical Society, Washington DC, 1994). Такие аналоги входят в объем данного изобретения.
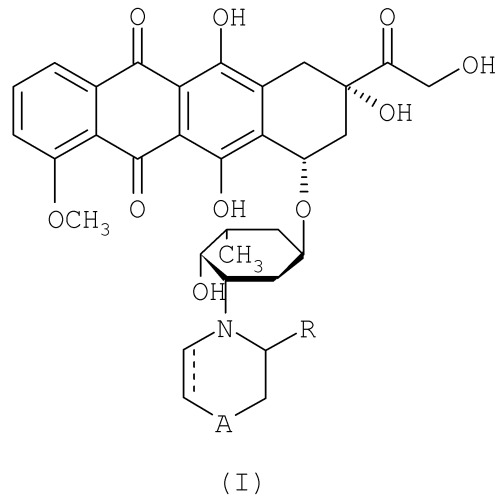
В предпочтительном аспекте, изобретение относится к иммуноконъюгату, содержащему антитело, направленное на заболевание, и антрациклиновое химиотерапевтическое лекарственное средство формул I и II:
где А отсутствует или может быть выбрано из группы, состоящей из NH, N-алкила, N-циклоалкила, O, S и CH2; пунктирная линия означает простую или двойную связь, и R означает Н или CN, и линкер, связывающий нацеливающий фрагмент через сульфидную группу, а антрациклиновое химиотерапевтическое лекарственное средство - через внутриклеточно расщепляемый фрагмент. Когда А отсутствует, атомы углерода, соседние с А на каждой из сторон, соединены простой связью, таким образом образуя пятичленное кольцо.
Употребляемый в тексте термин «алкил» относится к насыщенному алифатическому углеводородному радикалу, включающему в себя группы с прямой и разветвленной цепью, состоящие из 1-20 атомов углерода (всякий раз это числовой диапазон; например, встречающееся здесь обозначение «1-20» означает, что группа - в случае алкильной группы - может содержать 1 атом углерода, 2 атома углерода, 3 атома углерода и т.д., вплоть до 20 атомов углерода, включая и это значение). Алкильные группы, состоящие из 1-4 атомов углерода, относятся к низшим алкильным группам. Наиболее предпочтительно алкильная группа является алкилом среднего размера, имеющим от 1 до 10 атомов углерода, например, метилом, этилом, пропилом, 2-пропилом, н-бутилом, изобутилом, трет-бутилом, пентилом и пр. Самое предпочтительное, когда она является низшим алкилом, имеющим от 1 до 4 атомов углерода, например, метилом, этилом, пропилом, 2-пропилом, н-бутилом, изобутилом или трет-бутилом и пр.
Термин «циклоалкил» относится к 3-8-членному углеродному моноциклическому кольцу, углеродному 5-членному/6-членному или 6-членному/6-членному конденсированному бициклическому кольцу или мультициклическому конденсированному кольцу («конденсированная» кольцевая система означает, что каждое кольцо в системе делит соседнюю пару атомов углерода с каждым другим кольцом в системе), где одно или более колец может содержать одну или более двойных связей, но ни одно из колец не имеет полностью конъюгированную пи-электронную систему. Примерами циклоалкильных групп, без ограничения, являются циклопропан, циклобутан, циклопентан, циклопентен, циклогексан, циклогексадиен, адамантан, циклогептан, циклогептатриен и пр. Циклоалкильная группа может быть замещенной или незамещенной.
В другом предпочтительном аспекте фрагментом, расщепляемым внутри клетки, является гидразон.
В предпочтительном аспекте mAb является mAb, которое нацелено на связанные с опухолью антигены. Связанные с опухолью антигены определяют как антигены, экспрессируемые опухолевыми клетками или их сосудистой сетью в большем количестве, чем в нормальных клетках, где нормальные клетки способны к осуществлению клеточных функций, существенных для выживания больного. Связанные с опухолью антигены также могут быть антигенами, связанными с различными нормальными клетками, такими как дифференцировочные антигены линий дифференцировки различных гемопоэтических клеток, В-клеток, Т-клеток или миелоидных клеток, тем самым больной может выживать, несмотря на кратковременное избирательное уменьшение количества указанных нормальных клеток, в то время как злокачественные клетки, экспрессирующие такой же антиген(ы), разрушаются в достаточной степени, чтобы ослабить симптомы болезни и также улучшить состояние больного. Антитело mAb также может быть реактивным по отношению к антигену, связанному с гематологическими злокачественными опухолями.
В другом аспекте антигены выбирают из группы антигенов, связанных с В-клетками, Т-клетками, миелоидными клетками и другими гемопоэтическими клетками, таких как CD19, CD20, CD21, CD22, CD23 в В-клетках; CD33, CD45 и CD66 в миелоидных клетках; IL-2 (TAC или CD25) в Т-клетках; MUC1, тенасцин, CD74, HLA-DR, CD80 в различных гемопоэтических типах опухолей; СЕА, CSAp, MUC1, MUC2, MUC3, MUC4, PAM4, EGP-1, EGP-2, AFP, HCG, HER2/neu, EGFR, VEGF, P1GF, Le(y), карбоангидразы IX, PAP, PSMA, MAGE, S100, тенасцин и TAG-72 в различных карциномах, тенасцин в глиомах, и из антигенов, экспрессируемых сосудистой сетью и эндотелиальными клетками, а также поддерживающей стромой определенных опухолей. В другом предпочтительном аспекте mAb выбирают из группы, состоящей из LL1 (антитела против CD74), LL2 (антитела против CD22), hA20 и ритуксимаб (антитела против CD20), M195 (антитела против CD33), RS7 (антитела против эпителиального гликопротеина-1 (EGP-1)), 17-1А (антитела против EGP-2), PAM-4, BrE3 и КС4 (все анти-MUC1), MN-14 (антитела против онкофетального антигена (СЕА)), Mu-9 (антитела против антигена-р, специфичного для ободочной кишки), Immu 31 (антитела против альфа-фетопротеина), анти-TAG-72 (например, СС49), анти-Tn, J591 (анти-PSMA), BC-2 (антитело против тенасцина) и G250 (mAb против карбонатангидразы IX). Другие используемые антигены, которые могут быть нацелены с помощью указанных конъюгатов, включают в себя HER-2/neu, CD19, CD20 (например, C2B8, hA20, cA20, 1F5 MAb), CD21, CD23, CD33, CD40, CD80, альфа-фетопротеин (AFP), VEGF, EGF рецептор, P1GF (фактор роста плаценты), ILGF-1 (инсулиноподобный фактор-1 роста), MUC1, MUC2, MUC3, MUC4, PSMA, ганглиозиды, HCG, EGP-2 (например, 17-1А), CD37, HLA-DR, CD30, Ia, Ii, A3, A33, Ep-CAM, KS-1, Le(y), S100, PSA, тенасцин, рецептор фолата, антигены Thomas-Friedenreich, антигены некроза опухоли, антигены ангиогенеза опухоли, Ga 733, IL-2 (CD25), T101, MAGE, CD66, CEA, NCA95, NCA90 или их комбинации.
В особенно предпочтительном аспекте нацеливающее mAb направлено против поверхностного антигена, который затем быстро поглощается антителом.
В особенно предпочтительном аспекте нацеливающее mAb направлено против антигена CD74.
В другом предпочтительном аспекте, линкером является радикал 4-[N-малеимидометил]циклогексан-1-карбоксилгидразид.
Также описаны способы получения композиций согласно изобретению вместе со способами применения указанных композиций.
Краткое описание чертежей
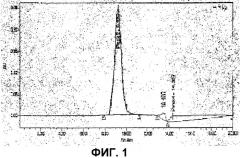
Фигура 1 представляет собой профиль элюции при гель-фильтрации с помощью ВЭЖХ конъюгата антрациклин-антитело, приготовленного описанными методами.
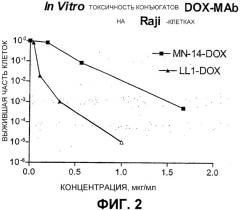
На фигуре 2 показана in vitro эффективность конъюгата DOX-LL1 против Raji-клеток линии африканской лимфомы Беркитта, в сравнении с содержащим DOX конъюгатом ненацеливающего MN-14-антитела, при концентрации конъюгата лекарственное средство-mAb 1 мкг/мл. Содержание конъюгата DOX-LL1 во фракции выживших клеток на три порядка отличается от содержания конъюгата DOX-MN-14.
На фигуре 3 представлена эффективность одной 100 мкг дозы конъюгата 2-PDOX-RS7 в модели DU145 ксенотрансплантата простаты у бестимусных мышей.
На фигуре 4 представлена эффективность однократных доз 2-PDOX- и DOX-конъюгатов LL1-антитела на модели RAJI/SCID агрессивной системной опухоли мыши. Животных в./в. инъецировали Raji-клетками В-клеточной лимфомы и через пять дней обрабатывали конъюгатами, обозначенными на фигуре.
На фигуре 5 представлена эффективность однократной дозы 2-PDOX-LL1-антитело на модели RAJI/SCID агрессивной системной опухоли мыши по сравнению с необработанными контрольными животными, которым не давали конъюгат, или группой животных, которым давали ненацеливающий контрольный конъюгат, 2-PDOX-MN-14.
Подробное описание предпочтительных аспектов
Если не указано особо, в настоящем описании при употреблении единственного числа подразумевается "один или более".
Химиотерапевтические лекарственные средства, такие, которые описаны выше, могут быть связаны с антителом несколькими способами, с образованием конъюгата mAb-лекарственное средство. Например, химиотерапевтические лекарственные средства могут быть присоединены к mAb или его фрагментам после восстановления дисульфидных связей между цепями mAb. С помощью такого подхода образуется в среднем от восьми до десяти (в зависимости от типа IgG) свободных тиоловых групп на молекулу антитела, с воспроизводимостью при ограничении уровней тиола, используемых в реакции восстановления. Такой способ присоединения химиотерапевтических лекарственных средств является предпочтительным по следующим причинам: во-первых, присоединенные лекарственные средства располагаются на участке внутри или наполовину внутри молекулы mAb или его фрагментов, который не направлен к гидрофильным лизиновым остаткам. Такой подход способствует сохранению их стабильности благодаря более гидрофобным областям mAb, где располагаются химиотерапевтические лекарственные средства. Во-вторых, такой участок не изменяет общий заряд mAb или его фрагментов. В-третьих, расположение у внутренних тиоловых групп с меньшей вероятностью будет влиять на действие ADCC и комплемента, которые особенно важны при использовании «голых» вариантов mAb. Таким образом, участок присоединения выбирают таким, чтобы он не препятствовал проявлению активности, так, чтобы ADCC и связывание комплемента могло быть комплементарным к mAb или фрагментам mAb, играя роль носителя в доставке лекарственного средства. В-четвертых, расположение у внутренних тиоловых групп с меньшей вероятностью может привести к иммунному ответу против химиотерапевтических лекарственных средств по сравнению с расположением большого числа молекул химиотерапевтических лекарственных средств на "выставленных" лизиновых группах. В некоторых аспектах, общий электрический заряд антитела в конъюгате Ab-лекарственное средство не изменяется по сравнению с зарядом антитела до связывания. Это происходит вследствие того, что остатки лизина не используют в реакциях конъюгирования, и поэтому свободные положительные аминогруппы не модифицируются с образованием, например, нейтральных амидных связей.
Антитела
Антитело, как описано в тексте, относится к полноразмерной (т.е. природной или образованной способами рекомбинации нормального фрагмента гена иммуноглобулина) молекуле иммуноглобулина (например, антитело IgG) или иммунологически активной (т.е. специфически связанной) части молекулы иммуноглобулина, подобно фрагменту антитела.
Фрагмент антитела является частью антитела, такой как F(ab')2, F(ab)2, Fab', Fab, Fv, scFv (одна цепь Fv) и пр. Несмотря на структуру, фрагмент антитела связывается с таким же антигеном, который узнается интактным антителом, и поэтому антигенсвязывающий фрагмент антитела является его частью.
Термин "фрагмент антитела" также включает в себя любой синтетический или генноинженерный белок, который действует, подобно антителу, путем связывания со специфическим антигеном, с образованием комплекса. Например, фрагменты антитела включают в себя изолированные, состоящие из вариабельных областей фрагменты, такие как "Fv" фрагменты, состоящие из вариабельных областей тяжелых и легких цепей, рекомбинантные одноцепочечные полипептидные молекулы, в которых легкие и тяжелые вариабельные области соединены пептидным линкером ("scFv-белки") и минимальные распознающие единицы, состоящие из аминокислотных остатков, которые имитируют гипервариабельную область. Фрагменты Fv могут быть созданы различными способами, чтобы получить мультивалентные и/или мультиспецифические связывающие формы. Мультивалентные связывающие формы взаимодействуют более чем с одним связывающим участком против специфического эпитопа, в то время как мультиспецифические формы взаимодействуют более чем с одним эпитопом (любого антигена или даже против специфического антигена и другого антигена).
Употребляемый в тексте термин антительный слитый белок означает полученную рекомбинантным способом антигенсвязывающую молекулу, в которой два или более одинаковых или различных природных антител, одноцепочечное антитело или сегменты фрагмента антитела с одинаковыми или различными специфичностями связываются. Слитый белок содержит по меньшей мере один специфический связывающий участок.
Валентность слитого белка указывает на общее число связывающих ветвей или участков, которые слитый белок имеет с антигеном(ами) или эпитопом(ами); т.е. моновалентный, бивалентный, трехвалентный или мультивалентный. Мультивалентность антительного слитого белка означает, что он может использовать множество взаимодействий при связывании с антигеном, таким образом увеличивая возможности связывания с антигеном или с различными антигенами. Специфичность указывает на то, как много различных типов антигена или эпитопа способен связать антительный слитый белок, т.е. моноспецифический, биспецифический, триспецифический, мультиспецифический. Используя указанные определения, можно утверждать, что природное антитело, например, IgG, является бивалентным, поскольку оно имеет две связывающие ветви, но является моноспецифическим, поскольку оно связывается с одним типом антигена или эпитопа. Моноспецифический, мультивалентный слитый белок имеет более чем один связывающий участок для одного и того же антигена или эпитопа. Например, моноспецифическое диантитело является слитым белком с двумя связывающими участками, проявляющими активность в отношении одного и того же антигена. Слитый белок может включать в себя мультивалентную или мультиспецифическую комбинацию разных компонентов антитела или множество копий одного и того же компонента антитела.
В предпочтительном аспекте настоящего изобретения используют антитела, такие как моноклональные антитела (mAb), которые распознают или связывают маркеры или связанные с опухолью антигены, высокие уровни которых экспрессируются на клетках-мишенях и которые экспрессируются преимущественно или только на патологических клетках, в отличие от нормальных тканей, и антитела, которые быстро интернализируются. Антитела, используемые в объеме настоящего изобретения, включают в себя антитела против связанных с опухолью антигенов, такие антитела, которые имеют описанные выше свойства (и проявляют различные свойства в отношении разных уровней интернализации с клетками и микроорганизмами), и при раке, не ограничиваясь им, предполагается использовать следующие mAb: LL1 (антитела против CD74), LL2 (антитела против CD22), M195 (антитела против CD33), MN3 (анти-NCA90), RS7 (антитела против эпителиального гликопротеина-1 (EGP-1)), PAM-4, BrE3 и KС4 (все анти-MUC1), MN-14 (антитела против онкофетального антигена (CEA)), Mu-9 (антитела против антигена-р, специфичного для ободочной кишки), Immu 31 (антитела против альфа-фетопротеина), анти-TAG-72 (например, CC49), анти-Tn, J591 (анти-PSMA), M195 (анти-CD33) и G250 (антитела против карбоангидразы IX). Другие используемые антигены и различные эпитопы таких антигенов, на которые можно направить указанные конъюгаты, включают в себя HER-2/neu, CD19, CD20 (например, C2B8, hA20, 1F5 MAb), CD21, CD23, CD25, CD30, CD33, CD37, CD40, CD74, CD80, альфа-фетопротеин (AFP), VEGF, рецептор EGF, P1GF, MUC1, MUC2, MUC3, MUC4, PSMA, PAP, карбоангидразу IX, TAG-72, GD2, GD3, HCG, EGP-2 (например, 17-1A), HLA-DR, CD30, Ia, A3, A33, Ep-CAM, KS-1, Le(y), S100, PSA, тенасцин, рецептор фолата, Tn или антигены Thomas-Friedenreich, антигены некроза опухоли, антигены ангиогенеза опухоли, Ga 733, T101, MAGE или их комбинации. Ряд перечисленных выше антигенов описан в предварительной заявке США No. 60/426379, озаглавленной «Использование мультиспецифических, нековалентных комплексов для направленной доставки терапевтических лекарственных средств», поданной в 15 ноября 2002.
В другом предпочтительном аспекте настоящего изобретения используют антитела, которые быстро интернализируются и затем вновь экспрессируются на клеточных поверхностях, способствуя непрерывному поглощению и аккумулированию клетками циркулирующего конъюгата антитело-химиотерапевтическое лекарственное средство. В предпочтительном аспекте лекарственным средством является антрациклин, и конъюгат антитело-антрациклин интернализируется клеткам-мишеням и затем вновь экспрессируется на клеточной поверхности. Примером наиболее предпочтительной пары антиген/антитело является LL1 и CD74 (инвариантная цепь, класс II-специфический шаперон, Ii). Антиген CD74 является высокоэкспрессированным на В-клеточных лимфомах, некоторых Т-клеточных лимфомах, меланомах и некоторых других опухолях (Ong et al., Immunology 98:296-302 (1999)).
В предпочтительном аспекте антитела, которые используют при лечении заболеваний человека, являются человеческими или гуманизированными (CDR, трансплантированный в человеческую рамку считывания) вариантами антител, хотя могут быть использованы и мышиные, химерные варианты и варианты антител приматов. Для ветеринарных целей, IgG одного и того же вида, вероятно, является самым эффективным вектором, хотя IgG перекрестных видов должны оставаться пригодными, как использование мышиных антител для собак (например, L243 анти-HLA-DR-mAb для лечения лимфомы у собак). Молекулы иммуноглобулинов (IgG) одного и того же вида в качестве доставочных средств являются наиболее предпочтительными для снижения до минимума иммунных ответов. Это обстоятельство важно при учете повторных обработок. Для человека менее вероятно, что человеческое или гуманизированное IgG-антитело вызовет анти-IgG-иммунный ответ у больных. Нацеленные на интернализирующийся антиген, антитела такие как hLL1 и hLL2, быстро интернализируются после связывания с клетками-мишенями, что свидетельствует о том, что конъюгированное химиотерапевтическое лекарственное средство быстро попадает в клетки.
Иммуномодулятор, такой как цитокин, также может быть конъюгирован с моноклональным антителом-антрациклиновым лекарственным средством или может быть введен в виде не конъюгированного с конъюгатом химерное, гуманизированное или человеческое моноклональное антитело-антрациклиновое лекарственное средство, согласно предпочтительным аспектам настоящего изобретения. Иммуномодулятор может быть введен до, одновременно или после введения конъюгата моноклональное антитело-антрациклиновое лекарственное средство согласно предпочтительным аспектам настоящего изобретения. Иммуномодулятор также может быть конъюгирован с гибридным антителом, состоящим из одного или более антител, связанных с различными антигенами. Такой антиген также может быть иммуномодулятором. Например, CD40 или другие иммуномодуляторы могут быть введены в комбинации с анти-CSAp- или в комбинации с анти-CSAp/non-CSAp-антителом, либо вместе, либо до, либо после введения комбинаций антитела. Конъюгат моноклональное антитело-антрациклиновое лекарственное средство может быть использован в комбинации со слитым белком или может быть конъюгирован со слитым белком, таким как анти-CD40.
Употребляемый в тексте термин «иммуномодулятор» включает в себя цитокины, факторы роста стволовых клеток, лимфотоксины, такие как фактор некроза опухоли (TNF), и гематопоэтические факторы, такие как интерлейкины (например, интерлейкин-1 (IL-1), IL-2, IL-3, IL-6, IL-10, IL-12, IL-18 и IL-21), колониестимулирующие факторы (например, гранулоцитарный колониестимулирующий фактор (G-CSF) и гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF)), интерфероны (например, интерфероны-α, -β-γ), фактор роста стволовых клеток, обозначенный "S1-фактор", эритропоэтин и тромбопоэтин. Примеры подходящих фрагментов иммуномодуляторов включают в себя IL-2, IL-6, IL-10, IL-12, IL-18, IL-21, интерферон-γ, TNF-α и тому подобное.
Иммуномодулятор является терапевтическим агентом, как определено в настоящем изобретении, присутствие которого изменяет, подавляет или стимулирует иммунную систему организма. Обычно иммуномодулятор, используемый в настоящем изобретении, стимулирует иммунные клетки к пролиферации, или в каскаде иммунных реакций клетки, такие как макрофаги, В-клетки и/или Т-клетки, становятся активированными. Примером иммуномодулятора, описанного в тексте, является цитокин, который представляет собой растворимый белок небольшого молекулярного веса, составляющего 5-20 кД, высвобождающийся одной клеточной популяцией (например, примированные Т-лимфоциты) при контакте со специфическими антигенами, и который действует как межклеточные медиаторы между клетками. Как известно квалифицированным специалистам, примеры цитокинов включают в себя лимфокины, монокины, интерлейкины и несколько родственных сигнальных молекул, таких как фактор некроза опухоли (TNF) и интерфероны. Хемокины представляют собой подгруппу цитокинов. Некоторые интерлейкины и интерфероны являются примерами цитокинов, которые стимулируют пролиферацию Т-клеток или других иммунных клеток.
В предпочтительном аспекте настоящего изобретения иммуномодулятор усиливает эффективность конъюгата антрациклиновое лекарственное средство-антитело, и в некоторых случаях - посредством стимулирующих эффекторных клеток хозяина.
Конъюгаты антитело-химиотерапевтическое лекарственное средство
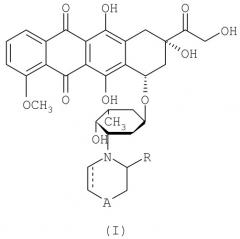
Настоящее изобретение относится к конъюгату антрациклинового лекарственного средства и антитела, где антрациклиновое лекарственное средство и антитело связаны через линкер, представляющий собой гидразид и малеимид. Линкером предпочтительно является 4-(N-малеимидометил)циклогексан-1-карбоксилгидразид. Конъюгат предпочтительно имеет формулу:
где n равно от 6 до 10.
Кроме того, антитело направлено против антигена или распознает связанный с опухолью антиген. Антитело может быть моноклональным антителом, его антиген-связывающим фрагментом или антительным слитым белком. Антительный слитый белок может быть мультивалентным и/или мультиспецифическим. Антительный слитый белок в конъюгате может включать в себя два или более одинаковых или разных природных или синтетических антитела, одноцепочечное антитело или сегменты фрагмента антитела с одинаковыми или разными специфичностями. Антитело или антительный фрагмент слитого белка может быть выбран из группы, состоящей из LL1, LL2, M195, MN-3, RS7, 17-1A, RS11, PAM-4, KC4, BrE3, MN-14, Mu-9, Immu 31, CC49, антитела Tn, J591, антитела Le(y) и G250.
Указанный, связанный с опухолью антиген может быть мишенью интернализирующего антитела. Конъюгат используют для нацеливания на карциномы, саркомы, лимфомы, лейкемии, глиомы или опухоли кожи, такие как меланомы. Связанный с опухолью антиген предпочтительно выбирают из группы, состоящей из CD74, CD22, EGP-1, CEA, антигена-р муцина, специфического для ободочной кишки (CSAp), карбоангидразы IX, HER-2/neu, CD19, CD20, CD21, CD23, CD25, CD30, CD33, CD40, CD45, CD66, NCA90, NCA95, CD80, альфа-фетопротеина (AFP), VEGF, рецептора EGF, P1GF, MUC1, MUC2, MUC3, MUC4, PSMA, GD2, GD3 ганглиозидов, HCG, EGP-2, CD37, HLA-D-DR, CD30, Ia, Ii, A3, A33, Ep-CAM, KS-1, Le(y), S100, PSA, тенасцина, рецептора фолата, антигенов Tn и Thomas-Friedenreich, антигенов некроза опухоли, антигенов ангиогенеза опухоли, Ga 733, IL-2, MAGE и их комбинаций. Наиболее предпочтительно, когда связанный с опухолью антиген выбирают из группы, состоящей из CD74, CD19, CD20, CD22, CD33, EPG-1, MUC1, CEA и AFP. Указанные опухоль-ассоциированные антигены могут быть дифференцировочными антигенами линий дифференцировки (CD) В-клеток, Т-клеток, миелоидных клеток или антигенами, ассоциированными с гематологическими злокачественными опухолями.