Биосинтетический имплантат, его применение и способ уменьшения риска формирования соединительной ткани после имплантации
Иллюстрации
Показать всеИзобретение относится к медицине. Описан биосинтетический имплантат, содержащий полупроницаемый барьер, предназначенный для обеспечения диффузии или предотвращения диффузии предварительно определенных веществ/материалов/молекул/клеток/клеточных линий, образуемых в организме человека, с одной стороны на противоположную сторону барьера и для обеспечения диффузии или предотвращения диффузии с указанной противоположной стороны предварительно определенных веществ, являющихся такими же, как указанные ранее вещества/материалы/молекулы/клетки/клеточные линии, или отличающихся от них. Полупроницаемый барьер, по меньшей мере, на указанной одной стороне имеет поверхностное покрытие из биоактивного металла, такого как титан, где поверхностное покрытие является проницаемым, чтобы обеспечить указанную диффузию. В способе для уменьшения риска формирования/роста соединительной ткани в связи с имплантатом, содержащим полупроницаемый барьер, данный барьер, по меньшей мере на одной стороне, снабжен проницаемым покрытием из биоактивного металла. Примером использования имплантата является биосинтетическая поджелудочная железа. 5 н. и 11 з.п. ф-лы, 38 ил.
Реферат
Область техники, к которой относится изобретение
Техническая область настоящего изобретения включает в себя биосинтетические имплантаты, основанные на полупроницаемом барьере.
Предпосылки изобретения
В области техники трансплантации органов известно, что человеческий организм противодействует трансплантации органа/ткани посредством феномена отторжения, вызываемого иммунной защитой организма. Для того чтобы избежать введения иммуносупрессирующих лекарственных средств (побочные эффекты, ухудшение иммунной защиты), разработаны биосинтетические имплантаты, содержащие донорские ткань/клетки для имплантации и полупроницаемый барьер или "фильтр", чтобы обеспечить диффузию питательных веществ и кислорода из организма реципиента к имплантированным (т.е. трансплантированным) донорским ткани/клеткам, но предотвратить диффузии механизмов иммунной защиты (клеток) реципиента и в то же время он должен обеспечивать диффузию желательных веществ, продуцируемых донорскими тканью/клетками в организм реципиента. Примеры таких биосинтетических имплантатов в патентной литературе включают US-A-6632244 и WO 02/02745, где подробно обсуждена имплантация выделенных островков Лангерганса (биосинтетическая поджелудочная железа) для получения инсулина в организме реципиента. В US 6632244 также обсуждают риск фиброза (рост соединительной ткани) в организме реципиента, приводящий к закрытию пор в барьере соединительной тканью, вследствие чего имплантат "погибает голодной смертью" (гипоксия), так как он не получает кислорода и питательных веществ из организма реципиента. Этот феномен имеет место в барьерных материалах, не являющихся биосовместимыми. Согласно последнему патенту этот недостаток устраняют посредством биосовместимого имплантата в виде тонкого слоя из трех компонентов: (a) ядра, состоящего из живой ткани, трофических факторов и клеток-"нянь", полимера альгината, сшитого, например, кальцием, и сети из волокон для прочности, (b) покрытия из полимера альгината, сшитого кальцием для контроля проницаемости, и (c) покрытия, также содержащего сшитый полимер альгината. Рекомендовано, чтобы толщина имплантата не превышала 400 мкм.
Трансплантат, который также покрыт альгинатом (многослойное покрытие), описан в патенте США 5876742. Указанно, что покрытие нефибриногенно. Толщина покрытия составляет 20-200 мкм.
В патенте США 5782912 описан имплантат со стенкой, состоящей из первой пористой мембраны, которая является проксимальной для ткани реципиента и которая, как указано, способствует формированию сосудистых структур на границе раздела реципиент-мембрана и тем самым предотвращает формирование соединительной ткани. Имплантат также содержит вторую пористую мембрану, формирующую иммуноизолированное пространство. В данном пространстве заключена ткань, панкреатические островки, которые должны быть защищены от контакта с клетками реципиента. Вторая мембрана допускает диффузию компонентов, образуемых окруженной тканью, продуцирующей, например, инсулин. Вторая мембрана также допускает диффузию питательных веществ от реципиента в пространство для обеспечения ткани питательными веществами. Мембраны сделаны из полимера, а первая мембрана состоит из специальной трехмерной пористой структуры. В данной патентной публикации указано, что известные биосовместимые медицинские имплантаты состоят из керамики и металлов. При условии, что данные материалы можно обрабатывать так, чтобы обеспечить описанные здесь трехмерные структуры, они также могут быть пригодными в настоящем изобретении".
В патенте США 5782912 также описано применение средства в качестве покрытия на вживленном датчике или на вживленном катетере, в качестве средств для транспортировки физиологических факторов для вживленных сенсоров, в качестве средств для транспортировки лекарственных средств из камеры или катетера в ткань реципиента и в качестве средств для инкапсуляции трансплантированных клеток для лечения клеточных и молекулярных дефектов (иммуноизоляции).
Описанные выше имплантаты и другие имплантаты на основе полупроницаемых барьеров сложны в разработке и их трудно производить. Существует основание полагать, что данные обстоятельства препятствуют получению хорошо воспроизводимых имплантатов с желаемыми свойствами. Также существует основание полагать, что барьер из образующихся сосудов у известных имплантатов недостаточно эффективен для предотвращения фиброза, так как во внимание не принимается заполненный жидкостью промежуток между соединительной тканью и барьером.
Задача изобретения
Задачей изобретения является получение такого биосинтетического полупроницаемого имплантата описанного выше типа, т.е. обладающего свойством васкуляризации, которая ингибирует рост соединительной ткани (фиброз), при этом данный имплантат характеризуется простотой в разработке и легкостью в изготовлении по сравнению с известными имплантатами.
Раскрытие изобретения
Задача изобретения достигается посредством имплантата, характеризующегося признаками согласно п.1 формулы изобретения и способу по п.9 формулы изобретения. Предпочтительные варианты осуществления характеризуются признаками, определенными в зависимых пунктах формулы изобретения.
Изобретение основано на неожиданном открытии авторов изобретения, что если традиционный полупроницаемый барьер, "фильтр", "мембрана", адаптированнные для имплантации в организм человека и способные к селективному пропусканию питательных веществ, кислорода, других газов, тканевых/клеточных веществ, клеточных линий, но через который не распространяются механизмы иммунной защиты, снабжены проницаемым покрытием из биосовместимого или биологически активного металла, проблемы с фиброзом в значительной степени устраняются.
Проведенные эксперименты дали авторам изобретения основание полагать, что данное препятствующее фиброзу действие является следствием того факта, что кровеносные сосуды у реципиента, которому имплантируют барьер с биоактивным покрытием, "притягиваются" к поверхности покрытия и растут вдоль него. В результате рост соединительной ткани, фиброз, около этой поверхности блокируется, и такой рост соединительной ткани не возникает снова, пока кровеносные сосуды растут рядом с поверхностью биоактивного покрытия. Кровеносные сосуды и рост кровеносных сосудов рядом с поверхностью биоактивного сосуда, в свою очередь, приводят к тому факту, что питательные вещества и кислород из кровеносных сосудов может транспортироваться (диффундировать) через имплантат без препятствий от соединительной ткани.
Здесь "притягивание" не следует интерпретировать как строгое научное выражение, так как лежащий в основе данного эффекта механизм еще не установлен. Выражение скорее служит установлению того факта, что согласно открытиям авторов настоящего изобретения кровеносные сосуды не растут (растут в недостаточной степени) по направлению к поверхности или около поверхности традиционного барьера, указываемого как биосовместимый или нет, хотя кровеносные сосуды делают это рядом с таким покрытием на традиционном барьере, состоящем из биоактивного металла.
Следует отметить, что металлическое покрытие не следует считать полупроницаемым барьером в дополнение к традиционному полупроницаемому барьеру, на который нанесен металл. Он является противоположностью альгинатному слою или полимерной мембране в указанных выше патентах, придавая свойство васкуляризации и ингибирования фиброза подлежащему полупроницаемому барьеру или мембране. Альгинатный/полимерный слой сам является полупроницаемым и обеспечивает проницаемость имплантата, которая является проницаемостью, отличающейся от проницаемости подлежащего полупроницаемого барьера. Металлическое покрытие имплантата по изобретению не обладает таким эффектом.
ПРИМЕР 1
Различие в показателях роста соединительной ткани в связи с имплантатом из полупроницаемого барьера без покрытия из биоактивного металла и с покрытием из биоактивного металла, согласно изобретению проиллюстрировано на фиг. 1 и 2.
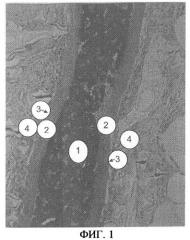
Фиг.1 представляет собой фотографию с применением светового микроскопа, иллюстрирующую традиционный имплантат, содержащий островки Лангерганса 1 окруженные альгинатным барьером 2, где имплантат находится в трансплантированном состоянии. Слой, обозначенный 3, идентифицирован как соединительная ткань. Фотография показывает, что соединительная ткань 3 находится рядом с имплантатом, между имплантатом и тканью/кровеносным сосудом реципиента 4.
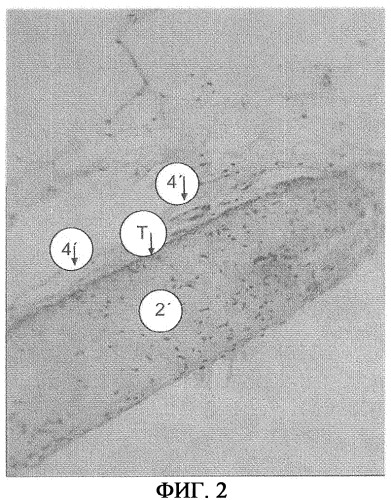
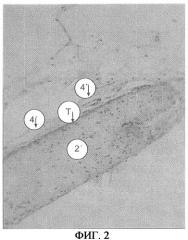
На фиг.2 показан имплантат, состоящий из традиционного полупроницаемого барьера 2', который на одной стороне по изобретению покрыт титановым покрытием T. Компонент, обозначенный 4', идентифицирован как кровеносный сосуд. Он расположен рядом с титановым покрытием T и даже немного проникает в покрытие. Между кровеносным сосудом и барьером нет соединительной ткани. Каких-либо кровеносных сосудов по всей протяженности другой стороны барьера, которая не имеет титанового покрытия, почти нет.
Варианты осуществления изобретения
Полупроницаемый барьер
Полупроницаемый барьер имплантата, где барьер сделан из полимерного материала с указанными выше свойствами относительно указанного выше транспорта, может быть барьером того же типа, который известен из предыдущего уровня техники, например согласно указанному выше патенту США 6372244, или каким-либо другим материалом гистосовместимого типа, например GoreTex®. Полупроницаемые барьеры из других веществ, таких как углеводороды, целлюлоза, пластик (например, поликарбонат), гидрогели, уже доступны в продаже, например от Millipore Inc, Baxter Inc, Amicon и Pall Corporation. Их продают или производят по запросу с различным размером пор в зависимости от того, что необходимо блокировать или пропускать. Например, в продаже существуют полупроницаемые барьеры, блокирующие диффузию клеток (иммунная защита), но пропускающие через себя молекулы (питательные вещества и кислород, а также вещества из организма реципиента, которому имплантирован барьер) и вещества из окруженных барьером органа/части органа/ткани донора в организм реципиента, например инсулин, продуцируемый островками Лангерганса, имплантированными в организм реципиента. Барьер может быть в форме слоя, которым окружена(ы) ткань или клетки для имплантации, или в форме контейнера (резервуар, гильза) в который заключены(а) клетки/ткань для имплантации. В данном случае биоактивное покрытие, по меньшей мере, расположено на наружной стороне контейнера.
Покрытие из биоактивного металла и его нанесение
Покрытие имплантата из биоактивного металла должно быть проницаемым, т.е. иметь поры/отверстия, позволяющие проходить (диффундировать) питательным веществам, кислороду и тканевым/клеточным веществам, т.е., покрытие не должно препятствовать функционированию и цели использования полупроницаемого барьера. Однако размер пор не должен предотвращать проникновение иммунной защиты; об этом заботится полупроницаемый барьер. Таким образом, проницаемость покрытия должна быть, по меньшей мере, такой же, как проницаемость барьера (принимая в рассмотрение небольшое воздействие металлического покрытия на стенки пор полупроницаемого барьера). Покрытие может состоять из порошка/пудры, нанесенных на барьер посредством какого-либо процесса тонкого измельчения, известного из предшествующего уровня техники, или тонкопленочной технологии, такой как выпаривание (PVD), напыление, или оно может быть в форме сетчатой структуры или перфорированной (например, лазером) пленки, прикрепляемой каким-либо подходящим способом, например приклеиванием к барьеру с применением биологического клея или сваркой ее лазером. Прикрепление пленки прошивкой также является приемлемым способом. Другую возможность представляет собой "распыление" частиц на барьер. При выборе способа нанесения покрытия на барьер непременно следует принимать в рассмотрение характер материала барьера, особенно термостойкость.
Покрытие должно быть по существу непрерывным, посредством чего подразумевают предотвратить рост соединительной ткани на подлежащем полупроницаемом барьере. Хотя такое требование едва ли создает проблемы, если покрытие состоит из пленки, требование необходимо принимать во внимание, если покрытие наносят на полупроницаемый барьер с применением способа, где покрытие состоит из частиц, наносимых, например, распылением, выпариванием, химической преципитацией. Таким образом необходимо обеспечить, чтобы покрытие из биоактивного материала на полупроницаемом барьере являлось равномерным и без значительных узлов, которые могут вызвать рост соединительной ткани. С другой стороны, также необходимо обеспечить, чтобы требование отсутствия узлов в покрытии не приводило к нанесению избыточного покрытия так, чтобы покрытие становилось чрезмерной толщины и таким образом закупоривало поры в полупроницаемом барьере.
Выявлено, что очень хороших результатов (транспорт, как указано выше, и предотвращение фиброза) можно достичь с применением современного способа покрытия с толщиной металлического покрытия приблизительно от 5 нм и более, более предпочтительно - приблизительно 50-250 нм, в независимости от размера пор барьера.
Со ссылкой на вышеуказанное необходимо отметить, что согласно изобретению нельзя исключить, что частицы биоактивного материала при покрытии проникают в поры/отверстия барьера, таким образом, уменьшая их, при условии, что остаются поры/отверстия для указанного транспорта или диффузии.
Биоактивный металл
Под биоактивным металлом понимают биосовместимый металл, который в дополнение к биосовместимости способен, как указано выше, "притягивать" ткань и прикреплять ее к себе. Такие вещества представляют собой титан, цирконий, тантал и их пригодные сплавы, как уже известно. Согласно изобретению предпочтителен титан.
ПРИМЕР 2, фиг.3
A титановое покрытие наносили на одну сторону полупроницаемого барьера из целлюлозы, состоящей из Diaflo YM5 LOT AN 01383A от Amicon. Нанесение проводили способом выпаривания в испарителе Edwards Inc. Покрытие наносили с толщиной в 30 нм. Результат показан на фиг.3, из которой очевидно, что поры целлюлозного барьера не закупорены титановыми частицами, т.е. покрытие не приводит к значительному изменению поверхностной структуры барьера. На фиг.2 показан этот барьер с покрытием в качестве имплантата у мыши через месяц после имплантации.
ПРИМЕР 3
Пример повторяли с применением фильтра из Millipore Inc типа SS 3,0 мкм. Получены такие же результаты, как и в примере 1.
Дополнительные аспекты изобретения
Основные идеи изобретения пригодны не только к полупроницаемым барьерам, окружающим ткань/клетки организма донора для трансплантации реципиенту, которые таким образом выживают вследствие снабжения питательными веществами/кислородом из организма реципиента. Идея изобретения также применима к инструментам, измерительным элементам и т.д., которые необходимо ввести в живой организм, для обеспечения транспорта веществ, как правило, через полупроницаемый барьер с противоположных сторон стенки барьера. Пример такого применения представляет собой датчик выявления сахара в крови с окружающим сенсорный элемент полупроницаемым барьером, имплантированный в организм человека и соединенный с инсулиновым насосом для доставки инсулина посредством инфузионного набора, введенного в организм и также снабженного полупроницаемым барьером по изобретению в соответствии с выявленным содержанием сахара в крови. Задача изобретения, т.е. предотвращение роста соединительной ткани рядом с барьером, в этих случаях также разрешена посредством проницаемого титанового покрытия, как описано выше.
Примеры других применений по изобретению представляют собой секрецию лекарственных средств (хемотерапевтических, анальгетиков и т.д.), трансплантацию органов (почка, печень и т.д.), клетки в резервуаре, продуцирующие эритропоэтин, факторы свертывания, гормон роста, интерферон α, паратиреоидные гормоны, инсулин и т.д., искусственные органы (например, клетки печени), способ микродиализа.
Очевидно, что изобретение применимо для людей, а также животных.
Металлическое покрытие может состоять из одного или нескольких отдельно нанесенных слоев металла (пленки или порошка) и, если желателен селективный транспорт веществ через имплантат, слой/слои титана в имплантате могут находиться с барьером/барьерами в конструкции типа "сэндвич".
Дополнительные примеры
ПРИМЕРЫ 4 и 5
На фиг. 4a-4c и 5a-5c проиллюстрированы исследования традиционных полупроницаемых барьеров (мембран) с торговыми марками TF-200 и Versapor®-200 от Pall Corporation. Структуры покрытых и не покрытых Ti мембран исследовали с применением микроскопа LEICA M76 с внешним источником света. При покрытии мембран слоем Ti по сравнению с непокрытыми мембранами не смогли выявить изменений в структуре. Структуру мембраны также исследовали после инкубации покрытых Ti мембран в водном растворе и не наблюдали изменений. Таким образом, структура мембраны сохраняется и после процедуры покрытия, и после воздействия водного раствора. На фиг.4a проиллюстрирована мембрана TF-200 без модификации, т.е. без слоя Ti; на фиг. 4b проиллюстрирована сухая мембрана TF-200, покрытая одним слоем Ti, а на фиг.4c проиллюстрирована влажная мембрана TF-200, покрытая одним слоем Ti. На фиг.5a проиллюстрирована мембрана Versapor® 200 без модификации, т.е. без слоя Ti; на фиг.5b проиллюстрирована сухая мембрана Versapor® 200, покрытая одним слоем Ti, а на фиг.5c проиллюстрирована влажная мембрана Versapor® 200, покрытая одним слоем Ti.
ПРИМЕРЫ 6 и 7
На фиг. 6a-6d и 7a-7c проиллюстрирована эффективность диализа с применением мембран Versapor® 200 и HT-200 из Pall Corporation. На фиг.6a проиллюстрировано устройство для тестирования эффективности диализа со стаканом 10, камерой для диализа 11, мембраной 12 и магнитной мешалкой 13. Камеру для диализа 11 заполняли 1 мл человеческой крови, содержащей 0,5 М глюкозы и 2,5 Ед/л инсулина, а мембрану монтировали на камеру. Диализ проводили в стакане, наполненном 50 мл PBS. Образцы собирали на 0, 15, 30, 60, 120, 180, 240 и 300 мин и анализировали на поглощение при 280 нм, устанавливая концентрацию глюкозы, концентрацию белков и содержание IgG. Между непокрытыми и покрытыми Ti мембранами Versapor® 200 и HT 200 не смогли выявить различий в эффективности диализа. На фиг.6b проиллюстрирован диализ глюкозы через мембрану Versapor® 200, на фиг.6c проиллюстрирован диализ белков через мембрану Versapor® 200 и на фиг.6d проиллюстрирован диализ IgG через мембрану Versapor® 200. На фиг.7a проиллюстрирован диализ глюкозы через мембрану HT-200, на фиг.7b проиллюстрирован диализ белков через мембрану HT-200 и на фиг.7c проиллюстрирован диализ IgG через мембрану HT-200.
ПРИМЕР 8
Устройство TheraCyte™, см. фиг.8a, по существу представляет собой резервуар, образующийся между двумя листами мембран. Каждый лист состоит из трех слоев - наружного слоя из тканого полиэфира, среднего слоя из PTFE с размером по 5 мкм и внутреннего слоя из PTFE с размером пор 0,45 мкм. Полагают, что два внешних слоя работают в качестве направляющей для формирования кровеносных сосудов. Внутренний слой представляет собой изолирующий слой для изоляции клеток внутри от клеток снаружи.
Указанное выше устройство TheraCyte™ до и после покрытия одним или двумя слоями Ti исследовали с применением микроскопа LEICA M76 с внешним источником света и светового микроскопа Nikon Eclipse E600. Изменений в структуре устройства вследствие процедуры покрытия Ti выявить не смогли. На фиг.8b проиллюстрировано устройство без модификации (без покрытия Ti), на фиг.8c проиллюстрировано устройство с одним слоем Ti, а на фиг.8d проиллюстрировано устройство с двумя слоями Ti. На фиг.8e-8g проиллюстрировано устройство без модификации с одним слоем Ti и с двумя слоями Ti соответственно. На фиг.8h-8j проиллюстрировано устройство без модификации с одним слоем Ti и с двумя слоями Ti соответственно. На фиг. 8k-8m проиллюстрировано устройство без модификации с одним слоем Ti и с двумя слоями Ti соответственно.
На указанных выше устройствах проводили диализ в 0,9% NaCl. В устройство вводили инсулин и радиоактивно меченую глюкозу соответственно. Образцы собирали на 0, 15, 30, 60, 120 и 180 минутах после начала диализа. Глюкозу выявляли с применением жидкостного сцинтилляционного счетчика, а инсулина - с применением иммуноферментного анализа (ИФА) изоинсулина. Результат: см. фиг.8n и 8o. На фиг.8n проиллюстрирован диализ глюкозы из устройства TheraCyte™. Числа означают количества слоев Ti на устройстве. K означает немодифицированное устройство. На фиг.8o проиллюстрирован диализ инсулина из устройства TheraCyte™. Числа означают количества слоев, нанесенных на устройство. Контроль означает немодифицированное устройство.
Устройства TheraCyte™ имплантировали самцам крыс LEWIS. Через 17 суток устройства вынимали. На микроскопическом уровне непокрытые устройства окружены капсулой, содержащей сывороточную жидкость. Поперечные срезы выявили наличие более плотного контакта с тканью для покрытого Ti устройства TheraCyte™, чем для непокрытого устройства. См. фиг.8p-8s, сверху: фиг. 8p - два слоя, фиг.8r - контроль (непокрытое, немодифицированное), фиг. 8s - один слой Ti. На фиг. 8t проиллюстрирован поперечный срез контрольного устройства (непокрытое, немодифицированное), на фиг.8u проиллюстрирован поперечный срез устройства с одним слоем Ti, а на фиг.8v проиллюстрирован поперечный срез устройства с двумя слоями Ti.
На фиг.9a и 9b проиллюстрированы резервуары TheraCyte™, имплантированные мышам под грудные мышцы. Резервуары оставляли в мышах в течение 41 суток, а затем в устройства инъецировали раствор 30 ммоль/л глюкозы, содержащий 14C-глюкозу. Образцы крови забирали, как указано на фиг.9. На фиг. продемонстрировано, что у контрольного животного с непокрытым резервуаром (закрашенные круги) уровень глюкозы, что отражено и фактической концентрацией и радиоактивностью, является постоянным приблизительно при 10 ммоль/л вплоть до 20 мин с последующим возрастанием до 25 ммоль/л через 75 мин. В отличие от этого у животных с резервуаром с титановым покрытием уровни глюкозы начинают увеличиваться уже через 5 минут.
Этот результат находится в полном соответствии с открытием того, что титановое покрытие обеспечивает более плотное соединение с окружающей тканью, тем самым позволяя глюкозе диффундировать непосредственно в ткани и окружающие кровеносные сосуды. В отличие от этого у контрольного животного контакт между резервуаром и тканью не является плотным, что приводит к образованию полости между веществом и тканью и капсулы из фиброзной ткани. Перед тем как достигнуть сосудов ткани, глюкоза должна диффундировать в жидкость, расположенную в промежутке, и в капсулу из фиброзной ткани. Это объясняет задержку в увеличении концентрации глюкозы.
На фиг.10 проиллюстрирована часть имплантированного резервуара TheraCyte™ под электронным микроскопом при увеличении 11500. Светлая часть слева представляет собой волокно слоя тканого полиэфира, черная линия рядом с ним представляет собой покрытие Ti, а остальное представляет собой ткань организма рядом с покрытием Ti. Покрытие Ti составляет приблизительно 100 нм в толщину.
1. Биосинтетический имплантат, содержащий полупроницаемый барьер, предназначенный для обеспечения диффузии или предотвращения диффузии предварительно определенных веществ/материалов/молекул/клеток/клеточных линий с одной стороны на противоположную сторону барьера и для обеспечения диффузии или предотвращения диффузии с указанной противоположной стороны предварительно определенных веществ, являющихся такими же, как вышеуказанные вещества/материалы/молекулы/клетки/клеточные линии, или отличающихся от них, отличающийся тем, что полупроницаемый барьер имеет поверхностное покрытие из биоактивного металла, где указанное поверхностное покрытие является проницаемым, чтобы обеспечить или предотвратить указанные виды диффузии.
2. Имплантат по п.1, отличающийся тем, что указанные предварительно определенные вещества/материалы/молекулы/клетки/клеточные линии получены в организме человека или животного.
3. Имплантат по п.1, отличающийся тем, что указанное поверхностное покрытие представляет собой сеть из биоактивного металла.
4. Имплантат по п.1, отличающийся тем, что указанный биоактивный металл выбран из титана, циркония, тантала или их сплава.
5. Имплантат по п.4, отличающийся тем, что указанный биоактивный металл представляет собой титан.
6. Имплантат по п.1, отличающийся тем, что металл нанесен способом тонкого измельчения, таким как распыление или выпаривание.
7. Имплантат по п.1, отличающийся тем, что имеет форму контейнера.
8. Имплантат по п.1, отличающийся тем, что барьер имеет дополнительное поверхностное покрытие на другой стороне.
9. Имплантат по п.1, отличающийся тем, что покрытие/покрытия обладает/обладают толщиной приблизительно от 5 нм, в частности, приблизительно 50-250 нм.
10. Имплантат по п.1, отличающийся тем, что полупроницаемый барьер предназначен для обеспечения диффузии питательных веществ клеток организма и кислорода из организма реципиента с одной стороны на противоположную сторону барьера, где находятся орган/клетки из организма донора, и для обеспечения диффузии с указанной противоположной стороны предварительно выбранных веществ, продуцируемых органом/клетками организма донора.
11. Имплантат по п.1, отличающийся тем, что полупроницаемый барьер содержит сенсорный элемент, причем указанный полупроницаемый барьер предназначен для обеспечения диффузии вещества с одной стороны на противоположную сторону барьера, при этом указанное вещество определяется указанным сенсорным элементом, и для обеспечения диффузии данного вещества с указанной противоположной стороны.
12. Имплантат по п.11, отличающийся тем, что указанное вещество представляет собой сахар крови, а указанный сенсорный элемент является сенсорным элементом для определения сахара крови.
13. Инсулиновый насос, включающий биосинтетический имплантат по п.12 и инфузионный набор для доставки инсулина, основанной на уровне сахара в крови, определенном при помощи указанного сенсорного элемента, предназначенного для определения сахара крови и содержащегося в указанном биосинтетическом имплантате, где указанный инфузионный набор снабжен полупроницаемым барьером, который имеет поверхностное покрытие из указанного биоактивного металла, при этом указанное поверхностное покрытие является проницаемым для обеспечения диффузии инсулина через указанный полупроницаемый барьер.
14. Применение имплантата по п.1 в качестве биосинтетической поджелудочной железы.
15. Применение имплантата по п.1 в качестве части датчика на измерительном устройстве, помещаемом в живой организм.
16. Способ снижения риска формирования/роста соединительной ткани в связи с имплантатом по п.1, содержащим полупроницаемый барьер, отличающийся тем, что барьер, по меньшей мере, на одной стороне снабжен проницаемым покрытием из биоактивного металла.