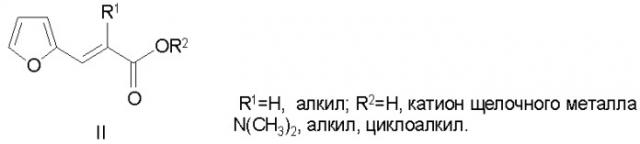N-(2-фурилалкил)-nhr карбамиды, проявляющие росторегулирующую и иммуномоделирующую активность, и способ их получения
Иллюстрации
Показать всеНастоящее изобретение относится к новым соединениям N-(2-фурилалкил)-NHR карбамидам формулы 1:
проявляющим росторегулирующую и иммуномоделирующую активность, и способу их получения, заключающемуся во взаимодействии фурфурилиденацетона с мочевиной в условиях гидроаминирования в автоклаве в присутствии скелетного никелевого катализатора и органического растворителя при температуре 70-90°С и соотношении субстрат-реагент 1:1 или 2:1. Данное изобретение может найти применение в сельском хозяйстве. 2 н.п. ф-лы, 9 табл.
Реферат
Группа изобретений относится к области сельского хозяйства и к химии биологически активных веществ, а именно к новым химическим соединениям, обладающим росторегулирующей и иммуномоделирующей активностью, и способу их получения.
Известны химические соединения 2-(5-R-Аминометилфурил-2)-1,3-диоксоланы формулы
где 1a) R=-Ts; 1б) R=-CO-Ph, проявляющие рострегулирующую и антистрессовую активность (см. патент на изобретение РФ №2288230, МПК C07D 407/04).
Общим с предлагаемым решением является наличие фуранового цикла в структуре этих соединений, однако они не относятся к классу гетероциклических производных мочевины. Данные соединения не обладают иммуномоделирующей активностью.
Аналогами по структуре заявляемого объекта формулы I являются замещенные мочевины, которые в настоящее время представляют наиболее многочисленный класс пестицидных средств. Среди разрешенных к применению на территории России росторегуляторов выделяются три группы замещенных карбамидов (Список пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации // Приложение к журн. «Защита и карантин растений». - 2000. - №3. - С.303): ацилмочевины, в том числе содержащие фрагменты замещенной бензойной кислоты; сульфанилмочевины, содержащие фрагменты арилсульфокислот; мочевины, содержащие гетероциклические заместители различных рядов, в том числе азинов, диазинов, триазинов, азолов, тиазолов. Однако карбамиды, содержащие фурановый цикл, до настоящего времени практически не изучены. Возможно, это связано с отсутствием доступных методов их синтеза. В то же время природными фитогормонами, обладающими цитокининовой активностью, т.е. интенсифицирующими клеточное деление, устойчивость растений к заболеваниям, - являются N-,N'-дифенилмочевина: C6H5NHCONHC6H5 и 6-фурфуриладенин, или кинетин
Последний является наиболее близким по структуре к заявляемым объектам природным регулятором роста, не относящимся к классу замещенных мочевин.
Синтетическим аналогом заявляемых объектов по биологическому действию является фурилзамещенная акриловая кислота и ее производные (Регуляторы роста растений, биологические составы на их основе и применение. Заявка 2666963 Франции, МКИ3 A01N 43/02, 43/08. Заявлено 21.09.90, опубл. 27.03.92, РЖХ, 1993, 40413), являющиеся регуляторами роста овощей и фруктов:
Среди замещенных мочевин, обладающих пестицидной активностью, прототипом заявляемого технического решения является разрешенный к применению на территории РФ препарат монурон - N,N-диметил-N'-п-хлорфенилмочевина (2) (Пестициды: Справочник. / В.И.Мартыненко, В.К.Промоненков и др. М.: Агропромиздат, 1992. - С.368, с.205, 216).
Задачами группы изобретений является:
- поиск новых биологически активных соединений из класса фурилзамещенных карбамидов, проявляющих росторегулирующую активность, малотоксичных, экологически безопасных и эффективных при низкой норме расхода.
- разработка препаративно удобного, эффективного способа их получения на основе легкодоступных исходных веществ (фурфурол, ацетон, ацетальдегид, мочевина).
Техническим результатом является увеличение выхода фурилалкилкарбамидов, обладающих рострегулирующей и иммуномоделирующей активностью, при упрощении способа получения.
Для решения поставленной задачи получен новый класс химических соединений N-(2-фурилалкил)-NHR-карбамидов формулы I
Соединения, относящиеся к классу N-алкил-фурил-N'-арилкарбамидов, проявляющие росторегулирующую активность в отношении овощных, зерновых и кормовых культур, в литературе не описаны.
Заявляемые соединения I отличаются от известного росторегулятора II наличием в структуре I мочевинного фрагмента -NH-CO-NH-, алкильной группы (C1-C4), отсутствием в молекуле карбоксильной группы, ненасыщенного фрагмента С=С, заместителя в фурановом цикле.
Указанные различия в структуре соединений I и II приводят появлению у заявляемых веществ I нового вида биологического действия, а именно иммуномоделирующей активности в отношении ряда кормовых, овощных и зерновых культур, а также усилению росторегулирующего эффекта.
Заявляемые фурилалкилкарбамиды I являются замещенной мочевиной и содержат структурный фрагмент -NH-CO-NH-. Заявляемый объект отличается от прототипа (2) наличием N-алкилфурильного заместителя при одном или двух атомах азота мочевинного фрагмента. Указанные структурные различия приводят к появлению у соединений I нового типа биологического действия - росторегулирующей активности, проявляющейся при использовании препаратов в концентрации 10-3-10-4 моль/л (50 мг/га) для предпосевной обработки семян, в то время как прототип не обладает росторегулирующим действием, являясь гербицидным препаратом при норме расхода 4 кг/га.
Заявляемые соединения относятся к классу несимметричных моно- и дизамещенных мочевин, содержащих фурилалкильный заместитель росторегулирующей активности, проявляющейся при использовании препаратов в концентрации 10-3-10-4 моль/л (50 мг/га) для предпосевной обработки семян, в то время как прототип не обладает росторегулирующим действием, являясь гербицидным препаратом при норме расхода 4 кг/га.
Заявляемые соединения относятся к классу несимметричных моно- и дизамещенных мочевин, содержащих фурилалкильный заместитель.
Известные способы получения замещенных карбамидов основываются на ацилировании аминов различных рядов арилизоцианатами или конденсации первичных аминов с мочевиной в расплаве [Вишнякова Т.П., Голубева И.А., Глебова Е.В. Замещенные мочевины, методы синтеза и области применения // Успехи химии. - 1985. - Т.54. Вып.3. - С.429-448]:
Заявляемые соединения, их свойства и способ получения до наших исследований не были известны.
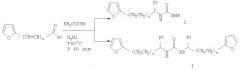
Некоторые карбамиды фуранового ряда получены нами при взаимодействии фурилалкиламинов с фенил(2,4-дихлорфенил)изоцианатами в растворителе при температуре 60-80°С в течение 1-6 часов [Норицина М.В., Клочкова И.Н., Анисимова О.А. Синтез и нуклеофильные реакции некоторых фурилпропиламинов // Химия и технология фурановых соединений. Краснодар: Изд-во КПИ. - 1985. - С.34-41]:
Однако данный метод нельзя считать препаративно удобным, так как в реакцию легко вступают только первичные амины, образуя соответствующие карбамиды с выходами 65-76%. Вторичные амины реагируют только в жестких условиях (при длительном кипячении), выход не превышает 40%. Кроме того, метод предусматривает использование токсичных и дорогостоящих реактивов-арилизоцианатов.
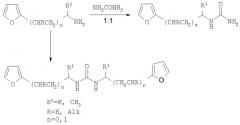
Конденсация фурилалкиламинов с мочевинами в эквимолярных соотношениях приводит преимущественно к образованию N-монозамещенных карбамидов, а при избытке субстратов - N,N'-дизамещенных карбамидов:
Существенным недостатком этого метода является отсутствие региоселективности, что обусловливает необходимость трудоемкого разделения смеси моно- и дипродуктов методом многократной дробной кристаллизации, что приводит к дополнительным трудозатратам и снижению выходы целевых продуктов до 20-25%.
Другие сведения относительно синтеза моно- и дифурилалкилкарбамидов в литературе отсутствуют.
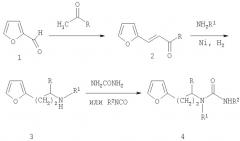
Разработанные нами ранее методы синтеза N-алкилфурилкарбамидов, рассмотренные выше, базируются на использовании в качестве субстратов аминоалкилфуранов, получаемых восстановительным аминированием фурфурола и продуктов его кротоновой конденсации с ацетальдегидом и ацетоном по технологической схеме, включающей стадии синтеза карбонильных соединений фуранового ряда 2 (см. схему ниже) из фурфурола 1 [Понамарев А.А. Синтезы и реакции фурановых веществ. Саратов: Изд-во СГУ. - 1960. - 243 с.], каталитического гидроаминирования с получением фурфуриламинов 3 [А. С.1204617 СССР, МПК С07D 207/08. Способ получения производных 3-(2-пирролидин)пропанолов. [И.Н.Клочкова, М.В.Норицина, О.Ю.Растегаев, О.А. Анисимова. Заявка 33709963, приор. от 09.01.84. Опубл. в БИ - 1986. - №2. - С.20] и ацилирования последних с получением соответствующих карбамидов фуранового ряда 4 [Норицина М.В., Клочкова И.Н., Анисимова О.А. Синтез и нуклеофильные реакции некоторых фурилпропиламинов // Химия и технология фурановых соединений. Краснодар: Изд-во КПИ. - 1985. - С.34-41].
R=H, СН3, С6Н5; R1=Н, СН3; R2=C6H5, 2,4-Cl2C6H3
Описанный способ получения фурилзамещещенных карбамидов является наиболее близким к заявляемому.
Поставленная задача достигается использованием новой технологической схемы получения N-алкилфурилкарбамидов, исключающей стадию синтеза и выделения фурилалкиламинов. Предлагаемый новый способ заключается в непосредственном взаимодействии карбонильных соединений фуранового ряда с NH- и NR-карбамидами в условиях каталитического гидроаминирования в присутствии гетерогенного катализатора, о чем сведений в литературе не имеется.
Процесс осуществляют в стальном вращающемся автоклаве в растворе абсолютного этанола в присутствии скелетного никелевого катализатора при соотношении субстрат-реагент 1:1 или 2:1 в течение 1,5-2 часов. Начальное давление электролитического водорода 60 атм, температурный режим 70-80°С. При температуре ниже 70°С возрастает время взаимодействия вследствие уменьшения скорости реакции. При увеличении температуры до 90-100°С наблюдается сильное осмоление реакционной смеси, что приводит к уменьшению выхода целевых продуктов. При оптимальном температурном режиме (70-80°С) результат составляет 72-87%, что соответствует увеличению выхода фурилкарбамидов в расчете на исходные карбонильные соединения в 1,8-2,0 раза (на 80-100%).
Теоретическое обоснование возможности непосредственного взаимодействия карбонильных субстратов и карбамидных реагентов иллюстрирует следующая схема:
Первоначально происходит нуклеофильная атака карбамидного реагента на электронодефицитный карбонильный атом субстрата с образованием продукта нуклеофильного присоединения - интермедиата А. Далее происходит внутримолекулярная дегидратация (интермедиат Б) и гидрирование этиленовой и иминной кратных связей. Карбонильная группа в этих условиях не восстанавливается. При избытке карбонильного субстрата возможна нуклеофильная атака второго атома азота карбамидного реагента, что приводит к образованию N,N'-диалкилфурилзамещенных мочевин I.
Существенным признаком данного технического решения, обусловливающим его новизну, является возможность получения целевого продукта I непосредственным взаимодействием фурановых карбонильных соединений с NH- или N-фенилмочевинами в условиях каталитического гидроаминирования, минуя стадию каталитического синтеза и выделения из реакционной смеси промежуточных продуктов - N-(алкилфурил)аминов, получаемых по способу [А.С. 1204617 СССР, С07D 207/08. Способ получения производных 3-(2-пирролидин)пропанолов. / И.Н.Клочкова, М.В.Норицина, О.Ю.Растегаев, О.А.Анисимова. Заявка 33709963, приор. от 09.01.84. Опубл. в БИ - 1986. - №2. - С.20].
Заявляемый способ получения соединений I является новым и осуществляется по реакции восстановительного аминирования фурфурола и 1,2-ненасыщенных карбонильных соединений фуранового ряда NH- и NR-карбамидами в среде абсолютного этанола при температуре 80°С и давлении водорода 60 атм в присутствии гетерогенного катализатора.
Технический уровень заявляемого способа обеспечивает совокупность положительных признаков, оптимизирующих процесс и повышающих его эффективность:
- высокий выход целевых продуктов;
- значительное сокращение времени синтеза;
- сокращение трудозатрат;
- исключение необходимости использования токсичных реагентов (изоцианаты) и растворителей (бензол, хлороформ, дихлорэтан и др.)
Изобретения иллюстрируются примерами конкретного выполнения.
Пример 1. Синтез N-[4-(2-фурил)-2-бутил]карбамида I.
В стальной вращающийся автоклав емкостью 250 мл помещают раствор, содержащий 27 г (0.2 моля) фурфурилиденацетона, 12 г (0.2 моля) мочевины в 110 мл абсолютного этанола и 2,7 г катализатора никеля скелетного, который получают выщелачиванием Ni-Al сплава, содержащего не меньше 40% Ni. Начальное давление электролитического водорода 120 атм, температура гидрирования 80°С. Необходимое количество водорода (100 атм) поглощается за 2 часа. По окончании реакции автоклав разгружают. Гидрогенизат отфильтровывают от катализатора и отгоняют растворитель. Остаток перекристаллизовывают из этанола. Получают белый мелкокристаллический продукт Iд, выход 27,2 г.(75%).
Найдено, %: С 59,48; Н 7,54; N 15,10. С9Н14N2O2.
Вычислено, %: С 59,34; Н 7,69; N 15,38.
В ИК спектре Iд валентные колебания ассоциированной вторичной амидной группы проявляются узкой интенсивной полосой в высокочастотной области спектра с максимумом 3240 см-1. Колебания связанной первичной амидогруппы в монозамещенном фурилалкилкарбамиде Iд обусловливают расщепление полосы валентных колебаний связи NH с появлением второго максимума в виде плеча в интервале 3360-3300 см-1. Валентные колебания карбонильной группы проявляются интенсивной полосой с положением максимума поглощения 1660 см-1. В спектре наблюдается полосы валентных и деформационных колебаний СН фуранового цикла (соответственно 3100 см-1, 730, 820 см-1) и алифатической цепи (соответственно 2940, 2860 см-1, 1430, 1380 см-1). Отсутствие широкой полосы валентных колебаний тидроксильной группы (3700-3400 см-1) свидетельствует о том, что фурилалкилкарбамид Iд существует в кристаллическом состоянии только в карбонильной форме.
В УФ спектре I наблюдается интенсивная полоса поглощения, связанная с π→π' переходами гетероароматического заместителя, и хромофорной группы с λ макс. 215 нм (lgε 3.94), а также слабоинтенсивный максимум запрещенного n→π' перехода с λ макс. 265 нм (lgε 2.38).
N-Фурфурилкарбамид (Iа), N-фурфурил-N'-фенилкарбамид (Iб), N-[3-(2-фурил)-1-пропил]-N'-фенилкарбамид (Iв), N-[4-(2-фурил)-2-бутил]-N'-фенилкарбамид (Iг) получены аналогично исходя из эквимолярных количеств мочевины или фенилмочевины и соответственно фурфурола, фурилакролеина и фурфурилиденацетона. Аналитические и спектральные характеристики карбамидов Iа-д представлены в таблицах 1, 2.
Пример 2. Синтез ди[N,N'-4-(2-фурил)-2-бутил]карбамида (Iж).
В стальной вращающийся автоклав емкостью 250 мл помещают раствор, содержащий 20,4 г (0.15 моль) фурфурилиденацетона, 9.5 г (0.07 моль) мочевины в 80 мл абсолютного этанола. Добавляют 2,1 г катализатора никеля скелетного. Начальное давление электролитического водорода 100 атм, температура 80-90°С. Автоклав выдерживают в режиме 4 часа, в течение которых поглощается необходимое количество водорода (53 атм). Автоклав разгружают, гидрогенизат освобождают от катализатора фильтрованием и отгоняют растворитель при пониженном давлении. Остаток перекристаллизовывают из этанола. Получают 17 г (77%) Iж в виде мелкокристаллического порошка белого цвета.
Найдено, %: С 67,51; Н 7,49; N 9,20. С17Н24N2О3.
Вычислено, %: С 67,10; Н 7,89; N 9,21.
ИК спектр, ν см-1: 3260 (NH), 3100 (=CH), 2960-2830 (СН, CH2), 1640 (ν C=O), 1600 (ν C=C), 1570 (δ NH), 1480, 1440, 1380 (δСН3, СН2).
Пример 3. Полевые испытания росторегулирующей активности фурилзамещенных мочевин.
Полевые испытания росторегулирующей активности бутилфурилмочевины I БФМ и дибутилфурилмочевины I ДиБФМ проводили на следующих культурах: люцерне сорта «Зайкевича» и «Медиа» в условиях Ершовской опытной станции (Саратовская область), томатах сорта «Новичок» в условиях совхоза «Энгельсский» (Саратовская область), пшенице сорта Саратовская-29 в условиях Аркадакской сельскохозяйственной опытной станции (Саратовская область). Опыты проводились в период с 1996 по 2004 г.г. Семена растений обрабатывались в течение 20 часов растворами фурилзамещенных мочевин в концентрациях 10-3% и 10-4% (10 мг/л или 1 мг/г действующего вещества соответственно) [Велик В.Ф., Кротова Р.А. Качество семян, способы предпосевной их обработки // Овощеводство открытого грунта. М.: Колос. - 1984, 108 с.]. В качестве контроля использовалась вода, стандартом в опытах с люцерной служил водный раствор янтарной кислоты с весовой концентрацией 2·10-3%, в опытах с пшеницей и томатами - водный раствор промышленного стимулятора роста и развития растений иммуноцитофита такой же концентрации.
Полевые испытания росторегулирующей активности бутилфурилмочевины Iд (БФМ-1) и дибутилфурилмочевины Iж (ДиБФМ-II) проводили на следующих культурах: люцерне сорта «Зайкевича» и «Медиа» в условиях Ершовской опытной станции (Саратовская область), томатах сорта «Новичок» в условиях совхоза «Энгельсский» (Саратовская область), пшенице сорта Саратовская-29 в условиях Аркадакской сельскохозяйственной опытной станции (Саратовская область). Опыты проводились в период с 1996 по 2004 г.г. Семена растений обрабатывались в течение 20 часов растворами фурилзамещенных мочевин в концентрациях 10-3% и 10-4% (10 мг/л или 1 мг/г действующего вещества соответственно) [Велик В.Ф., Кротова Р.А. Качество семян, способы предпосевной их обработки // Овощеводство открытого грунта. М.: Колос. - 1984, 108 с.]. В качестве контроля использовалась вода, стандартом в опытах с люцерной служил водный раствор янтарной кислоты с весовой концентрацией 2·10-3%, в опытах с пшеницей и томатами - водный раствор промышленного стимулятора роста и развития растений иммуноцитофита такой же концентрации.
Закладку опытов, уборку и учет урожайности проводили согласно Госстандарту [Методика государственных сортоиспытаний сельскохозяйственных культур. М. - 1985. - Вып.2. - 268 с.].
Семена пшеницы и люцерны высеивали на делянке площадью 25 м2 в 4-кратной повторности.
Для томатов получили рассаду, которую высаживали в открытый грунт через 46 дней после всходов на делянке площадью 20 м2 в 4-кратной повторности.
Опыты закладывались на черноземных и темно-каштановых почвах. Подготовка почвы включала лущение, зябевую вспашку на глубину 25-30 см, весенние боронование, двукратную культивацию.
В период вегетации томатов было проведено 6-8 поливов. Для пшеницы проводился один полив в конце кущения, однократный полив в период трубкования, двукратный полив в период колошения и молочной спелости.
Посев люцерны производили сплошным способом на делянках площадью 25 м2 с защитными зонами 1,5 м на орошаемых участках. Посевы держали 4 года. Ежегодно проводили два укоса зеленой массы.
Уборку урожая проводили ручным способом, учет урожайности проводили со всех учетных делянок. Томаты собирали по мере созревания плодов.
Для измерения и взвешивания рассады томатов брали по 10 растений с каждой повторности.
Результаты испытаний представлены в таблице 3.
Из данных таблицы 3 видно, что обработка семян люцерны как сорта «Зайкевича», так и сорта «Медиа» растворами фурилзамещенных мочевин в концентрации 10-4% положительно сказалась на продуктивности растений. Урожай зеленой массы в вариантах с фурилзамещенными мочевинами в этой концентрациях превысил контроль на 15-29 ц/га. Поскольку высота растений в этих вариантах была меньше, чем в контроле, то можно считать, что прибавка урожая произошла за счет увеличения кустистости. Такие растения удобнее подвергать механизированной уборке.
Положительный эффект от обработки фурилзамещенными мочевинами отмечен на пшенице (таблица 4). Фурилзамещенные мочевины повысили полевую всхожесть семян на 1-8% по сравнению с контролем.
В вариантах опыта с фурилзамещенными мочевинами существенно возросло количество продуктивных стеблей с 1 м2 - на (75-123 шт.), увеличилась масса 1000 зерен на 2-5 г, это привело к значительной (13-23%) прибавке урожая по сравнению с контролем. Росторегулирующую активность фурилзамещенные мочевины проявили так же в отношении томатов (таблицы 5,6).
Обработка замещенными мочевинами Iд, ж способствовала формированию у рассады более мощной корневой системы и надземной части растений, что указывает на интенсификацию под влиянием фурилзамещенных мочевин процессов клеточного метаболизма.
Использование фурилзамещенных мочевин для выращивания томатов также способствовало формированию более раннего урожая, который не успевал поражаться грибными и вирусными заболеваниями (таблица 5).
Под влиянием фурилзамещенных мочевин произошла значительная (5-90%) прибавка урожая плодов томатов по сравнению с контролем, а также улучшилась структура урожая (таблица 6). Возросло количество плодов с одного растения на 1-4 штуки и увеличилась масса одного плода на 6-23 г.
Приведенные данные свидетельствуют о росторегулирующем действии фурилзамещенных мочевин на кормовые (люцерна), зерновые (пшеница) и овощные (томат) культуры. Биологическая активность фурилзамещенных мочевин по некоторым показателем выше, чем у стандартных стимуляторов роста и развития растений (янтарная кислота и иммуноцитофит).
Пример 4: Полевые испытания иммуномоделирующей активности фурилзамещенных мочевин и лабораторные опыты по определению их влияния на активность фермента пероксидазы в проростках растений.
В полевых условиях на люцерне проводили учет степени пораженности растений вирусным заболеванием - микоплазмозом, на пшенице проводили наблюдения за степенью пораженности корневой гнилью, мучнистой росой и бурой ржавчиной, у томатов учитывали распространенность септориоза, вершинной гнили и фитофтороза. Фитосанитарная экспертиза на данных культурах проводилась в соответствии с рекомендациями Росинформагротех Министерства сельского хозяйства РФ [Фитосанитарная экспертиза сельскохозяйственных культур. М.: Росинформагротех Министерства сельского хозяйства РФ. - 2002. - 134 с.].
Учет степени пораженности растений и развития основных заболеваний проводили по известным методикам [Власов Ю.И. Методические указания по оценке люцерны на полевую устойчивость к микоплазмозу. Л.: ВИЗР. - 1989. - 35 с.]. Устойчивость люцерны к микоплазмозу оценивали визуально.
Учет распространения бурой ржавчины на пшенице проводили по шкале Петерсона.
Степень поражения мучистой росой в период молочно-восковой спелости оценивали по шкале Гемеле. Учет корневых гнилей проводили в фазе полных всходов и перед уборкой.
Учет болезни томата проводили путем осмотра растений на корню и при проведении сбора плодов [Ореховска М.В., Гуркина Л.К. Болезни томатов // Защита растений. - 1990. - №3. - С.54].
Статистическую обработку данных проводили по методу Доспехова [Доспехов Б.А. Методика опытного дела. М.: Колос. - 1985. - С.111].
В таблицах 7, 8, 9 приведены данные по изучению влияния фурилзамещенных мочевин на устойчивость растений к основным инфекциям вирусной и грибковой этиологии.
Результаты полевых испытаний указывают на то, что фурилзамещенные мочевины, интенсифицируя процессы клеточного метаболизма растений, индуцируют их устойчивость к заболеваниям.
Под воздействием обработки фурилзамещенными мочевинами снизилась степень поражения люцерны микоплазмом на 2-17% по сравнению с контролем (таблица 7).
Положительный эффект от обработки фурилзамещенными мочевинами отмечен на пшенице (таблица 9). Снижение степени пораженности корневой гнилью составило 0,4-1,8%, мучнистой росой 2,6-7,2%, бурой ржавчиной 13,4-24,9%.
Защитное действие фурилзамещенных мочевин выявлено и на томате (таблица 8). Под влиянием обработки фурилзамещенными мочевинами распространенность септориоза снизилась на 2,5-6,7%, вершинной гнили - на 1,5-5,6%, фитофтороза - на 17-53%.
Таким образом, из приведенных данных следует, что испытанные фурилзамещенные мочевины являются индукторами устойчивости растений, интенсифицируют защитные механизмы растений, вырабатывая в них неспецифическую резистентность к широкому кругу патогенов.
Иммунизирующее действие фурилзамещенных мочевин I и II оценивали также в лабораторных опытах по изменению активности фермента пероксидазы в растениях, полученных из обработанных фурилзамещенными мочевинами семян.
Активность пероксидазы определяли на проростках растений, выращенных в термостате в рулонах фильтровальной бумаги из обработанных фурилзамещенными мочевинами Iж, д семян по методу [Суслова Т.А. Хорошева Т.М. К вопросу о биохимических аспектах устойчивости микоплазмозу // Защита растений: Сб. научн. работ. Саратов. - Изд СХИ. - 1993. - С.111-119].
В растительной клетке фермент пероксидаза выполняет защитную функцию, поэтому усиление пероксидазной активности в растениях можно считать одной из форм их биологической защиты.
Под влиянием обработки фурилзамещенными мочевинами отмечена активация фермента пероксидазы в растениях в 1,5-2 раза по сравнению с контролем (таблицы 7, 8, 9). Установлена обратная коррелятивная зависимость (r=-0,25) между активностью пероксидазы и восприимчивостью изученных культур к основным грибковым и вирусным заболеваниям.
Таким образом, предварительно можно полагать, что под действием фурилзамещенных мочевин в клетках растений происходит интенсификация окислительно-восстановительных процессов, что приводит к накоплению перекиси водорода, являющейся одной из активных форм кислорода, принимающих участие в формировании иммунитета растений [Озерцковская О.Л., Васюкова Н.И. Действие иммуномодуляторов на устойчивость и восприимчивость картофеля к Phytophtora infestans // Физиология растений. - 2006. - Т.53. - №4. - С.546-553].
| Таблица 3Влияние фурилзамещенных мочевин на высоту растений и урожайность зеленой массы люцерны (среднее за четыре года) | ||||
| Вариант опыта | Сорт Зайкевича | Сорт Медиа | ||
| высота, м | урожай, ц/га | высота, м | урожай, ц/га | |
| Контроль | 0,87 | 158 | 0,92 | 188 |
| БФМ 10-3% | 0,86 | 148 | 0,92 | 184 |
| БФМ 10-4% | 0,87 | 173 | 0,87 | 217 |
| ДиБФМ 10-3% | 0,84 | 145 | 0,89 | 161 |
| ДиБФМ 10-4% | 0,85 | 183 | 0,87 | 197 |
| Стандарт (2·10-3%-ный раствор янтарной кислоты) | 0,90 | 175 | 0,88 | 175 |
| НСР05 | 0,02 | 0,4 | 0,01 | 0.3 |
| Таблица 4Влияние фурилзамещенных мочевин на структуру урожая и продуктивность пшеницы Саратовская 29 (среднее за два года) | |||||||
| Вариант опыта | Полевая всхожесть, % | Длина колоса, см | Число зерен в колосе, шт | Масса 1000 зерен, г | Количество продуктивных стеблей, шт/м2 | урожай | |
| ц/га | прибавка, % | ||||||
| Контроль | 66 | 7,6 | 14 | 19 | 371 | 32,0 | - |
| БФМ 10-3% | 67 | 7,7 | 13 | 22 | 475 | 39,2 | 23 |
| БФМ 10-4% | 71 | 7,9 | 14 | 23 | 456 | 37,9 | 19 |
| ДиБФМ 10-3% | 67 | 8,0 | 14 | 21 | 494 | 37,8 | 18 |
| ДиБФМ 10-4% | 72 | 8,1 | 14 | 24 | 446 | 36,2 | 13 |
| Стандарт (иммуноцитофит 5·10-3%) | 59 | 7,5 | 14 | 20 | 362 | 30,7 | - |
| НСР05 | 0,8 | 0,07 | 0,03 | 0,3 | 3,8 | 0,3 |
| Таблица 5Влияние фурилзамещенных мочевин на качество рассады и происхождение фаз органогенеза у томатов сорта Новичок (открытый грунт, среднее за два года) | ||||||
| Вариант опыта | Высота стебля, см | Длина корня, см | Фенофаза, % растений | |||
| до бутонизации | бутонизация | цветение | начало плодообразования | |||
| Контроль | 24,2 | 8,5 | 65 | 25 | 6 | 3 |
| БФМ 10-3% | 23,5 | 7,8 | 34 | 34 | 9 | 2 |
| БФМ 10-4% | 22,1 | 7,8 | 6 | 56 | 28 | 9 |
| ДиБФМ 10-3% | 25,0 | 8,8 | 3 | 16 | 38 | 44 |
| ДиБФМ 10-4% | 34,3 | 10,3 | 0 | 16 | 50 | 34 |
| Стандарт (иммуноцитофит 5·10-3%) | 18,9 | 9,2 | 25 | 44 | 6 | 25 |
| НСР05 | 0,2 | 0,08 | 0,3 | 0,9 | 0,02 | 0,7 |
| Таблица 6Влияние фурилзамещенных мочевин на урожайность томатов сорта Новичок в открытом грунте (среднее за два года) | ||||
| Вариант опыта | Количество плодов с 1 растения, шт | Масса 1 плода, г | урожай | |
| ц/га | прибавка, % | |||
| Контроль | 6,5 | 74 | 194 | - |
| БФМ 10-3% | 7,5 | 60 | 195 | 5 |
| БФМ 10-4% | 10,5 | 81 | 255 | 31 |
| ДиБФМ 10-3% | 8,6 | 86 | 296 | 53 |
| ДиБФМ 10-4% | 8,8 | 106 | 368 | 90 |
| Стандарт (иммуноцитофит 5·10-3%) | 11,8 | 78 | 312 | 61 |
| НСР05 | 0,05 | 0,3 | 1,8 |
| Таблица 8Влияние фурилзамещенных мочевин на устойчивость томата сорта Новичок к основным грибковым заболеваниям и активность фермента пероксидазы | |||||
| Вариант опыта | Распространенность, % | Фитофтороз | Активность пероксидазы, уд.ед/100 г | ||
| септориоз | вершинная гниль | степень развития, % | распространенность | ||
| Контроль | 6,7 | 11,8 | 3,4 | 80 | 3,6 |
| БФМ 10-3% | 4,2 | 10,3 | 3,3 | 67 | 4,9 |
| БФМ 10-4% | 2,8 | 6,2 | 1,2 | 27 | 7,1 |
| ДиБФМ 10-3% | 0 | 9,1 | 2,9 | 73 | 5,0 |
| ДиБФМ 10-4% | 1,3 | 8,4 | 1,8 | 31 | 5,9 |
| Стандарт - (иммуноцито-фит 5·10-3) | 6,7 | 9,3 | 2,6 | 46 | 2,6 |
| НСР05 | 0,02 | 0,1 | 0,04 | 0,2 | 0,06 |
| Таблица 9Влияние фурилзамещенных мочевин на степень пораженности пшеницы сорта Саратовская 29 грибковыми болезнями и активность фермента пероксидазы (среднее за два года) | |||||
| Вариант опыта | Корневая гниль, % | Мучнистая роса, % | Бурая ржавчина | Активность пероксидазы, уд.ед/100 г | |
| степень развития, % | Распространенность, % | ||||
| Контроль | 2,4 | 9,7 | 31,2 | 24,0 | 175 |
| БФМ 10-3% | 2,0 | 7,1 | 17,8 | 15,1 | 214 |
| БФМ 10-4% | 1,3 | 6,2 | 14,2 | 12,8 | 237 |
| ДиБФМ 10-3% | 0,6 | 4,6 | 6,3 | 13,0 | 238 |
| ДиБФМ 10-4% | 0,7 | 2,5 | 6,4 | 12,0 | 220 |
| Стандарт (иммуноцитофит 5·10-3) | 1,5 | 3,8 | 3,8 | 20,3 | 200 |
| НСР05 | 0,01 | 0,12 | 0,3 | 0,7 | 1,8 |
Таким образом, в результате лабораторных опытов и медкоделяночных испытаний в течение длительного периода установлены преимущества фурилбутилмочевины (Iд) и дибутилфурилмочевины (Iж) перед синтетическим аналогом по биологическому действию - фурилзамещенной акриловой кислотой и ее производными (II), являющимися регулятором овощей и фруктов, поскольку заявляемые соединения I обладают новым видом биологического действия, отсутствующим у аналога II, а именно: иммуномоделирующей активностью в отношении ряда зерновых, кормовых и овощных культур. Выявлены также преимущества соединений I по сравнению с разрешенными к применению на территории РФ прототипами - препаратами монурон, иммуноцитофит, янтарная кислота. Указанные препараты не обладают иммуномоделирующим эффектом. Расход монурона составляет 4 кг/га, что создает ряд технологических и экономических трудностей и экологических проблем. Кроме того, растворы этого препарата неустойчивы при хранении.
Предлагаемые соединения формулы I применяются в низкой концентрации (10-4%) только для предпосевной обработке семян при норме расхода 50 мг/га. Соединению устойчивы в водных растворах, бесцветны, не имеют запаха, малотоксичны (LD50 составляет 1350-1500 мг/кг массы животного (беспородные белые мыши) при внутрибрюшном введении в виде водного раствора).
Препараты формулы I интенсифицируют процессы клеточного метаболизма, что приводит к морфогенезу - формированию мощной корневой системы и надземной части растений, обеспечивая их быстрый рост и развитие в стадиях вегетации, цветения, колошения и плодоношения. В результате морфогенетического и иммуномоделирующего действия препаратов формулы I по сравнению с эталонами имеет место увеличение общей товарной урожайности, повышение устойчивости растений к заболеваниям вирусной и грибковой этиологии, что ведет к повышению уровня рентабельности производства овощных, зерновых и кормовых культур.
Способ получения заявленных веществ формулы I является новым, препаративно удобным, основанным на использовании продуктов основного органического синтеза и фурфурола, имеющего ежегодно возобновляемую сырьевую базу в виде отходов деревообрабатывающей промышленности и сельскохозяйственного производства.
Новые препараты формулы I расширяют арсенал высокоэффективных регуляторов роста, повышающих устойчивость растений к заболеваниям и проявляющих одновременно морфогенетическую активность.
Соединения указанного ряда проявляют пестицидную активность, конкретно, росторегулирующее и биостимулирующее действие. Обнаруженное положительное влияние препаратов на интенсификацию ростовых процессов, качественные и количественные показатели урожайности, семенной продуктивности и повышение устойчивости к ряду заболеваний грибковой этиологии важнейших зерновых и овощных культур открытого и защищенного грунта позволяет предположить возможность применения заявляемых соединений в сельскохозяйственном производстве в качестве регуляторов роста.
1. N-(2-фурилалкил)-NHR карбамиды формулы
проявляющие росторегулирующую и иммуномоделирующую активность.
2. Способ получения фурилалкилкарбамидов по п.1, заключающийся во взаимодействии фурфурилиденацетона с мочевиной в условиях гидроаминирования в автоклаве в присутствии скелетного никелевого катализатора и органического растворителя при температуре 70-90°С, при этом соотношение субстрат-реагент составляет 1:1 или 2:1.