Селективные антагонисты r-кадгерина и способы
Иллюстрации
Показать всеПредложен выделенный циклический пептид, имеющий аминокислотную последовательность Cys-Ile-Xaa-Ser-Cys (SEQ ID NO:7); где Хаа представляет собой аминокислотный остаток, выбранный из группы, состоящей из Asp, Asn, Glu и Gin, и содержащий дисульфидную связь между двумя остатками Cys, который можно использовать в качестве селективного антагониста R-кадгерина млекопитающих. Селективные пептиды-антагонисты R-кадгерина по изобретению могут использоваться для ингибирования нацеливания гематопоэтической стволовой клетки (HSC) на развивающуюся сосудистую сеть, для ингибирования опосредованной R-кадгерином клеточной адгезии и ингибирования ангиогенеза сетчатки. 5 н. и 3 з.п. ф-лы, 12 ил.
Реферат
Перекрестная ссылка на родственные заявки
По заявке испрашивается приоритет предварительной заявки США, серийный номер 60/467188, поданной 1 мая 2003, которая приведена здесь в качестве ссылки.
Изложение интереса правительства
Изобретение сделано при поддержке правительства Соединенных Штатов, гранты № EY11254 и EY12598 Национальных Институтов Здоровья. Правительство Соединенных Штатов обладает определенными правами на настоящее изобретение.
Область техники, к которой относится изобретение
В целом, изобретение относится к антагонистам молекул клеточной адгезии млекопитающих. Более конкретно, изобретение относится к селективным пептиднам, которые являются антагонистами R-кадгерина (кадгерина-4) млекопитающих, и способам ингибирования клеточной адгезии и, следовательно, ангиогенеза сетчатки.
Уровень техники
Семейство молекул кадгерина состоит из трансмембранных гликопротеидов, которые функционируют в кальций-зависимых селективных межклеточных взаимодействиях. Эти молекулы играют важную роль в ходе эмбрионального развития и морфогенеза ткани, участвуя в клеточном распознавании и сортировке клеток. Подсемейства кадгеринов (классические кадгерины, протокадгерины, десмоколлины и другие белки, относящиеся к кадгеринам) характеризуются разнообразными внеклеточными доменами кадгерина, единичным трансмембранным сегментом и единичным цитоплазматическим доменом. Как сообщается, так называемые классические кадгерины (то есть E, P, N и R-кадгерин) содержат пять тандемно повторяющихся внеклеточных доменов кадгерина (EC1-EC5), которые участвуют, предпочтительно, в гомофильных взаимодействиях, и высококонсервативный цитоплазматический хвост, который опосредует специфические сигналы адгезии в клетке.
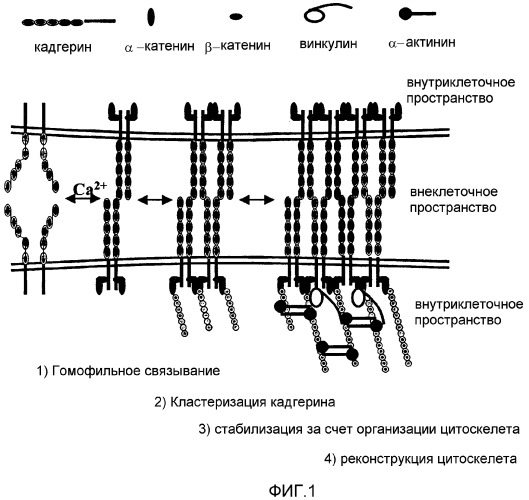
Опосредованная кадгерином межклеточная адгезия происходит как экспрессия множества молекул кадгерина при взаимодействии прилегающих клеток, что приводит к формированию адгезивных связей. Согласно модели зиппера для кадгерина, предложенной Shapiro et al. Nature 1995; 374 (6520): 327-37, молекулы кадгерина в мембране одной клетки образуют плотные димеры с параллельными цепочками (то есть так называемые цис-димеры). Как показано на фиг.1, эти цис-димеры затем связываются с димерами кадгерина, экспрессированными на прилегающих клетках (то есть происходит транс-димеризация). Когда поддерживается достаточное взаимодействие, может возникать кластеризация кадгерина, поскольку все большее количество молекул кадгерина вовлекается в сайт взаимодействия, что приводит к переплетению молекул поверхностей двух клеток. Таким образом, относительно слабые взаимодействия могут объединяться с образованием довольно прочной межклеточной адгезии.
Сначала, при адгезии кадгерина внутриклеточные сигналы, передаваемые через взаимодействия цитоплазматических хвостов кадгерина с молекулами α и β катенина, приводят к преобразованию цитоскелета. Несмотря на то, что объединение с актиновыми филаментами, как считается, не влияет на гомофильное связывание, их объединение помогает удерживать молекулы кадгерина в местах взаимодействия. В симбиотическом типе взаимоотношения кластеризация кадгерина вызывает преобразование цитоскелета и обеспечивает точки присоединения на мембране, которые являются важными для клеточных изменений, происходящих после формирования адгезивных контактов. В это время объединение с цитоскелетом удерживает кадгерины в местах взаимодействия и помогает вовлекать новые молекулы кадгерина, таким образом приводя к кластеризации кадгерина. В ходе кластеризации кадгерина кальций играет важную роль кофактора. В растворах с недостаточной концентрацией ионов кальция (то есть приблизительно ниже 2 мМ) кадгерин теряет свою функцию, и молекулы становятся более чувствительными к протеазной деградации. Кальций необходим для стабилизации структуры молекул кадгерина и обеспечивает правильную ориентацию прилегающих поверхностей кадгерина, поэтому в его отсутствие происходит потеря функции кадгерина и протеазная деградация.
Несмотря на то, что, как сообщается, каждый из пяти внеклеточных доменов классического кадгерина, от EC1 до EC5, играет важную роль в обеспечении димеризации кадгерина, на основе мутационного анализа было сделано предположение, что большинство остатков, которые образуют поверхность димеризации, было обнаружено на N-конце самого большего домена кадгерина (EC1) (Kitagawa, et al., Biochem. Biophys. Res. Commun., 2000; 271(2):358-63). Однако о механизмах специфичной гомодимеризации между молекулами кадгерина известно относительно немного.
Кадгерины играют значительную роль в контроле нейронов и развитии центральной нервной системы. Как сообщается, различные отделы мозга определяются экспрессией различных типов кадгерина при дифференциации. Кадгерины также играют важную роль в невральном развитии сетчатки за счет специфичной экспрессии в различных областях развивающейся сетчатки. Например, как сообщается, в ходе развития сетчатки эмбриона курицы, B-кадгерин обнаружен только в глии Мюллера, в то время как определенные популяции биполярных клеток экспрессируют R-кадгерин (также известный, как кадгерин-4). Амакринные клетки и субпопуляция ганглионарных клеток экспрессируют кадгерины 6B и 7. Во внутреннем плексиформном слое сетчатки эти же кадгерины экспрессируются только в подслоях, связанных с синапсин-I-позитивными нервными окончаниями, что дает основание для предположения, что различные профили экспрессии вносят свой вклад в формирование синапса между специфическими субпопуляциями нейронов в ходе развития сетчатки. В зародышевом зрительном нерве разрастание аксона ганглионарной клетки опосредовано адгезией N-кадгерина с глиальными клетками, экспрессирующими R-кадгерин.
Адгезия кадгеринов также играет роль в васкуляризации сетчатки при развитии (Dorrell, et al. Invest. Ophthalmol. Vis. Sci. 2002; 43 (11):3500-10). Нарушение адгезии R-кадгерина в ходе формирования поверхностного сплетения сосудов приводит к потере сложных соединений сосудов, наблюдаемых при нормальном формировании сосудов. При блокировании адгезии R-кадгерина в ходе последующего формирования глубоких сосудистых слоев ключевые направляющие сигналы утрачиваются, что приводит к миграции сосуда за пределы нормальной глубины сплетения сосудов в слой зрительных рецепторов.
Сетчатка состоит из четких слоев нейронных, глиальных и сосудистых элементов. Любое заболевание или состояние, которое даже незначительно изменяет слои сетчатки, может привести к дегенерации нейронов и значительной потере зрения. В течение более чем 70 лет в качестве модели для многих заболеваний, которые приводят к гибели клеток зрительных рецепторов, исследовали мышь с дегенерацией сетчатки (мышь rd/rd). У мыши rd/rd, дегенерация зрительных рецепторов начинается в первые три недели после рождения, поскольку палочковидные клетки подвергаются апоптозу, который возникает в результате мутации в β субъединице цГМФ-зависимой фосфодиэстеразы, что приводит к гибели колбочек, зрительных рецепторов. Сосудистая атрофия в сетчатке также связана во времени с гибелью клеток зрительных рецепторов у мышей rd/rd. По всей видимости, нормальное формирование сосудистой сети происходит при развитии трех функциональных слоев в течение первых трех недель. Однако когда сосуды в глубоком сосудистом слое начинают дегенерировать в течение второй недели, и к концу четвертой недели после рождения наблюдают существенное уменьшение числа сосудов, происходит почти полное исчезновение глубоких и промежуточных сосудистых сплетений.
В нормальном кровотоке и костном мозге взрослого организма присутствует популяция гематопоэтических стволовых клеток, от которой могут дифференцироваться различные субпопуляции клеток по положительной линии (Lin+HSC) или отрицательной линии (Lin-HSC). Кроме того, авторы настоящего изобретения обнаружили, что в субпопуляции Lin-HSC присутствуют эндотелиальные клетки-предшественники (EPC), способные формировать кровеносные сосуды in vitro и in vivo. EPC в популяции Lin-HSC могут воздействовать и стабилизировать дегенерирующую сосудистую сеть у мышей rd/rd при внутриглазном введении мышам. В поверхностный сосудистый слой вводили астроциты, мишени Lin-HSC и наблюдали за эндогенной развивающейся сосудистой сетью после инъекции на 2 день после рождения (P2). При достижении эндогенной сосудистой сетью периферии сетчатки, куда нацеливались Lin-HSC, клетки встраивались в новые кровеносные сосуды с образованием функциональных мозаичных сосудов со смешанными популяциями введенных Lin-HSC и эндогенными эндотелиальными клетками. Кроме того, Lin-HSC нацеливаются на области глубоких и промежуточных сосудистых слоев сетчатки до возникновения васкуляризации этих слоев за счет эндогенных эндотелиальных клеток. Включение Lin-HSC восстанавливает глубокую сосудистую сеть мышей rd/rd приблизительно в 2-3 раза сильнее по сравнению с нормальными мышами и контрольными мышами, которым вводили Lin+HSC. Кроме того, восстановление глубокой сосудистой сети предотвращает деградацию зрительных рецепторов во внешнем ядерном слое сетчатки. Однако, поскольку нет никакого основания для предложения, что эти стволовые клетки могут подвергаться дифференциации в нейроны сетчатки или глиальные клетки, механизм защиты нейронов остается неизвестным.
Нацеливание Lin-HSC на астроциты и глубокие сосудистые области перед естественной васкуляризацией предполагает, что Lin-HSC экспрессируют молекулы клеточной поверхности, которые действуют при нацеливании, сходном с нацеливанием эндогенных эндотелиальных клеток в ходе развития. Адгезия R-кадгерина играет важную роль в нацеливании эндотелиальных клеток на астроциты и сосудистые сплетения в ходе ангиогенеза сетчатки при развитии.
R-кадгерин был идентифицирован и секвенирован у большого числа млекопитающих. На фиг.2 показана аминокислотная последовательность (SEQ ID NO: 1) варианта препробелка R-кадгерина человека, описанного Kitagawa et al. в базе данных SWISS-PROT под номером NP 001785, версия NP 001785,2, GI: 14589893, соответствующее описание которого приведено здесь в качестве ссылки. SEQ ID NO: 1 включает аминокислотную последовательность IDSMSGR (SEQ ID NO: 2) в положениях 222-228.
На фиг.3 показана аминокислотная последовательность (SEQ ID NO: 3) еще одного варианта препробелка R-кадгерина человека, описанного Tanihara et al. в базе данных SWISS-PROT под номером NP P55283, версия P55283, GI: 1705542, соответствующее описание которого приведено здесь в качестве ссылки. SEQ ID NO: 3 включает аминокислотную последовательность INSMSGR (SEQ ID NO: 4) в положениях 222-228.
На фиг.4 показана аминокислотная последовательность (SEQ ID NO: 5) варианта препробелка R-кадгерина мыши (мышь домашняя), описанного Hutton et al. в базе данных SWISS-PROT под номером NP 033997, версия NP 033997,1, GI:6753376, соответствующее описание которого приведено здесь в качестве ссылки. SEQ ID NO: 5 включает аминокислотную последовательность IDSMSGR (SEQ ID NO: 2) в положениях 219-225.
Неселективные пептидные антагонисты кадгеринов, включая аминокислотную последовательность His-Ala-Val (HAV), описаны Blaschuket al. в патенте США № 6465427, № 63456512, № 6169071, и № 6031072. Blaschuket al. описали как линейные, так и циклические пептидные антагонисты кадгеринов, все из которых могут противодействовать множеству типов молекул кадгерина без различия.
Селективные пептидные антагонисты N-кадгерина, которые содержат аминокислотную последовательность Ile-Asn-Pro (INP), были описаны Williams et al., Mol. Cell Neurosci.,2000; 15(5): 456-64. В то время как пептиды HAV представляют собой неспецифичные антагонисты кадгеринов, пептидные антагонисты INP, описанные Williams et al., являются специфичными в отношении N-кадгерина и не проявляют существенного связывания с другими молекулами кадгерина, такими как R-кадгерин.
Вследствие различного распределения молекул клеточной адгезии в различных тканях организма, существует постоянная потребность в антагонистах, селективных к специфичным молекулам клеточной адгезии, в особенности в антагонистах, селективных к R-кадгерину. Селективные пептиды-антагонисты R-кадгерина настоящего изобретения удовлетворяют этой потребности.
Сущность изобретения
Выделенный пептид, применимый в качестве селективного антагониста R-кадгерина млекопитающих, содержит от 3 до 30 аминокислотных остатков, три соседних остатка пептида имеют аминокислотную последовательность Ile-Xaa-Ser (IXS); где Xaa представляет собой аминокислотный остаток, выбранный из группы, включающей Asp, Asn, Glu и Gln. Предпочтительно, Xaa представляет собой Asp или Asn. В одном из предпочтительных вариантов осуществления пептид содержит по меньшей мере семь аминокислотных остатков, и семь соседних аминокислотных остатков пептида имеют аминокислотную последовательность Ile-Xaa-Ser-Met-Ser-Gly-Arg (SEQ ID NO: 6), где Xaa представляет собой такие же остатки, как определено выше. Настоящее изобретение также относится к фармацевтическим композициям, содержащим пептиды-антагонисты R-кадгерина в фармацевтически приемлемом носителе.
В еще одном предпочтительном варианте осуществления пептид представляет собой циклический пептид, содержащий от 3 до 10 аминокислотных остатков, выстроенных в кольцо, три соседних остатка пептида имеют аминокислотную последовательность Ile-Xaa-Ser; где Xaa представляет собой аминокислотный остаток, выбранный из группы, включающей из Asp, Asn, Glu и Gln. Предпочтительно, Xaa представляет собой Asp или Asn.
Предпочтительный циклический пептид имеет формулу:
где X1 и X2 независимо представляют собой аминокислотный остаток или множество аминокислотных остатков до 10, связанных пептидными связями; Y1 и Y2 независимо представляют собой аминокислотные остатки, связанные друг с другом дисульфидной связью, и Xaa представляет собой аминокислотный остаток, выбранный из группы, включающей Asp, Asn, Glu и Gln.
Особенно предпочтительный циклический пептид имеет аминокислотную последовательность: циклическая Cys-Ile-Xaa-Ser-Cys (SEQ ID NO: 7); где Xaa представляет собой аминокислотный остаток, выбранный из группы, включающей Asp, Asn, Glu и Gln, и пептидное кольцо сформировано с помощью дисульфидной связи между двумя остатками цистеина.
Способ ингибирования опосредованной R-кадгерином клеточной адгезии предусматривает введение клеток, экспрессирующих R-кадгерин, в контакт с ингибирующим адгезию количеством селективного пептида-антагониста R-кадгерина настоящего изобретения. Например, ангиогенез сетчатки ингибируют путем введения пациенту, страдающему от патологического сосудистого ангиогенеза сетчатки, ингибирующего ангиогенез количества пептида-антагониста R-кадгерина настоящего изобретения. Таким же образом, нацеливание отрицательной линии гематопоэтических стволовых клеток на развивающуюся сосудистую сеть ингибируют путем введения стволовых клеток в контакт с ингибирующим нацеливание на сосудистую сеть количеством селективного пептида-антагониста R-кадгерина настоящего изобретения. Ингибированное нацеливания Lin-HSC, таких как эндотелиальные клетки-предшественники, на развивающуюся сосудистую сеть полезно для лечения заболеваний, связанных с патологическим развитием сосудов, таким как возрастная дегенерация желтого пятна и диабетическая ретинопатия.
Краткое описание чертежей
В разделе чертежей на фиг.1 представлена схема кластеризации кадгерина и кадгерин-регулируемой клеточной адгезии;
на фиг.2 показана аминокислотная последовательность варианта препробелка R-кадгерина человека (SEQ ID NO: 1), содержащего последовательность IDSMSGR (SEQ ID NO: 2) при остатках 222-228;
на фиг.3 показана аминокислотная последовательность варианта препробелка R-кадгерина человека (SEQ ID NO: 3), содержащего последовательность INSMSGR (SEQ ID NO: 4) при остатках 222-228;
на фиг.4 показана аминокислотная последовательность варианта препробелка R-кадгерина мыши (SEQ ID NO: 5), содержащего последовательность IDSMSGR (SEQ ID NO: 2) при остатках 229-225;
на фиг.5 (A) отражена гомология последовательностей при остатках 24-92 N-кадгерина мыши и различных R-кадгеринов (консервативные остатки (синие) и неконсервативные (красные) остатки); отмечается гомология между R-кадгеринами млекопитающих от человека, мыши и крысы, каждый из которых содержит последовательность IDS или INS при остатках 53-55, в отличие от R-кадгерина курицы и N-кадгерина мыши, которые содержат последовательность IDP и INP, соответственно, при остатках 53-55; (B) циклические и линейные пептиды, в этой области, соответствующие остаткам R-кадгерина мыши и человека и N-кадгерина мыши, синтезировали наряду с соответствующими контрольными пептидами: циклический CIDSC (SEQ ID NO: 8), циклический CINPC (SEQ ID NO: 9), IDSMSGR (SEQ ID NO: 2), IDSASGR (SEQ ID NO: 10), INPASGQ (SEQ ID NO: 11), циклический CSDIC (SEQ ID NO: 12) и циклический CRADC (SEQ ID NO: 13); частичные последовательности кадгерина, приведенные на фиг.5 (A), представляют собой сверху вниз: N-кадгерин мыши (SEQ ID NO: 14), R-кадгерин мыши (SEQ ID NO: 15), R-кадгерин крысы (SEQ ID NO: 16), R-кадгерин человека (SEQ ID NO: 17), другой R-кадгерин человека (SEQ ID NO: 18) и R-кадгерин курицы (gallus gallus) (SEQ ID NO: 19);
на фиг.6 (A) изображены микрофотографии, демонстрирующие агрегацию L-клеток, экспрессирующих R-кадгерин и N-кадгерин; (B) представляет собой столбчатую диаграмму процента агрегации L-клеток, опосредованной R и N-кадгеринами в присутствии и в отсутствие кальция;
на фиг.7 продемонстрирована устойчивая трансфекция L-клеток R-кадгерином и N-кадгерином; (A) иммуноблоттинг R-кадгерина; (B) иммуноблоттинг N-кадгерина; (C-E) микрофотографии окрашенных L-клеток, демонстрирующих экспрессию R-кадгерина (C) и N-кадгерина (D), по сравнению с клетками, не экспрессирующими ни R-кадгерин, ни N-кадгерин (E);
на фиг.8 графически представлено селективное ингибирование агрегации L-клеток, экспрессирующих кадгерин, с помощью пептидов, содержащих IDS, которые связываются с клетками, экспрессирующими R-кадгерин, по сравнению с пептидами, содержащими INP, которые связываются с клетками, экспрессирующими N-кадгерин;
на фиг.9 отражено селективное ингибирование васкуляризации сетчатки мыши после интравитреальной инъекции циклического CIDSC (SEQ ID NO: 8) по сравнению с циклическим CINPC (SEQ ID NO: 9); на (A) отображены микрофотографии сетчаток мышей rd/rd на стадии развития P2; на (B) отображены микрофотографии сетчаток мышей rd/rd на стадии развития P7; (C) представляет собой столбчатую диаграмму поверхностной васкуляризации; (D) представляет собой столбчатую диаграмму глубокой васкуляризации;
на фиг.10 отражены результаты анализа проточной цитометрии экспрессии R-кадгерина в гематопоэтических стволовых клетках (HSC);
на фиг.11 отображены поперечные микрофотографии сетчаток мышей rd/rd, обработанных различными пептидами изобретения и контрольными пептидами; и
на фиг.12 отражено блокирование нацеливания Lin-HSC на развивающуюся сосудистую сеть сетчатки пептидами-антагонистами R-кадгерина изобретения.
Подробное описание предпочтительных вариантов осуществления
Как используется здесь и в прилагаемой формуле изобретения, термин "циклический пептид" относится к молекулам, содержащим множество аминокислот, соединенных в цепь пептидными связями, концы данной цепи соединены с образованием кольца аминокислотных остатков. Циклический пептид может быть соединен пептидной связью, дисульфидной связью между двумя аминокислотными остатками, такими как остатки цистеина, или посредством любой другой подходящей связующей группы. Непептидные связующие группы могут представлять собой любое химическое соединение, способное реагировать с функциональными группами на каждом конце пептидной цепи для образования связи между ними. Например, два конца пептидной цепи можно связать с помощью небелковой аминокислоты, такой как, например, 3-аминомасляная кислота, или дисульфида, образованного непептидными тиоловыми группами, такими как амид тиогликолевой кислоты на амино-конце и амид, образованный из 2-аминоэтантиола на карбокси-конце.
Как используется здесь и в прилагаемой формуле изобретения, термин "фармацевтически приемлемый" и его грамматические варианты, при указании на носители и другие инертные наполнители, означает, что такие материалы могут использоваться для введения пациенту человеку без образования нежелательных физиологических побочных эффектов, таких как раздражение сетчатки или глаз, тошнота, головокружение, неясное или ослабленное зрение, цитотоксичность и тому подобное.
Термин "аминокислота", как используется здесь и в прилагаемой формуле изобретения, в целом, относится к любой альфа-аминокислоте. Предпочтительно, пептиды настоящего изобретения содержат 21 аминокислоту, кодируемую генетическим кодом, хотя также могут быть включены измененные аминокислотные остатки. Аминокислоты могут быть в L, D или D, L форме. Предпочтительно, пептиды по настоящему изобретению содержат аминокислоты L-формы. Чтобы минимизировать вероятность протеиназнойдеградации in vivo, вводимые пептиды настоящего изобретения могут включать один или более аминокислотных остатков в D-форме.
Выделенный пептид, являющийся селективным антагонистом R-кадгерина млекопитающего, содержит от 3 до 30 аминокислотных остатков, три соседних остатка пептида имеют аминокислотную последовательность Ile-Xaa-Ser. Xaa представляет собой аминокислотный остаток, выбранный из группы, состоящей из Asp, Asn, Glu и Gln. Предпочтительно, Xaa представляет собой Asp или Asn. Пептид-антагонист R-кадгерина настоящего изобретения может быть линейным или циклическим.
Селективные пептиды-антагонисты R-кадгерина по настоящему изобретению воспроизводят последовательности Ile-Asp-Ser и Ile-Asn-Ser, найденные в домене EC1 R-кадгерина млекопитающих, но не в других молекулах кадгерина. Пептиды, содержащие последовательность Ile-Xaa-Ser, могут связываться с молекулами R-кадгерина млекопитающих и противодействовать им. Xaa, предпочтительно, представляет собой остаток аспарагиновой кислоты (Asp) или остаток аспарагина (Asn), для соответствия природной последовательности в молекулах R-кадгерина млекопитающих. Остатки глутаминовой кислоты (Glu) и глутамина (Gln) также подходят в качестве Xaa из-за химического сходства с Asp и Asn, соответственно.
В одном предпочтительном варианте осуществления пептид содержит, по меньшей мере, семь аминокислотных остатков, и семь соседних аминокислотных остатков пептида имеют аминокислотную последовательность Ile-Xaa-Ser-Met-Ser-Gly-Arg (SEQ ID NO: 6). Xaa представляет собой аминокислотный остаток, выбранный из группы, состоящей из Asp, Asn, Glu и Gln. Предпочтительно, Xaa представляет собой Asp или Asn.
В другом предпочтительном варианте осуществления пептид представляет собой циклический пептид, содержащий от 3 до 10 аминокислотных остатков, выстроенных в кольцо, три соседних остатка пептида имеют аминокислотную последовательность Ile-Xaa-Ser; где Xaa представляет собой аминокислотный остаток, выбранный из группы, включающей Asp, Asn, Glu и Gln. Предпочтительно, Xaa представляет собой Asp или Asn.
Предпочтительный циклический пептид с пятью аминокислотами, выстроенными в кольцо, имеет формулу:
где X1 и X2 независимо представляют аминокислотный остаток или множество аминокислотных остатков до 10, связанных пептидными связями; Y1 и Y2 независимо представляют аминокислотные остатки, связанные друг с другом дисульфидной связью, и Xaa представляет собой аминокислотный остаток, выбранный из группы, включающей Asp, Asn, Glu и Gln. Предпочтительно, Y1 и Y2 представляют собой остатки цистеина, соединенные дисульфидной связью (то есть остаток цистина).
Особенно предпочтительный циклический пептид имеет аминокислотную последовательность: цикло Cys-Ile-Xaa-Ser-Cys (SEQ ID NO: 7); где Xaa представляет собой аминокислотный остаток, выбранный из группы, включающей Asp, Asn, Glu и Gln, и данное кольцо сформировано с помощью дисульфидной связи между двумя остатками цистеина. Предпочтительно, Xaa представляет собой Asp или Asn.
Способ ингибирования опосредованной R-кадгерином клеточной адгезии предусматривает введение клеток, экспрессирующих R-кадгерин, в контакт с ингибирующим адгезию количеством селективного пептида-антагониста R-кадгерина настоящего изобретения. Клетки можно ввести в контактс пептидомантагонистом in vivo путем введения ингибирующего клеточную адгезию количества антагониста млекопитающему, страдающему заболеванием или состоянием, лечение которого можно осуществлять путем ингибирования опосредованной R-кадгерином клеточной адгезии (например, заболевания сетчатки, характеризующиеся патологической пролиферацией сосудов). Например, человека, страдающего возрастной дегенерацией желтого пятна или диабетической ретинопатией, можно лечить с помощью селективного пептида-антагониста R-кадгерина по настоящему изобретению. Предпочтительно, антагонист вводят в виде фармацевтической композиции, содержащей антагонист и фармацевтически приемлемый носитель.
Для селективного нацеливания или антагонизма R-кадгерина пептиды и композиции по настоящему изобретению можно вводить в терапевтически эффективном количестве парентерально, перорально, с помощью ингаляции или местно в стандартной лекарственной форме вместе с фармацевтически приемлемыми носителями, средствами доставки и адъювантами. Термин "парентеральный", как используется здесь, включает внутривенное, подкожное, внутримышечное, надчревное, внутриглазничное (например, в стекловидное тело) и интраперитонеальное введение, а также введение путем инфузии.
Можно использовать любой подходящий путь введения, и фармацевтическую композицию, включая селективный пептид-антагонист R-кадгерина по настоящему изобретению, вводят в дозе, эффективной для предполагаемого лечения. Специалист в данной области легко определит терапевтически эффективные количества, необходимые для лечения конкретного медицинского состояния или ингибирования его развития, применяя предклинические и клинические исследования, известные в области медицины.
Термин "терапевтически эффективное количество", как используется здесь, относится к количеству активного ингредиента, которое оказывает биологический или лечебный эффект на медицинскую ткань, систему, животное или человека, которого добивается врач или исследователь.
Термин "ингибировать", как используется здесь, относится к замедлению, задержке или прекращению медицинского состояния или биохимического взаимодействия, но не обязательно указывает на полное прекращение состояния или полное устранение взаимодействия. Длительное сохранение эффекта у пациента или длительное снижение тяжести симптомов указывает на то, что медицинское состояние положительно контролируется (то есть ингибировано).
Режимы дозировки для пептидов-антагонистов R-кадгерина по настоящему изобретению и содержащих его композиций основаны на нескольких факторах, таких как возраст, вес, пол и тип заболевания у пациента, тяжесть состояния, путь введения и антагонистическая активность конкретного используемого пептида-антагониста. Режим дозировки можно изменять в зависимости от вышеупомянутых факторов. Например, для ингибирования ангиогенеза сетчатки применяют уровни дозировки с порядком от приблизительно 0,01 мг до приблизительно 1000 мг на килограмм веса тела. Предпочтительные уровни дозировки находятся в диапазоне от приблизительно 0,01 мг до приблизительно 100 мг на килограмм веса тела.
Для введения путем инъекции композицию, содержащую пептид по настоящему изобретению, составляют вместе с фармацевтически приемлемым носителем, таким как вода, солевой раствор или водный раствор декстрозы. Для инъекции типичная суточная доза составляет от приблизительно 0,01 мг до приблизительно 100 мг на килограмм веса тела, которую вводят ежедневно в качестве однократной дозы или в качестве многократной дозы в зависимости от указанных выше факторов.
Фармацевтические композиции по настоящему изобретению, содержащие селективный пептид-антагонист R-кадгерина по изобретению и фармацевтически приемлемый носитель, могут также содержать фармацевтически приемлемые инертные наполнители. Фармацевтически приемлемые инертные наполнители, которые могут входить в состав фармацевтических композиций по настоящему изобретению, включают, например, физиологически переносимые поверхностно-активные вещества, растворители, забуференные агенты, консерванты и тому подобное, хорошо известные из уровня техники.
Например, для ингибирования ангиогенеза сетчатки пациенту, страдающему от патологической пролиферации сосудов сетчатки, вводят терапевтически эффективное количество пептида антагониста R-кадгерина по настоящему изобретению. Введенный пептид селективно связывается с R-кадгерином в сетчатке, таким образом, прерывая и ингибируя ангиогенез в ней. Предпочтительно, пептидный антагонист вводят путем инъекции в стекловидное тело.
Нацеливание Lin-HSC на развивающуюся сосудистую сеть ингибируют путем введения стволовых клеток в контакт с ингибирующим нацеливание на сосудистую сеть количеством селективного пептида-антагониста R-кадгерина по настоящему изобретению. Ингибированное нацеливание Lin-HSC, таких как эндотелиальные клетки-предшественники, на развивающуюся сосудистую сеть можно использовать при лечении заболеваний, связанных с патологическим развитием сосудов, таким как возрастная дегенерация желтого пятна и диабетическая ретинопатия. Предпочтительно, Lin-HSC приводят в контакт in vivo путем введения пептидов-антагонистов R-кадгерина по настоящему изобретению млекопитающему, такому как человек, страдающему сосудистым пролиферативным заболеванием или состоянием.
Следующие неограничивающие примеры представлены для дополнительной иллюстрации различных аспектов изобретения. Для специалиста в данной области техники очевидно, что модификации примеров и проиллюстрированных вариантов осуществления, раскрытых здесь, можно осуществить без отклонения от сущности и объема изобретения.
Пример 1. Синтез пептида
Пептиды по настоящему изобретению и различные контрольные пептиды синтезировали в центральном учреждении белков и нуклеиновых кислот The Scripps Research Institute с применением твердофазного синтеза и очищали до максимально возможной степени чистоты (чистота более 95%) в соответствии с данными анализа ВЭЖХ. Последовательности пептидов анализировали с помощью масс-спектрометрии для подтверждения синтеза правильных пептидов. Все пептиды блокировали на амино-конце амидной группой и ацетилировали на карбокси-конце. Циклические пептиды готовили с цистеиновыми остатками на амино- и карбокси-концах, для создания дисульфидной связи и формирования кольца, содержащего пять аминокислотных остатков. На фиг.5 (B) показаны полученные пептиды: циклический CIDSC (SEQ ID NO: 9), циклический CINPC (SEQ ID NO: 9), IDSMSGR (SEQ ID NO: 2), IDSASGR (SEQ ID NO: 10), INPASGQ (SEQ ID NO: 11), циклический CSDIC (SEQ ID NO: 12) и циклический CRADC (SEQ ID NO: 13).
Пример 2. Трансфекции L-клетки
R-кадгерин мыши и плазмиды N-кадгерина были любезно предоставлены доктором Masatoshi Takeichi (Kyoto University, Japan). Плазмиды субклонировали в векторы pDsRed2 N1 (Clontech) для кодирования составных белков с красным флуоресцентным белком (RFP), присоединенным к C-концу молекул кадгерина. L-клетки (клетки фибробластов L929 мыши, ATCC #CRL-2148) устойчиво трансфицировали либо R, либо N-кадгерином pDsRed2 N1 с применением системы трансфекции фосфата кальция (Life Technologies) в соответствии с протоколом изготовителя. После селекции путем выращивания в питательных средах с добавкой генетицина (700 нг/мл генетицина G418, Gibco BRL) отобрали положительные клоны. Клетки исследовали на экспрессию RFP и проверили на экспрессию кадгерина с помощью иммунофлюоресцентного окрашивания и иммуноблоттинга. На фиг.6 проиллюстрирована агрегация L-клеток, экспрессирующих R и N-кадгерины. На фиг.6 (A) показаны микрофотографии L-клеток, экспрессирующих R-кадгерин (слева) и N-кадгерин (посередине), агрегирующих в средах, содержащих кальций, по сравнению с нетрансфицированными L-клетками, которые не агрегировали. Фиг.6 (B) представляет собой столбчатую диаграмму, иллюстрирующую процент агрегации клеток, показанных на фиг.6 (A). Клетки, трансфицированные N-кадгерином и R-кадгерином, трипсинизировали в буфере, содержащем приблизительно 5 мМ хлорида кальция (обозначенные как TC), образовывали крупные кластеры клеток, тогда как эндогенные L-клетки демонстрировали незначительную агрегацию в буфере, содержащем кальций. Клетки, трипсинизированные с EDTA в буфере без кальция (обозначенные как ТЕ), демонстрировали незначительную агрегацию, независимо от того, трансфицировали клетки кадгеринами или нет.
Пример 3. Клеточная культура и иммунофлюоресценция
Трансфицированные L-клетки или L-клетки дикого типа выращивали в модифицированной среде Eagles (MEM) с добавкой основного раствора соли Earl's, 2 мМ Glutamax, 1 мМ пирувата натрия, 0,1 мМ заменимых аминокислот и 10% эмбриональной бычьей сыворотки. Трансфицированные линии клеток выращивали в средах с добавкой приблизительно 700 мкг/мл G418 (все реактивы питательных сред были от Gibco BRL). Для иммунофлюоресценции клетки выращивали до приблизительно 75% слияния на покровных стеклянных полосках. Клетки фиксировали в 4% параформальдегиде в течение приблизительно получаса с последующей блокировкой 5% нормальной козьей сывороткой и 5% эмбриональной бычей сывороткой в 1x фосфатном буферном солевом растворе (PBS). Поликлональные антитела козы против R-кадгерина или N-кадгерина (Santa Cruz) использовали с разбавлением 1:200, и флюоресценцию обеспечили за счет инкубации с маркированными вторичными IgG анти-коза Alexa488 (Molecular Probes). Изображения сделали с применением флуоресцентного конфокального микроскопа Radiance 200 (BioRad). Для иммуноблот-анализа клетки растворили в буфере, содержащем 1% Triton X-100. Приблизительно 50 мкг полного лизата клеток добавили на каждую дорожку 8% полиакриламидного геля и белки разделили с помощью электрофореза. Для визуализации соответствующих полос использовали моноклональные антитела (1:1000, BD Biosciences), специфичные для N-кадгерина или R-кадгерина.
На фиг.7 (A) показан иммуноблоттинг нативных L-клеток и L-клеток, трансфицированных R-кадгерином и N-кадгерином и окрашенных антителом R-кадгерина. Только клетки, трансфицированные R-кадгерином, показали значительные уровни экспрессии R-кадгерина. На фиг.7 (В) показан иммуноблоттинг нативных L-клеток и L-клеток, трансфицированных R-кадгерином и N-кадгерином и окрашенных антителом N-кадгерина. Только клетки, трансфицированные N-кадгерином, показали значительные уровни экспрессии N-кадгерина. Фиг.7 (C) представляет собой флуоресцентную микрофотографию клеток, экспрессирующих R-кадгерин, маркированных флуоресцентными антителами кадгерина, демонстрирующую экспрессию на поверхности клетки только молекул R-кадгерина. Фиг.7 (D) представляет собой флуоресцентную микрофотографию клеток, экспрессирующих N-кадгерин, маркированных флуоресцентными антителами кадгерина, демонстрирующую экспрессию на поверхности клетки только молекул N-кадгерина. Фиг.7 (E) представляет собой флуоресцентную микрофотографию нативных L-клеток, подвергнутых воздействию флуоресцентных антител кадгерина, но не показывающую экспрессии на поверхности клетки молекул кадгерина любого типа.
Пример 4. Проба на агрегацию
L-клетки выращивали до высокого уровня слияния с последующей трипсинизацией с помощью 0,01% трипсина + 5 мМCaCl2 и без EDTA (TC) или с помощью 0,01% трипсина с 0,1 мМ EDTA и без кальция (ТЕ). Клетки собрали и промыли с последующим ресуспендированием в буферном растворе Hanks (HBSS) + 1% BSA с (TC) или без (ТЕ) 5 мМ CaCl2. Клетки культивировали при 37°C в 0,5 мл раствора при 2 × 105 клеток на каждую лунку 24-луночной плашки со встряхиванием при приблизительно 60-70 об/мин с переменными концентрациями пептида. Все пробы выполняли трижды. Степень агрегации клеток представляли отношением полного количества частиц после 2 часов инкубации (N2hr) к начальному количеству частиц (N0). Частицы подсчитывали на гемоцитометре с применением суммы 8 отдельных 20 мкл счетов на лунку до (N0), и после (Nt) инкубации. Результаты проиллюстрированы на фиг.8.
Пример 5. Обработка мышей посредством инъекции пептидов в стекловидное тело
Пептиды растворили в PBS + 10% диметилсульфоксид до концентрации 10 мМ. Приблизительно 0,5 м