Способ кардиопротекции и нейропротекции внутривенным введением галогенсодержащего летучего анестезирующего средства
Иллюстрации
Показать всеИзобретение относится к медицине и может быть использовано в случае возникновения ишемии ткани мозга, миокарда и других тканей. Для этого осуществляют парентеральное введение препарата, в состав которого входит галогенсодержащий анестетик в суб-анестетических дозах. В качестве галогенсодержащих анестетиков вводят дезфлуран, изофлуран, галотан или севофлуран. Изобретение позволяет обеспечить ускоренную индукцию защиты от ишемии за счет снижения потребления ишемизированной тканью кислорода, а также за счет быстрого и удобного введения галогенсодержащих летучих анестетиков, позволяющих избежать побочных явлений, связанных с их использованием при традиционном способе введения. 4 н. и 16 з.п. ф-лы, 5 ил., 9 табл.
Реферат
Данная заявка заявляет приоритет предварительной заявки на патент Соединенных Штатов серийный № 60/417934, поданной 11 октября, 2002, раскрытие которой полностью включено путем ссылки.
Настоящее изобретение относится к способу улучшения тканевой толерантности и сопротивляемости к ишемическому состоянию у пациента, предпочтительно человека, введением внутривенной композиции, содержащей эффективное количество галогенсодержащего, летучего анестезирующего средства (ГЛА) пациенту.
Доклинические и клинические данные указывают на то, что ГЛАа (например галотан, метоксифлуран, изофлуран, энфлуран, дезфлуран и севофлуран) имеют дополнительное преимущество кардиопротекции во время ишемических состояний. Данное преимущество не наблюдается у парентерально вводимых анестезирующих средств, как, например у пропофола и барбитуратов. К тому же существует возрастающая обеспокоенность тем, что ГЛАа уменьшают потребление мозгом кислорода и могут также оказывать нейропротекцию во время ишемии нервной ткани посредством этого механизма, а также и другими механизмами.
В то время как подобные улучшения тканевой толерантности к ишемии являются очень желательными, современные летучие анестезирующие средства вводятся, главным образом, только ингаляционно, что требует применения аппарата для наркоза в контролируемой окружающей среде, как, например операционной. Чтобы обеспечить более широкую популяцию пациентов, которой данные анестезирующие средства могут быть введены более удобно, очень желателен способ введение ГЛАв в других помещениях больницы, а также за пределами больницы.
Парентеральное введение, особенно внутривенное введение ГЛАв является проблемой, вследствие ряда факторов, относящихся к их соединению с плазмой крови. Данные анестезирующие средства имеют слабую растворимость в воде и их внутривенное введение, применяя общепринятую композицию, не очень хорошо переносится, приводя к выраженным локальным реакциям. В дополнение, может случиться газовая эмболия при внутривенном введении ГЛАв, точка кипения которых находится на уровне или ниже внутренней температуры тела здорового человека. Были предложены более устойчивые парентеральные композиции, которые применяются для традиционной анестезии. Однако данная область применения не признала целесообразности применения таких парентеральных композиций для защиты ткани, и, особенно, не признала целесообразности применения, за пределами области хирургической анестезии, для достижения такой защиты ткани.
Сущность изобретения
Первый аспект изобретения касается способа лечения пациента, имеющего ткань, как, например сердца, мозга, сосудистой сети, кишки, печени, почки и глаза, которые подвергнуты ишемическому явлению. Способ включает парентеральное введение препаративной формы, содержащей галогенсодержащее летучее анестезирующее средство, пациенту в количестве эффективном для улучшения сопротивление тканей или толерантности ишемического явления. В предпочтительном варианте выполнения, количество препаративной формы, вводимой пациенту, является суб-анастетическим.
В одном предпочтительном варианте способ проводится с препаративной формой, которая включает эмульгирующее вспомогательное вещество и эмульгатор, в дополнение к галогенсодержащему летучему анестезирующему средству.
Применяя способ, введение препаративной формы объекту воздействия может проводиться перед, одновременно и/или после ишемического явления. Ишемическое явление может быть связано, например, с пластикой аневризмы аорты, множественной травмой, заболеванием периферических сосудов, заболеванием сосудов почек, инфарктом миокарда, ударом, сепсисом и полиорганной недостаточностью.
Ведение препаративной формы может проводиться болюсным введением препаративной формы или инфузией препаративной формы. Предпочтительно, галогенсодержащее летучее анестезирующее вещество выбирается из группы, состоящей из дезфлурана, изофлурана, энфлурана, галотана и севофлурана.
Предпочтительный аспект изобретения касается способа лечения пациента, имеющего ткань миокарда, которая подвергается ишемическому явлению. Ишемическое явление может быть связано, например, с ангиопластикой, аорто-коронарным шунтированием, катетеризацией сердца и нестабильной стенокардией. Способ включает парентеральное введение препаративной формы, содержащей галогенсодержащее летучее анестезирующее средство, объекту воздействия в количестве, эффективном для улучшения сопротивления ткани миокарда или устойчивости к ишемическому явлению. В предпочтительном варианте осуществления, количество препаративной формы, вводимой объекту воздействия, является суб-анастетическим. Галогенсодержащее летучее анестезирующее средство в композиции может быть, например, дезфлураном, изофлураном, энфлураном, галотаном и севофлураном.
Другой предпочтительный объект изобретения касается способа лечения пациента, имеющего ткань миокарда, которая подвержена инфаркту миокарда. Способ включает парентеральное введение препаративной формы, включающей галогенсодержащее летучее анестезирующее средство, пациенту, в количестве, эффективном для улучшения сопротивления тканей миокарда или толерантности к инфаркту миокарда. В предпочтительном способе осуществления, количество препаративной формы, вводимой объекту воздействия, является суб-анастетическим и введение проводится внутривенным введением. Галогенсодержащее летучее анестезирующее средство в препаративной форме предпочтительно выбирается из севофлурана, энфлурана и изофлурана.
Другой объект изобретения касается лечения пациента, имеющего нервную ткань, которая подвергается ишемическому явлению. Например, ишемическое событие может быть выбрано из группы, состоящей из пластики аневризмы аорты, каротидной эндартерэктомии, церебральной ангиографии, угрожающего удара и транзиторных ишемических атак. Способ включает парентеральное введение композиции, которая содержит галогенсодержащее летучее анестезирующее средство, объекту воздействия, в количестве, эффективном для улучшения сопротивления нервной ткани или устойчивости к ишемическому явлению. Предпочтительно, количество вводимой композиции является суб-анастетическим.
Определения
Следующие термины будут иметь, для целей заявки, соответствующие значения изложенные ниже.
"Болюсная доза" означает введение препаративной формы, которое проводится в течение относительно короткого промежутка времени, так как будет признано специалистами, как, например, примерно 5 минут или меньше.
"Эффективное количество" в тех случаях, когда применяется для описания дозы анестезирующего средства, относится к количеству ГЛА, эффективному для улучшения сопротивляемости ткани или устойчивости к ишемическому явлению.
"Улучшить сопротивляемость ткани и толерантность к ишемическому явлению" в тех случаях, когда применяется для описания эффектов лечениям, относится к способам лечения, которые (i) уменьшают количество некротической ткани, которое ожидается после ишемического явления; (ii) уменьшают химические характеристики (например, рН, уровень КФК, уровень тропонина, уровень белка S-100, оксид азота, индуцированную синтетазу оксида азота) данного явления; или (iii) иным способом обеспечивают фармакологический, физиологический или лекарственный индикатор уменьшения ишемического повреждения, как, например, уменьшение ожидаемого повреждения, касающегося структурных, механических или динамических функций ишемизированного органа.
"Доза введения" означает введение композиции, которое проводится в течение относительно длительного периода времени, так как будет признано специалистами, как например, более чем две минуты, предпочтительно более чем пять минут. Введение может происходить до, во время или после ишемического повреждения.
"Минимальная альвеолярная концентрация (МАК)", как известно в данной области, представляет альвеолярную концентрацию анестезирующего средства, вводимую путем ингаляции при давлении в 1 атмосферу, которая предотвращает движение у 50% пациентов в ответ на болевой раздражитель. МАК зависит от возраста; на нее может влиять медицинское состояние пациента; на нее могут влиять также другие фармацевтические средства, вводимые пациенту. С точки зрения внутривенного введения ГЛАв, термин "МАК" или "МАК-эквивалент" предназначен для обозначения внутривенной дозы, которая создает ту же самую концентрацию анестезирующего средства в плазме крови, которая достигается при ингаляционном введении газообразной концентрации анестезирующего средства, которая предотвращает подобное движение у 50% пациентов.
"Пациент" означает животное, предпочтительно млекопитающее, и, более предпочтительно, человека.
"Седативный эффект" указывает на степень расслабления пациента, при которой достаточный раздражитель может активизировать пациента.
"Суб-анестетическая доза" относится к анестезирующей дозе, к которой, по меньшей мере, применимо одно из нижеследующих: (а) доза, при которой уменьшение боли является недостаточным, чтобы устранить ответ пациента на хирургический стимул или повреждение у большинства объектов воздействия; или (b), в которой доза находится ниже 1 МАК или МАК-эквивалента, более предпочтительно ниже 0,75 МАК или МАК-эквивалента. В предпочтительном варианте осуществления, суб-анестезирующая доза относится к (b). В то время как значение МАК может изменяться с другими параметрами, суб-анестезирующая доза может быть аппроксимирована специалистом в данной области (например, лечащим врачом) значением, соответствующим возрасту, размеру и видам. Концентрация в плазме, дозированная пациенту, может быть подсчитана контролированием мониторингом ГЛА, выдыхаемого пациентом (применяя соответствующие коэффициенты распределения и поправки для неравновесного переноса массы) или прямым отбором проб крови.
"% Об./об." относится к проценту точно определенного ингредиента, исходя из объема ингредиента, как процента общего объема эмульсии.
"% Мас./об." Относится к проценту установленного ингредиента исходя из массы ингредиента, как процента от общего объема эмульсии.
Краткое описание чертежей
Фиг.1 является схематическим изображением протокола эксперимента, применяемого для определения размера инфаркта у кроликов.
Фиг.2 указывает на размер инфаркта (ИР), изображенный, как процент зоны риска (ЗР) для каждого животного.
Фиг.3 является графиком, показывающим размер инфаркта (ИР), представленный как функция зоны риска (ЗР) для леченных носителем животных. Каждая точка означает один индивидуальный эксперимент.
Фиг.4А является графиком, показывающим размер инфаркта (ИР), представленный как функция зоны риска (ЗР) для леченых дезфлураном животных. Каждая точка означает один индивидуальный эксперимент.
Фиг.4В является графиком, показывающим размер инфаркта (ИР), представленный как функция зоны риска (ЗР) для леченных энфлураном животных. Каждая точка означает один индивидуальный эксперимент.
Фиг.5А является графиком, показывающим размер инфаркта (ИР), представленный как функция зоны риска (ОР) для леченных энфлураном животных. Каждая точка означает один индивидуальный эксперимент.
Фиг.5В является графиком, показывающим размер инфаркта (ИР), представленный как функция зоны риска (ЗР) для леченных севофлураном животных. Каждая точка означает один индивидуальный эксперимент.
Подробное описание изобретения
Изобретение предоставляет способы лечения пациентов с тканью, восприимчивой к повреждению от ишемического явления (как, например, ткани миокарда или нервной ткани) с ГЛА для улучшения тканевой толерантности к ишемическому явлению. Способы предпочтительно относятся к внутривенному введению пациенту препаративной формы, содержащей ГЛА до или во время ишемического явления. В частности, способы предоставляют удобную методику для быстрой предварительной подготовки ткани для противостояния ишемическому явлению.
В дополнение к предоставлению более удобного способа введения, внутривенное введение ГЛАв может обеспечить более быструю индукцию защитного эффекта по сравнению с введением путем ингаляции. В дополнение, внутривенное введение ГЛАв позволяет избежать сужения дыхательных путей пациента. Более того, внутривенное введение предотвращает раздражение дыхательных путей некоторыми ГЛАи; уменьшает высвобождение ГЛАв в окружающую среду лечения; устраняет необходимость испарителя для введения средства; позволяет введение внутри и вне больничной обстановки; облегчает введение ГЛАв до, во время и после ишемического явления; и уменьшает потребность в персонале, обученном для введения ингаляционных анестезирующих средств.
Повреждение ткани в результате ишемии может происходить как сопутствующее с недостаточным кровоснабжением ткани и может также происходить вслед за ишемическим инсультом, например, благодаря реперфузии поврежденной ткани. Ткани, которые особенно восприимчивы к ишемическим событиям, включают сердечную, сосудистую и нервную ткань (особенно церебральную ткань). Другие ткани, которые восприимчивы к ишемии, включают ткани кишечника, печени, почки и глаза.
В одном предпочтительном объекте, пациент, который должен лечиться, нуждается в кардиопротекции. В некоторых вариантах осуществления эта необходимость может возникать благодаря присущей вероятности ишемии при сердечных лечебных или диагностических процедурах. Например, ишемические состояния могут возникать во время таких лечебных процедур, как сердечная и церебральная ангиопластика (с или без установления стента), церебральной эмболизации и во время аорто-коронарного шунтирования (с применением аппарата искусственного кровообращения или без). Ишемические состояния могут также возникать во время диагностических процедур, во время, как, например, катетеризации и церебральной артериографии. В дополнение, необходимость в кардиопротекции может возникать вследствие определенных физиологических заболеваний, как, например, нестабильная стенокардия, травма или эпизоды остановки сердца или во время забора органов или трансплантации.
Для хирургических и диагностических процедур, когда показана необходимость кардиопротекции, парентеральная препаративная форма может быть введена немедленно перед, во время или немедленно после хирургической и диагностической процедуры, которая проводится для улучшения толерантности ткани к ишемии.
Парентеральная препаративная форма может также быть введена в неотложных ситуациях, когда показана кардиопротекция, как, например при лечении пациентов с продолжающимся инфарктом миокарда. Внутривенное введение композиции энфлурана, изофлурана или севофлурана перед окклюзией коронарной артерии, как показано в настоящее время, дает значительное уменьшение размера инфаркта миокарда у кроликов относительно леченных носителем животных (смотри Пример 2).
В другом предпочтительном объекте, пациент, на которого оказывается воздействие, нуждается в нейропротекции. Такая необходимость возникает, например, при определенных процедурах, когда есть вероятность прерывания артериального кровотока. Примеры таких процедур, без ограничения, представляют каротидную эндартерэктомию, пластику аневризмы аорты, церебральную ангиопластику, церебральное стентирование и церебральную артериографию. В дополнение, такие заболевания, как удар, транзиторные ишемические атаки или угрожающий удар (amaurosis fugax) являются возможными состояниями для лечения, применяя способ изобретения. Когда удар повышает риск развития повторного удара или другое состояние повышает риск удара в течение часов или дней, данный способ может применяться для уменьшения такого риска. В дополнение, препаративная форма может вводится для неотложного применения пациенту, страдающему продолжающимся ударом, для улучшения сопротивляемости или толерантности ткани к удару.
Специалисты в данной области будут распознавать обстоятельства, связанные с увеличивающимся риском других ишемических повреждений тканей. Такие заболевания включают недостаточность мезентериальной артерии, стеноз почечной артерии, тромбоз печеночных вен, периферическую сосудистую недостаточность, множественную травму, сепсис и полиорганную системную недостаточность.
В способе изобретения дозы препаративной формы, которые вводятся пациенту, зависят от состояния пациента и вариантов лечения, которым следуют. Во многих примерах желательно вводить препаративную форму в дозах, которые представляют суб-анестетические, при этом ГЛА обеспечивает только эффект, защищающий ткань. Однако существуют примеры, в которых, наряду с защитой ткани, желателен и седативный эффект. Например, в случаях, как, например, в некоторых из описанных выше хирургических и диагностических процедур, когда процедуры требуют седативного воздействия на пациента, ГЛА может выполнять двойную роль, обеспечивая защиту ткани от ишемии и обеспечивая седативный эффект. ГЛА вводится пациенту воздействия в более высоких дозах для создания и седативного эффекта, и защиты ткани. Для обеспечения эффектов защиты ткани суб-анестетическая доза ГЛА может, также, быть доставлена внутривенно, в то время, когда вводится доза другого анестетика. В примерах, в которых желательна как защита ткани, так и анестезия, могут также вводиться дополнительные лекарственные препараты, как, например мышечные релаксанты, седативные средства и анальгетики, как это обычно делается во время введения седативного средства.
В вариантах осуществления способа, в котором вводимые дозировки препаративной формы должны обеспечивать как защиту ткани, так и седативный эффект, практикующий врач может основываться на протоколах анестезии, которые хорошо известны в данной области, которые обеспечивают адекватную потерю чувствительности к хирургическому раздражителю или повреждению. Дозировки, которые обеспечивают эффективный седативный эффект, являются более высокими, чем те, которые требуются для эффективной защиты ткани, так что введение препаративной формы в данных более высоких дозах эффективно лечит оба необходимых показания.
В другом варианте осуществления способа, желательно вводить меньшие количества препаративной формы, которые являются суб-анастетическими, так, чтобы, прежде всего, обеспечивался только тканевой защитный эффект. Такие введения могут быть оправданы в таких процедурах, как, например, диагностические процедуры, когда существует необходимость сохранить чувствительность пациента к раздражителю от практикующего врача или препаративная форма изобретения применяется для обеспечения эффекта защиты ткани, при этом другая анестезирующая препаративная форма достигает системного анестезирующего эффекта (net anesthetic effect). Специалистами в данной области будут признаны другие варианты осуществления, в которых желательно вводить парентерально суб-анестетические дозы препаративной формы, как, например, неотложные медицинские ситуации, когда введение обеспечивает эффект защиты ткани. Такое введение может быть осуществлено, например, медицинским работником экстренной помощи до лечения пациента персоналом реанимационного отделения больницы (например, во время транспортировки пациента). С другой стороны, парентеральное ГЛА может применяться в суб-анестетическом количестве, совместно с анестетиком другого класса, как, например, опиоид или пропофол, или другое ингаляционное ГЛА.
В настоящее время показано, что введение суб-анестетических эффективных количеств энфлурана, изофлурана или севофлурана, например, обеспечивает защиту миокарда у кроликов. Исследования с кроликами показывают, что защита миокарда может быть видна при таких низких дозах, как 0,15 до 0,17 МАК эквивалентов (измеренные как концентрации в крови) (смотри Пример 2).
Препаративная форма может быть введена с применением болюсного введения или инфузионного введения, в зависимости от потребности пациента. Конечно, препаративная форма может также вводиться другими инъекционными внутривенными способами, как, например, медленные внутривенные процедуры или с помощью непрерывного инфузионного насоса до, во время и после ишемического события.
Для болюсного внутривенного введения препаративной формы количество ГЛА, доставляемое пациенту, зависит от выбора конкретного ГЛА и должен ли ГЛА выполнять роль анестезирующего средства. Для изофлурана, например, обычно применяются дозировки примерно 10 мг/кг до 200 мг/кг, хотя более высокие количества могут применяться, когда объект воздействия интубирован. Для специалистов в данной области очевидно, что уровень дозировки, необходимый для индукции анестезии у любого данного пациента будет различаться в зависимости от индивидуального медицинского состояния пациента, от реакции пациента на применяемый ГЛА, а также других факторов. Таким образом, дозировки, описанные здесь для индукции анестезии являются только примерными и неограничивающими. Вообще, доза изофлурана, которая обеспечит защиту ткани и анестезирует пациента, будет выше, примерно, 125 мг/кг. Например, для изофлурана эффективная анестезирующая доза будет, примерно, 145 мг/кг, которая, если эмульсия составляется с 10% в/в изофлураном, будет соответствовать 1,0 мл/кг препаративной формы. Когда пациенту должно быть дано количество изофлурана, эффективное для защиты ткани (например, кардиопротекция, нейропротекция), но количество, которое является суб-анастетическим, обычно вводится доза менее чем, примерно, 125 мг/кг изофлурана, например, примерно 110 мг/кг. Действительные суб-анестетические дозы будут зависеть от возраста пациента, состояния и отклика на анестезирующие средства, применения других лекарственных средств и ряд других факторов. Таблица 1 (ниже) предоставляет предпочтительные пределы дозировок изофлурана и дезфлурана. Предпочтительные болюсные дозировки для ГЛАв могут быть легко посчитаны специалистами в данной области, основываясь на мощностях ГЛАв.
Дозирование препаративной формы для инфузии, например, дозировки изофлурана, полезные для защиты ткани от ишемических явлений, составляют примерно 2 мг/кг/мин до 20 мг/кг/мин. Препаративная форма вводится, предпочтительно, за период времени, полезный для создания предварительной адаптации ткани, например, примерно 15 минут. Более короткие периоды, в некоторых случаях, например 5 минут, могут быть также достаточными. Скорость введения для изофлурана, которая обеспечит и защиту ткани и анестезию пациента, будет выше, примерно, 8 мг/кг/мин, например, примерно 12 мг/кг/мин. Когда пациенту должно быть дано количество изофлурана, эффективное для защиты ткани (например, кардиозащита, нейрозащита), но количество является суб-анастетическим, тогда изофлуран предпочтительно вводится со скоростями, которые меньше, чем, примерно, 8 мг/кг/мин. В таблице 1 (ниже) показаны предпочтительные скорости дозирования для изофлурана и дезфлурана. Предпочтительные скорости введения для других ГЛАв могут быть легко подсчитаны специалистами в данной области на основании относительных эффективностей ГЛАв.
| Таблица 1 | ||
| Изофлуран | Дезфлуран | |
| Диапазон болюсной дозы, мг/кг (Не интубированный пациент) | 10-200 | 30-800 |
| Предпочтительный диапазон болюса мг/кг | 50-150 | 100-500 |
| Диапазон скорости введения, мг/кг/мин | 2-50 | 6-250 |
| Диапазон предпочтительной скорости введения, мг/кг/мин | 3-15 | 15-60 |
Типичные ГЛАа, которые могут быть применены в способе изобретения включает галотан, метоксифлуран, изофлуран, энфлуран, дезфлуран и севофлуран. Предпочтительно ГЛА представляет изофлуран, галотан, энфлуран и севофлуран. Эмульсия содержит ГЛА в пределах примерно 1% до 30% об./об.
ГЛА может вводиться в любой препаративной форме, которая успешно выполняет доставку количества ГЛА, эффективного для улучшения сопротивления ткани или толерантности к ишемическому явлению. Препаративные формы, подходящие для изобретения, включают, например, препаративные формы, содержащие масла и поверхностно-активные вещества, и липосомальные препаративные формы.
Одна предпочтительная внутривенная препаративная форма, которая применяется в способе, представляет эмульсию, которая содержит ГЛА, эмульгирующее вспомогательное вещество и один или более эмульгаторов (также известных как стабилизаторы эмульсии). Эмульсия, обычно, содержит носитель, который типично представляет водный компонент. Дополнительно, эмульсия может содержать добавочные компоненты, как, например, агенты, придающие изотоничность и основание.
Эмульсия содержит эмульгирующее вспомогательное вещество, в котором ГЛА растворим и, предпочтительно, в котором ГЛА сильно растворим. Подходящие вспомогательные вещества включают, например, соевое масло или перфторуглеродный растворитель (например, перфтордекалин). Другие эмульгирующие вспомогательные вещества, имеющие свойства соевого масла или перфторуглеродных растворителей, являются известными для специалистов в данной области и могут применяться в препаративной форме. Пригодный диапазон концентраций для эмульгирующего вспомогательного вещества составляет, примерно, 5% до 30% мас./об., и предпочтительный диапазон составляет 10% до 20% мас./об. Общий объем ГЛА и эмульгирующего вспомогательного вещества составляет, предпочтительно, 40% мас./об. или менее.
Анестезирующая препаративная форма также включает эмульгатор, который, кроме того, помогает стабилизировать эмульсию. Например, фосфолипиды, такие как лецитин, могут применяться в количествах, которые являются эффективными для стабилизации эмульсии. Лецитин, например, в основном применяется в количестве, примерно от, 0,2% до 3,6% мас./об.
Носителем препаративной формы обычно является водный ингредиент, как, например, разбавленный водный буфер или чистая вода. Когда чистая вода применяется в качестве носителя, основание, например, гидроксид натрия, может применяться для установления рН препаративной формы до подходящего уровня, как, например, от 6 до 9.
В некоторых вариантах осуществления может быть полезным включать дополнительные ингредиенты, например агент, придающий изотоничность. Агентом, придающим изотоничность, может быть хлорид натрия или полиол, например, глицерин, который, если присутствует то, применяется в пределах примерно 1 до 4% мас./об.
Одна, особенно предпочтительная препаративная форма для применения в способе, применяет соевое масло в качестве эмульгируещего вспомогательного вещества, лецитин, примерно, 2,4% мас./об. в качестве эмульгатора, глицерин в качестве агента, придающего изотоничность, воду в качестве инъекционного носителя и ГЛА, выбранное из изофлурана, энфлурана и севофлурана.
В другой особенно предпочтительной препаративной форме применяется перфторуглерод, как например перфтордекалин в качестве эмульгирующего вспомогательного вещества, фосфолипид, примерно 3,6% мас./об. в качестве эмульгатора и воду как носитель. Например, фторуглеродные эмульсии, как, например, описанные в патентах США № 5628930 и № 5635538 (которые оба включены путем ссылки) Weers et al. могут быть применены. ГЛА, выбранный из изофлурана, энфлурана и севофлурана предпочтительно добавляется в препаративную форму.
Эмульсионная препаративная форма может быть приготовлена любым способом, который дает стабильную и стерильную препаративную форму. В одном предпочтительном способе для приготовления препаративной формы, подходящие количества эмульгирующего вспомогательного вещества (например, соевое масло) и эмульгатор (например, лецитин) объединяются, применяя любой из дополнительных способов, как, например тепло или перемешивание для ускорения процесса растворения. Затем соответствующее количество ГЛА растворяется в смеси вспомогательное вещество-эмульгатор для образования масляной фазы эмульсии. Раздельно готовится водная фаза эмульсии, причем используется раствор, содержащий водный ингредиент, который должен быть применен в композиции. На данном этапе необязательный тонизирующий ингредиент (например, хлорид натрия, глицерин) может быть объединен с водным ингредиентом. Масляная фаза добавляется к водной фазе перемешиванием для образования первичной эмульсии. Величина рН эмульсии может быть доведена основанием (например, гидроксидом натрия), и оставшаяся вода добавляется в эмульсию, чтобы довести препаративную форму до необходимого объема. Получаемая смесь эмульгируется, применяя, например, гомогенизатор для образования окончательной эмульсии. Эмульсия может быть отфильтрована и затем перенесена в контейнеры. Они могут быть стерилизованы соответствующей тепловой обработкой в случаях, когда такая обработка не вызывает значительных и необратимых физических изменений препаративной формы.
Предпочтительно, протоколы введения разработаны так, чтобы довести до минимума образование микропузырьков вследствие летучести ГЛА. Микропузырьки могут приводить к уменьшению конечного дыхательного СО2 и градиента СО2 между артериальной и альвеолярной кровью, особенно в препаративных формах, содержащих больше летучих ГЛА, как, например, дезфлуран. Вероятность таких явлений больше, когда эмульсия вводится при комнатной температуре, чем когда ГЛА - содержащая препаративная форма нагревается до температуры тела. Следовательно, препаративная форма предпочтительно вводится пациенту, как только она становится согретой до температуры тела.
В дополнение, протоколы введения должны, предпочтительно, избегать применения отрицательного давления для извлечения доз из мультидозового флакона, поскольку концентрация ГЛА, остающаяся во флаконе, может быть изменена вследствие летучести ГЛА. Однако с анастетическими средствами с большей точкой кипения это имеет меньшее значение.
Следующие примеры, кроме того, иллюстрируют настоящее изобретение, но не должны рассматриваться как ограничивающие его объем.
Пример 1: Приготовление внутривенной ГЛА препаративной формы
В данном примере, в частности, описано приготовление эмульсии севофлурана. Подобные способы применяются для препаративных форм, содержащих энфлуран, изофлуран и дезфлуран (смотри ниже).
Приготовление масляной фазы:
Взять собственный вес резервуара вместе с его
перемешивающим агрегатом.
Добавить очищенное соевое масло.
Нагреть масло приблизительно до 50±5°С.
Добавить лецитин в резервуар масляной фазы.
Перемешать содержимое, пока лецитин полностью не растворится.
Довести температуру масло/лецитин до примерно 22±2°С и поддерживать эту температуру.
Добавить требуемое количество севофлурана и поддерживать температуру до 22±2°С.
Приготовление водной фазы
Взять собственный вес резервуара вместе с его перемешивающим агрегатом, применяемым для приготовления водной фазы.
Добавить требуемую воду для инъекций в резервуар с водной фазой.
Добавить глицерин в резервуар с водной фазой.
Добавление водной фазы в масляную фазу
Когда ингредиенты водной фазы и масляной фазы полностью растворены, переносят водную фазу в масляную фазу.
Эмульгирование
Энергично перемешивают первичную эмульсию в течение, по меньшей мере, 10 минут при 22±2°С. Следят за однородностью первичной эмульсии. Прекращают перемешивание, как только эмульсия станет однородной.
Охлаждение первичной эмульсии
Собирают охлаждающую ванну с ледяной водой для охлаждения первичной эмульсии. Охлаждают первичную эмульсию быстро до ≤15°С, постоянно перемешивая.
Гомогенизация
Пропускают первичную эмульсию 3 раза через гомогенизатор при 14500 фунтов на кв. дюйм. Ванна с ледяной водой применяется для охлаждения эмульсии во время данного этапа.
Собирают окончательный прогон в чистый сухой контейнер.
Наполняют эмульсией индивидуальный контейнер в атмосфере азота.
| Таблица 2 | |
| Ингредиент | мг/кварта |
| Соевое масло Особой Очистки, Фармакопея США | 200,0 |
| Севофлуран (готовый продукт) | 80,0 |
| Глицерин, Фармакопея США/NF | 22,5 |
| Лецитин, Липоид Е80 | 24,0 |
| Стерильная вода для инъекций. Фармакопея США/NF, достаточное количество, мл | 1,0 |
После завершения получения препаративной формы фактический выход севофлурана в препаративной форме, определяемый газохроматографическим анализом, составил 7,0 мас./об.
Способы для других внутривенных препаративных форм, которые включали энфлуран и изофлуран, были идентичны тем, которые применялись с севофлураном.
Способ также проводился подобным образом с дезфлураном, за исключением того, что обеспечивались дополнительные охлаждающие мероприятия, вследствие более низкой точкой кипения дезфлурана. В частности, масляная фаза охлаждалась и ее температура поддерживалась при 2-5°С, при перемешивании с дезфлураном; водная фаза охлаждалась до 2-5°С перед объединением с масляной фазой; и эмульсия поддерживалась при 2-5°С на последующих этапах обработки.
Таблица 3 указывает на ГЛА целевую концентрацию и на действительную ГЛА концентрацию после окончательного приготовления лекарственной формы для препаративных форм энфлурана, изофлурана и дезфлурана.
| Таблица 3 | ||
| Анестезирующее средство | Целевая концентрация в эмульсии | Действительная концентрация в эмульсии |
| Энфлуран | 8% мас./об. | 7,0% мас./об. |
| Изофлуран | 8% мас./об | 7,1% мас./об. |
| Дезфлуран | 12% мас./об | 9,6% мас./об. |
Данные внутривенные препаративные формы применялись в Примере 2
Пример 2: Эффект внутривенного дезфлурана, энфлурана, изофлурана и севофлурана на размер инфаркта миокарда у кроликов
Данные исследования были разработаны для характеристики эффектов различных ГЛАв (энфлурана, изофлурана, севофлурана и дезфлурана), вводимых внутривенно в эмульсии, на размер инфаркта миокарда, развивающегося вслед за ишемией и реперфузией у крыс.
Общее приготовление
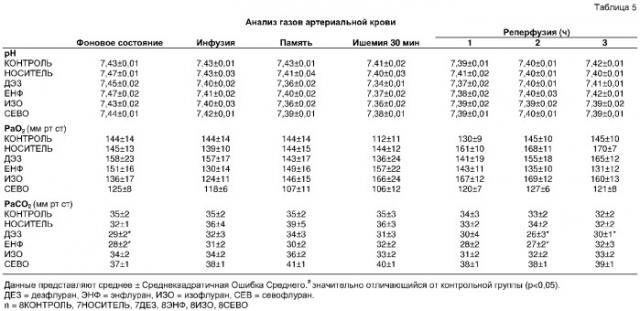
Самцы Новозеландских белых кроликов весом между 2,5 и 3,0 кг были анестезированы внутривенным пентобарбиталом натрия (30 мг/кг). Дополнительные дозы пентобарбитала были титрованы, как требовалось, чтобы обеспечить отсутствие педального и пальпебрального рефлексов на протяжении всего исследования. Была выполнена трахеотомия через вентральную борозду средней линии и произведено канюлирование трахеи. Кролики вентилировались положительным давлением, применяя смесь воздух-кислород (FiO2=0,33). Парциальное давление газов артериальной крови и кислотно-щелочной статус поддерживались в пределах нормального физиологического диапазона (рН 7,35-7,45, PaCO2 25-40 мм рт. ст. и PaO2 90-150 мм рт. ст.) регулированием частоты дыхания или дыхательного объема. Температура тела поддерживалась одеялом с электрообогревом. Наполненные гепарином катетеры вставлялись в правую сонную артерию и левую яремную вену для измерения артериального давления и введение жидкости или лекарственного средства, соответственно. Жидкости, поддерживающие водный баланс, состояли из 0,9% физиологического раствора (15мл/кг/час), которые вводились в течение всего исследования.
Была выполнена левосторонняя торакотомия в четвертом межреберном пространстве и сердце было подвешено на перикардиальной люльке. Была выделена выступающая ветвь левой передней нисходящей коронарной артерии (ЛПН) и шелковая лигатура помещена вокруг данной артерии приблизительно на половине пути между основанием и верхушкой для создания окклюзии коронарной артерии и реперфузии в исследованиях размера инфаркта миокарда. Каждому кролику была проведена антикоагуляция 500 Ед гепарина, сразу же перед ЛНП окклюзией. Окклюзия коронарной артерии была подтверждена эпикардиальным цианозом и местной дискинезией в ишемизированной зоне, и реперфузия была подтверждена путем наблюдения за эпикардиальной гиперемической реакцией. Гемодинамика постоянно записывалась на полиграф в течение всего исследования. После хирургической подготовки, была п