Электрохимический способ получения фторалифатических бис-фторсульфатов на электрокаталитических наноразмерных материалах
Иллюстрации
Показать всеИзобретение относится к улучшенному электрохимическому способу получения фторалифатических бис-фторсульфатов и может быть использовано в органической химии. Способ заключается в том, что проводят электролиз фторолефинов общей формулы CF2=CF-Rf, где Rf=CF3, CF2OSO2F, R'FO, R'F=CF3, C2F5, С3Р7, с использованием анода, представляющего собой наноразмерные частицы, нанесенные на стеклоуглерод, в потенциостатическом режиме в бездиафрагменном электролизере, снабженном анодом и катодом, во фторсульфоновой кислоте, в результате чего осуществляется прямое анодное окисление вышеуказанных фторолефинов. При этом используют анод, полученный путем термолиза металлоорганических кластеров платины и иридия на стеклоуглеродную подложку. Технический результат - повышение эффективности электролиза. 11 з.п. ф-лы, 10 ил., 4 табл.
Реферат
Изобретение относится к электрохимическому методу получения фторалифатических бис-фторсульфатов прямым окислением фторолефинов общей формулы CF2=CF-Rf где Rf=CF3, CF2OSO2F, RFO, CF3,С2F5,С3F7 используемых в качестве исходных соединений для получения фторированных ионообменных мембран типа «Флемион».
Патентная заявка ФРГ No DE 3128118 A1 с приоритетом от 16.07.81 (Hoechst AG, автор Н. Millauer) и сообщение Schwerfeger W., Sigemund G., Millauer Н. (тезисы 11-го Международного Симпозиума по химии фтора, Берлин, 1985, с.82) относятся к способу получения α,ω-бис-фторсульфатов общей формулы FSO2-O-(CF2-CF2)n-OSO2F (n=1-5) и FSO2-O-(С3F6)2-OSO2F (смесь изомеров) в условиях анодной генерации пероксидисульфурилдифторида FSO2-O-O-SO2F (в результате электроокисления HSO3F) в электрохимической ячейке и его дальнейшей реакции с фторолефинами.
Brunei D., Colmettes A., Germain A., Morea R. // J. Fluor. Chem. 1989. V.45. P.147 // описали окисление перфтороктена-1 в HSO3F при потенциале 2.01 В относительно Cu/Cu2+, приводящее к смеси бис-фторсульфатов. В.М.Роговик, В.Ф.Черстков, В.А.Гринберг, Ю.Б.Васильев, М.Г.Петерлейтнер, С.Р.Стерлин и Л.С.Герман (Изв. АН СССР, сер. хим., 1991, №10, с.2362) получили смесь бис-фторсульфатов окислением тетрафторэтилена на Pt-электроде при потенциале 1,5 В относительно Pd/H2 во фторсульфоновой кислоте.
Электрохимическое фторсульфатирование фторолефинов - как терминальных, так и интернальных - является удобным методом получения фторалифатических фторсульфатов. Эти соединения являются исходными веществами в синтезе разнообразных классов фторалифатических соединений. Как правило, электрохимическое фторсульфатирование осуществляют электролизом смеси фторолефина и фторсульфоновой кислоты в гальваностатических условиях при высоких анодных потенциалах. Пероксидисульфурилдифторид (I), образующийся в результате электроокисления фторсульфонилокси-аниона, взаимодействует со фторолефином, давая бис-фторсульфаты; выход по току I составляет 60-65% из-за частичного восстановления I водородом, выделяющемся на катоде, а также прямого электровосстановления.
Реакция электрохимического фторсульфатирования в гальваностатическом режиме носит ярко выраженный радикальный характер и в случаях высших фторолефинов приводит к образованию смеси изомерных бис-фторсульфатов - продуктов фторсульфатодимеризации исходных фторалкенов.
Следует отметить, что при изучении прямого электроокисления перфтороктена-1 в HSO3F (Brunei D.,Colmettes A., Germain A., Morea R. // J. Fluor. Chem. l989. V.45. P.147) были получены одинаковые соотношения 1,2-бис(фторсульфонилокси)перфтороктана и 7,8-бис(фторсульфонилоксидифторметил)перфтортетрадекана как в условиях потенциостатического, так и гальваностатического электроокисления.
Известен также способ получения α,ω-бисфторсульфатоперфторалканов электролизом α,ω-дигидроперфторалканов в бездиафрагменном электролизере с образованием пероксодисульфурилдифторида, позволяющий получить индивидуальные
α,ω-бисфторсульфатоперфторалканы, свободные от примесей теломер-гомологов (авторское свидетельство 1825785, опубл. 07.07.1993).
Состав продуктов прямого электрохимического фторсульфатирования тетрафторэтилена (В.М.Роговик, В.Ф.Черстков, В.А.Гринберг, Ю.Б.Васильев, М.Г.Петерлейтнер, С.Р.Стерлин и Л.С.Герман, Изв. АН СССР, сер. хим., 1991, №10, с.2362) существенно отличается от состава продуктов непрямого электрофторсульфатирования тетрафторэтилена (H.Millauer, DE 3128118 А1 с приоритетом: 16.07.81). В условиях потенциостатического электроокисления основным продуктом реакции явился 1,2-бис(фторсульфонилокси)перфторэтан (содержание в смеси ˜90%), тогда как электролиз в гальваностатическом режиме приводит к образованию в основном 1,4-бис(фторсульфонилокси)перфторбутана - продукта фторсульфатодимеризации тетрафторэтилена (содержание в смеси ˜70%).
К недостаткам непрямого электросинтеза бис-фторсульфатов на основе терминальных фторолефинов следует отнести невысокую селективность процесса - образуются смеси изомерных фторсульфатодимеров исходных фторолефинов, которые невозможно разделить традиционными методами. Недостатками прямого электросинтеза бис-фторсульфатов являются невысокая коррозионная стабильность и низкая электрокаталитическая активность электродов-катализаторов, используемых для окисления фторолефинов, потенциалы окисления которых близки к потенциалу окисления FSO3-аниона. Также возможна пассивация анода в ходе электролиза. Таким образом, возможность получения фторалифатических бис-фторсульфатов прямым электроокислением фторолефинов общей формулы CF2=CF-Rf где Rf=CF3, CF2OSO2F, R'FO R'F=CF3, С2F5, С3F7, в условиях способа согласно настоящему изобретению с высокими выходами по току и высокой селективностью не столь очевидна.
Настоящее изобретение является электрохимическим процессом получения фторалифатических бис-фторсульфатов путем электролиза в потенциостатическом режиме фторолефинов общей формулы CF2=CF-Rf, где Rf=CF3, CF2OSO2F, R'FO, R'F=CF3, C2F5, С3F7 в бездиафрагменном электролизере, снабженном анодом и катодом, в среде фторсульфоновой кислоты, в результате которого происходит прямое анодное окисление вышеуказанных фторолефинов.
По сравнению с известными методами прямого электросинтеза бис-фторсульфатоперфторалканов - исходных соединений для получения различных классов фторалифатических соединений - предлагаемое изобретение обладает рядом преимуществ:
а) высокий выход целевых бис-фторсульфатоперфторалканов, составляющий в зависимости от строения фторолефина и природы электрода-катализатора от 50 до 90%;
б) применение анода из электродных материалов для анодного окисления фторолефинов, проявляющих каталитическую активность в интервале потенциалов, при которых происходит окисление фторолефинов;
в) применение анода из материалов, обладающих высокой коррозионной устойчивостью в условиях длительного электролиза в интервале потенциалов, при которых осуществляется электроокисление фторолефинов, в частности Ir- и СУ-электродов;
г) применение наноразмерных электрокатализаторов на основе наночастиц платины, иридия и сплава платина-иридий, полученных из органометаллических кластеров, нанесенных на стеклоуглеродную подложку, с высокой электрокаталитической активностью и коррозионной стойкостью в реакции электроокисления фторолефинов в условиях потенциостатического электролиза;
д) применение катода из материалов с низким перенапряжением водорода и низкой электрокаталитической активностью по отношению к фторсульфоновой кислоте, в частности электродов из нержавеющей стали;
е) проведение длительного электролиза в гальваностатических условиях, стимулирующих электролиз в потенциостатическом режиме.
Описание изобретения
Электросинтез бис-фторсульфатов с использованием фторолефинов общей формулы CF2=CF-Rf, где Rf=CF3, CF2OSO2F, R'FO, R'F=CF3, С2F5, С3F7 проводились в потенциостатическом режиме в бездиафрагменной электрохимической ячейке, снабженной охлаждающей рубашкой, обратным холодильником, магнитной мешалкой и барботером для введения газообразных фторолефинов или капельной воронкой для введения жидких фторолефинов. В качестве анодных материалов использовались платина, иридий, сплав платина-иридий, стеклоуглерод, α- или β-диоксид свинца, а также наноразмерные частицы на основе наночастиц платины, иридия и сплава платина-иридий, нанесенные на стеклоуглеродную подложку из органометаллических кластеров; в качестве катодного материала использовалась нержавеющая сталь. Температурный режим поддерживался и контролировался с помощью термостата.
Вольт-амперометрические измерения проводились в электрохимической ячейке, использовавшейся для проведения препаративного электролиза, или в отдельной ячейке, снабженной анодами, аналогичными рабочим электродам. В частности, электроды могут быть изготовлены из платины, сплавов Pt-Ir с содержанием иридия 10-40%, иридия или стеклоуглерода. Один из катодов использовался в качестве противоэлектрода; системы Pt/H2 или Cu/Cu2+, соединенные рабочим объемом ячейки капилляром Лугина, использовались в качестве электродов сравнения. Анодные потенциалы при осуществлении способа находятся в интервале 1,0-2,4 В по отношению к Cu/Cu2+ электроду сравнения. Температура процесса составляет 5-40°С., а соотношение площадей анода и катода составляет 5-20:1.
Для препаративных электросинтезов и вольт-амперометрических измерений использовался потенциостат/гальваностат PAR (модель 273), подсоединенный к ПК через GPIB-контроллер.
Спектры ЯМР 19F полученных соединений записаны на ЯМР-спектрометре "Broker" WP-200 SY (188 MH2) (внешний эталон CF3СООН). Химические сдвиги приведены в м.д. Масс-спектры записаны на хромато-масс-спектрометре VG-7070 (70 eV, OV-101, 30°C, 5°C мин-1).
α- PbO2 получена анодным осаждением на Pt-сетку из электролита следующего состава: Pb - 0,2 N, NaOH - 1N, этиленгликоль - 3 мл/л, плотность тока - 0,3-5 А/дм2, т-ра - 60°С. β - PbO2 получена аналогично из электролита: 1М Pb(NO3)2, 0,4 М Cu(NO3)2, 0,2 М Al(NO3)3; плотность тока 0,25-6 А/дм2, т-ра - 18-20°С.
Наноразмерные частицы на основе наночастиц платины, иридия и сплава платина-иридий, нанесенные на стеклоуглеродную подложку, были получены термолизом органометаллических кластеров.
Фторсульфоновая кислота была перегнана при пониженном давлении, фторсульфат калия был очищен перекристаллизацией из 5-7% водн. КОН аналитической чистоты.
А. Электроокисление фторолефинов на анодных материалах различной химической природы
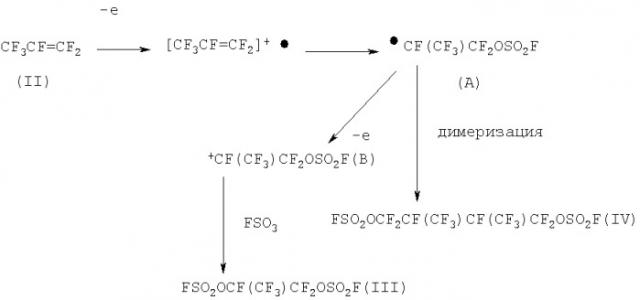
Установлено, что электролиз гексафторпропилена (II) во фторсульфоновой кислоте в потенциостатическом режиме приводит к образованию смеси вицинального бис-фторсульфата CF3CF(OSO2F)CF2OSO2F и фторсульфатодимера а не смеси двух изомерных бис(фторсульфонилокси)перфторизогексанов, образующихся из гексафторпропилена под действием электрохимически генерируемого пероксидисульфурилдифторида (Millauer Н. Deutschland Patent Application No DE 3128 118 A1, 1981; Schwerfeger W., Sigemund G, Millauer Н., тезисы 11-ого Международного Симпозиума по химии фтора, Берлин, 1985, с.82).
Синтез бис-фторсульфатов на основе гексафторпропилена (II) на Pt-электроде.
Потенциостатический электролиз смеси HSO3F/0,25М FSO3K в присутствии олефина (II) проводили при потенциалах окисления олефина в стеклянном бездиафрагменном электролизере; анод - Pt-сетка (20 см2), катод - нержавеющая сталь (0,5 см2), электроды сравнения - Pd/H2 или Cu/Cu2+. По окончании электролиза реакционную массу вылили на лед, орг. слой отделили, промыли водой, высушили MgSO4 и перегнали.
Эксперимент
Потенциостатический электролиз проводили при напряжении Е=1.9 В отн. Pd/H2. После пропускания 4000 кулон электричества (1,11А-час) (поглотилось 5 г олефина (II)) реакционную массу обработали и получили 5 г смеси фторсульфатов (III) и (IV) в соотношении (III):(IV)=1:1 (ЯМР 19F; ГЖХ). Суммарный выход (III)+(IV) по току 50%. Масс-спектр CF3CF(OSO2F)CF2 -OSO2F (III) (m/z, I rel. %): 279 [М-CF3]+ (2.5); 249 [М-SO3F] (60); 199 [CF3CFOSO2F]+ (10), 169 [С3F7]+ (40); 149 [CF2OSO2F]+ (40); 97 [CF3СО]+ (40); 83 [SO2F]+ (82), 69 [CF3]+ (60), 47 [CFO]+ (20);
Спектр ЯМР 19F (δ, ppm.): 3.8 (3 F1); 65.0 (1 F2); 7.0 (2 F4); 126.0 (2 F3,5)
Масс-спектр (m/z, Irel., %): 399 [М- SO3F]+ (20), 297 [М- SO3F-SO2F]+ (40), 269 [C5F11]+ (50), 181 [C4F7]+ (50), 149 [CF2OSO2F]+ (48), 131 [C3F5]+ (23), 119 [C2F5]+ (20), 83 [SO2F]+ (93), 69 [CF3]+ (94), 47 [CFO]+ (50);
Спектр ЯМР 19F (δ, ppm.) (смесь диастереомеров): -7.0 и - 6.6 (6F1,2); м с центром 100.0 (2F3,4); -3.4 и -2.9 (4F5,6); -126 (2F7,8)
Т.о., состав продуктов потенциостатического электролиза гексафторпропилена (II) в HSO3F - (III:IV=1:1), причем чистота фторсульфатодимера (IV) составляет ˜97-98% - существенно отличается от состава продуктов аналогичной реакции, но проведенной в условиях гальваностатического режима, что было описано ранее (Deutschland Patent Application No DE 3128118 A1 (1981)) [1,2-бис(фторсульфонилокси)перфторпропан:бис(фторсульфонилокси)перфторизогексаны (смесь изомеров)=1:2; соотношение фторсульфатодимеров гексафторпропилена (IV): 1,4-бис(фторсульфонилокси)-2-трифторметилперфторпентан (III)=2:1]. Электрохимические превращения олефина (II) в условиях потенциостатического электролиза могут быть представлены следующей схемой:
Совершенно очевидно, что отсутствие изомера «голова к хвосту» (IVa) связано с локализацией химических превращений олефина (II) на поверхности анода: в приэлектродном слое (II) полностью превращается в радикал (А), димеризация или окисление которого дают смесь (III)/(IV). Скорости этих процессов существенно выше скорости десорбции радикала (А) в объем электролита, где он может взаимодействовать с олефином (II), давая изомерный фторсульфатодимер (IVa). В итоге изомер (IVa) образуется лишь в следовых количествах.
Электрохимическое поведение стеклоуглеродного электрода во фторсульфоновой кислоте в ходе электросинтеза бис-фторсульфатов
Электроокисление (II) на СУ-электроде сопровождается появлением необратимой волны окисления и, как и в случае Pt-электрода, осуществляется в условиях смешанной кинетики. Однако попытка провести потенциостатический электролиз при потенциале предельного тока окисления(II) (2,35 В по отношению к Cu/Cu2+ -электроду сравнения) закончилась неудачей: величина тока окисления быстро понизилась в результате пассивации поверхности электрода.
Очевидно, что фторсульфатирование поверхности СУ-электрода в ходе анодной поляризации в области высоких положительных потенциалов понижает его электрокаталитическую активность по отношению к реакции окисления (II). Фторсульфатирование стеклоуглерода в области потенциалов его окисления также приводит к падению токов окисления его поверхности, что, по-видимому, объясняет высокую коррозионную устойчивость СУ-анодов при электроокислении в среде HSO3F. Также была попытка осуществить препаративное фторсульфатирование (II) в условиях гальваностатического электролиза, но при плотности анодных токов на порядок ниже тех, что были использованы в патенте ФРГ (см. выше). При этих условиях потенциал, определенный по отношению к Cu/Cu2+ -электроду сравнения, попадает в область потенциалов, предшествующих потенциалу окисления FSO3 - аниона.
Эксперимент
В электролитическую ячейку (анод - СУ-2000, площадь 20 см2; катод - нержавеющая сталь, площадь 5 см2) поместили 56 г HSO3F и 5,6 г KSO3F и подвергли электролизу (ток - 200 мА), пропуская олефин (IV) со скоростью 2 мл/мин.
В этих условиях наблюдается быстрая пассивация стеклоуглеродного анода.
Электрохимическое поведение PbO2-электродов при электросинтезе бис-фторсульфатов во фторсульфоновой кислоте.
Была изучена возможность использования в качестве анодного материала для фторсульфатирования гексафторпропилена (II) в условиях потенциостатического электролиза в HSO3F.
Анод - электроосажденный α-PbO2 (площадь 5 см2), катод - стальной стержень (площадь 0,5 см2). Гексафторпропилен вводили в электролит со скоростью 2 мл/мин.
Пример 1
Потенциостатический электролиз проводили при Е=2,2 В (по отношению к Cu/Cu2+ электроду сравнения). После пропускания 3500 К электричества (0,97 А/час) выделено 3,3 г реакционной массы, содержащей бис-фторсульфаты (III) и (IV) в мол. соотношении 1:1 (ЯМР 19F; ГЖХ). Выход по току 40,7%; потеря веса анода - 300 мг.
Пример 2
Электролиз проводили в условиях примера 1. После пропускания 4300К (1,19 А/час) обработкой электролита выделено 3,9 г смеси бис-фторсульфатов (III) и (IV) в мол. соотношении 1.3:1 (выход по току 40,3%) Потери веса анода - 330 мг.
В примерах 1-2 наблюдается образование белого осадка, по всей вероятности, образующегося при восстановлении на катоде ионов Pb4+ который, однако, не мешает выделению продуктов реакции.
Следует отметить, что стационарный потенциал α-PbO2-электрода в HSO3F составляет 1,8-1,9 В. Как правило, при этих потенциалах диоксид свинца проявляет достаточную коррозионную стабильность. Переход PbO2 в электролит не связан с коррозией в области высоких анодных потенциалов и не является результатом его реакции с водородом, выделяющимся на катоде, а определяется простым растворением PbO2 во фторсульфоновой кислоте.
Электрокаталитические свойства Ir-электрода при прямом электроокислении гексафторпропилена во фторсульфоновой кислоте.
Известно, что в кислых водных растворах иридий обладает более высокой коррозионной стабильностью по сравнению с платиной. Стабильность иридия в неводных средах практически не изучена.
Потенциостатический электролиз олефина (II) в HSO3F/[KSO3F] проводили при потенциале его окисления в диафрагменном электролизере (емк. 50 мл). Анод - Ir-пластина (площадь 16 см2), катод - стальной стержень (площадь 0,5 см2), электрод сравнения - Cu/Cu2+.
Эксперимент.
В электролит 35 мл (60,5 г HSO3F) и 2 г KSO3F при потенциале Е=2,4 В относительно Cu/Cu2+ электрода сравнения вводили гексафторпропилен (II) со скоростью 2 мл/мин. После пропускания 1500 Кулон (0,41 А/час) электричества обработкой реакционной массы было выделено 2,8 г смеси бис-фторсульфатов (III)/(IV) в мол. соотношении 1:1 (ЯМР 19F; ГЖХ). Выход по току 84%.
Фторсульфатирование (II) было проведено в условиях гальваностатического электролиза при анодной плотности тока 3,7-6,2 А/см2, что соответствует потенциалам, не превышающим потенциал электроокисления (II), т.е. в условиях, стимулирующих потенциостатическое окисление.
Пример 1
Через электролит (60,5 г HSO3F+2 г KSO3F) пропускали олефин (IV) со скоростью 2 мл/мин, подвергая смесь электролизу при токе 100 мА (анод - Ir-пластина; площадь 16 см2; катод - сталь; площадь 1,5 см2). Всего пропущено 5,25 А/час электричества (по мере формирования орг. слоя его извлекали пипеткой, добавляя к электролиту равный объем HSO3F). По окончании электролиза электролит разложили ледяной водой, органические продукты объединили, высушили MgSO4 и перегонкой получили 33,6 г смеси бис-фторсульфатов в соотношении (III):(IV):(IVa)=1:2,3:0,27. По мере накопления органических продуктов относительное содержание (IVa) повышается от 8 до 10,5%. Выход по току 84%. Потери иридия составили 20 мг.
Пример 2
Электроокисление (II) проводили в электролите, насыщенном органическими продуктами, в условиях примера 1 при токовой нагрузке 60 мА. После пропускания 4,04 А/час электричества получили 32,4 г смеси (III): (IV): (IVa)=1:2,2:0,28; выход по току 84%. Относительное содержание димера IVa в смеси димеров IV/IVa составляет 11,2%. Общие потери иридия при получении 66 г смеси бис-фторсульфатов III-IV/IVa составляет 55 мг.
Выше отмечалось, что введение органической фазы в электролит может существенно влиять на состав продуктов электросинтеза. Образование димера IVa может быть представлено схемой, включающей в себя присоединение радикала А (см. схему) к гексафторпропилену (наличие орг. фазы, в которой растворимость радикала А и гексафторпропилена выше, чем в электролите, благоприятствует этому процессу). В то же время содержание димера IVa («голова к хвосту») в общей массе фторсульфатодимеров не превышает 8-11%. Бис-фторсульфаты (III) и (IV)/(IVa) легко делятся перегонкой.
Электросинтез бис-фторсульфатов III-IV на Ir-электроде в режиме непрерывного электролиза.
Типовой эксперимент.
Электросинтез проводили в режиме потенциостатического электролиза при Е=2,4В относительно Cu/Cu2+ электрода сравнения; электролит - 58 г HSO3F+2 г KSO3F; скорость подачи гексафторпропилена 2 мл/мин. Анод - Ir-пластина (площадь 16 см2); катод - сталь (площадь 2 см2). После пропускания 1500 кулон электричества устанавливается ток в 60 мА; напряжение на электролитической ячейке - 3,7 В.
Последующий электролиз для получения бис-фторсульфатов в препаративных количествах проводили в гальваностатическом режиме при токе 60 мА, что соответствует потенциалам, не превышающим потенциалы электроокисления (II) (условия симулируют режим потенциостатического электролиза).
Периодически после пропускания 1,45-1,5 А/час полученный органический слой отделяли, добавляя к электролиту равный объем HSO3F. После пропускания 23 А/час электричества электролит вылили на лед, органические продукты объединили, обработали по методике, указанной выше, и получили 172 г смеси бис-фторсульфатов (III):(IV):(IVa)=1:2,95:0,25; выход по току 87%. В смеси фторсульфатодимеров IV относительное содержание изомера IVa «голова к хвосту» составляет 8%. Потери иридия 72,7 мг (0,35 мг на 1 г полученной смеси продуктов).
Следует отметить, что напряжение на ячейке не менялось в ходе электролиза (3,7 В). Это свидетельствует о том, что формирования оксидных слоев на аноде не происходит и гальваностатический режим электролиза стимулирует потенциостатический. Высокая чистота димера (IV) позволяет использовать его в синтетических целях.
Электросинтез бис-фторсульфатов (III)-(IV)/(IVa) на Pt-Ir-электроде.
Пример 1
Электролит - 34,6 г HSO3F+1,2 г KSO3F; анод - металлургический сплав Pt-Ir (содержание Ir 40%), площадь 8 см2; катод - сталь, площадь 1 см2; потенциал анода - 2,4 В по отношению к Cu/Cu2+ электроду сравнения. Фторсульфатирование (IV) проводили в условиях предыдущего примера. После пропускания 7120 кулон (1,97 А/час) обработкой электролита выделено 8,5 г смеси (IV):(III)=2,0:1,32 (фторсульфатодимер (IVa) обнаружен не был). Выход по току 54,5%; потеря материала анода - 50 мг.
В следующем примере представлены результаты гальваностатического электролиза, стимулирующего потенциостатический режим.
Пример 2
Электролиз проводили в условиях примера 1 при токе 60 мА. После пропускания 1,74 А/час электричества обработкой электролита было выделено 9,3 г смеси (III):(IV)=2:1,1; изомер (IVa) не обнаружен). Выход по току 67,3%. Потеря материала анода - 15,9 мг.
Т.о., фторсульфатирование гексафторпропилена на аноде из сплава Pt-Ir показало, что:
1) состав продуктов реакции, проведенной в условиях потенциостатического электролиза и гальваностатического электролиза, симулирующего потенциостатический режим, практически идентичен;
2) отсутствие изомера (IVa) в продуктах, полученных при относительно кратковременном электролизе, подтверждает предположение о том, что для образования изомера (IVa) требуется формирование органической фазы;
3) электрокаталитическая активность электрода из Pt-Ir-сплава близка к активности иридиевого электрода;
4) коррозионная стабильность Pt-Ir-сплава в ˜5 раз ниже по сравнению с иридием (коррозионные потери анода из Pt-Ir-сплава составляют 1,7 мг на 1 г смеси продуктов реакции).
Электросинтез бис-фторсульфатов (III)-(IV)/(IVa) на Pt-Ir-электроде.
Пример 1
Электролит 57,9 г HSO3F+2 г KSO3F; анод - Pt-Ir-сплав (содержание Ir - 10%; площадь 16 см2); катод - сталь (площадь 5 см2). Условия электролиза аналогичны условиям предыдущего примера. После пропускания 1500 кулон электричества устанавливается ток 100 мА. Напряжение на ячейке 3,7 В.
Аналогично предыдущему примеру электролиз проводили в гальваностатическом режиме при 100 мА, периодически отбирая органические продукты реакции и добавляя к электролиту равный объем HSO3F. После пропускания 9,61 А/час электричества электролит вылили на лед, орг. продукты объединили, обработали по методике, указанной выше, и получили 62 г смеси (III):(IV)=1:1 (изомер IVa обнаружен не был). Выход по току 73%.
| Табл.1 | ||||||
| Синтез бис-фторсульфатов (III)/(IV) на различных анодных материалах | ||||||
| N | Состав электролита | Пропущенный заряд, Потенциал анода отн. Cu/Cu2+, В | Выделенные продукты, г и соотношение (III): (IV): (IVa) | Выход по току, % | Материал анода | Коррозия анода, мг |
| 1. | FSO3H (57.9r) FSO3K (2 г) | 82817,22.4 | 1721:2.91:0.25 | 87 | Ir | 72.7 |
| 2. | FSO3H (34.6 г) FSO3K (1.2 г) | 71202.4 | 8.52:1.32 | 54.5 | Pt-40% Ir металлургический сплав | 50 |
| 3. | FSO3Н (34.6 г) FSO3K(1.2 г) | 6265.2гальваностат.эксп. N2 | 9.32:1.1 | 67.3 | Pt-40% Ir металлургический сплав | 15.9 |
| 4. | FSO3H (34.6 г) FSO3K (1.2 г) | 15302.4 | 1.83.55: 1 | 54.9 | Pt-40% Ir получен термическим разложением солей на Ti основе | - |
| 5. | FSO3H (57.9r) FSO3K (2.0 г) | 346032.4 | 621:1 | 73 | Pt-10% Ir металлургический сплав | 183 |
| 6. | FSO3Н (34.6 г) FSO3K (1.2 г) | 51002.4 | 8.01:1 | 73 | Pt-10% Ir металлургический сплав | 39 |
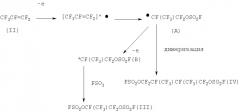
Электрохимическое поведение перфтораллилфторсульфата на Pt- и СУ-электродах во фторсульфоновой кислоте.
Электрохимическое поведение перфтораллилфторсульфата (V) при электролизе на Pt- и СУ-электродах в HSO3F напоминает электрохимическое поведение гексафторпропилена. Разница в потенциалах начала электроокисления (V) и FSO3-аниона на Pt-электроде в HSO3F составляет 0,6 В, что позволяет осуществить фторсульфатирование (V) его прямым электроокислением без генерации пероксидисульфурилдифторида. Аналогичная картина наблюдается при электроокислении (V) на СУ-аноде, однако разница в потенциалах окисления (V) и FSO3-аниона составляет лишь 50 мВ, т.е. потенциалы генерации пероксидисульфурилдифторида и окисления (V) отличаются незначительно.
Препаративное фторсульфатирование перфтораллилфторсульфата.
Потенциостатический электролиз (V) в HSO3F/0,25М KSO3F при потенциале лимитирующих токов окисления (V) в диафрагменном электролизере. Анод - сплав Pt-10% Ir (площадь 9 см2), катод - сталь (площадь 0,5 см2), электрод сравнения - Cu/Cu2+. Продукты реакции выделялись по стандартной методике.
Пример
Потенциостатический электролиз смеси 25 г HSO3F, 0,7 г KSO3F и 3 г (V) проводили при потенциале 2,3 В по отношению к Cu/Cu2+ электроду сравнения. После пропускания 2520 кулон электричества обработкой электролита было выделено 5 г смеси 1,2,3-трис (фторсульфонилокси)пентафторпропана (VI) и 2,3-бис(фторсульфонилоксидифторметил)-1,4-бис(фторсульфонилокси)тетрафторбутана (VII) в соотношении (VI):(VII)=8:1 (ЯМР 19F; ГЖХ). Выход по току 90%. Потери материала анода 4,47 мг (0,89 мг на 1 г орг. продуктов).
Электрохимические превращения (V) могут быть представлены следующей схемой:
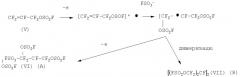
Электрохимическое поведение перфторалкилвиниловых эфиров RFOCF=CF2 на Pt-и СУ-электродах во фторсульфоновой кислоте.
Как и в случае прямого окисления (II), анодное окисление перфторалкилвиниловых эфиров можно представить следующей схемой:
где RF=CF3(а); С3F7(б); CF3ОС3F6(в); FSO2CF2CF2OCF(CF3)CF2)(г); FSO2CF2CF2(д)
Электрохимическое поведение перфторметилвинилового эфира CF3OCF=CF2 (VIII) на Pt- и СУ-электродах во фторсульфоновой кислоте.
Прямое электроокисление перфторметилвинилового эфира (VIII) на Pt- и СУ-электродах в HSO3F наблюдается при потенциалах 1,4-2,6 В для платины и 1,6-2,4 В для стеклоуглерода (электрод сравнения Cu/Cu2+).
Фторсульфатирование перфторметилвинилового эфира.
Потенциостатический электролиз смеси HSO3F/0,25 М KSO3F в присутствии олефина (VIII) проводили при потенциале предельных токов окисления (VIII) в диафрагменном электролизере; анод - СУ (площадь 12 см2), катод - сталь (площадь 0,5 см2), электрод сравнения Cu/Cu2+; (VIII) подавали в электролит через барботер со скоростью 2 мл/мин.
Пример. Потенциостатический электролиз проводили при Е=2,2 В по отношению к электроду сравнения. После пропускания 2861 К электричества обработкой электролита выделено 3 г смеси трифторметил-α,β-бис(фторсульфонилокси)трифторэтилового эфира (IX) и 2,3-бис(трифторметокси)-1,4-бис(фторсульфонилокси)тетрафторбутана (X) [фторсульфатодимер (VIII) «голова к голове»] в соотношении (IX):(Х)=1:0,6 (ЯМР 19F; ГЖХ) [фторсульфатодимер (VIII) «голова к хвосту» обнаружен не был]. Выход по току 50%. В ходе электролиза пассивации электрода не отмечалось.
[FSO3CF2CF(OCF3)]2 (В) (смесь диастереомеров);
Таким образом, бис-фторсульфат (В), являющийся предшественником 2,3-бис(трифтометокси)перфторсукцинилдифторида, может рассматриваться как полупродукт для получения фторкатионитов типа «Флемион», содержащий фторалкоксильные группы, модифицирующие физико-химические свойства таких катионитов.
Б. Электроокисление (II) на электрокаталитических материалах из наночастиц Pt, Ir, сплава Pt-10%Ir, нанесенных на стеклоуглерод
Результаты препаративного электроокисления (II) с целью получения исходных продуктов для синтеза мембран типа «Флемион» на наноэлектрокаталических материалах из наночастиц Pt, Ir и сплава Pt-10% Ir приведены в таблице 2.
| Таблица 2. | ||||
| Электросинтез бисфторсульфатов на основе прямого окисления (II) на анодах из наноэлектрокатализаторов Pt, Ir, сплава Pt-10%Ir | ||||
| № п/п | Олефин | Условия электролиза | Продукты электролиза | Выход по току, % |
| 1 | CF3CF=CF2 | HSO3F/KSO3F Наноэлектрокатализатор Pt Е=1.8 В отн.Cu/Cu2+ 25-28°С | (III):(IV)=1:1 | 70 |
| 2 | CF3CF=CF2 | HSO3F/KSO3F Наноэлектрокатализатор Ir Е=1.8 В отн. Cu/Cu2+ | Те же продукты, что и в примере 1(III): (IV)=1:2.5 | 90 |
| 25-28°С | ||||
| 3 | CF3CF2=CF2 | HSO3F/KSO3F Наноэлектрокатализатор Pt-10% Ir Е=2.2 В отн. Cu/Cu2+ | Те же продукты, что и в примере 1 | 84 |
| 25-28°С | (III): (IV)=1:1.5 | |||
| 4 | CF3CF=CF2 | HSO3F/KSO3F СУ анод Е=2.2 В отн Cu/Cu2+ 25-28°С | Пассивация | - |
Электроокисление перфторалкилвиниловых эфиров на каталитических материалах из наночастиц Pt, Ir, сплава Pt-10%Ir, нанесенных на стеклоуглерод
Электрохимическое поведение перфторалкилвиниловых эфиров очень подобно поведению перфторолефинов. Также наблюдается необратимая волна окисления, которая лимитируется как скоростью переноса заряда, так и адсорбционной стадией. Однако потенциалы окисления эфиров не сильно изменяются в отличие от перфторолефинов при увеличении длины перфторуглеродной цепи. Сравнительные результаты электроокисления перфторолефинов и перфторалкилвиниловых эфиров приведены в таблице 3.
| Таблица 3. | |||
| Потенциалы окисления фторолефинов и перфторалкилвиниловых эфиров | |||
| RFCF=CF2 | RFOCF=CF2 | ||
| RF | Е,В | RF | Е,В |
| F | 1.65 | ||
| CF3 | 2.05 | CF3 | 1.67 |
| С3F7 | 2.15 | С3F7 | 1.71 |
| C5F11 | 2.30 | FSO2C2F4 | 1.74 |
| FSO3H | 2.34 | FSO2C2F4OCF(CF3)CF2 | 1.74 |
По видимому, электрохимическое поведение виниловых эфиров и терминальных олефинов определяется различной адсорбцией на поверхности анода. Причиной этому может быть различная электронная плотность двойных связей. Для виниловых эфиров характерна высокая электронная плотность и высокая энергия адсорбции, что по нашему мнению связано с влиянием кислорода в альфа-положении, который увеличивает плотность заряда на двойной связи, и стерические затруднения, связанные с влиянием заместителя, незначительны. В случае терминальных олефинов двойная связь истощена и стерические факторы играют существенную роль за место олефина на поверхности электрода, что существенно сказывается на потенциале их окисления. Наблюдается монотонный рост потенциала окисления с увеличением длины перфторуглеродной цепи заместителя.
Результаты препаративых синтезов в условиях прямого окисления виниловых эфиров с использованием анодов из катализаторов на основе наночастиц Pt, Ir и сплава Pt-10% Ir, нанесенных на стеклоуглерод, приведены в таблице 4.
| Таблица 4. | ||||
| Электросинтез бисфторсульфатов на основе прямого окисления трифторметилвинилового эфира на анодах из наночастиц Pt, Ir, сплава Pt-10% Ir, нанесенных на стеклоуглерод | ||||
| № п/п | Субстрат | Условия | Продукты | Выход по |
| 1 | CF3OCF=CF2 | HSO3F/KSO3F Наноэлектрокатализатор Pt Е=2.0 В отн. Cu/Cu2+ 25-28°С | 80,1 | |
| 2 | CF3OCF=CF2 | HSO3F/KSO3F Наноэлектрокатализатор PtE=2.0 В отн. Cu/Cu2+25-28°С | Такие же продукты, как в примере 1(IIIa):(IVa)=1:1 | 84 |
| 3 | CF3OCF=CF3 | HSO3F/KSO3F Наноэлектрокатализатор-сплав Pt10% Ir Е=2.2 В отн Cu/Cu2+ 25-28°С | (IIIa):(IVa)=1,6: 1 | 86.9 |
| 4 | CF3OCF=CF2 | HSO3F/KSO3F СУ анод Е=2.0 В отн. Cu/Cu2+ 25-28°С | Такие же продукты, как в примере 1(IIIa):(IVa)=1:0.6 | 50 |
Исследование электрокаталитической активности наноэлектрокатализаторов Ir в реакции окисления и гексафторпропилена (II)
На фиг.1 представлены циклические вольтамограммы электроокисления гексафторпропилена (II) на стеклоуглероде а) и на стеклоуглероде, модифицированном наночастицами иридия. Из фиг.1 видно, электроокисление (II) на стеклоуглеродном аноде происходит в области потенциалов 2.0÷2.25 В, т.е. в области потенциалов, близкой к окислению анионов фторсульфоновой кислоты. Область потенциалов электроокисления (II) на наноэлектрокатализаторе на основе иридия 1.6÷1.76 В. Электрокаталитическая активность анода на основе наночастиц иридия на порядки превосходит электрокаталитическую активность стеклоуглеродного электрода. Сравнение электрокаталитической активности электродов из гладкого иридия и модифицированного наночастицами иридия стеклоуглеродного электрода показывает, что скорость электроокисления (II) на наноэлектрокатализаторе при потенциале 1.85 В в 15 раз выше скорости окисления (II) на гладком иридиевом электроде (см. фиг.2).
Таким образом, исследование электроокисления фторолефинов и перфторалкилвиниловых эфиров на наноэлектрокатализаторах на основе наночастиц Pt, Ir, сплава Pt-10% Ir на гладком углеродном носителе (стеклоуглероде), полученных на основе гомо- и гетерометаллических кластеров, продемонстрировало:
1) Скорость прямого электроокисления олефинов и перфторалкилвиниловых эфиров на каталитических наноматериалах увеличивается на порядки по сравнению со стеклоуглеродом и в 5-15 раз по сравнению с гладкими платиной и иридием.
2) Соотношение продуктов синтеза аддукта и димера (бис-фторсульфатов), используемых в качестве исходных для синтеза перфторированных мембран, зависит от природы наноматериала анода.
3) В случае наночастиц платины основным продуктом является аддукт, в случае иридия, на котором адсорбция интермедиатов ниже, чем на платине, основным продуктом является фторсульфатодимер.
4) Выход по току продуктов прямого электроокисления фторолефинов и перфторалкилвиниловых эфиров во фторсульфоновой кислоте на анодах из каталитических наноматериалов составляет 70-90%.
5) Загрузки благородных металлов для проведения электрокаталитических процессов снижаются на порядки и составляют 0,4-1 мг/