Конъюгат ангиотензиновой пептидной составляющей с носителем, композиция вакцины, способ иммунизации животного и способ лечения или профилактики физического нарушения, ассоциированного с активируемой ренином ангиотензиновой системой
Иллюстрации
Показать всеИзобретение относится к области генной инженерии, конкретно к иммуногенным конъюгатам, и может быть использовано для лечения и профилактики состояний, ассоциированных с активируемой ренином ангиотензиновой системой. Посредством непептидной ковалентной связи конъюгируют вирусоподобную частицу РНК-бактериофага с ангиотензиновой пептидной составляющей. Полученный конъюгат ангиотензиновой пептидной составляющей с носителем используют для иммунизации. Изобретение позволяет получить упорядоченный и повторяемый конъюгат ангиотензиновой пептидной составляющей с носителем. 5 н. и 24 з.п. ф-лы, 5 ил., 2 табл.
Реферат
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Область изобретения
Изобретение относится к областям медицины, здравоохранения, иммунологии, молекулярной биологии и вирусологии.
Связанная область
Артериальное кровяное давление у млекопитающих контролируется по большей части биохимическим каскадом, известным как ренин-ангиотензиновая система (RAS). Он инициируется высвобождением ренина из эпителиоидных клеток юкстагломерулярного аппарата почки после падения артериального кровяного давления. Ренин ферментативно расщепляет пептид ангиотензиноген (аминокислотная последовательность: Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-His-Leu-Val-Ile-His-Asn, SEQ ID NO: 15), который секретируется в сыворотку печенью. Данное расщепление приводит к образованию декапептида ангиотензина I (аминокислотная последовательность: Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-His-Leu, SEQ ID NO: 16). Ангиотензин-превращающий фермент (АСЕ), который находится в эндотелии легких, за секунды отщепляет две С-концевые аминокислоты ATI с образованием ангиотензина II (аминокислотная последовательность: Asp-Arg-Val-Tyr-Ile-His-Pro-Phe, SEQ ID NO: 17). В то время как ангиотензин I является в организме очень короткоживущим и не имеет или имеет очень слабую сосудосуживающую активность, ангиотензин II оказывает сильное действие на систему циркуляции, а также на эндокринную систему. Повышенные концентрации активированного RAS ангиотензина II вызывают суживание сосудов, задержку почками солей и воды, причем оба данных эффекта вносят вклад в повышенное артериальное давление (гипертензию), которое может приводить к повреждению сердечно-сосудистой системы. Возможными клиническими проявлениями гипертензии являются инсульт, инфаркт, застойная сердечная недостаточность, почечная недостаточность или кровоизлияние в сетчатку.
Согласно данным U.S.Centers for Disease Control and Prevention (CDC), застойная сердечная недостаточность является основным хроническим заболеванием лиц старшего возраста и вызывает в США примерно 260000 смертей за год. В 1'995 г.из-за случаев сердечной недостаточности программой страхования здоровья (Medicare) было выплачено $3,4 миллиарда. Хотя для лечения гипертензии доступны лекарственные средства, контролировать гипертензию удается только примерно у половины подвергнутых лечению пациентов с гипертензией. Частично это является следствием отсутствия соблюдения больным режима и схем лечения или неэффективности использованных лекарственных средств.
Современное лечение гипертензии включает вмешательство в систему RAS с использованием небольших органических молекул. Основными мишенями являются ренин, АСЕ и рецепторы ангиотензина II. Ингибиторы АСЕ включают лизиноприл®, каптоприл® и эналаприл®, однако, данные лекарственные средства не являются полностью эффективными. Во-первых, оказывается, что они не полностью блокируют активность АСЕ, и, во-вторых, воздействию подвергается образование посредством АСЕ других биологически активных пептидов, включая брадикинин, что нежелательно. Данные лекарственные средства могут индуцировать побочные эффекты, такие как сухой кашель и гипотензивный эффект первой дозы с головокружением и возможным обмороком. Антагонисты рецептора ангиотензина II включают лозартан®, валсартан® и исбесафтан®, которые специфично воздействуют на рецептор ангиотензина ATI; поэтому они блокируют основные сосудосуживающие эффекты ангиотензина II и лучше переносятся, но не влияют на другие действия ангиотензиновых гормонов. Однако антагонисты рецептора ангиотензина, как и ингибиторы АСЕ, требуют приема на регулярной основе, часто в течение длительных периодов, таких как большая часть взрослой жизни, что, по крайней мере, частично объясняет плохое соблюдение больным режима и схем лечения. Поэтому существует явная потребность в лекарственных средствах для лечения гипертензии, которые были бы эффективными, хорошо бы переносились и сопровождались бы хорошим соблюдением больным режима и схем лечения.
Предполагаемый подход к лечению или профилактике заболеваний или нарушений, связанных с активностью гормона, представляет собой нейтрализацию эффектов гормона в организме пациента путем иммунотерапии, например, путем иммунизации пациента против данного гормона или ферментов, участвующих в его образовании, так что активность данного гормона нейтрализуется или его концентрации снижаются за счет специфических антител против гормона или фермента. Такие антитела могут вводиться путем пассивной иммунизации, или они могут генерироваться in situ путем активной иммунизации с использованием иммуногена, основанного на гормоне или связанном с ним ферменте.
Осуществимость вакцинации против компонентов RAS с целью модуляции гипертензии показана на экспериментальных животных (для обзора см. Michel, Am. Heart J. 117:756 (1989)). Вакцинация против ренина была эффективной для понижения кровяного давления, однако, животные страдали от аутоиммунного нефрита (Michel et al., Circulation 81:1899 (1990); Lo et al., Hypertension 16:80 (1990)). Количество данных по активной иммунизации против гомологичного АСЕ очень ограничено. В одном из сообщений описана вакцинация кроликов, но только 1 из 50 животных характеризовалось детектируемым уровнем антител против АСЕ (Softer, Fed. Proc. 42:2735 (1983)). Пассивный перенос иммунной сыворотки против АСЕ может снижать кровяное давление у кроликов, но ведет к иммуноаллергической реакции с отеком легким, возможно, поскольку АСЕ экспрессируется в мембраносвязанной форме в легких (Cadwell, FEBS Lett. 63:82 (1976)). Не доступны сообщения об активной иммунизации против ангиотензиногена, однако, в некоторых исследованиях анализировалась осуществимость вакцинации против ангиотензина-I и ангиотензина-II. В двух исследованиях сообщается об эффекте на кровяное давление (Christlieb, J. Clin. Invest. 48:1506 (1969); Gardiner, Br. J. Pharmacol. 129:1178 (2000)) у вакцинированных животных, и не отмечалось аутоиммунитета. Однако множество исследований по вакцинации ангиотензиновыми пептидами имели отрицательные результаты, возможно, потому что индуцированные титры антител против ангиотензиновых пептидов были слишком низкими, или потому что специфичность индуцированных антител не была оптимальной. Вероятно, что вакцина, которая направлена только на ангиотензин II, не имеет такого эффекта на RAS, как вакцина, которая индуцирует антитела против ангиотензина II, а также против ангиотензина I и, возможно, также против их предшественника ангиотензиногена.
В WO 98/58952 описано лечение конъюгатом, содержащим ангиотензин I, конъюгированный со столбнячным анатоксином, что ведет к индукции специфичных в отношении ангиотензина антител у крыс, при использовании совместно с адъювантом, таким как гидроксид алюминия. Адъюванты часто являются токсичными или по крайней мере вызывают раздражение. Из адъювантов для применения у человека разрешены только минеральные соли (гидроксид алюминия, фосфат алюминия, фосфат кальция) и виросомы. Чаще всего для людей используется адъювант гидроксид алюминия (алюминиевые квасцы). Хотя он считается безопасным, он остается в организме в течение длительного периода времени, характеризуясь депонированием. Последствия такого депонирования пока изучены слабо, поэтому в будущих вакцинах следует пробовать избегать применения алюминиевых квасцов без утраты иммуногенности вакцины.
Таким образом, в данной области сохраняется потребность в предоставлении конъюгатов, приводящих к индукции высоких титров антител даже в отсутствие адъювантов.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящее время авторы изобретения разработали мощные иммуногены для индукции антител, специфичных в отношении ангиотензиногена, ангиотензина I или ангиотензина II (совместно обозначенных здесь, как «ангиотензиновые пептиды»), которые эффективны даже без применения адъювантов и которые обеспечивают in vivo продукцию антител, которые специфично направлены на один или несколько ангиотензиновых пептидов, таких как ангиотензиноген, ангиотензин I или ангиотензин II. Иммуногены состоят из ангиотензиновых пептидных составляющих, которые связаны с вирусоподобными частицами (VLP). Это приводит к образованию высокоиммуногенного повторяющегося антигенного мотива, способного стимулировать образование антител даже без применения адъювантов. В зависимости от аминокислотной последовательности использованных ангиотензиновых пептидных составляющих индуцируются высокие титры антител, и, более того, они могут специфично индуцироваться против N- или С-концов ангиотензиногена, ангиотензина I или ангиотензина II. Это обеспечивает специфичную направленность против только одного вида ангиотензиновых пептидов или их комбинации. Таким образом, иммуногены по настоящему изобретению могут использоваться в иммунотерапевтическом подходе для борьбы с состояниями, ассоциированными с повышенными концентрациями ангиотензина II, продуцированного RAS.
Данные конъюгаты и конъюгаты по изобретению могут индуцировать антитела, которые связываются более чем с одним видом ангиотензиновых пептидов, одновременно блокируя таким образом все близкие ангиотензины, причем не подразумевается, что это явление ограничено какой-либо конкретной теорией действия или механизма. Альтернативно, индуцированные антитела могут специфично связываться с С-концом ангиотензиногена, ангиотензина I или ангиотензина II. В данных условиях, индуцированные антитела блокируют активацию ангиотензиногена или ангиотензина I ренином или АСЕ, соответственно. Тем не менее, протеазы, отличные от АСЕ или ренина, такие как эндопептидазы и аминопептидазы, могут разрушать ангиотензиноген, ангиотензин I или ангиотензин II с N-конца, предотвращая таким образом накопление связанного с антителом интактного ангиотензиногена, ангиотензина I или ангиотензина II.
Таким образом, по изобретению предоставлены иммуногены, которые содержат один или несколько ангиотензиновых пептидов или пептидных составляющих или их производных, связанных с одной или несколькими коровыми частицами, предпочтительно, с одной или несколькими вирусоподобными частицами (VLP) с образованием конъюгатов, имеющих структуру упорядоченных или повторяемых мотивов. Коровые частицы, содержащие один участок связывания, и ангиотензиновые пептиды или их производные, содержащие второй участок связывания, ассоциированы через указанные первый и второй участки связывания с образованием таких упорядоченных или повторяемых мотивов. Взаимодействие между первым и вторым участками может быть непосредственным, или в нем может участвовать, по крайней мере, одна другая молекула, например, линкер.
В одном из осуществлений первый участок связывания присущ коровой частице от природы. Альтернативно, первый участок связывания добавляется путем химического присоединения или с использованием рекомбинантных способов. Предпочтительные первые участки связывания содержат аминогруппы, карбоксильные группы или сульфгидрильные группы. Предпочтительные аминокислоты, содержащие второй участок связывания, выбраны из лизина, аргинина, цистеина, аспарагиновой кислоты, глутаминовой кислоты, тирозина и гистидина. Особенно предпочтительными являются остатки лизина.
Подходящими вторыми участками связывания на ангиотензиновых пептидах или их производных являются амин, амид, карбоксильная или сульфгидрильная группы. Имеется много разнообразных соединений, которые были разработаны для обеспечения перекрестного связывания пептидов/белков или конъюгации белка с дериватизированными молекулами путем образования ковалентной связи с реакционноспособной группой белковой молекулы коровой частицы.
Коровые частицы с первым участком связывания по изобретению включают любую частицу, подходящую для образования упорядоченных повторяющихся мотивов. В некоторых осуществлениях такие коровые частицы включают вирусоподобные частицы (VLP), бактериофаг, частицы, подобные вирусу бактериофагу, пили, и тому подобное. В некоторых осуществлениях они представляют собой VLP из HBcAg, бактериофаговые VLP и пили I типа. Изобретение также относится к вариантным формам коровых частиц, которые сохраняют способность образовывать упорядоченную повторяющуюся структуру. Вариантные формы включают рекомбинантные и природные формы, и мутантные формы коровых частиц. В некоторых осуществлениях мутантные формы коровых частиц включают те, в которых тип первого участка связывания или некоторого количества указанных участков отличается от первоначального. Особенно предпочтительным является изменение числа остатков лизина на коровой частице.
В некоторых осуществлениях конъюгаты по изобретению содержат ангиотензиновые пептидные составляющие, которые химически связаны с вирусоподобными частицами (VLP). Это приводит к образованию высокоиммуногенного повторяющегося мотива антигенов, который способен стимулировать образование антител даже без применения адъювантов. В зависимости от аминокислотной последовательности применяемых ангиотензиновых пептидных составляющих индуцируются высокие титры антител, и, более того, они могут специфично индуцироваться против N- или С-концов ангиотензиногена, ангиотензина I или ангиотензина II. Это обеспечивает специфичную направленность против только одного вида ангиотензиновых пептидов или их комбинации. Иммуногены по изобретению могут использоваться в иммунотерапевтическом подходе для борьбы с состояниями, ассоциированными с повышенными концентрациями ангиотензина II, продуцированного RAS.
Таким образом, настоящее изобретение относится к конъюгатам, содержащим коровую частицу и один или несколько ангиотензиновых пептидов или ангиотензиновых пептидных составляющих, подходящих для применения при индукции иммуных ответов. Изобретение также относится к конъюгатам, включающим такие конъюгаты по изобретению и один или несколько дополнительных компонентов, таких как один или несколько наполнителей или носителей, предпочтительно, один или несколько фармацевтически приемлемых наполнителей или носителей. Конъюгаты и конъюгаты по изобретению включают вакцинные конъюгаты или конъюгаты с дополнительными фармацевтически приемлемыми наполнителями или адъювантами, или без них. Например, настоящее изобретение также относится к вакцинным конъюгатам, содержащим иммунологически эффективное количество одного или нескольких данных конъюгатов или конъюгатов по настоящему изобретению вместе с фармацевтически приемлемым разбавителем, носителем или наполнителем. В дальнейшем осуществлении вакцина, кроме того, содержит по крайней мере, один адъювант, такой как алюминиевые квасцы или неполный адъювант Фрейнда. Изобретение также относится к способам иммунизации и/или лечения животного, предпочтительно, млекопитающего, такого как человек, предусматривающим введение данному животному иммунологически эффективного количества конъюгатов, конъюгатов или вакцин по изобретению с индукцией таким образом иммунного ответа против данных конъюгатов. Животных можно подходящим образом иммунизировать данными конъюгатами или конъюгатами по изобретению любым известным в данной области путем введения, включая, в качестве не ограничивающих примеров, подкожный, внутримышечный, интраназальный, внутрикожный, внутривенный, чрескожный, пероральный пути введения, введение через слизистые оболочки или введение непосредственно в лимфатический узел. Интраназальная иммунизация представляет собой особенно подходящий путь; данный тип введения не только приводит к образованию высоких титров антител, включая IgA, как это показано в примерах, но также за счет избежания болезненных процедур иммунизации (например, внутримышечной) является более приемлемым для пациента и ведет к улучшенному соблюдению больным режима и схем лечения.
Конъюгаты и конъюгаты по изобретению индуцируют иммунный ответ, включая продукцию антител. Поэтому еще в одном осуществлении данное изобретение относится к способам продукции антител против одного или нескольких ангиотензиновых пептидов или ангиотензиновых пептидных составляющих. Такие антитела по изобретению могут использоваться для лечения или профилактики физических нарушений, ассоциированных с RAS, и для детекции ангиотензиновых пептидов или ангиотензиновых пептидных составляющих, например, в способах диагностики физических нарушений, ассоциированных с присутствием одного или нескольких компонентов RAS в тканях или циркуляторном русле животного.
В связанных осуществлениях изобретение относится к профилактике или лечению заболеваний, нарушений или состояний ассоциированных с RAS, включая, в качестве не ограничивающих примеров, инсульт, инфаркт, застойную сердечную недостаточность, почечную недостаточность, кровоизлияние в сетчатку и тому подобное. Иммунизация данными конъюгатами или конъюгатами по изобретению приводит к иммунному ответу против одного или нескольких ангиотензиновых пептидов или ангиотензиновых пептидных составляющих, так что иммунные молекулы, особенно антитела, связываются с ангиотензиновыми пептидами или с ангиотензиновыми пептидными составляющими. Пассивный перенос антител также может использоваться для лечения и профилактики нарушений, ассоциированных с RAS.
Авторами настоящего изобретения обнаружено, что конъюгаты ангиотензиновых пептидов или ангиотензиновых пептидных составляющих, присоединенных к вирусоподобным частицам (VLP), индуцируют высокоспецифичные в отношении ангиотензина антитела IgG. Поэтому настоящее изобретение относится к терапевтическому средству лечения физических нарушений, ассоциированных с RAS, которое в особо предпочтительном осуществлении основано на упорядоченных и повторяемых конъюгатах VLP-ангиотензиновый пептид/составляющая. Данное терапевтическое средство способно индуцировать высокие титры антиангиотензиновых антител у вакцинированного животного. Высокие титры антител индуцируются даже в отсутствие адъювантов и охватывают не только субтип IgG, но также субтип IgA. Более того, неожиданно данное терапевтическое средство не ассоциировано с индукцией потенциально патогенного иммунного ответа, такого как воспаление. Терапевтические конъюгаты по изобретению содержат, по крайней мере, один ангиотензиновый пептид или ангиотензиновую пептидную составляющую и VLP, предпочтительно VLP РНК-фага, или, по крайней мере, ангиотензиновый пептид или ангиотензиновую пептидную составляющую и альтернативную коровую частицу, такую как HBcAg или пили.
Другие осуществления настоящего. изобретения будут понятны обычному специалисту в свете имеющейся в данной области информации, следующих чертежей и описания изобретения, а также формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
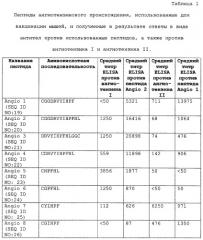
Фигура 1 представляет собой анализ методом ELISA антител IgG, специфичных в отношении пептида Angio 1 и ангиотензина II, в сыворотке мышей, иммунизированных пептидами Angio 1, Angio 2, Angio 3 или Angio 4, конъюгированными с белком капсида Qβ.
Фигура 2 представляет собой анализ методом ELISA антител IgG, специфичных в отношении пептида Angio 2 и ангиотензина I, в сыворотке мышей, иммунизированных пептидами Angio 1, Angio 2, Angio 3 или Angio 4, конъюгированными с белком капсида Qβ.
Фигура 3 представляет собой анализ методом ELISA антител IgG, специфичных в отношении пептида Angio 1 и ангиотензина II, в сыворотке мышей, иммунизированных пептидами Angio 5, Angio 6, Angio 7, Angio 8 или Angio 9, конъюгированными с белком капсида Qβ.
Фигура 4 представляет собой анализ методом ELISA антител IgG, специфичных в отношении пептида Angio 2 и ангиотензина I, в сыворотке мышей, иммунизированных пептидами Angio 5, Angio 6, Angio 7, Angio 8 или Angio 9, конъюгированными с белком капсида Qβ.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
В последующем описании интенсивно используется ряд терминов, используемых в области молекулярной биологии, иммунологии и медицины. Для обеспечения более ясного и непротиворечивого понимания описания и формулы изобретения, включая объем, в котором даны такие термины, предоставлены следующие не ограничивающие определения.
Активная иммунизация. Используемый в данном описании термин «активная иммунизация» относится к индукции иммунного ответа у субъекта, обычно животного, вызванной введением иммуногена, вакцины, антигена или конъюгата ангиотензиновый пептид-носитель. Пассивная иммунизация, наоборот, означает обеспечение у субъекта иммунитета путем переноса указанному субъекту иммунных молекул или клеток.
Альфавирус. Используемый в данном описании термин «альфавирус» относится к любому из РНК-вирусов, входящих в состав рода Alphavirus. Описание представителей данного рода содержится в Strauss and Strauss, Microbiol. Rev., 58:491-562 (1994). Примеры альфавирусов включают вирус Аура, вирус Бебару, вирус Кабассу, вирус Чикунгунья, вирус восточного энцефаломиелита лошадей, вирус Форт-Морган, вирус Гета, вирус Кызыл-Агача, вирус Майоаро, вирус Миддлебурга, вирус Мукамбо, вирус Ндуму, вирус Пиксуна, вирус Тонате, вирус Тринити, вирус Уна, вирус западного энцефаломиелита лошадей, вирус Уатароа, вирус Синдбис (SIN), вирус леса Семлики (SFV), вирус венесуэльского энцефаломиелита лошадей (VEE) и вирус Росс-Ривер.
Аминокислотный линкер. «Аминокислотный линкер», также называемый в данной.спецификации «линкером», при использовании в данном описании осуществляет ассоциацию антигена или антигенной детерминанты со вторым участком связывания, или, более предпочтительно, уже включает или содержит второй участок связывания, обычно, но необязательно, в виде одного аминокислотного остатка, предпочтительно, остатка цистеина. Используемый в данном описании термин «аминокислотный линкер», однако, не подразумевает, что данный аминокислотный линкер состоит исключительно из аминокислотных остатков, даже если аминокислотный линкер, состоящий из аминокислотных остатков, является предпочтительным осуществлением по настоящему изобретению. Аминокислотные остатки аминокислотного линкера, предпочтительно, состоят из встречающихся в природе аминокислот или неприродных аминокислот, известных в данной области, полностью из L-аминокислот или полностью из D-аминокислот, или их смесей. Однако аминокислотный линкер, содержащий молекулу с сульфгидрильной группой или остаток цистеина, также относится к настоящему изобретению. Такая молекула предпочтительно содержит С1-С6-алкильную, циклоалкильную (С5, С6), арильную или гетероарильную группу. Однако, в дополнение к аминокислотному линкеру, линкер, предпочтительно содержащий C1-С6-алкильную, циклоалкильную (С5, С6), арильную или гетероарильную группу и не содержащий какой(-их)-либо аминокислоты(-т), также будет входить в объем настоящего изобретения. Ассоциация между антигеном или антигенной детерминантой или, необязательно,.вторым участком связывания и аминокислотным линкером, предпочтительно, осуществляется посредством, по крайней мере, одной ковалентной связи, более предпочтительно, посредством, по крайней мере, одной пептидной связи.
Ангиотензиновая пептидная составляющая. Используемый в данном описании термин «ангиотензиновая пептидная составляющая» относится к любой составляющей, независимо от того, имеет или нет данная составляющая биологическую активность нативного ангиотензина in vivo (например, природную гормональную активность в отношении рецепторов, включая ангиотензин I и II), которая способна действовать как иммуномиметик природных ангиотензиновых пептидов (т.е. которая иммунологически имитирует ангиотензин, так что генерируются антитела, которые связываются с нативными ангиотензиновыми пептидами). Таким образом, данная составляющая может подходящим образом содержать ангиотензиновый пептид, предпочтительно, ангиотензиноген, ангиотензин I (декапептид формулы Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-His-Leu, SEQ ID NO: 16) или ангиотензин II (октапептид формулы Asp-Arg-Val-Tyr-Ile-His-Pro-Phe, SEQ ID NO: 17), или его функционально эквивалентный вариант. Следовательно, «ангиотензиновая пептидная составляющая» охватывает «ангиотензиновый пептид», как данный термин определен в данном описании. Такие функционально эквивалентные варианты могут включать модификации последовательности ангиотензина I или II с единичной или множественными аминокислотными заменами, добавлениями или делециями, и также последовательности, где аминокислотные остатки химически модифицированы, но которые, несмотря на это, сохраняют иммуногенную активность ангиотензина. Такие функционально (или иммунологически) эквивалентные варианты могут иметь место как природные биологические вариации, или они могут быть получены с использованием известных и стандартных способов, например, химического синтеза или модификации, мутагенеза, например, сайт-специфического или случайного мутагенеза, и т.д. Для целей данного определения ключевой чертой, касающейся модификации, является то, что ангиотензиновый пептид сохраняет способность действовать как иммуномиметик нативного ангиотензина. Так, например, аминокислота может быть замещена другой, которая сохраняет физико-химическую характеристику ангиотензинового пептида или его эпитопа(-ов), например, в плане плотности заряда, гидрофильности/гидрофобности, размера и конфигурации, и потому сохраняет иммунологическую структуру. Варианты «добавления» могут включать N- или С-концевые приращения, а также вставки внутри последовательности одной или нескольких аминокислот. Делеции могут иметь место внутри последовательности или могут представлять собой укорочения с N- или С-концов. Предпочтительными мутантными формами с делецией являются те, что обеспечивают индукцию антител против N- или, предпочтительно, С-конца. Такие антитела могут предотвращать образование активного ангиотензина II, но при этом оставлять возможность для деградации связанного с антителом ангиотензиногена, ангиотензина I или ангиотензина II.
Ангиотензиновый пептид. Используемый в данном описании термин «ангиотензиновый пептид» охватывает все, предпочтительно природные, ангиотензиновые пептиды и их функционально эквивалентные варианты. Следовательно, «ангиотензиновый пептид» может считаться подмножеством термина «ангиотензиновая пептидная составляющая», как это определено в данном описании. На практике, определение того, является ли данный вариант ангиотензинового пептида (или ангиотензиновой пептидной составляющей) «функциональным эквивалентом», предпочтительно, нативного ангиотензинового пептида, может осуществляться разнообразными способами анализа для определения биологической активности ангиотензинового пептида. Некоторые из данных способов анализа описаны здесь, а другие хорошо известны обычному специалисту в данной области.
Антитело. Используемый в данном описании термин «антитело» относится к молекулам, способным связываться с эпитопом или антигенной детерминантой. Подразумевается, что данный термин охватывает целые антитела и их антигенсвязывающие фрагменты, включая одноцепочечные антитела. Такие антитела включают антигенсвязывающие фрагменты антител человека и охватывают, в качестве неограничивающих примеров, Fab, Fab' и F(ab')2, Fd, одноцепочечные Fv (scFv), одноцепочечные антитела, связанные дисульфидной связью Fv (sdFv) и фрагменты, содержащие VL- или VH-домен. Антитела могут происходить из любого животного, включая птиц и млекопитающих. Предпочтительно, антитела происходят от млекопитающих, например, из человека, мыши, кролика, козы, морской свинки, верблюда, лошади и тому подобного, или других подходящих животных, таких как куры. Используемый в данном описании термин «человеческие» антитела охватывают антитела, характеризующиеся аминокислотной последовательностью человеческого иммуноглобулина, и охватывают антитела, выделенные из библиотек имуноглобулинов человека или из животных, трансгенных по одному или нескольким человеческим иммуноглобулинам и не экспрессирующих эндогенные иммуноглобулины, как описано, например в патенте США № 5939598, описание которого включено сюда полностью в качестве ссылки.
Антиген. Используемый в данном описании термин «антиген» относится к молекуле, способной связываться с антителом или с Т-клеточным рецептором (TCR), если презентируется молекулами МНС. Используемый в данном описании термин «антиген» также охватывает Т-клеточные эпитопы. Т-клеточный эпитоп распознается Т-клеточным рецептором в связи с МНС класса I, который присутствует на всех клетках организма кроме эритроцитов, или с МНС класса II, присутствующим на клетках иммунной системы и, в частности, на антигенпредставляющих клетках. Данное событие распознавания ведет к активации Т-клеток и последующему запуску эффекторных механизмов, таких как пролиферация Т-клеток, секреция цитокинов, секреции перфоринов и т.д. Кроме того, антиген способен распознаваться иммунной системой и/или способен индуцировать гуморальный иммунный ответ и/или клеточный иммунный ответ, что ведет к активации В- и/или Т-лимфоцитов. Это, однако, по крайней мере в некоторых случаях может требовать того, чтобы антиген содержал или был связанным с эпитопом ТH-клеток и был представлен в адъюванте. Антиген может содержать один или несколько эпитопов. (В- и Т-эпитопов). Специфическая в отношении антигена реакция означает, что антиген предпочтительно взаимодействует с соответствующим ему антителом или TCR, обычно высокоселективным образом, и не взаимодействует с множеством других антител или TCR, которые могут индуцироваться другими антигенами. Используемые здесь антигены также могут представлять собой смесь различных индивидуальных антигенов.
Антигенная детерминанта. Подразумевается, что используемый в данном описании термин «антигенная детерминанта» относится к той части антигена, которая специфично распознается В- или Т-лимфоцитами. В-лимфоциты реагируют на чужеродные антигенные детерминанты путем продукции антител, в то время как Т-лимфоциты являются медиаторами клеточного иммунитета. Таким образом, антигенные детерминанты или эпитопы являются теми частями антигена, которые распознаются антителами или, в связи с МНС, Т-клеточными рецепторами. Антигенная детерминанта содержит один или несколько эпитопов. Аллергены также служат в качестве антигенов у позвоночных животных.
Ассоциация. Используемый в данном описании термин «ассоциация» в применении к первому и второму участкам связывания относится к связыванию с первым и вторым участками связывания, которое предпочтительно осуществляется посредством, по крайней мере, одной непептидной связи. Природа ассоциации может быть ковалентной, ионной, гидрофобной, полярной, или представлять собой любую их комбинацию, предпочтительно, природа ассоциации является ковалентной.
Участок связывания, первый. Используемое в данном описании выражение «первый участок связывания» относится к элементу коровой частицы природного или неприродного происхождения, с которым может ассоциировать второй участок связывания, локализованный на антигене или антигенной детерминанте. Первый участок связывания может представлять собой белок, полипептид, аминокислоту, пептид, сахар, полинуклеотид, природный или синтетический полимер, вторичный метаболит или соединение (биотин, флуоресцеин, ретинол, дигоксигенин, ионы металлов, фенилметилсульфонилфторид), или их комбинацию, или их химическую реакционноспособную группу. Первый участок связывания обычно и предпочтительно локализован на поверхности коровой частицы, предпочтительно, такой как вирусоподобная частица. Множественные первые участки связывания присутствуют на поверхности коровой и вирусоподобной частицы, соответственно, обычно в повторяемой конфигурации.
Участок связывания, второй. Используемое в данном описании выражение «второй участок связывания» относится к элементу, ассоциированному с антигеном или антигенной детерминантой, с которым может ассоциировать первый участок связывания, локализованный на поверхности коровой частицы и вирусоподобной частицы, соответственно. Второй участок связывания антигена или антигенной детерминанты может представлять собой белок, полипептид, пептид, сахар, полинуклеотид, природный или синтетический полимер, вторичный метаболит или соединение (биотин, флуоресцеин, ретинол, дигоксигенин, ионы металлов, фенилметилсульфонилфторид), или их комбинацию, или их химическую реакционноспособную группу. По крайней мере, один второй участок связывания присутствует на антигене или антигенной детерминанте. Термин «антиген или антигенная детерминанта с, по крайней мере, одним вторым участком связывания», таким образом, относится к антигену или антигенной конструкции, содержащим, по крайней мере, антиген или антигенную детерминанту и второй участок связывания. Однако, в особенности для второго участка связывания неприродного происхождения, т.е. он не встречается в данном антигене или антигенной детерминанте в природе, данный антиген или антигенная конструкция содержат «аминокислотный линкер».
Связанный. Используемый в данном описании термин «связанный» относится к связыванию или присоединению, которое может быть ковалентным, например, образованным путем химического связывания, или нековалентным, например, представлять собой ионные взаимодействия, гидрофобные взаимодействия, водородные связи и т.д. Ковалентные связи могут быть, например, сложноэфирными, эфирными, фосфоэфирными, амидными, пептидными, имидными, связями между углеродом и серой, связями между углеродом и фосфором, и тому подобным. Термин «связанный» охватывает такие термины, как «объединенный», «слитый» и «присоединенный», и шире их.
Покровный(-ые) белок(-и). Используемый в данном описании термин «покровный(-ые) белок(-и)» относится к белку(-ам) бактериофага или РНК-фага, способному(-ым) включаться в состав капсида бактериофага или РНК-фага при его сборке. Однако, при ссылке на конкретный генный продукт гена покровного белка РНК-фагов используется термин «СР». Например, конкретный генный продукт гена покровного белка РНК-фага Qβ указывается как «СР Qβ«, причем «покровные белки» бактериофага Qβ включают «СР Qβ«, а также белок А1. Капсид бактериофага Qβ в основном составлен из СР Qβ, с небольшим содержанием белка А1. Сходным образом, покровный белок VLP Qβ состоит главным образом из СР Qβ с небольшим содержанием белка А1.
Коровая частица. Используемый в данном описании термин «коровая частица» относится к ригидной структуре с присущей ей повторяемой организацией. Коровая частица, как этот термин используется в данном описании, может являться продуктом синтетического процесса или продуктом биологического процесса.
Эффективное количество. Используемый в данном описании термин «эффективное количество» относится к количеству, необходимому или достаточному для реализации требуемого биологического эффекта. Эффективное количество композиции является тем количеством, с которым достигается выбранный результат, и такое количество может быть определено в порядке рутинной работы специалиста в данной области. Например, эффективное количество для лечения иммунодефицита может быть тем количеством, которое необходимо для активации иммунной системы, что приведет к развитию антигенспецифического иммунного ответа после воздействия антигена. Данный термин также синонимичен термину «достаточное количество».
Эффективное количество для любого конкретного применения может варьировать в зависимости от таких факторов, как заболевание или состояние, подлежащее лечению, конкретная композиция, подлежащая введению,. размер субъекта и/или тяжесть заболевания или состояния. Обычный специалист в данной области может эмпирически определить эффективное количество конкретной композиции по настоящему изобретению без необходимости избыточного экспериментирования.
Эпитоп. Используемый в данном описании термин «эпитоп» относится к основному элементу или наименьшей единице распознавания индивидуальным антителом или Т-клеточным рецептором и, таким образом, к конкретному домену, области или молекулярной структуре, с которой связывается указанное антитело или Т-клеточный рецептор. Антиген может состоять из множества эпитопов, в то время как гаптен обычно может содержать мало эпитопов.
Слияние. Используемый в данном описании термин «слияние» относится к комбинации аминокислотных последовательностей ра