Способы повышения толерантности к абиотическому стрессу и/или биомассы у растений и получаемые таким образом растения
Иллюстрации
Показать всеКлетку растения трансформируют экзогенным полинуклеотидом, экспрессия которого придает клетке повышенную толерантность к абиотическому стрессу, а затем культивируют из нее зрелое растение. Трансформацию осуществляют посредством введения в клетку конструкции, содержащей конститутивный или индуцируемый абиотическим стрессом промотор. Либо растение инфицируют авирулентным вирусом, включающим в себя упомянутый экзогенный полинуклеотид, экспрессия которого в растении придает ему устойчивость к абиотическому стрессу, такому как засоленность почвы, недостаток воды, низкая или высокая температура и др. 5 н. и 32 з.п. ф-лы, 5 ил., 6 табл.
Реферат
Область и предпосылки изобретения
Настоящее изобретение относится к способам повышения толерантности к абиотическому стрессу и/или биомассы у растений, а более конкретно к растениям, экспрессирующим гены устойчивости к экзогенному абиотическому стрессу.
Условия абиотического стресса (также названного как «экологический стресс»), например засоленность почвы, периоды засухи, наводнения, недостаточно оптимальная температура и токсическое химическое загрязнение являются причиной существенного повреждения сельскохозяйственных растений. У большинства растений существуют развитые стратегии собственной защиты против этих условий. Однако если тяжесть и продолжительность стрессовых условий являются слишком сильными, то влияния на развитие, рост и урожайность растений большинства сельскохозяйственных культур являются глубокими. Кроме того, большинство сельскохозяйственных культур являются очень восприимчивыми к абиотическому стрессу (ABS) и, таким образом, требуют оптимальных условий роста для сбора урожая на коммерческом уровне. Продолжительное воздействие стресса является причиной значительных изменений в метаболизме растений, что приводит, в конечном счете, к гибели клеток, а в результате, к потерям урожая. Таким образом, несмотря на обширные исследования и применение сложных и трудоемких мер по защите урожая, потери вследствие условий абиотического стресса ежегодно составляют миллиарды долларов.
Развитие устойчивых к стрессу растений представляет собой стратегию, обладающую потенциалом для решения или содействия в решении, по крайней мере, некоторых из этих проблем. Однако традиционные стратегии селекции растений, применяемые для развития новых линий растений, проявляющих толерантность к ABS, являются относительно малоэффективными, так как они трудоемки, требуют много времени и не поддаются прогнозированию. Кроме того, значительные проблемы, встречающиеся при традиционном скрещивании, представляют собой ограниченные ресурсы зародышевой плазмы для устойчивости к стрессу и несовместимость при скрещиваниях между отдаленно родственными видами растений. Кроме того, клеточные процессы, приводящие к толерантности к ABS, по своей природе являются комплексными и вовлекают множество механизмов клеточной адаптации и многочисленные метаболические пути.
В уровне техники описаны генно-инженерные исследования, направленные на получение у трансгенных культур толерантности к абиотическому стрессу. В исследованиях Apse and Blumwald (Curr Opin Biotechnol. 13:146-150, 2002), Quesada et al. (Plant Physiol. 130:951-963, 2002), Holmström et al. (Nature 379:683-684, 1996), Xu et al. (Plant Physiol 110:249-257, 1996), Pilon-Smits and Ebskamp (Plant Physiol. 107:125-130, 1995) и Tarczynski et al. (Science 259:508-510, 1993) были предприняты попытки получения устойчивых к стрессу культур.
Кроме того, в нескольких патентах и патентных заявках США также описаны полинуклеотиды, ассоциированные с толерантностью к стрессу, и их применение в создании устойчивых к стрессу культур. В патентах США № 5296462 и 5356816 описаны растения, трансформированные полинуклеотидами, кодирующими белки, вовлеченные в адаптацию к холоду у Arabidopsis thaliana, для обеспечения, таким образом, адаптации к холоду у трансформированных растений.
В патенте США № 6670528 описаны растения, трансформированные полинуклеотидами, кодирующими полипептиды, связанные с элементами, отвечающими на стресс, для повышения, таким образом, толерантности трансформированных растений к абиотическому стрессу.
В патенте США № 6720477 описаны растения, трансформированные полинуклеотидами, кодирующими передающий сигнал, связанный со стрессом белок, способствующий повышению толерантности к абиотическому стрессу у трансформированных растений.
В заявках США №№ 09/938842 и 10/342224 описаны гены, связанные с абиотическим стрессом, и их применение для придания растениям толерантности к абиотическому стрессу.
В заявках США № 10/231035 у растений описана повышенная экспрессия сульфуразы с молибденовым кофактором, для повышения, таким образом, их толерантности к абиотическому стрессу.
Несмотря на то, что указанные выше исследования, по крайней мере отчасти, являлись успешными в создании растений, устойчивых к стрессу, все еще остается необходимость в генах устойчивости к стрессу, которые можно применять для создания растений, устойчивых к широкому спектру условий абиотического стресса.
Во время доведения настоящего изобретения до практического осуществления авторы настоящего изобретения при помощи биоинформатики и лабораторных исследований идентифицировали несколько новых генов толерантности к абиотическому стрессу, которые можно применять для повышения толерантности к абиотическому стрессу и/или биомассы растений.
Сущность изобретения
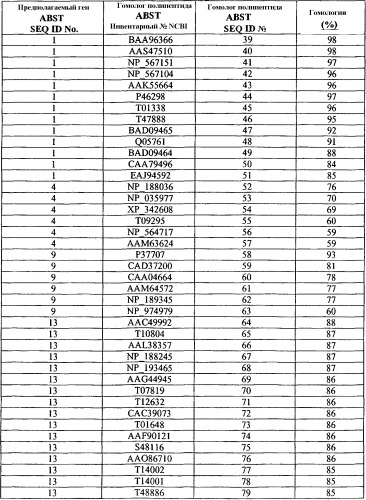
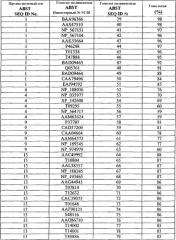
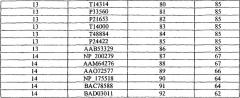
В одном из аспектов настоящее изобретение относится к способу повышения толерантности растений к абиотическому стрессу. Способ включает в себя экспрессию в растении экзогенного полипептида, включающего в себя аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID №№39-92.
В еще одном аспекте настоящее изобретение относится к растительной клетке, содержащей экзогенный полинуклеотид, по крайней мере, на 90% гомологичный полинуклеотиду, выбранному из группы, состоящей из SEQ ID №№1-18.
В еще одном аспекте настоящее изобретение относится к растительной клетке, содержащей экзогенный полинуклеотид, кодирующий полипептид, включающий в себя аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID №№39-92.
В еще одном аспекте настоящее изобретение относится к конструкции нуклеиновой кислоты, включающей в себя полинуклеотид, по крайней мере, на 90% гомологичный нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID №№1-18, и промотор, обеспечивающий управление транскрипцией полинуклеотида в клетке хозяина.
В еще одном аспекте настоящее изобретение относится к конструкции нуклеиновой кислоты, включающей в себя полинуклеотид, кодирующий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID №№39-92, и промотор, обеспечивающий управление транскрипцией полинуклеотида в клетке хозяина.
В другом дополнительном аспекте настоящее изобретение относится к выделенному полипептиду, включающему в себя аминокислотную последовательность, по крайней мере, на 90% гомологичный нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID №№ 1-18, и промотор, обеспечивающий управление транскрипцией полинуклеотида в клетке хозяина.
В еще одном аспекте настоящее изобретение относится к конструкции нуклеиновой кислоты, включающей в себя полинуклеотид, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID №№ 39-92, и промотор, обеспечивающий управление транскрипцией полинуклеотида в клетке хозяина.
В другом дополнительном аспекте настоящее изобретение относится к выделенному полипептиду, включающему в себя аминокислотную последовательность, по крайней мере, на 90% гомологичную аминокислотной последовательности, кодируемой полинуклеотидом, выбранным из группы, состоящей из SEQ ID №№ 1-18.
В другом дополнительном аспекте настоящее изобретение относится к выделенному полипептиду, включающему в себя аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID №№ 39-92.
Согласно дополнительным признакам в описанных предпочтительных вариантах осуществления экспрессию проводят (i) трансформацией клетки растения экзогенным полинуклеотидом; (ii) генерацией зрелого растения из клетки; и (iii) культивированием зрелого растения в условиях, пригодных для экспрессии экзогенного полинуклеотида в зрелом растении.
Согласно другим дополнительным признакам в описанных предпочтительных вариантах осуществления трансформацию проводят введением в растительные клетки конструкции нуклеиновой кислоты, включающей в себя экзогенный полинуклеотид и, по крайней мере, один промотор, обеспечивающий направление транскрипции полинуклеотида в клетке хозяина.
Согласно другим дополнительным признакам в описанных предпочтительных вариантах осуществления, по крайней мере, один промотор представляет собой конститутивный промотор.
Согласно другим дополнительным признакам в описанных предпочтительных вариантах осуществления конститутивный промотор представляет собой промотор CaMV 35S.
Согласно другим дополнительным признакам в описанных предпочтительных вариантах осуществления конститутивный промотор представляет собой At6669 промотор.
Согласно другим дополнительным признакам в описанных предпочтительных вариантах осуществления, по крайней мере, один промотор представляет собой индуцибельный промотор.
Согласно другим дополнительным признакам в описанных предпочтительных вариантах осуществления индуцибельный промотор представляет собой индуцибельный промотор абиотического стресса.
Согласно другим дополнительным признакам в описанных предпочтительных вариантах осуществления, по крайней мере, один промотор представляет собой тканеспецифичный промотор.
Согласно другим дополнительным признакам в описанных предпочтительных вариантах осуществления экспрессию проводят инфицированием растения вирусом, включающим в себя экзогенный полинуклеотид.
Согласно другим дополнительным признакам в описанных предпочтительных вариантах осуществления вирус представляет собой невирулентный вирус.
Согласно другим дополнительным признакам в описанных предпочтительных вариантах осуществления абиотическим стрессом является выбранный из группы, состоящей из засоленности почвы, недостатка воды, низкой температуры, высокой температуры, токсического действия тяжелых металлов, анаэробиоза, недостатка питательных веществ, избытка питательных веществ, загрязнения атмосферы и УФ-излучения.
Согласно другим дополнительным признакам в описанных предпочтительных вариантах осуществления растение представляет собой двудольное растение.
Согласно другим дополнительным признакам в описанных предпочтительных вариантах осуществления растение представляет собой однодольное растение.
Согласно другим дополнительным признакам в описанных предпочтительных вариантах осуществления растительная клетка формирует часть растения.
Настоящее изобретение успешно обходит недостатки известных в настоящее время конструкций посредством обеспечения способов применения новых генов устойчивости к абиотическому стрессу для повышения толерантности к абиотическому стрессу и/или биомассы растений.
Краткое описание чертежей
Изобретение здесь описано только посредством примера со ссылкой на прилагаемые чертежи. Теперь на конкретном примере подробного описания чертежей подчеркнуто, что сведения представлены посредством примера и только в целях иллюстративного обсуждения предпочтительных вариантов настоящего изобретения и приведены для предоставления того, что, как полагают, является наиболее пригодным и легко понимаемым описанием принципов и концептуальных аспектов изобретения. В этом отношении не делали попыток показать структурные детали изобретения более подробно, чем это необходимо для фундаментального понимания изобретения и для того, чтобы описание, взятое с чертежами, делало очевидным специалистам в данной области, как некоторые части изобретения можно применять на практике.
Фиг.1 представляет собой блок-схему, иллюстрирующую процесс идентификации предполагаемых генов растений устойчивости к стрессу из баз данных последовательностей нуклеиновых кислот.
Фиг.2А-В представляют собой фотографии, иллюстрирующие T2 трансгенное зрелое растение Arabidopsis thaliana на стадии цветения, экспрессирующее трансген экзогенной люциферазы из промотора At6669. Одно и то же растение показано в условиях нормальной освещенности (фиг.2А) и в темноте (фиг.2В). Сильное освещение, указывающее на экспрессию люциферазы, наблюдали на цветках и корневых тканях.
На фиг.3 приведена средняя масса сырой ткани трансгенных растений T1 A. thaliana, выращенных в нормальных или стрессовых условиях (орошение 0 или 100 М раствором NaCl, соответственно). Растения трансформировали предполагаемыми генами толерантности к стрессу, или репортерным геном люциферазы (контроль), помещенными под транскрипционный контроль промотора At6669. Средние значения, обозначенные теми же обозначениями, статистически не отличаются по одностороннему T-тесту ANOVA.
На фиг.4А приведена средняя масса сырой ткани растений T2 A. thaliana выращенных в нормальных или стрессовых условиях (орошение 0 или 100 М раствором NaCl, соответственно). Растения трансформировали предполагаемыми генами толерантности к стрессу по настоящему изобретению, или репортерным геном люциферазы (контроль), помещенными под транскрипционный контроль промотора 35S. Средние значения, обозначенные теми же обозначениями, статистически не отличаются по одностороннему T-тесту ANOVA.
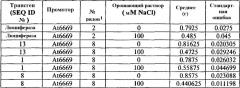
На фиг.4 приведена средняя масса сырой ткани растений T2 A. thaliana выращенных в нормальных или стрессовых условиях (орошение 0 или 100 М раствором NaCl, соответственно). Растения трансформировали предполагаемыми генами толерантности к стрессу по настоящему изобретению, или репортерным геном люциферазы (контроль), помещенными под транскрипционный контроль промотора At6669. Средние значения, обозначенные теми же обозначениями, статистически не отличаются по одностороннему T-тесту ANOVA.
На фиг.5 приведена относительная (процент) масса сырой ткани трансгенных растений T1 A. thaliana, выращенных в стрессовых условиях засоленности почвы (орошение 100 мМ раствором NaCl), по сравнению с подобными растениями, выращенными в нормальных условиях (орошение только водой). Растения трансформировали предполагаемыми генами толерантности к стрессу по настоящему изобретению, или репортерным геном люциферазы (контроль), помещенными под транскрипционный контроль промотора At6669.
Описание предпочтительных вариантов осуществления
Настоящее изобретение относится к способам повышения толерантности растений к абиотическому стрессу и/или биомассы применением новых генов толерантности к абиотическому стрессу и растений, демонстрирующим повышенную толерантность к стрессовым условиям и/или повышенную способность наращивать биомассу.
Принципы и применение настоящего изобретения можно понять лучше со ссылкой на чертежи и сопровождающие описания.
Перед подробным объяснением, по крайней мере, одного варианта осуществления изобретения необходимо понимать, что изобретение не ограничено его применением деталями конструкции и расположением компонентов, указанных в следующем далее описании или проиллюстрированных в чертежах. Изобретение допускает другие варианты осуществления, или применение на практике или выполнение различными способами. Также необходимо понимать, что формулировки и терминологию применяют здесь с целью описания и их не следует рассматривать как ограничивающие.
Во время доведения настоящего изобретения до практического осуществления авторы настоящего изобретения, применяя биоинформатические способы, идентифицировали полинуклеотидные последовательности, кодирующие предполагаемые устойчивые к абиотическому стрессу белки (ABST)(пример 1). Выбранные последовательности выделяли (пример 2), клонировали в экспрессионные векторы (примеры 3-4) и вводили в растения Arabidopsis thaliana (пример 5). Растения, выращенные в стрессовых условиях засоленности почвы или в нормальных условиях, демонстрировали значительно более высокую биомассу по сравнению с подобными растениями, не несущими экзогенные гены ABST (пример 6).
Таким образом, по одному аспекту настоящее изобретение относится к способу повышения толерантности растений к абиотическому стрессу и/или биомассы растений. Способ включает в себя экспрессию в растении экзогенного полинуклеотида, гомологичного, по крайней мере, на 70%, предпочтительно, гомологичного, по крайней мере, на 80%, более предпочтительно, гомологичного, по крайней мере, 85%, наиболее предпочтительно, гомологичного, по крайней мере, на 90% полинуклеотиду, выбранному из группы, состоящей из SEQ ID №№ 1-18. В качестве альтернативы экзогенный полинуклеотид настоящего изобретения кодирует полипептид с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID №№ 39-92.
Используемое здесь идиоматическое выражение «абиотический стресс» употребляется по отношению к любому неблагоприятному действию на метаболизм, рост, репродукцию и/или жизнеспособность растения. Таким образом, абиотический стресс можно индуцировать при помощи субоптимальных условий роста окружающей среды, таких как, например, засоленность почвы, недостаток воды, избыток воды, низкая или высокая температура, токсическое действие тяжелых металлов, анаэробиоз, недостаток питательных веществ, загрязнение атмосферы или УФ-излучение.
Применяемое здесь идиоматическое выражение «толерантность к абиотическому стрессу» относится к способности растения переносить абиотический стресс без существенного изменения в метаболизме, росте, производительности и/или жизнеспособности.
Пригодным для применения в способе настоящего изобретения может быть любое однодольное или двудольное растение, включающее в себя в качестве неограничивающих примеров кукурузу, пшеницу, просо, рожь, овес, рис, сою, арахис, горох, чечевицу и люцерну, хлопок, рапс, канолу, перец, подсолнечник, картофель, табак, томат, баклажан, эвкалипт, растение с древовидным стеблем, декоративное растение, многолетнюю траву и кормовую культуру.
Применяемый здесь термин «экзогенный полинуклеотид» относится к последовательности нуклеиновых кислот, не экспрессируемой растением в природе, но которая при введении в растение в длительных или кратковременных условиях продуцирует, по крайней мере, один полипептидный продукт.
В настоящем изобретении экспрессия экзогенного полинуклеотида растением может быть результатом трансформации одной или более клеток растения экзогенным полинуклеотидом, с последующей генерацией зрелого растения из трансформированных клеток и культивированием зрелого растения в условиях, пригодных для экспрессии экзогенного полинуклеотида в зрелом растении.
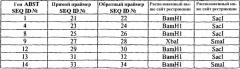
Предпочтительно трансформацию проводят введением в растительную клетку конструкции нуклеиновых кислот, включающую в себя экзогенный полинуклеотид настоящего изобретения и, по крайней мере, один промотор, обеспечивающий управление транскрипцией экзогенного полинуклеотида в растительной клетке. Дальнейшие детали применяемых подходов трансформации представлены далее.
Применяемый здесь термин «промотор» относится к области ДНК, расположенной выше области инициации транскрипции гена, с которым связывается РНК-полимераза для инициации транскрипции РНК. Промотор контролирует, где (например, какая часть растения, какой орган в животном и т.д.) и/или когда (например, на какой стадии или условии существования организма) экспрессируется ген.
Любую пригодную промоторную последовательность можно применять при помощи конструкции нуклеиновых кислот настоящего изобретения. Предпочтительно промотор представляет собой конститутивный промотор, тканеспецифичный или индуцибельный промотор абиотического стресса.
Предполагаемые конститутивные промоторы включают в себя, например, промотор CaMV 35S (SEQ ID NO: 19; Odell et al., Nature 313:810-812, 1985); промотор Arabidopsis At6669 (SEQ ID NO: 20); кукурузный Ubi 1 (Christensen et al., Plant Sol. Biol. 18:675-689, 1992); актин риса (McElroy et al., Plant Cell 2:163-171, 1990); pEMU (Last et al., Theor. Appl. Genet. 81:581-588, 1991); и Synthetic Super MAS (Ni et al., The Plant Journal 7:661-76, 1995). Другие конститутивные промоторы включают в себя конститутивные промоторы по патентам США №№ 5659026, 5608149; 5608144; 5604121; 5569597; 5466785; 5399680; 5268463; и 5608142.
Предполагаемые тканеспецифичные промоторы включают в себя в качестве неограничивающих примеров специфичные для листьев промоторами, такими как описано Yamamoto et al., Plant J. 12:255-265, 1997; Kwon et al., Plant Physiol. 105:357-67, 1994; Yamamoto et al., Plant Cell Physiol. 35:773-778, 1994; Gotor et al., Plant J. 3:509-18, 1993; Orozco et al., Plant Mol. Biol. 23:1129-1138, 1993; и Matsuoka et al., Proc. Natl. Acad. Sci. USA 90:9586-9590, 1993.
Предполагаемые индуцибельные промоторы абиотического стресса включают в себя, но не ограничены индуцированными засоленностью промоторами, такими как RD29A (Yamaguchi-Shinozalei et al., Mol. Gen. Genet. 236:331-340, 1993); индуцированными засухой промоторами, такими как промотор кукурузного гена rabl7 (Pla et al., Plant Mol. Biol. 21:259-266, 1993), промотор кукурузного гена rab28 (Busk et al., Plant J. 11:1285-1295, 1997) и промотор кукурузного гена Ivr2 (Pelleschi et al., Plant Mol. Biol. 39:373-380, 1999); и индуцированными повышенной температурой промоторами, такими как тепловой промотор томатов hsp80 из томатов (патент США №5187267).
Конструкция нуклеиновой кислоты настоящего изобретения предпочтительно дополнительно включает в себя соответствующий селективный маркер и/или ориджин репликации. Предпочтительно применяемая конструкция нуклеиновой кислоты представляет собой челночный вектор, способный размножаться в Е.coli (где конструкция содержит соответствующий селективный маркер и ориджин репликации) и пригодный для размножения в клетках. Конструкцией по настоящему изобретению может являться, например, плазмида, бакмида, фагмида, космида, фаг, вирус или искусственная хромосома.
Конструкцию нуклеиновых кислот настоящего изобретения можно применять для устойчивой или кратковременной трансформации растительных клеток. В случае устойчивой трансформации экзогенный полинуклеотид настоящего изобретения встраивали в геном растения, и по существу он представляет устойчивый и наследуемый признак. В случае кратковременной трансформации трансформированные клетки экспрессируют экзогенный полинуклеотид, но он не встроен в геном и по существу представляет кратковременный признак.
Существуют различные способы введения чужеродных генов в однодольные и двудольные растения (Potrykus, I., Annu. Rev. Plant. Physiol., Plant. Mol. Biol. (1991) 42:205-225; Shimamoto et al., Nature (1989) 338:274-276).
Основные способы получения устойчивой интеграции экзогенной ДНК в геномную ДНК растения включают в себя два основных подхода:
(i)Перенос Agrobacterium-опосредованного гена: Klee et al. (1987) Annu. Rev. Plant Physiol. 38:467-486; Klee and Rogers in Cell Culture and Somatic Cell Genetics of Plants, Vol. 6, Molecular Biology of Plant Nuclear Genes, eds. Schell, J., and Vasil, L. K., Academic Publishers, San Diego, Calif. (1989) p.2-25; Gatenby, in Plant Biotechnology, eds. Kung, S. and Arntzen, C. J. , Butterworth Publishers, Boston, Mass. (1989) p.93-112.
(ii) Прямое поглощение ДНК: Paszkowski et al., in Cell Culture and Somatic Cell Genetics of Plants, Vol. 6, Molecular Biology of Plant Nuclear Genes eds. Schell, J., and Vasil, L. K., Academic Publishers, San Diego, Calif. (1989) p.52-68; включающее в себя способы для прямого поглощения ДНК в протопласты, Toriyama, K. et al. (1988) Bio/Technology 6:1072-1074. Поглощение ДНК индуцировали при помощи короткого электрического шока растительных клеток: Zhang et al. Plant Cell Rep. (1988) 7:379-384. Fromm et al. Nature (1986) 319:791-793. Введение ДНК в растительные клетки или ткани при помощи бомбардировки частицами, Klein et al. Bio/Technology (1988) 6:559-563; McCabe et al. Bio/Technology (1988) 6:923-926; Sanford, Physiol. Plant. (1990) 79:206-209; посредством применения систем микропипетирования: Neuhaus and Spangenberg, Physiol. Plant. (1990) 79:213-217; трансформация культур клеток, эмбрионов или костной ткани с применением нитей стекловолокна или карбида кремния, патент США № 5464765, или при помощи прямой инкубации ДНК с зародышевой пыльцой, DeWet et al. in Experimental Manipulation of Ovule Tissue, eds. Chapman, G. P. and Mantell, S. H. and Daniels, W. Longman, London, (1985) p.197-209; и Ohta, Proc. Natl. Acad. Sci. USA (1986) 83:715-719.
Сиситема Agrobacterium включает в себя применение плазмидных векторов, содержащих определенные сегменты ДНК, интегрирующиеся в геномную ДНК растения. Способы инокуляции растительной ткани очень зависят от видов растений и системы доставки Agrobacterium. Способ листовой пластинки представляет собой широко применяемый подход, который можно выполнять для любого эксплантата ткани, который представляет собой хороший источник для инициации дифференцирования целого растения. Horsch et al. in Plant Molecular Biology Manual A5, Kluwer Academic Publishers, Dordrecht (1988) p.1-9. Дополнительный подход использует систему доставки Agrobacterium в комбинации с вакуумной инфильтрацией. Система Agrobacterium является особенно жизнеспособной при создании трансгенных двудольных растений.
Существуют различные способы прямого переноса ДНК в растительные клетки. При электропорации протопласты подвергают кратковременному воздействию сильного электрического поля. При микроинъекции ДНК механически вводят прямо в клетки, применяя очень маленькие микропипетки. При бомбардировке микрочастицами ДНК адсорбируют на бомбардирующие микрочастицы, такие как кристаллы сульфата магния или вольфрамовые частицы, а бомбардирующие микрочастицы с ускорением физически направляют в клетки или растительные ткани.
После устойчивой трансформации проводят размножение растения. Наиболее часто встречающимся способом выращивания растения является посев семян. Однако регенерация посредством размножения семенами имеет тот недостаток, что в результате гетерозиготности существует отсутствие единообразия в культуре, так как растения продуцируют семена в соответствии с генетической изменчивостью, обусловленной законами Менделя. По существу, каждое семя является генетически отличимым, и каждое растет со своими собственными специфическими признаками. Поэтому предпочтительно, что трансформированное растение произведено таким, что восстановленное растение имеет идентичные признаки и свойства родительского трансгенного растения. Таким образом, предпочтительно, что трансформированное растение восстановлено посредством вегетативного размножения, предоставляющего быстрое, устойчивое воспроизведение трансформированных растений.
Вегетативное размножение представляет собой процесс роста нового поколения растений из одного образца ткани, отделенного от отобранного родительского растения или сорта. Этот процесс дает возможность массовому размножению растений с предпочтительной тканевой экспрессией гибридного белка. Новое поколение растений производят генетически идентичными и обладающими всеми свойствами первичного растения. Вегетативное размножение обеспечивает массовую продукцию качественного растительного материала в короткий период времени и предлагает быстрое размножение выбранных сортов при сохранении свойств первично трансгенного или трансформированного растения. Преимуществами размножаемых вегетативным путем растений являются скорость размножения растений, и качество и единообразие продуцируемых растений.
Вегетативное размножение представляет собой многоступенчатый способ, требующий перемены культуральной среды или условий роста между стадиями. Таким образом, процесс вегетативного размножения включает в себя четыре основных стадии: первая стадия - первоначальное культивирование ткани; вторая стадия - размножение тканевой культуры; третья стадия - дифференциация и формирование растения; и четвертая стадия - культивирование в оранжерее и закаливание. В течение первой стадии первоначального культивирования ткани создавали тканевые культуры и подтверждали отсутствие контаминации. В течение второй стадии первоначальную культуру ткани размножили до тех пор, пока не получали достаточного количества образцов ткани для удовлетворения производственных целей. В течение третьей стадии образцы ткани, выращенные во второй стадии, делили и растили в отдельных саженцах. На четвертой стадии трансформированные саженцы переносили в оранжерею для закаливания, где устойчивость растений к свету постепенно повышалась так, что их становилось возможным выращивать в естественной окружающей среде.
Предпочтительно, зрелые трансформированные растения, полученные, как описано выше, далее отбирали по устойчивости к абиотическому стрессу. Соответственно, трансформированные и нетрансформированные (дикого типа) растения подвергали воздействию условиям абиотического стресса, таких как недостаток воды, субоптимальная температура, недостаток питательных веществ, или, предпочтительно, условия солевого стресса. Солевой стресс можно обеспечивать при помощи многих способов, таких как, например, орошение растений гиперосмотическим раствором, культивирование растений способом гидропоники в гиперосмотическом растворе для выращивания (например, раствор Хогланда), или культивирование растений в гиперосмотической питательной среде (например, среда MS). Так как различные растения значительно отличаются по их устойчивости к засоленности, концентрацию соли в орошающей воде, растворе для выращивания или питательной среде предпочтительно уточняют в соответствии со специфическими свойствами специфического сорта или вида растения, для того, чтобы оказать мягкое или среднее действие на физиологию и/или морфологию растений (для руководства в отношении получения подходящих концентраций см. Bernstein and Kafkafi, Root Growth Under Salinity Stress In: Plant Roots, The Hidden Half 3rd ed. Waisel Y, Eshel A and Kafkafi U. (editors) Marcel Dekker Inc., New York, 2002, и ссылки в них). Последующее воздействие стрессовыми условиями на растения часто контролировали до появления значительных физиологических и/или морфологических эффектов в растениях дикого типа. Затем трансформированные растения, не демонстрирующие значительных физиологических и/или морфологических эффектов или демонстрирующие более высокую биомассу, чем растения дикого типа, идентифицировали как растения, устойчивые к абиотическому стрессу.
Хотя в настоящем изобретении предпочтительна стабильная трансформация, в настоящем изобретении также рассматривается транзиторная трансформация клеток листьев, меристематических клеток или целого растения.
Транзиторную трансформацию можно проводить любым из описанных выше способов переноса ДНК или посредством вирусного заражения с применением модифицированных вирусом растений.
Вирусы, для которых показано, что они пригодны для трансформации растений-хозяев, включают в себя CaMV, TMV и BV. Трансформация растений с применением вирусов растений описана в патенте США № 4855237 (BGV), EP-A 67553 (TMV), Japanese Published Application № 63-14693 (TMV), EPA 194809 (BV), EPA 278667 (BV) и Gluzman, Y. et al., Communications in Molecular Biology: Viral Vectors, Cold Spring Harbor Laboratory, New York, pp. 172-189 (1988). Псевдовирусные частицы для применения в экспрессии чужеродной ДНК во многих хозяевах, включая растения, описаны в WO 87/06261.
Предпочтительно, чтобы вирус по настоящему изобретению являлся авирулентным и, таким образом, неспособным вызывать серьезные симптомы, такие как уменьшенная скорость роста, мозаичность, кольцевая пятнистость, скручивание листьев, пожелтение, полосчатость, формирование оспы, формирование опухоли и эрозия. Пригодный авирулентный вирус может представлять собой встречающийся в природе авирулентный вирус или искусственно аттенуированный вирус. Аттенуацию вируса можно проводить с применением хорошо известных в данной области способов, включающих в себя в качестве неограничивающих примеров сублетальное нагревание, химическую обработку или способы прямого мутагенеза, такие как описанные, например, у Kurihara and Watanabe (Molecular Plant Pathology 4:259-269, 2003), Gal-on et al. (1992), Atreya et al. (1992) и Huet et al. (1994).
Пригодные вирусные штаммы можно получить из доступных источников, таких как, например, American Type Culture Collection (ATCC), или выделением из инфицированных растений. Выделение вирусов из инфицированных растительных тканей можно проводить хорошо известными в данной области способами, такими как описанные, например, у Foster and Tatlor, Eds. "Plant Virology Protocols: From Virus Isolation to Transgenic Resistance (Methods in Molecular Biology (Humana Pr), Vol 81)", Humana Press, 1998. В кратком изложении, ткани инфицированного растения, для которых полагают, что они содержат высокую концентрацию пригодного вируса, предпочтительно молодые листья и цветочные лепестки, помещают в буферный раствор (например, раствор фосфатного буфера) для получения инфицированного сока, который можно применять для последующих инокуляций.
Конструирование РНК-вирусов растений для введения в растения и экспрессии в них невирусных экзогенных полинуклеотидных последовательностей продемонстрировано указанными выше ссылками, а также у Dawson, W.O. et al., Virology (1989) 172:285-292; Takamatsu et al. EMBO J. (1987) 6:307-311; French et al. Science (1986) 231:1294-1297 и Takamatsu et al., FEBS Letters (1990) 269:73-76.
Когда вирус представляет, собой ДНК-вирус, пригодные модификации можно проводить с самим вирусом. Альтернативно, для облегчения конструирования желаемого вирусного вектора с чужеродной ДНК вирус сначала можно клонировать в бактериальную плазмиду. Затем вирус можно вырезать из плазмиды. Если вирус представляет собой ДНК-вирус, к вирусной ДНК можно присоединить бактериальный ориджин репликации, а затем реплицировать вирусную ДНК в бактериях. Транскрипция и трансляция этой ДНК продуцирует белок оболочки, инкапсулирующий вирусную РНК. Если вирус представляет собой РНК-вирус, вирус, как правило, клонируют в виде кДНК и вставляют в плазмиду. Затем плазмиду применяют для получения всех конструкций. Затем посредством транскрипции вирусной последовательности плазмиды и трансляции вирусных генов для получения белка(ов) оболочки, инкапсулирующий вирусную РНК, получают РНК-вирус.
Конструирование РНК-вирусов растений для введения в растения и экспрессии в них невирусных экзогенных полинуклеотидных последовательностей, таких как включенные в конструкцию по настоящему изобретению полинуклеотидные последовательности, продемонстрировано указанными выше ссылками, а также в патенте США № 5316931.
В одном из вариантов осуществления представлен полинуклеотид вируса растений, в котором кодирующая нативный белок оболочки последовательность удалена из полинуклеотида вируса, а вставлены кодирующая ненативный белок оболочки вируса растений последовательность и ненативный промотор, предпочтительно субгеномный промотор кодирующей ненативный белок оболочки последовательности, способной к экспрессии в растительном хозяине, пакуя рекомбинантный полинуклеотид вируса растений и обеспечивая системное заражение хозяина рекомбинантным полинуклеотидом вируса растений. Альтернативно, ген белка оболочки можно инактивировать посредством вставки в него ненативной полинуклеотидной последовательности, при которой продуцируется белок. Рекомбинантный полинуклеотид вируса растений может содержать одну или более дополнительных ненативных субгеномных промоторов. Каждый ненативный субгеномный промотор способен направлять транскрипцию или экспрессию прилежащих генов или полинуклеотидных последовательностей в растительном хозяине и не способен к рекомбинации с другими и с нативным субгеномными промоторами. Ненативные (чужеродные) полинуклеотидные последовательности можно вставлять следом за нативным субгеномным промотором вируса растения или нативным и ненативным субгеномными промоторами вирусов растений, если вставлено более одной полинуклеотидной последовательности. Ненативные полинуклеотидные последовательности транскрибируются и экспрессируются в растительном хозяине под контролем субгеномного промотора с получением желательных продуктов.
Во втором варианте осуществления предоставлен рекомбинантный полинуклеотид вируса растения, как и в первом варианте осуществления, за исключением того, что вместо кодирующей ненативный белок оболочки последовательности следом за одним из ненативных субгеномных промоторов белка оболочки помещена последовательность, кодирующая нативный белок оболочки.
В третьем варианте осуществления предоставлен рекомбинантный полинуклеотид вируса растений, в котором нативный ген белка оболочки находится следом за его субгеномным промотором, а в вирусный полинуклеотид вставлены один или несколько ненативных субгеномных промоторов. Вставленные ненативные субгеномные промоторы способны направлять транскрипцию или экспрессию прилежащих генов в растительном хозяине и не способны к рекомбинации с другими и с нативным субгеномными промоторами. Ненативные полинуклеотидные последовательности можно вставлять следом за ненативными субгеномными промоторами вирусов растений так, что последовательности транскрибируются и экспрессируются в растительном хозяине под контролем субгеномных промоторов с получением желательного продукта.
В четвертом варианте осуществления предоставлен рекомбинантный полинуклеотид вируса растения, как и в третьем варианте осуществления, за исключением того, что последовательность, кодирующая нативный белок оболочки, замещена на последовательность, кодирующую ненативный белок оболочки.
Для получения рекомбинантного вируса растений вирусные вект