Способ массового производства мультимерного маннозосвязывающего лектина
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии, в частности к генно-инженерному способу, обеспечивающему массовое производство мультимерного рекомбинантного маннозосвязывающего лектина (MBL) человека, и может быть использовано в биомедицинской промышленности. Предложенный способ включает а) стадию культивирования линии клеток-хозяев СНО, трансфицированной рекомбинантным вектором pMSG-MBL, содержащим последовательность кодирующей области MBL человека, и б) стадию очистки рекомбинантного белка. При этом на первой стадии предпочтительно используют новую клеточную линию СНО MBL D1-3, депонированную в Корейской коллекции типовых культур под номером КСТС 10472ВР, которую культивируют в безбелковой среде с использованием биореактора, а на второй проводят избирательную очистку высокомолекулярной формы MBL от среды культивирования, предусматривающую разделение образцов с помощью анионообменной хроматографии, нанесение их на колонку с иммоболизованным на ней MBL-связывающим белком, в частности с гликозилированным белком оболочки вируса pre-S, в присутствии ионов кальция и последующее элюирование буферным раствором с EDTA или EGTA. Высокий выход функционально активного продукта открывает возможности его применения при разработке терапевтических средств для лечения вирусной, бактериальной или грибковой инфекций. 2 н. и 4 з.п. ф-лы, 11 ил.
Реферат
Область техники
Настоящее изобретение относится к разработке способа, посредством которого возможно массовое производство мультимерного рекомбинантного маннозосвязывающего лектина человека (rhMBL).
Уровень техники изобретения
Маннозосвязывающий лектин (здесь и далее обозначаемый как «MBL») представляет собой белок сыворотки, являющийся элементом врожденного иммунитета (генетически предетерминированного иммунитета). Молекулярная масса MBL составляет 32 кДа. MBL состоит из C-концевого углеводраспознающего домена (CRD), коллагенового домена и богатой цистеином области на N-конце. Три молекулы MBL формируют комплекс посредством образования тройной спирали, используя коллагеновые домены, и затем вплоть до 6 комплексов могут объединяться вместе при помощи межмолекулярной дисульфидной связи (-s-s-) между остатками цистеинов на N-конце, приводя к образованию мультимерной молекулы MBL, состоящей из вплоть до 18 молекул MBL.
Олигомерная форма MBL может формировать комплекс с другими белками, такими как ассоциированные с MBL сериновые протеазы (MBSP-1, MASP-2 или MASP -3) или ассоциированный с MBL белок (Map19). Хотя общая молекулярная структура и функция MBL, вовлеченного в активацию комплемента, сходны с C1q, который является первым компонентом системы комплемента, в отличие от C1q MBL активирует систему комплемента, расщепляя C4 и C2. Такой процесс активации комплемента, называемый лектинзависимый путь, осуществляется при помощи ассоциированной с MBL сериновой протеазы, активируемой при связывании MBL с микроорганизмом. Активация системы комплемента посредством MBL является одной из функций MBL в первичной защите от микробной инфекции, до того как появляется адаптивный иммунный ответ. Связывание MBL с микроорганизмом посредством углеводораспознающих доменов (CRD), которые распознают уникальные паттерны гликозилирования на поверхностном белке микроорганизма, является необходимым условием активации комплемента. Связывание MBL с микроорганизмом активирует ассоциированные с MBL предшественники сериновых протеаз, MASP-1 и MASP-2, приводя к расщеплению C4 и C2 системы комплемента, приводящему к образованию C4b2a и C3b. Некоторые из белков, образующихся при активации комплемента, непосредственно присоединяются к поверхности микроорганизма как опсонин, и MBL может также функционировать как опсонин, чтобы более эффективно осуществить фагоцитоз связанных с MBL микроорганизмов фагоцитами. Некоторые активированные белки комплемента непосредственно лизируют проникающие микроорганизмы, образуя мембраноатакующий комплекс (MAC), и другие белковые фрагменты комплемента, полученные в ходе процесса активации, способствуют выделению цитокина, вызывающего воспаление.
В предыдущих сообщениях описана экспрессия гена MBL в различных клетках, таких как клетки CHO, клетки гепатомы HLF или клетки HEK293-EBNA. В частности, уровень экспрессии в клетках CHO был очень высокий, но продуцируемый MBL в основном представлял собой мономеры или димеры (Katsuki Ohtani et al., J. Immunol. Methods, 222: 135-144, 1999). В клетках HEK293-EBNA осуществлялась продукция олигомерной формы MBL, но общая продуктивность составляла менее чем 1 мкг/мл (T. Vorup-Jensen et al, International Immunopharmacology, 1: 677-687, 2001). Продукция олигомерной формы MBL чрезвычайно важна, поскольку мономеры и димеры, состоящие из 3 субъединиц и 6 субъединиц соответственно, обладают небольшими, если таковые вообще имеются, активностями. Также важный вопрос в разработке фармацевтического продукта из MBL - получить клеточную линию-суперпродуцент, так как он необходим в количестве нескольких миллиграмм.
MBL также может играть важную роль в адаптивном иммунитете. Клетки, вовлеченные в фагоцитоз, такие как нейтрофилы и макрофагы, играют важную роль в удалении проникающих чужеродных микроорганизмов посредством фагоцитоза. В дополнение к этому макрофаг является антигенпрезентирующей клеткой (APC), которая активирует T-клетки, приводя к индукции приобретенного иммунного ответа. Следовательно, мультимерный MBL, вовлеченный в активацию системы комплемента как опсонин, играет важную роль не только в первичной защите в качестве компонента врожденной иммунной системы, но также и в индукции приобретенных иммунных ответов.
Количество MBL в сыворотке человека изменяется в зависимости от индивидуумов, находясь в диапазоне от 50 нг/мл до нескольких мкг/мл вследствие генетической изменчивости гена MBL. Например, если произошла точечная мутация в кодоне 52, 54 или 57 экзона 1 гена MBL, молекулы MBL не образуют олигомерные формы, приводя к появлению нефункциональных меньших комплексов, состоящих не более чем из 3 молекул MBL. Если мутация происходит в промоторных областях гена MBL, уровень экспрессии MBL уменьшается, приводя к значительному изменению уровня MBL в крови среди пораженных людей. В основном, те младенцы или пациенты с нейтропенией, у которых уровень MBL ниже определенного уровня, обладают слабым имммунитетом, становясь в высокой степени подверженными микробным инфекциям (Sumiya, M. et al., Lancet, 337: 1569-1570, 1991; Summerfield, J. A. et al., Lancet, 345: 886, 1995; Garred, P. et al., Lancet, 346: 941, 1995; Summerfield, J. et al., Br. Med. J., 314: 1229, 1997; Mullighan, C. G. et al., Scand. J. Immunol, 51: 111-122, 2000; Nefh, O. et al., Lancet, 358: 614-618, 2001; Peterslund, N. A. et al., Lancet, 358: 637-638, 2001; Mullighan C. G. et al., Blood, 99: 3524-3529, 2002).
Согласно исследованию пациентов с хроническим вирусом гепатита В уровень MBL в крови является важным фактором при прогнозировании развития заболевания (Hakozaki Y. et al., Liver 22, 29-34, 2002). В частности, среди пациентов, у которых развивалась скоротечная печеночная недостаточность при хронической инфекции вирусом гепатита B, смертность пациентов, у которых уровень MBL в крови находился свыше 3 мкг/мл, составляла 0%, тогда как у пациентов, у которых уровень MBL в крови составлял 1,5 мкг/мл и ниже 0,5 мкг/мл, смертность составляла 58% и более чем 80% соответственно. Данное исследование показывает значительную взаимосвязь между уровнем MBL в крови и смертностью пациентов с инфекционным заболеванием. Данное исследование также предполагает, что добавление MBL пациентам с низким уровнем или отсутствием MBL может быть благоприятным.
Для того чтобы рекомбинантный MBL можно было использовать в качестве терапевтического средства, рекомбинантный белок MBL необходимо производить в большом количестве по разумной цене в форме активных олигомерных молекул. В отличие от цитокинов он необходим в количестве нескольких миллиграмм для пациента при каждом приеме. Например, объем крови человека в среднем составляет приблизительно 5 литров, что требует 25 мг для получения 5 мкг/мл MBL. Принимая во внимание объем других жидкостей тела, может потребоваться намного большее количество при каждом приеме. Поэтому представляло собой крайне важную проблему при разработке коммерческого продукта MBL, что создается не только рекомбинантная клеточная линия суперпродуцент, но также клеточная линия, которая продуцирует активные формы полимерного MBL.
Таким образом, авторы настоящего изобретения прилагали все усилия, чтобы создать рекомбинантную клеточную линию, которая могла бы продуцировать MBL в промышленном масштабе и, в то же самое время, которая могла бы продуцировать функционально активную олигомерную форму MBL, которая способна активировать систему комплемента, специфически связываясь с гликопротеинами, связывающими MBL, в присутствии MASP. В результате данных усилий авторы настоящего изобретения подготовили данное изобретение, утверждая, что активный rhMBL, подходящий для терапевтического применения, можно продуцировать в промышленном масштабе в форме мультимерного полимера в клеточной линии СНО, трансфицированной клонирующим вектором, содержащим полинуклеотид, кодирующий последовательность rhMBL.
Описание чертежей
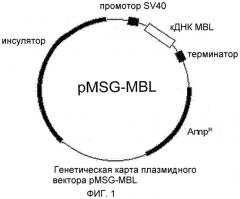
Фиг.1 представляет собой схематическое изображение, показывающее генетическую карту плазмидного вектора pMSG-MBL.
Фиг.2A и Фиг.2B представляют собой изображения MBL, продуцируемого рекомбинантной клеточной линией CHO, CHO MBL/D1-3, которая трансформирована pMSG-MBL. Фиг.2A представляет собой вид анализа SDS-PAGE и на фиг.2B показан вид анализа вестерн-блоттом, с использованием специфичного для MBL моноклонального антитела.
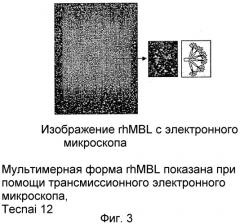
Фиг.3 представляет собой фотографию с электронного микроскопа, демонстрирующую олигмерные формы MBL. Четко видны олигмерные молекулы MBL, состоящие из 2, 3, 4, 5 и 6 тримерных субъединиц MBL.
Фиг.4 представляет собой фотографию с электронного микроскопа, демонстрирующую комплекс рекомбинантного белка MBL и золотой наночастицы, покрытой pre-S, в присутствии иона кальция.
На фиг.5A и фиг.5B показано, что rhMBL специфически связывается с pre-S, гликопротеином или маннаном с активностью, количественно схожей с природным MBL.
На фиг.6 показана относительная связывающая способность больших полимерных форм MBL и меньших форм, состоящих, в основном, из мономеров и димеров трехмерных субъединиц. Меньшие формы обладают небольшой, если таковая вообще имеется, связывающей способностью.
На фиг.7 показано сравнение способности активировать C4 больших форм и меньших форм rhMBL.
На фиг.8 показано, что rhMBL специфически связывается с различными микроорганизмами.
На фиг.9 показано, что rhMBL ингибирует инфицирование эмбриональных клеток почек обезьян (FRhK-4) SARS-CoV.
Фиг.10 представляет собой ряд изображений фазово-контрастного микроскопа, показывающих клетки FRhk-4, инфицированные SARS-CoV. Без обработки rhMBL клетки выглядят нездоровыми, тогда как с MBL присутствуют здоровые клетки.
Фиг.11 представляет собой схематическое изображение, показывающее диагностический набор, полученный с использованием рекомбинантного MBL человека.
Описание
Цель изобретения
Цель настоящего изобретения заключается в конструировании клеточной линии СНО, которая трансфицирована вектором, содержащим кодирующую полинуклеотидную последовательность MBL человека, с целью продуцирования функционально активной олигомерной формы MBL в большом количестве, которое будет использоваться с коммерческой целью.
Дополнительно цель настоящего изобретения заключается в создании способа очистки rhMBL от среды культивирования рекомбинантной клеточной линии СНО.
Сущность изобретения
В настоящем изобретении предлагается экспрессирующий вектор pMSG-MBL, содержащий последовательность кодирующей области rhMBL, представленной на карте плазмиды на фиг.1.
В настоящем изобретении также предлагается линия клеток-хозяев, трансфицированная экспрессирующим вектором.
В настоящем изобретении дополнительно предлагается способ массового производства мультимерного рекомбинантного MBL в соответствии со следующими стадиями:
(1) получение клеток-хозяев, трансфицированных экспрессирующим вектором, содержащим последовательность кодирующей область MBL человека;
(2) продукция рекомбинантного MBL человека клеточной линией, трансформированной экспрессирующим вектором с последовательностью, кодирующей область MBL человека, в системе культивирования; и
(3) очистка рекомбинантного MBL человека, полученного на стадии (2).
В настоящем изобретении также предлагается набор для определения рекомбинантного MBL человека, включающий i) твердофазную подложку с тестовой линией и контрольной линией, где мышиные антитела против маннозосвязывающего лектина человека фиксированы в тестовой линии и антитела против IgG мыши или антитела против pre-S фиксированы в контрольной линии; ii) подложку для красителя с сорбированным конъюгатом с красителем и соединенную с нижней частью твердофазной подложки, где, если в контрольной линии фиксированы антитела против IgG мыши, конъюгат с красителем представляет собой конъюгат мышиных антител против маннозосвязывающего лектина человека и золота и если в контрольной линии фиксированы антитела против pre-S, конъюгат с красителем представляет собой конъюгат pre-S и золота; и iii) подложку образца, соединенную с нижней частью подложки с красителем, на которую загружают образец.
Подробное описание изобретения
В настоящем изобретении предлагается экспрессирующий вектор pMSG-MBL, содержащий полинуклеотид, кодирующий rhMBL, представленный на карте плазмиды на фиг.1, которого достаточно для экспрессии олигомерного рекомбинантного MBL человека, который может активировать систему комплемента, специфически связываясь со связывающим MBL гликопротеином в присутствии ассоциированных с MBL сериновых протеаз.
В предпочтительном осуществлении настоящего изобретения кДНК MBL человека (Gene Bank NM_000242) встраивали в вектор pMSG (№ доступа: KCCM (Корейский центр микроорганизмов) 10202), содержащий MAR-элемент (элемент сайта связывания с ядерным матриксом) гена бета-глобина, поли-A вируса SV40 и комплекс терминатора транскрипции гена гастрина, что привело к созданию конструкции уникального вектора, обозначенного pMSG - MBL.
В настоящем изобретении также предлагаются клетки-хозяева, трансфицированные экспрессирующим вектором, содержащим полинуклеотид, кодирующий rhMBL, которых достаточно для экспрессии рекомбинантного MBL человека, который способен активировать систему комплемента, специфически связываясь с гликопротеином на поверхности микроорганизмов в присутствии ассоциированных с MBL сериновых протеаз.
Клетки-хозяева, используемые в настоящем изобретении, представляют собой, в основном, клетки животных и, предпочтительно, выбраны из группы, состоящей из клеток CHO (яичника китайского хомячка), гепатоцитов, клеток HEK (эмбриональной почки человека) и т.д.
В предпочтительном варианте осуществления настоящего изобретения трансформант получали встраивая клонирующий вектор pMSG-MBL, содержащий полинуклеотид, кодирующий rhMBL, которого достаточно для экспрессии рекомбинантного MBL человека, способного активировать систему комплемента, специфически связываясь с гликопротеином на поверхности микроорганизмов в присутствии ассоциированных с MBL сериновых протеаз, в линию клеток-хозяев, такую как клетки CHO, и затем адаптируя трансформанты к условиям с MTX (метотрексатом) приводящему к селекции трансформанта, который способен экспрессировать в большом количестве белок rhMBL в виде мультимерного полимера. Выбранный трансформант обозначили MBL D1-3 (клеточная линия CHO) и депонировали в Корейскую коллекцию типовых культур, Тэджон, Корея 16 мая 2003 (№ доступа: KCTC 10472BP).
Рекомбинантный MBL человека, продуцируемый трансформантом, описанным в настоящем изобретении, находится, в основном, в виде мультимерной формы, которая подобна природному MBL из крови человека. Клеточная линия, полученная в настоящем изобретении, продуцировала, в основном, функционально активную мультимерную форму MBL и показала высокий уровень экспрессии, обеспечивая возможность использовать трансформированную клеточную линию CHO для получения в больших количествах функционально активного белка rhMBL.
В настоящем изобретении дополнительно предлагается способ получения рекомбинантного MBL человека, включающий следующие стадии:
(1) Способ получения клеток-хозяев, трансфицированных конструкцией ДНК, включающей клонирующий вектор, содержащий полинуклеотид, кодирующий rhMBL, которого достаточно для экспрессии рекомбинантного MBL человека, способного активировать систему комплемента, специфически связываясь с гликопротеином на поверхности микроорганизмов в присутствии ассоциированных с MBL сериновых протеаз.
(2) Способ получения рекомбинантного MBL человека посредством экспрессии полинуклеотида, кодирующего MBL человека, в клетке животного и из клетки, применяя массивную систему культуры клеток.
(3) Способ очистки рекомбинантного MBL, полученного на стадии (2).
В частности, использование характеров связывания MBL с гликопротеином на стадии (1) и связывающего MBL гликопротеина, примерами которого являются гликозилированный белок оболочки вируса, содержащий pre-S HBV, гликозилированный бактериальный белок, гликозилированный грибковый белок и синтетический гликопротеин.
В предпочтительном варианте осуществления настоящего изобретения стадия продуцирования рекомбинантного MBL на стадии (2) характеризуется стадиями суспензионного культивирования клеток в бессывороточной/безбелковой среде и пересевания таких клеток, хорошо приспособленных к бессывороточной/безбелковой среде для того, чтобы постепенно увеличивать продукцию, приводя к получению в большом количестве белка rhMBL в форме мультимерного полимера.
На стадии (3) рекомбинантный белок MBL очищали от среды культивирования трансформантов гена MBL, используя анионообменную хроматографию и связывающую способность MBL относительно pre-S вируса гепатита B. Способ очищения MBL состоит из следующих стадий: (a) разделения образцов, содержащих мультимерный рекомбинантный MBL человека с использованием анионообменной хроматографии; (b) подготовки колонки путем заполнения ее субстратом, на котором иммобилизован pre-S вируса гепатита B; (c) специфического захвата рекомбинантных MBL на иммобилизованном pre-S вируса гепатита B при прохождении через колонку образца, содержащего рекомбинантные белки MBL в присутствии ионов кальция, после уравновешивания колонки буфером, содержащим ионы кальция; и (d) элюирования рекомбинантных белков MBL добавлением буферного раствора с дополнением EDTA или EGTA к колонке, на которой захватывался рекомбинантный MBL на стадии (c).
На стадии (a) использовали вещество, которое обычно используют для анионообменной хроматографии, и Q-сефароза представляла собой одно из таких используемых веществ для колонки. Образец, содержащий белки MBL в виде мономера или димера, разделяли в присутствии 150 - 200 мМ NaCl, и другую порцию, содержащую высокомолекулярный белок MBL в виде сополимера, элюировали в присутствии 350 - 400 мМ NaCl.
На стадии (b) использовали субстрат, который обычно используют для аффинной хроматографии, и сефароза представляла собой один из обычно используемых субстратов.
На стадии (c) уравновешивание колонки проводили добавляя буферный раствор или такой же раствор, как используемый для аффинного связывания рекомбинантного MBL и pre-S вируса гепатита В. Связывание рекомбинантного MBL с pre-S вируса гепатита В предпочтительно проводили в присутствии ионов кальция и тогда концентрация кальция составляла предпочтительно 2 - 20 мМ. Образец, содержащий рекомбинантный белок, может представлять собой супернатант, полученный из среды культивирования клетки-трансформанта, продуцирующей MBL или раствор MBL, элюированный с колонки фракционирования MBL, упомянутой выше.
На стадии (d) элюирование белка rhMBL проводили используя буферный раствор EDTA или EGTA при отсутствии ионов кальция. Буферный раствор может представлять собой раствор, содержащий EDTA или EGTA в концентрации 2 - 10 мМ, например дистиллированную воду или буфер Tris-Cl, pH 7,4.
Элюент, полученный на стадии (d), лиофилизировали или диализировали перед лиофилизацией, приводя к получению очищенного рекомбинантного белка MBL.
Способ очистки белка rhMBL по настоящему изобретению также применим для очистки MBL, полученного из природных биологических образцов, в дополнение к рекомбинантному белку MBL, полученному из трансформанта. Биологический образец может представлять собой в качестве примера кровь, плазму или сыворотку.
В настоящем изобретении также предлагается набор для определения рекомбинантного MBL человека, включающий: i) твердофазную подложку, содержащую тестовую линию и контрольную линию, где мышиные антитела против маннозосвязывающего лектина человека фиксированы в тестовой линии и антитела против IgG мыши или антитела против pre-S фиксированы в контрольной линии; ii) подложку красителя с адсорбированным конъюгатом с красителем и соединенную с нижней частью твердофазной подложки, где, если в контрольной линии фиксированы антитела против IgG мыши, то конъюгат с красителем представляет собой конъюгат мышиных антител против маннозосвязывающего лектина человека и золота и если в контрольной линии фиксированы антитела против pre-S, конъюгат с красителем представляет собой конъюгат pre-S и золота; и iii) подложку для образца, соединенную с нижней частью подложки красителя, в которую загружают образец.
В настоящем изобретении нитроцеллюлозную мембрану, поливинилидендифторид (PVDF) и нейлоновую мембрану можно использовать в качестве твердофазной подложки. В качестве подложки с красителем можно использовать, но не ограничиваясь этим, полиэстер, стекловолокно и т.д.
В настоящем изобретении также предлагается способ получения набора для определения рекомбинантного MBL человека, включающий следующие стадии:
(1) приготовления конъюгатов с красителем посредством связывания антител против маннозосвязывающего лектина человека или белка pre-S с золотыми частицами;
(2) сорбирования конъюгатов с красителем на подложку для красителя;
(3) связывания антител против маннозосвязывающего лектина человека с твердофазной подложкой в тестовой линии и антител против pre-S человека с твердофазной подложкой в контрольной линии, если конъюгаты с красителем представляют собой золотые частицы с антителами против маннозосвязывающего лектина человека, или связывания антител против pre-S с твердофазной подложкой в качестве контрольной линии, если конъюгаты с красителем представляют собой золотые частицы с мышиными антителами против MBL человека; и
(4) присоединения подложки для образца и подложки с красителем к нижней части твердофазной подложки.
В настоящем изобретении белки pre-S или антитела против MBL человека можно использовать, но не ограничиваясь этим, в качестве конъюгата с красителем.
В настоящем изобретении также предлагается способ определения MBL с использованием набора для определения MBL, который включает следующие стадии:
(1) нанесения образца, содержащего MBL, на подложку с красителем, соединенную с нижней частью твердофазной подложки; и
(2) подтверждения того, что антитела связываются с тестовой линией и контрольной линией твердофазной подложки.
Рекомбинантный MBL человека по настоящему изобретению похож на природную форму, очищенную из крови человека. Он представляет собой олигомерные формы, и он активен в отношении связывания с микроорганизмом, таким образом активируя систему комплемента. И высокий уровень получения продукта (50 мкг/миллион клеток/день) обеспечивает коммерческое производство функционально активного MBL для разработки нового продукта. Таким образом, полученный rhMBL можно эффективно использовать для лечения индивидуума, инфецированного вирусом, бактериями или грибами. Его также можно использовать для производства диагностического набора для определения рекомбинантного MBL человека.
Примеры
Практические и в настоящее время предпочтительные варианты осуществления настоящего изобретения являются наглядными, как показано в следующих ниже примерах.
Тем не менее, будет оценено по достоинству, что специалисты в данной области могут вносить изменения и усовершенствования в пределах сущности и объема настоящего изобретения.
Пример 1: Получение трансформанта гена MBL и экспрессия рекомбинантного MBL человека.
<1-1> Конструирование экспрессирующего вектора
pEZ-MBL 2-5 конструировали, клонируя кДНК MBL, полученную при ПЦР из библиотеки кДНК гепатоцита человека, в вектор pEZ, и затем подтверждали, что нуклеотидная последовательность кДНК MBL аутентична известной нуклеотидной последовательности MBL (Gene Bank NM_000242). ПЦР проводили, используя pEZ-MBL 2-5 в качестве матрицы и используя набор праймеров (прямой праймер 1 и обратный праймер 2) для амплификации кДНК MBL размером приблизительно 750 тыс.н.п. Каждый праймер содержал сайт распознавания рестриктаз и последовательность Козака, так что амплифицировали целую кодирующую область. Затем pMSG-MBL получали, клонируя кДНК MBL в вектор pMSG (№ доступа: KCCM 10202), и затем подтверждали встроенную нуклеотидную последовательность MBL (фиг. 1).
Прямой праймер 1 (SEQ. ID. № 1)
ctagctagcc accatgtccc tgtttccatc actc (34-мер)
Обратный праймер 2 (SEQ. ID. № 2)
gaagatctca gatagggaac tcacagacg (29-мер)
<l-2> Трансформация клеток-хозяев pMSG-MBL
<l-2-l> Получение экспрессирующей плазмидной ДНК pMSG-MBL
E.coli трансфицировали pMSG-MBL и полученный трансформант культивировали в 100 мл среды LB с добавлением ампициллина в концентрации 100 мкг/мл (Sigma, США). ДНК pMSG-MBL отделяли при помощи набора для очищения плазмид (QUIAPREP Plasmid Midi Kit, Quiagen, США). Очищенную ДНК для того, чтобы сделать ее линейной, расщепляли рестрикционным ферментом Sea I, который отделяли при помощи набора очищения продукта ПЦР (QIAQuick PCR product purification kit, Quiagen, США).
<l-2-2> Получение клеток-хозяев
После культивирования клеток-хозяев CHO DG44 (dhfr-/dhfr-) в среде α-MEM с добавлением 10% cFBS количество клеток подсчитывали в гемоцитометре. Клетки распределяли (2 × 105 клеток/лунку) в среде α-MEM с добавлением 10% cFBS, которые культивировали в инкубаторе CO2 в течение 24 часов.
<l-2-3> Трансформация
2 мкг вектора pMSG-MBL смешивали с 5,3 мкл реактива Dosper™ и 16 нг ДНК вектора pDCHlP (плазмида, содержащая ген DHFR, Venolia, L. et al., 1987, Somat. Cell MoI. Genet. 13, 491-501), чтобы индуцировать реакцию при комнатной температуре в течение 45 минут. Полученный в результате продукт добавляли к клеткам-хозяевам. Клетки культивировали при 37°C в течение 6 часов, затем среду заменяли на свежеприготовленную среду α-MEM с добавлением 10% cFBS (3 мкл/лунку), после чего следовало дальнейшее культивирование. Через 2-3 дня, когда трансформированные клетки вырастали в достаточной степени, добавляли трипсин и добавляли к клеткам 2 мкл α-MEM (мас./об.), содержащей 10% dFBS (4×105 клеток/лунку), после чего снова следовало дальнейшее культивирование. Каждые 2-3 дня среду заменяли на свежеприготовленную и за состоянием клеток и образованием единичных колоний наблюдали в микроскоп. Через 10 дней получали адаптированные ранние клетки.
<l-3> Отбор экспрессирующей MBL клеточной линии и амплификация гена MBL
После получения адаптированных ранних клеток постепенно увеличивали концентрацию MTX (метотрексата) в среде, для того чтобы индуцировать амплификацию гена MBL, встроенного в трансформированные клетки. Клетки помещали в количестве 4×105 клеток/лунку и затем культивировали в среде (α-MEM+10% dFBS) с добавлением 10 нМ MTX вплоть до слияния, во время которого среду заменяли на свежеприготовленную каждые 2-3 дня. Клетки снова распределяли в количестве 4×105 клеток/лунку и адаптировали к среде с добавлением 100 нМ MTX, после чего следовала такая же процедура, как описана выше, и затем снова адаптировали к условиям с 1 мкМ MTX. Во время амплификации гена MBL проводили вестерн-блот анализ на каждой стадии для того, чтобы наблюдать изменения уровня экспрессии MBL. Здесь экспрессия MBL увеличивалась с увеличением содержания MTX в среде.
<l-4> Отбор одной клеточной линии
Для того чтобы отделить одну клеточную линию, показывающую высокую степень экспрессии MBL, клетки, культивируемые в среде (α-MEM+10% dFBS), содержащей 1 мкМ MTX, распределяли на 96-луночном планшете чтобы получить 0,5 клеток/лунку, затем культивировали в среде, содержащей 1 мкМ MTX. Через 2 недели, когда подтверждали образование единичной колонии, клетки переносили в 24-луночный планшет, который далее культивировали до тех пор, пока клетки в достаточной степени пролиферировали. Некоторые из них замораживали и хранили, и некоторые из них использовали для сравнения экспрессии посредством вестерн-блот анализа. И трансформант D1-3 в виде одной клетки, которая, как подтвердили, продуцировала высокомолекулярную форму MBL в большом количестве, выбирали в качестве клеточной линии по настоящему изобретению. Выбранный трансформант обозначили MBL D1-3 (линия клеток CHO) и депонировали в Корейскую коллекцию типовых культур, Тэджон, Корея 16 мая 2003 (№ доступа: KCTC 10472BP). Анализ PAGE рекомбинантного белка MBL, экспрессированного трансформантом, проводили при неденатурирующих условиях и, как было обнаружено, белок представлял собой мультимерную форму MBL, которая очень схожа по характеристикам с MBL человека природного происхождения.
<l-5> Количественный анализ рекомбинантного MBL, экспрессируемого трансформантом
Основываясь на стандартном количестве очищенного MBL, полученного из сыворотки человека, оценивали уровень экспрессии рекомбинантного белка MBL из трансформированных клеток CHO MBL/D1-3. Клетки помещали в колбы T25 в концентрации 4×105 и затем культивировали в среде (α-MEM(мас./об.)+10% dFBS) до 90% слияния. Затем добавляли к ним 3 мл среды (α-MEM(мас./об.)+5% dFBS) и далее культивировали в течение 4 дней. Среду культивирования разбавляли в 10 раз, после чего следовал вестерн-блот анализ. Результат сравнивали со стандартным количеством природного MBL. При этом уровень экспрессии рекомбинантного белка MBL, как подтверждали, составлял приблизительно 50 мкг/106 клеток/день как культивированных в колбе для культивирования клеток.
Пример 2: Способ массового производства белка rhMBL
<2-l> Получение клеточной линии, адаптированной для суспензионной культуры в бессывороточной среде
Зависимую от культуральной подложки клеточную линию, экспрессирующую MBL, культивировали в среде (α-MEM(мас./об.) с добавлением 10% dFBS и 1 мкМ MTX. После восстановления жизнеспособных клеток их инокулировали в роллерную колбу объемом 250 мл, содержащую 100 мл не содержащей белка среды HyQ SFM4 СНО (Hyclone, США) с добавлением 0,15% бикарбоната натрия при величине посевного материала 4×105 клеток/мл. Культивирование в роллерной колбе проводили при 37°C в инкубаторе с 5% CO2, которую перемешивали все время на 40 об./мин. Когда количество клеток достигло 1,0-2,0×105 клеток/мл, клетки снова инокулировали в среду HyQ SFM4 СНО с добавлением 0,15% бикарбоната натрия при величине посевного материала 5×105 клеток/мл. Жизнеспособность клеток определяли способом исключения трипанового синего. В частности, жизнеспособность свыше 90% подтверждали на поздней стадии адаптации.
Клетки, адаптированные к бессывороточной безбелковой среде, культивировали до тех пор, пока плотность клеток не достигала 2,5×106 клеток/мкл. Затем клетки восстанавливали и ресуспендировали в замораживающей среде. Клетки помещали в криопробирки для получения концентрации 2,8×107 клеток/мкл, которые затем хранили в емкости с жидким азотом.
<2-2> Создание культуры в биореакторе, используя клеточную линию, адаптированную для бессывороточного суспензионного культивирования
Клетки для суспензионного культивирования инокулировали в роллерную колбу объемом 250 мл, содержащую 100 мл бессывороточной/безбелковой среды (среда HyQ SFM4 СНО) с добавлением 0,15% бикарбоната натрия при величине посевного материала 5×105 клеток/мкл. Когда количество клеток возрастало до 1,0-2,0×106 клеток/мкл, клетки инокулировали в роллерную колбу объемом 500 мл, содержащую 200 мл среды HyQ SFM4 СНО при величине посевного материала 5×105 клеток/мкл. Затем, когда количество клеток снова возрастало до 2,0 × 106 клеток/мкл, клетки инокулировали в роллерную колбу объемом 1000 мл, содержащую 400 мл среды HyQ SFM4 СНО при величине посевного материала 5×105 клеток/мкл. Таким образом, клетки культивировали с постепенным увеличением, приводя к получению 1 л для высевания культуры с концентрацией 2,5×106 клеток/мкл.
Культуру клеток для высевания, полученную выше, инокулировали в биореактор объемом 7,5 л (рабочий объем 5 л) и культивировали при 34°C в течение 5 дней (50 об.мин, DO 50, pH 7,2-7,4).
Пример 3: Способ очистки мультимерного рекомбинантного белка MBL человека
Экспрессирующие MBL клетки CHO культивировали в среде HyQ SFM4 CHO и затем среду культивирования центрифугировали и пропускали через мембранный фильтр размером пор 0,45 мкм, чтобы удалить клетки. Анионообменную хроматографию проводили для очистки рекомбинантных белков MBL. Количество очищенных белков определяли используя набор MBL ELISA.
<3-l> Разделение образца, содержащего мультимерный полимер, с использованием колонки с Q-сефарозой
После оптимизации величины pH и коэффициента фильтрации супернатанта меньшие формы MBL, такие как мономер и димер, удаляли, используя колонку, заполненную Q-сефарозой, и собирали только MBL больших форм. Образец, содержащий меньшие формы MBL, разделяли пропуская через 150-200 мМ буферного раствора NaCl и образец, содержащий большие формы MBL, элюировали с использованием 350-400 мМ буферного раствора NaCl. Данные результаты показывают, что более чем 80% экспрессировалось в виде высокомолекулярной сополимерной формы MBL клеточной линией, которая предлагается в данном изобретении (фиг. 2A).
<3-2> Получение колонки с pre-S-сефарозой
Рекомбинантный белок pre-S, используемый в настоящем изобретении, получали, экспрессируя ген pre-S, который представляет собой часть поверхностного белка вируса гепатита В в Sacharomyces cerevisiae, и затем очищая его виде гликозилированных в высокой степени молекул (международная патентная публикация № WO 02/094866).
Один грамм порошка сефарозы 4B, активированной CNBr, растворяли в 1 мМ HCl, после чего несколько раз следовала промывка. Для того чтобы использовать рекомбинантный белок pre-S в качестве лиганда, 6,4 мг белка pre-S растворяли в присоединяющем буфере (0,2 M NaHCO3, 0,5 M NaCl и pH 8,3), получая концентрацию 0,5 - 10 мг/мкл. Активированные CNBr смолы сефарозы 4B смешивали с раствором pre-S и подвергали взаимодействию при комнатной температуре в течение 2 часов. Затем смесь переносили в блокирующий буфер (0,1 M Tris-Cl, pH 8,0), после чего следовало дальнейшее взаимодействие при комнатной температуре в течение 2 часов. После промывки иммобилизованный на сефарозе pre-S подтверждали анализом вестерн-блот и, как обнаружили, почти все рекомбинантные белки pre-S иммобилизовались на колонке сефарозы, которую использовали для очистки рекомбинантного белка MBL. В заключение, колонку с pre-S-сефарозой для очистки рекомбинантного белка MBL человека получали наполняя колонку смолой pre-S-сефароза 4B.
<3-3> Очистка рекомбинантного MBL человека
Колонку, заполненную pre-S-сефарозой, уравновешивали буфером для связывания (20 мМ Tris, 150 мМ NaCl и 10 мМ CaCl2, pH 7,6). Фракция колонки с Q-сефарозы, содержащая рекомбинантные белки MBL, или среду культивирования, содержащую MBL, нагружали на колонку для адсорбции MSL. Затем колонку промывали несколько раз связывающим буфером. Элюирующий буфер (20 мМ Tris, 150 мМ NaCl и 5 мМ EDTA, pH 7,6) без Ca2+ пропускали через колонку для того, чтобы элюировать рекомбинантный MBL человека. Полученный элюент исследовали с использованием SDS-PAGE. В результате получили очищенный рекомбинантный MBL человека, имеющий 99,9% чистоты (фиг. 2A и фиг. 2B).
Пример 4: Верификация мультимерного рекомбинантного MBL человека посредством EM и по активности связывания MBL с поверхностью микроорганизма.
<4-1> Подтверждение образования мультимерного рекомбинантного MBL человека
Для того чтобы подтвердить образует ли или нет очищенный рекомбинантный MBL человека мультимерный полимер в виде букета цветов, очищенный рекомбинантный MBL человека обрабатывали аморфным углеродом и затем форму белка проверяли под трансмиссионным электронным микроскопом (Tecnai 12, FEI, Netherlands) и обнаружили, что очищенный рекомбинантный MBL человека представлял собой мультимерные полимеры в виде букета (фиг. 3).
<4-2> Связывание рекомбинантных MBL человека с частицами золота, покрытыми pre-S
Способность рекомбинантного MBL человека связываться с поверхностью микроорганизма наблюдали используя pre-S поверхностный белок вируса гепатита B. Белки Pre-S прикрепляли к поверхности частиц золота, которые имеют размер 20-40 нм, которые, таким образом, сделаны как будто микроорганизм. Рекомбинантные MBL человека добавляли к ним в присутствии кальция. Затем под трансмиссионным электронным микроскопом Tecnai 12 наблюдали, присоединялся ли рекомбинантный MBL человека к белкам pre-S, приводя к подтверждению образования комплекса. Как показано на фиг.4, белки pre-S, нанесенные на частицы золота были окружены рекомбинантными MBL человека в присутствии кальция. Это демонстрирует, как похоже связывание rhMBL с поверхностью микроорганизма. Фактически, MBL, связывающийся с микроорганизмом, мог бы механически блокировать инфекционность специфично для организмов, таких как вирусы к клеткам, в дополнение к активации системы комплемента и действию в качестве опсонина.
Пример 5: Подтверждение связывающей активности рекомбинантного MBL человека
Для того чтобы исследовать биологическую активность rhMBL, активность связывания с pre-S и маннаном исследовали в присутствии ионов кальция.
Маннан или белок pre-S вируса гепатита B растворяли в 50 мМ карбонат-гид