Конъюгаты пептида melan-a, аналога вирусоподобной частицы
Иллюстрации
Показать всеИзобретение относится к областям молекулярной биологии, вирусологии, иммунологии и медицины. Композиция содержит модифицированную вирусоподобную частицу (VLP), иммуностимулирующие вещества, в частности ДНК-олигонуклеотиды, содержащие неметилированные С и G (CpG) и отдельные пептиды, полученные из Melan-A. Такие CpG-VLP значительно более иммуногенны, чем их аналоги, не содержащие CpG, и индуцируют усиленные В- и Т-клеточные ответы. Иммунный ответ против аналогов пептида Melan-A, соединенного с VLP, усиливается подобным образом, как и иммунный ответ против самой VLP. Кроме того, Т-клеточные ответы против аналогов пептида Melan-A главным образом направлены к типу Th1. Антигены, связанные с VLP, нагруженными CpG, могут быть идеальными вакцинами для профилактической или терапевтической вакцинации против аллергии, опухолей и других аутологичных молекул и хронических вирусных заболеваний. Изобретение может быть использовано в медицине. 5 н. и 47 з.п. ф-лы, 3 ил., 4 табл.
Реферат
В данной заявке предлагается улучшенный вариант изобретения, описанный в предварительной заявке на выдачу патента США No. 60/457348, поданной 26 марта 2003, которая, таким образом, включена здесь в виде ссылки в полном объеме.
УРОВЕНЬ ТЕХНИКИ
Область техники, к которой относится изобретение
Настоящее изобретение относится к областям вакцинологии, иммунологии и медицины. Изобретение относится к композициям и способам усиления иммунологических ответов против аналогов пептида Melan-A, которые связывают, сливают или присоединяют иным образом с вирусоподобными частицами (VLP) посредством связывания, предпочтительно посредством упаковки иммуностимулирующих веществ, в частности иммуностимулирующих нуклеиновых кислот, и еще более конкретно олигонуклеотидов, содержащих по меньшей мере одну неметилированную последовательность CpG, в VLP. Изобретение можно применять для индукции сильных и продолжительных T-клеточных ответов, особенно полезных при лечении опухолей.
Предшествующий уровень техники
Существование иммунной системы построено на двух отдельных фундаментальных основах: одна из них представляет собой специфичный, или адаптивный, иммунитет, который характеризуется относительно медленной кинетикой ответа и способностью к запоминанию; другая представляет собой неспецифичный, или врожденный, иммунитет, имеющий быструю кинетику ответа, но при отсутствии памяти.
Хорошо установлено, что введения очищенных белков отдельно обычно недостаточно, чтобы вызвать сильный иммунный ответ; изолированный антиген, как правило, должен быть введен вместе с вспомогательными веществами, называемыми адъювантами. В указанных адъювантах введенный антиген защищен от быстрой деградации, и адъювант обеспечивает длительное высвобождение низкого уровня антигена.
В отличие от изолированных белков вирусы индуцируют быстрые и эффективные иммунные ответы в отсутствие какого-либо адъюванта как с помощью, так и без помощи T-клеток (Bachmann and Zinkernagel, Ann. Rev. Immunol. 15: 235-270 (1997)). Многие вирусы имеют квазикристаллическую поверхность, на которой представлена регулярная матрица эпитопов, которые эффективно перекрестно связывают специфичные по отношению к эпитопам иммуноглобулины на B-клетках (Bachmann и Zinkernagel, Immunol. Today 17: 553-558 (1996)). Структура вируса даже связана с образованием анти-антител при аутоиммунном заболевании и является частью естественного ответа на патогены (смотри Fehr, T. , et al., J. Exp. Med. 185: 1785-1792 (1997)). Таким образом, антигены на вирусных частицах, которые организованы в виде упорядоченной и повторяющейся матрицы, являются высокоиммуногенными, так как они могут непосредственно активировать B-клетки и индуцировать формирование ответа цитотоксических T-клеток, другой ключевой ветви иммунной системы.
Вирусные частицы в качестве антигенов имеют два преимущества по сравнению с их изолированными компонентами: (1) благодаря высокоповторяющейся структуре своей поверхности они способны непосредственно активировать B-клетки, приводя к высоким титрам антител и долговременной B-клеточной памяти; и (2) вирусные частицы, но не растворимые белки, имеют возможность индуцировать ответ цитотоксических T-клеток, даже если вирусы являются неинфекционными и адъюванты отсутствуют.
Кроме того, ДНК, богатая неметилированными мотивами CG (CpG), которые присутствуют в бактериях и у большинства беспозвоночных проявляет высокую стимулирующую активность по отношению к B-клеткам, дендритным клеткам и другим APC in vitro, а также in vivo. Хотя бактериальная ДНК является иммуностимулирующей у многих видов позвоночных, индивидуальные мотивы CpG могут отличаться. В действительности мотивы CpG, которые стимулируют иммунные клетки мышей, не обязательно стимулируют иммунные клетки человека и наоборот. Кроме того, иммуностимулирующие CpG-олигодезоксинуклеотиды индуцируют сильные побочные эффекты, вызывая экстрамедуллярный гемопоэз, сопровождаемый спленомегалией и лимфаденопатией у мышей (Sparwasser et al., J. Immunol. (1999), 162: 2368-74 и пример 18).
В последнее время были достигнуты значительные успехи в методике вакцинации, и все же остается необходимость в усовершенствовании существующих методик. В частности в данной области остается необходимость в разработке новых и улучшенных вакцин, которые стимулируют сильный иммунный ответ CTL и защиту против патогенов также эффективно, как природные патогены, в отсутствие генерализованной активации APC и других клеток.
Меланомы являются агрессивными, часто метастазирующими опухолями, происходящими либо из меланоцитов, либо родственных меланоцитам клеток невуса. Меланомы составляют примерно три процента всех злокачественных опухолей кожи, и увеличение распространенности меланомы во всем мире не превосходит ни одна неоплазма за исключением рака легкого у женщин. Даже когда меланома очевидно локализована в коже, у 30% пациентов будут развиваться системные метастазы и большинство пациентов погибнет. В последнее десятилетие появились иммунотерапия и генная терапия в качестве новых и многообещающих способов лечения меланомы, например лечение пациентов с меланомой пептидом Melan-A/MART-1 с адъювантами или без них. Успех указанных методик обычно ограничен. Кроме того, в большинстве исследований не измеряли непосредственно ex vivo ответ CTL с мультимерами MHC класса I, а использовали культуры CTL и стимулировали их в течение нескольких недель перед тем, как в конце концов могли измерить специфичный по отношению к Melan-A CTL-ответ. В общем, пептиды не являются иммуногенными сами по себе и имеют очень короткий период полужизни.
Другим способом иммунотерапии является либо нагрузка дендритных клеток пептидом Melan-A/MART-1, либо трансфекция дендритных клеток Melan-A/MART-1-РНК и повторная инъекция пациентам. Недостатком указанного способа является очистка и инкубация аутологичных дендритных клеток от каждого отдельного пациента в течение нескольких дней с цитокинами in vitro. Это необходимо делать очень осторожно, так как дендритные клетки должны быть в подходящем состоянии созревания, чтобы быть иммуногенными, а не толерогенными, что может привести к тому, что T-клетки больше не будут отвечать на опухоль.
Другим способом Dudley, M. E. (Science. 2002 Oct 25; 298 (5594): 850-4) является выделение Melan-A-специфичных T-клеток из аутологичного опухолевого материала пациентов, культивирование in vitro и размножение и повторная инъекция донору. Как в указанном выше способе, специфичная вакцина должна быть получена отдельно для каждого отдельного пациента, и поэтому не является наиболее эффективной терапией.
Поэтому характеристика эффективных вакцин против меланомы важна для разработки новой методики иммунотерапии злокачественных опухолей, в частности меланомы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение основано на обнаружении того, что отдельные аналоги пептида Melan-A человека в том случае, когда они связаны с коровой частицей, имеющей структуру с присущей ей повторяющейся организацией, и таким образом, в частности с вирусоподобными частицами (VLP) и субъединицами VLP соответственно, и указанные VLP упакованы с иммуностимулирующими веществами (ISS), такими как ДНК-олигонуклеотиды, представляют собой сильные иммуногены для индукции специфичных антител. Изобретение, кроме того, основано на обнаружении того, что иммуностимулирующие вещества, такие как ДНК-олигонуклеотиды, могут быть упакованы в VLP, которые делают их более иммуногенными. Неожиданно нуклеиновые кислоты и олигонуклеотиды соответственно, присутствующие в VLP, могут быть, в частности, заменены иммуностимулирующими веществами и ДНК-олигонуклеотидами, содержащими мотивы CpG соответственно. Неожиданно указанные упакованные иммуностимулирующие вещества, в частности иммуностимулирующие нуклеиновые кислоты, такие как неметилированные CpG-содержащие олигонуклеотиды, сохраняли свою иммуностимулирующую способность без обширной активации врожденной иммунной системы. Композиции, содержащие VLP и иммуностимулирующие вещества согласно настоящему изобретению, и в частности CpG-VLP, значительно более иммуногенны, чем их аналоги, не содержащие CpG, и индуцируют повышенные B- и T-клеточные ответы. Кроме того, T-клеточные ответы как против VLP, так и против аналогов пептида Melan-A, главным образом, направлены к типу Th1. Поэтому аналоги пептида Melan-A человека, связанные с VLP, нагруженными CpG, могут быть идеальными вакцинами для профилактической и терапевтической вакцинации против опухолей.
В первом варианте изобретение относится к композиции обычно и предпочтительно для усиления иммунного ответа у животного, содержащей вирусоподобную частицу, иммуностимулирующее вещество, предпочтительно иммуностимулирующую нуклеиновую кислоту и еще более предпочтительно неметилированный CpG-содержащий олигонуклеотид, и по меньшей мере один антиген или антигенную детерминанту, где иммуностимулирующее вещество, нуклеиновая кислота или олигонуклеотид связаны, слиты или иным образом присоединены или заключены в вирусоподобную частицу, например связаны с вирусоподобной частицей, и где указанный антиген или антигенная детерминанта связаны с указанной вирусоподобной частицей, и где указанный антиген содержит, альтернативно в основном состоит, или альтернативно состоит из аналога пептида Melan-A меланомы человека.
В предпочтительном варианте изобретения иммуностимулирующие нуклеиновые кислоты, в частности неметилированные CpG-содержащие олигонуклеотиды, стабилизированы фосфоротиоатными модификациями фосфатного остова. В другом предпочтительном варианте иммуностимулирующие нуклеиновые кислоты, в частности неметилированные CpG-содержащие олигонуклеотиды, упакованы в VLP посредством расщепления РНК в VLP и одновременного добавления ДНК-олигонуклеотидов, содержащих предпочтительные CpG. В равной мере предпочтительном варианте VLP могут быть подвергнуты разборке перед их повторной сборкой в присутствии CpG.
В следующем предпочтительном варианте иммуностимулирующие нуклеиновые кислоты не содержат мотивов CpG, но несмотря на это проявляют иммуностимулирующие активности. Такие нуклеиновые кислоты описаны в WO 01/22972. Все последовательности, описанные в указанной заявке, таким образом, включены в виде ссылки.
В следующем предпочтительном варианте вирусоподобная частица является рекомбинантной вирусоподобной частицей. Также предпочтительная вирусоподобная частица не содержит липопротеидной оболочки. Предпочтительно рекомбинантная вирусоподобная частица содержит, или альтернативно состоит из рекомбинантных белков вируса гепатита B, вируса BK или другого вируса полиомы человека, вируса кори, вируса Синдбис, ротавируса, вируса ящура, ретровируса, вируса Норуолк или вируса папилломы человека, РНК-фагов, Qβ-фага, GA-фага, fr-фага и Ty. В конкретном варианте вирусоподобная частица содержит, или альтернативно состоит из одного или нескольких различных белков кора(капсида) вируса гепатита B (HBcAg). В следующем предпочтительном варианте вирусоподобная частица содержит рекомбинантные белки или их фрагменты РНК-фага. Предпочтительными РНК-фагами являются фаг Qβ, фаг AP 205, фаг GA, фаг fr.
В конкретном варианте антиген содержит, или альтернативно состоит из эпитопа для цитотоксической T-клетки. В родственном варианте вирусоподобная частица содержит коровый белок вируса гепатита B, и эпитоп для цитотоксических T-клеток слит с C-концом указанного корового белка вируса гепатита B. В одном варианте они слиты лейциновой связывающей последовательностью. В особенно предпочтительном варианте антиген является полипептидом, подходящим для индукции иммунного ответа против клеток злокачественной опухоли.
В другом аспекте изобретения предлагается способ усиления иммунного ответа у человека или других видов животных, включающий в себя введение животному композиции, содержащей вирусоподобную частицу, иммуностимулирующее вещество, предпочтительно иммуностимулирующую нуклеиновую кислоту, и еще более предпочтительно неметилированный CpG-содержащий олигонуклеотид, и по меньшей мере один антиген или антигенную детерминанту, где иммуностимулирующие вещество, предпочтительно нуклеиновая кислота и еще более предпочтительно олигонуклеотид, связан (например, связан, присоединен или заключен) с вирусоподобной частицей, и где указанный антиген содержит, альтернативно в основном состоит, или альтернативно состоит из аналога пептида Melan-A меланомы человека, и где указанный аналог пептида Melan-A меланомы человека связан с указанной вирусоподобной частицей.
В еще одном варианте изобретения композицию вводят животному подкожно, внутримышечно, интраназально, интрадермально, внутривенно и непосредственно в лимфатический узел. В равной мере предпочтительном варианте усиливающую иммунитет композиция применяют местно вблизи опухоли или локального резервуара вирусной инфекции, против которой хотят провести вакцинацию.
В предпочтительном аспекте изобретения иммунный ответ представляет собой T-клеточный ответ, и T-клеточный ответ против антигена усиливают. В конкретном варианте T-клеточный ответ представляет собой ответ цитотоксических T-клеток, и ответ цитотоксических T-клеток против пептида Melan-A усиливают.
Настоящее изобретение также относится к вакцине, содержащей иммунологически эффективное количество усиливающей иммунитет композиции согласно настоящему изобретению вместе с фармацевтически приемлемым разбавителем, носителем или эксципиентом. В предпочтительном варианте вакцина, кроме того, содержит по меньшей мере один адъювант. Изобретение также относится к способу иммунизации и/или лечения животного, включающему в себя введение животному иммунологически эффективное количество предложенной вакцины.
В предпочтительном варианте изобретения, содержащие иммуностимулирующие вещество VLP, предпочтительно VLP, содержащие иммуностимулирующую нуклеиновую кислоту, еще более предпочтительно VLP, содержащие неметилированный CpG-содержащий олигонуклеотид, используют для вакцинации животных, обычно и предпочтительно человека, против меланомы или пептидов Melan-A соответственно. Модифицированные VLP обычно и предпочтительно можно использовать для вакцинации против опухолей. Вакцинация может быть в профилактических или терапевтических целях или и в тех и других целях.
Путь инъекции предпочтительно является подкожным или внутримышечным, но также можно применять CpG-содержащие VLP интрадермально, интраназально, внутривенно или непосредственно в лимфатический узел. В равной мере предпочтительном варианте CpG-содержащие связанные с аналогом пептида Melan-A или свободные VLP применяют местно вблизи опухоли или локального резервуара вирусной инфекции, против которой хотят провести вакцинацию.
Должно быть понятно, что и приведенное выше общее описание, и следующее подробное описание являются только примерными и поясняющими и предназначены для дополнительного разъяснения заявленного изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ/ФИГУР
На фигуре 1 показан анализ в SDS-ПААГ VLP Qb-Melan-A. Пептиды Melan-A связывали с VLP Qb, как описано в примере 20. Конечные продукты смешивали с буфером для образцов и разделяли в восстанавливающих условиях в 16% гелях Novex® с трис-глицином в течение 1,5 часа при 125 В. Разделенные белки красили, вымачивая гель в растворе Кумасси синего. Фоновое окрашивание удаляли промывкой геля в 50% метаноле, 8% уксусной кислоте. Маркер молекулярной массы (P 77085, New England BioLabs, Beverly, USA) использовали в качестве эталона скорости миграции Qb-Melan-A (дорожка 1). 14 мкг либо Qb отдельно (дорожка 2), либо Qb, дериватизованного SMPH (дорожка 3) наносили для сравнения с 8 мкг каждого конечного продукта: Qb-Melan-A 16-35 (дорожка 4), Qb-Melan-A 16-35 A/L (дорожка 5), Qb-Melan-A 26-35 (дорожка 6) и Qb-Melan-A 26-35 A/L (дорожка 7).
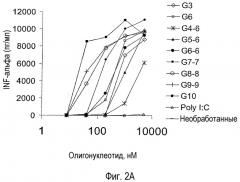
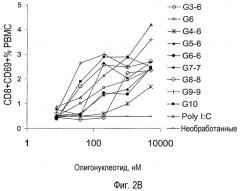
На фигуре 2A показан IFN-альфа, высвобождаемый в надосадки ISS-обработанных PBMC человека. PBMC получали из лейкоцитарной пленки и инкубировали с пятикратным разведением указанного ISS в течение 18 час. Обозначение G10 используют для олигонуклеотида G10-PO, а обозначение G3 используют для олигонуклеотида G3-6. Собирали надосадки и измеряли IFN-альфа в ELISA, используя набор антител, поставляемый PBL Biomedical Laboratories.
На фигуре 2B показана повышающая регуляция CD69 на PBMC CD8+ человека, обработанных ISS. PBMC получали из лейкоцитарной пленки и инкубировали с пятикратным разведением указанного ISS в течение 18 час. Клетки промывали и инкубировали с анти-CD8-ФИТЦ, анти-CD19-PE и анти-CD69-APC (все из BD PharMingen) в течение 20 мин на льду. После промывки клетки анализировали на приборе FACS Calibur, используя компьютерную программу CellQuest.
На фигуре 3 показаны титры вируса после иммунизации мышей Qbx33, упакованным с поли(I:C), G3-6 или G6. Мышей C57Bl6 иммунизировали посредством инъекции либо 100 мкг Qbx33, 100 мкг Qb VLP, упакованных с поли(I:C) и связанных с p33 (Qb-pIC-33, также называемые QbxZnxполиICxp33GGC), 90 мкг Qbx33, упакованных с G3-6 (Qbx33/G3-6), либо 90 мкг Qbx33, упакованных с G6 (Qbx33/G6). Через восемь дней мышей контрольно заражали 1,5×106 бляшкообразующих единиц вируса вакцинии, несущего эпитоп LCMV-p33. Спустя пять дней мышей забивали и собирали яичники. Готовили суспензию отдельных клеток из яичников и добавляли к клеткам BCS40 в серийных разведениях. Спустя один день слой клеток красили раствором, содержащим 50% этанол, 2% формальдегид, 0,8% NaCl и 0,5% кристаллический фиолетовый) и подсчитывали вирусные бляшки.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Если не оговорено особо, все технические и научные термины, используемые в данном описании, имеют такое же значение, которое обычно понимается специалистом в данной области, к которой относится данное изобретение. Хотя на практике или при проверке настоящего изобретения можно использовать любые способы и вещества, сходные или эквивалентные описанным в данной заявке, предпочтительном способы и вещества описаны далее.
1. Определения
Аминокислотный линкер: «аминокислотный линкер» или также называемый в данном описании просто «линкер» в используемом смысле либо связан с антигеном или антигенной детерминантой со вторым сайтом связывания или более предпочтительно уже включает в себя или содержит второй сайт связывания, обычно, но не обязательно - в виде одного аминокислотного остатка, предпочтительно остатка цистеина. Однако термин «аминокислотный линкер» в используемом в данном описании смысле не предполагает, что такой аминокислотный линкер состоит исключительно из аминокислотных остатков, хотя аминокислотный линкер, состоящий из аминокислотных остатков, является предпочтительным вариантом настоящего изобретение. Аминокислотные остатки аминокислотного линкера предпочтительно состоят из встречающихся в природе аминокислот или неприродных аминокислот, известных в данной области, всех L или всех D или их смесей. Однако аминокислотный линкер, содержащий молекулу с сульфгидрильной группой или остаток цистеина, также входит в объем изобретения. Такая молекула предпочтительно содержит остаток C1-C6-алкила-, циклоалкила (C5, C6), арила или гетероарила. Однако кроме аминокислотного линкера линкер, содержащий предпочтительно остаток C1-C6-алкила-, циклоалкила- (C5, C6), арила- или гетероарила- и лишенной какой-либо аминокислоты (аминокислот), также включен в объем изобретения. Связь между антигеном или антигенной детерминантой или необязательно вторым сайтом связывания и аминокислотным линкером предпочтительно осуществляется посредством по меньшей мере одной ковалентной связи, более предпочтительно посредством по меньшей мере одной пептидной связи.
Животное: В используемом в данном описании смысле имеется в виду, что термин «животное» включает, например, человека, овец, лошадей, коров, свиней, собак, кошек, крыс, мышей, млекопитающих, птиц, рептилий, рыб, насекомых и паукообразных.
Антитело: В используемом в данном описании смысле термин «антитело» относится к молекулам, которые способны связывать эпитоп или антигенную детерминанту. Подразумевается, что термин включает целые антитела и их антигенсвязывающие фрагменты, включая одноцепочечные антитела. Наиболее предпочтительно антитела являются антигенсвязывающими фрагментами антител человека и включают, но не ограничены указанным, Fab, Fab' и F(ab')2, Fd, одноцепочечные Fv (scFv), одноцепочечные антитела, связанные дисульфидными связями Fv (sdFv) и фрагменты, содержащие либо VL- либо VH-домен. Антитела могут быть из любого животного источника, включая птиц и млекопитающих. Предпочтительно антитела являются антителами человека, мыши, кролика, козы, морской свинки, верблюда, лошади или цыпленка. В используемом в данном описании смысле «человеческие» антитела включают антитела, имеющие аминокислотную последовательность иммуноглобулина человека, и включают антитела, выделенные из библиотек иммуноглобулинов человека или из животных, трансгенных по одному или нескольким иммуноглобулинам человека и которые не экспрессируют эндогенных иммуноглобулинов, которые, например, описаны в патенте США No. 5939598 Kucherlapati et al.
Антиген: В используемом в данном описании смысле термин «антиген» относится к молекуле, которая может быть связана антителом или рецептором T-клетки (TCR), если она презентирована молекулами MHC. Термин «антиген» в используемом в данном описании смысле также охватывает T-клеточные эпитопы. Антиген, кроме того, может узнаваться иммунной системой и/или способен индуцировать гуморальный иммунный ответ и/или клеточный иммунный ответ, приводящий к активации B- и/или T-лимфоцитов. Однако может требоваться, чтобы по меньшей мере в некоторых случаях антиген содержал или был связан с эпитопом, узнаваемым T-хелперными клетками (Th-клеточный эпитоп), и вводился в адъюванте. Антиген может иметь один или несколько эпитопов (B- и T-эпитопы). Специфичная реакция, указанная выше, предназначена для указания того, что антиген предпочтительно будет взаимодействовать, обычно высокоизбирательно, с соответствующим ему антителом или TCR и не будет взаимодействовать с множеством других антител или TCR, которые могут быть вызваны другими антигенами. Антигены в используемом в данном описании смысле также могут представлять собой смеси нескольких отдельных антигенов.
«Опухолевой антиген» в используемом в данном описании смысле является соединением, таким как пептид, связанным с опухолью или злокачественной опухолью и который способен вызывать иммунный ответ. В частности, соединение способно вызывать иммунный ответ, когда презентировано в контексте молекулы MHC. Опухолевые антигены могут быть получены из клеток злокачественной опухоли либо посредством получения неочищенных экстрактов клеток злокачественной опухоли, например, как описано в Cohen, et al., Cancer Research, 54: 1055 (1994), путем частичной очистки антигенов, рекомбинантной технологией или посредством синтеза de novo известных антигенов. К опухолевым антигенам относятся антигены, которые представляют собой антигенные части или целые полипептиды опухоли или злокачественной опухоли. Такие антигены могут быть выделены или получены рекомбинантно или любыми другими способами, известными в данной области. Злокачественные опухоли и опухоли включают, но не ограничены указанным, рак желчных путей; рак головного мозга; рак молочной железы; рак шейки матки; хориокарциному; рак ободочной кишки; эндометриальный рак; рак пищевода; рак желудка; интраэпителиальные неоплазмы; лимфомы; рак печени; рак легкого (например, мелкоклеточный и немелкоклеточный); меланома; нейробластомы; рак ротовой полости; рак яичника; рак поджелудочной железы; рак простаты; ректальный рак; саркомы; рак кожи; рак семенников; рак щитовидной железы и рак почки, а также другие карциномы и саркомы.
Антигенная детерминанта: В используемом в данном описании смысле подразумевается, что термин «антигенная детерминанта» относится к такой части антигена, которая специфично узнается либо B-, либо T-лимфоцитами. B-лимфоциты отвечают на чужеродные антигенные детерминанты продукцией антител, тогда как T-лимфоциты являются медиаторами клеточного иммунитета. Таким образом, антигенные детерминанты или эпитопы являются такими частями антигена, которые узнаются антителами или в контексте MHC рецепторами T-клеток.
Антигенпрезентирующая клетка: В используемом в данном описании смысле подразумевается, что термин «антигенпрезентирующая клетка» относится к гетерогенной популяции лейкоцитов и клеток, полученных из костного мозга, которые обладают иммуностимулирующей способностью. Например, указанные клетки, к созданию пептидов, связанных с молекулами MHC, которые могут узнаваться T-клетками. Термин является синонимом термина «вспомогательная клетка» и включает, например, клетки Лангерганса, интердигитальные клетки, B-клетки, макрофаги и дендритные клетки. В некоторых условиях эпителиальные клетки, эндотелиальные клетки и другие клетки, не происходящие из костного мозга, также могут служить в качестве антигенпрезентирующих клеток.
Ассоциация: В используемом в данном описании смысле термин «ассоциация» в применении к первому и второму сайтам связывания относится к связыванию первого и второго сайтов связывания, которое предпочтительно осуществляется посредством по меньшей мере одной непептидной связи. Природа ассоциации может быть ковалентной, ионной, гидрофобной, полярной или любой их комбинации, предпочтительно природа ассоциации является ковалентной, и снова более предпочтительно связывание осуществляется по меньшей мере посредством одной, предпочтительно одной непептидной связи. В используемом в данном описании смысле термин «ассоциация» в применении к первому и второму сайтам связывания охватывает не только прямое связывание или ассоциацию первого и второго сайта связывания, образующую композиции согласно изобретению, но также альтернативно и предпочтительно непрямую ассоциацию или связывание первого и второго сайта связывания, приводящее к композициям согласно изобретению, и при этом обычно и предпочтительно с использованием гетеробифункционального перекрестно-связывающего линкера.
Сайт связывания, первый: В используемом в данном описании смысле фраза «первый сайт связывания» относится к элементу неприродного или природного происхождения, обычно и предпочтительно входящему в вирусоподобную частицу, с которым может связываться второй сайт связывания обычно и предпочтительно входящий в аналог пептида Melan-A согласно изобретению. Первый сайт связывания может представлять собой белок, полипептид, аминокислоту, пептид, сахар, полинуклеотид, природный или синтетический полимер, вторичный метаболит или соединение (биотин, флуоресцеин, ретинол, дигоксигенин, ионы металлов, фенилметилсульфонилфторид) или их комбинации, или их химически активную группу. Первый сайт связывания обычно и предпочтительно локализован на поверхности вирусоподобной частицы. Множество первых сайтов связывания присутствуют на поверхности вирусоподобной частицы обычно в повторяющейся конфигурации. Предпочтительно первым сайтом связывания является аминокислота или ее химически активная группа.
Сайт связывания, второй: В используемом в данном описании смысле фраза «второй сайт связывания» относится к элементу ассоциированному, обычно и предпочтительно входящему в аналог пептида Melan-A согласно изобретению, который может связываться с первым сайтом связывания, локализованным на поверхности вирусоподобной частицы. Второй сайт связывания аналога пептида Melan-A согласно изобретению может представлять собой белок, полипептид, пептид, сахар, полинуклеотид, природный или синтетический полимер, вторичный метаболит или соединение (биотин, флуоресцеин, ретинол, дигоксигенин, ионы металлов, фенилметилсульфонилфторид) или их комбинацию, или их химически активную группу. По меньшей мере один второй сайт связывания присутствует на аналоге пептида Melan-A согласно изобретению. Термин «аналог пептида Melan-A» по меньшей мере с одним вторым сайтом связывания» относится к антигену или антигенной конструкции, содержащей по меньшей мере аналог пептида Melan-A согласно изобретению и второй сайт связывания. Однако, в частности, в случае второго сайта связывания, который имеет неприродное происхождение, например искусственно возникшего в аналоге пептида Melan-A согласно изобретению, указанные антиген или антигенные конструкции содержат «аминокислотный линкер».
Связанный: В используемом в данном описании смысле термин «связанный» относится к связыванию, которое может быть ковалентным, например, посредством химического связывания, или нековалентным, например ионные взаимодействия, гидрофобные взаимодействия, водородные связи и т.д.. Ковалентными связями могут быть, например, сложноэфирные, простые эфирные, фосфоэфирные, амидные, пептидные, имидные связи, связи углерод-сера, связи углерод-фосфор и тому подобные. Термин «связанный» является более широким и включает в себя такие термины как «соединенный», «слитый», «ассоциированный» и «присоединенный». Кроме того, по отношению к иммуностимулирующему веществу, связанному с вирусоподобной частицей, термин «связанный» также включает в себя заключение иммуностимулирующего вещества внутрь или его частичное заключение внутрь. Таким образом, по отношению к иммуностимулирующему веществу, связанному с вирусоподобной частицей, термин «связанный» является более широким и включает в себя такие термины, как «соединенный», «слитый», «заключенный», «упакованный» или «присоединенный». Например, иммуностимулирующее вещество, такое как неметилированный CpG-содержащий олигонуклеотид, может быть заключено в VLP без наличия действительного связывания, как ковалентного, так и нековалентного.
Белок(ки) оболочки: В используемом в данном описании смысле термин «белок(ки) оболочки»" относится к белку(кам) бактериофага или РНК-фага, который может быть включен в сборку капсида бактериофага или РНК-фага. Однако по отношению к специфичному генному продукту гена белка оболочки РНК-фагов используют термин «CP». Например, специфичный генный продукт гена белка оболочки РНК-фага Qβ называют «CP Qβ», в то время как «белки оболочки» бактериофага Qβ содержат «CP Qβ», а также белок A1. Капсид бактериофага Qβ, главным образом, содержит CP Qβ с минорным содержанием белка A1. Подобным образом белок оболочки VLP Qβ содержит, главным образом, CP Qβ с минорным содержанием белка A1.
Соединенный: В используемом в данном описании смысле термин «соединенный» относится к связыванию ковалентными связями или нековалентными взаимодействиями. Что касается соединения антигена с вирусоподобной частицей, термин «соединенный» предпочтительно относится к связыванию ковалентными связями. Кроме того, в отношении соединения антигена с вирусоподобной частицей термин «соединенный» предпочтительно относится к ассоциации и связыванию соответственно по меньшей мере одной пептидной связью. Любой способ, обычно используемый специалистами в данной области для соединения биологически активных веществ, можно использовать в данном изобретении.
Слияние: В используемом в данном описании смысле термин «слияние» относится к комбинации аминокислотных последовательностей разного происхождения в одной полипептидной цепи посредством комбинирования в рамке их кодирующих нуклеотидных последовательностей. Термин «слияние» особо охватывает внутренние слияния, т.е. инсерцию последовательностей другого происхождения в полипептидную цепь, кроме слиянии с одним из его концов.
CpG: В используемом в данном описании смысле термин «CpG» относится к олигонуклеотиду, который содержит по меньшей мере одну неметилированную последовательность динуклеотидов цитозин-гуанин (например, «CpG-ДНК» или ДНК, содержащая цитозин, за которым следует гуанозин, и связан фосфатной связью) и стимулирует/активирует, например, оказывает митогенное действие или индуцирует или увеличивает экспрессию цитокинов клеткой позвоночного. Например, CpG могут быть применимы для активации B-клеток, NK-клеток и антигенпрезентирующих клеток, таких как моноциты, дендритные клетки и макрофаги и T-клетки. CpG могут включать аналоги нуклеотидов, такие как аналоги, содержащие фосфотиоэфирные связи, и могут быть двунитевыми или однонитевыми. Как правило, двунитевые молекулы являются более стабильными in vivo, в то время как однонитевые молекулы обладают повышенной иммунной активностью.
Эпитоп: В используемом в данном описании смысле термин «эпитоп» относится к частям полипептида, обладающим антигенной или иммуногенной активностью у животного, предпочтительно млекопитающего и наиболее предпочтительно у человека. «Иммуногенный эпитоп» в используемом в данном описании смысле определяют как часть полипептида, которая вызывает гуморальный ответ или индуцирует T-клеточный ответ у животного, который определяют любым способом, известным в данной области (смотри, например, Geysen et al., Proc. Natl. Acad. Sci. USA 81: 3998 4002 (1983)). Термин «антигенный эпитоп» в используемом в данном описании смысле определяют как часть белка, в которой антитело может иммуноспецифично связывать свой антиген, которую определяют любым способом, хорошо известным в данной области. Иммуноспецифичное связывание исключает неспецифичное связывание, но не обязательно исключает перекрестную реактивность с другими антигенами. Антигенные эпитопы не обязательно должны быть иммуногенными. Антигенные эпитопы также могут быть T-клеточными эпитопами, и в данном случае они могут иммуноспецифично связываться рецептором T-клеток в контексте молекулы MHC.
Эпитоп может содержать 3 аминокислоты в пространственной конформации, которая является уникальной для эпитопа. Как правило, эпитоп состоит по меньшей мере примерно из 5 таких аминокислот, и более обычно состоит по меньшей мере примерно из 8-10 таких аминокислот. Если эпитоп является органической молекулой, он может быть таким небольшим, как нитрофенил. Предпочтительными эпитопами являются аналоги пептида Melan-A согласно изобретению.
Иммунный ответ: В используемом в данном описании смысле термин «иммунный ответ» относится к гуморальному иммунному ответу и/или клеточному иммунному ответу, приводящему к активации или пролиферации B- и/или T-лимфоцитов. Однако в некоторых случаях иммунные ответы могут быть низкой интенсивности и становятся выявляемыми только при использовании по меньшей мере одного вещества согласно изобретению. «Иммуногенный» относится к агенту, используемому для стимуляции иммунной системы живого организма, для того чтобы одна или несколько функций иммунной системы были повышены и направлены по отношению к иммуногенному агенту. «Иммуногенный полипептид» представляет собой полипептид, который вызывает клеточный и/или гуморальный иммунный ответ либо отдельно, либо будучи связанным с носителем в присутствии в или отсутствие адъюванта.
Иммунизация: В используемом в данном описании смысле термины «иммунизировать» или «иммунизация» или родственные термины относятся к приданию способности формировать значительный иммунный ответ (включая гуморальный и клеточный иммунитет, такой как эффекторные CTL) против антигена или эпитопа, являющегося мишенью. Указанные термины не требуют, чтобы был создан полный иммунитет, а чтобы был создан иммунный ответ, который существенно выше, чем исходный уровень. Например, млекопитающее можно считать иммунизированным против антигена-мишени, если клеточный и/или гуморальный иммунный ответ на антиген-мишень возникает после применения способов согласно изобретению.
Иммуностимулирующая нуклеиновая кислота: В используемом в данном описании смысле термин иммуностимулирующая нуклеиновая кислота относится к нуклеиновой кислоте, способной индуцировать и/или усиливать иммунный ответ. Иммуностимулирующие нуклеиновые кислоты в используемом в данном описании смысле включают рибонуклеиновые кислоты и особенно дезоксирибонуклеиновые кислоты. Предпочтительно иммуностимулирующие нуклеиновые кислоты содержат по меньшей мере один мотив CpG, например CG-динуклеотид, в котором C неметилирован. Динуклеотид CG может быть частью палиндромной последовательности или может входить в непалиндромную последовательность. Иммуностимулирующие нуклеиновые кислоты, не содержащие мотивов CpG, которые описаны выше, охватывают в качестве примера нуклеиновые кислоты, не имеющие динуклеотидов CpG, а также нуклеиновые кисло