Вакцинная композиция против вируса гепатита с
Иллюстрации
Показать всеИзобретение относится к области вирусологии. Вакцинная композиция для лечения и профилактики гепатита С содержит в качестве компонентов структурные белки вируса гепатита С в определенных соотношениях. Композиция обладает усиливающим действием в развитии иммунного ответа против вируса гепатита С. Также описаны комбинированные вакцины против патогенных организмов, включающие эту вакцинную композицию. Изобретение может быть использовано в медицине. 3 н. и 7 з.п. ф-лы, 36 ил., 5 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области иммунологии, в частности к вакцинной антигенной композиции, способной вызывать мощный и смешанный иммунный ответ против вируса гепатита С (HCV), и к комбинированным вакцинам против патогенных организмов, включающим эту вакцинную композицию.
Предпосылки к созданию изобретения
Созданию эффективной вакцины против HCV препятствовали различные проблемы, поскольку, являясь РНК-содержащим вирусом, этот вирус может быстро мутировать при адаптации к окружающей среде. Это вносит свой вклад в высокое разнообразие последовательностей множества вирусных изолятов, идентифицированных по всему миру. Значительная гетерогенность сосредоточена в гипервариабельном участке, заключенном в белке Е2 HCV, определенно включающем в себя нейтрализующий эпитоп (Bukh et al. US 6,110,465). Несмотря на наличие активной иммунной реакции, HCV вызывает персистентные инфекции у иммунокомпетентных индивидуумов. (Lechmann et al. (2000) Vaccine development for hepatitis C. Semin Liver Dis. 20:211-226). Не существует эффективной модели на животных или клеточной культуральной системы in vitro для поддержания репликации HCV и определения наличия нейтрализующих антител. Иммунологические модели, имеющие отношение к развитию заболевания или защитной реакции, не были определены полностью. Вероятно для избавления от HCV инфекции необходимы сильные, мультиспецифичные, долговременные как гуморальные, так и клеточные иммунные реакции (Lechmann et al. (2000) Vaccine development for hepatitis C. Semin Liver Dis. 20:211-226).
Для разработки вакцины против HCV было использовано несколько подходов, среди которых были всесторонне апробированы рекомбинантные белки, синтетические пептиды, вирусоподобные частицы, депротеинизированная ДНК и рекомбинантный вирус (Depla et al. US 6635257; Liang et al. US 6387662; Pachuk et al. US 6235888; Berzofsky et al. US 6685944).
Одной из первых стратегий, апробированных для HCV, была разработка вакцины на основе белковых субъединиц (Min et al. US 5985609), поскольку антитела к белкам оболочки могут обеспечивать защиту от некоторых флавивирусов. Некоторые стратегии, основанные на структурных антигенах HCV, вызывали ограниченную защиту против вируса в моделях на животных. Например, в случае с шимпанзе, иммунизированными олигомером E1 и E2, были вакцинированы семь шимпанзе, у 5 из 7 была защитная реакция, а 2 заболели, но выздоровление наступило до достижения хронической фазы (Choo et al. (1994) Vaccination of chimpanzees against infection by hepatitis C virus. PNAS USA, 91:1294-98). Такая защитная реакция коррелировала с наличием антител (Ат), способных ингибировать связывание E2 с клетками человека (Rosa et al. (1996) A quantitative test to estimate neutralizing antibodies to the hepatitis C virus: Cytofluorimetric assessment of envelope glycoprotein 2 binding to target cells. PNAS USA, 93:1759-63).
Рекомбинантный белок E1 из генотипа изолята 1b был очищен в виде гомодимеров, объединенных в частицы размером приблизительно 9 нм (Maertens et al. (2000) Improvement of chronic active hepatitis C in chronically infected chimpanzees after therapeutic vaccination with the HCV E1 protein. Acta Gastroenterol Belg. 63:203). Два шимпанзе, хронически инфицированных HCV, получали 9 доз по 50 мкг рекомбинантного белка E1. Вакцинация улучшала гистологическую картину печени, было установлено исчезновение вирусных антигенов в печени и снижение уровней аланинаминотрансферазы (ALT). Хотя уровни ARN в сыворотке не изменялись в течение лечения, после завершения лечения вновь появилось воспаление ткани печени и вирусные антигены. Наблюдалась корреляция между высоким уровнем антител к E1 и улучшением течения заболевания (Maertens et al. (2000) Improvement of chronic active hepatitis C in chronically infected chimpanzees after therapeutic vaccination with the HCV E1 protein. Acta Gastroenterol. Belg. 63:203).
Очень эффективным является получение вирусоподобных частиц из рекомбинантных белков и их использование в качестве вакцин, поскольку эти структуры зачастую имитируют свойства вируса (Liang et al. US 6,387,662). Частицы такой природы, полученные из клеток насекомых, инфицированных рекомбинантным бакуловирусом, несущим последовательность структурных антигенов HCV, обладали способностью вызывать гуморальный и клеточный иммунный ответ на такие антигены (Baumert et al. (1999) Hepatitis C virus-like particles synthesized in insect cells as a potential vaccine candidate. Gastroenterology 117:1397-407; Lechmann et al. (1999) Induction of humoral and cellular immune responses in mice by immunization with insect-cell derived HCV-like particles. Hepatology 30:423-29).
С другой стороны, для разработки рекомбинантной вакцины против HCV было апробировано несколько рекомбинантных вирусных векторов. В частности, интересными кандидатами являются рекомбинантные дефектные аденовирусы, благодаря их гепатотропизму, потенциальной возможности индуцировать гуморальный и клеточный иммунитет, а также возможности введения парентеральным и пероральным путем. Рекомбинантный аденовирус, содержащий гены, кодирующие структурные белки HCV, индуцирует антительный ответ на эти белки (Makimura et al. (1996). Induction of antibodies against structural proteins of hepatitis C virus in mice using recombinant adenovirus. Vaccine 14:28-36). Кроме того, после иммунизации мышей рекомбинантным аденовирусом, содержащим ядерный и E1 антиген, на эти антигены определялся T-цитотоксический специфический ответ (Bruna-Romero et al. (1997) Induction of cytotoxic T-cell response against hepatitis C virus structural antigens using a defective recombinant adenovirus. Hepatology 25:470-77). Хотя эти результаты были обнадеживающими, недавние проблемы, касающиеся применения рекомбинантных аденовирусов в генной терапии, подняли несколько вопросов в отношении их применения у людей. При использовании других рекомбинантных вирусов, подобных вирусу осповакцины, несущих различные гены HCV, у мышей индуцировался сильный Т-цитотоксический и хелперный ответ (Shirai et al. (1994) An epitope in hepatitis C virus core region recognized by cytotoxic T cells in mice and humans. J. Virol. 68:3334-42; Large et al. (1999) Suppression of host immune response by the core protein of hepatitis C virus: possible implications for hepatitis C virus persistence. J. Immunol. 162:931-38). Тем не менее, на применение этих рекомбинантных вирусов, а также других вариантов альфа вирусов, подобных вирусу леса Семлики, влияют нормативно-правовые вопросы и вопросы безопасности, связанные с их применением (Vidalin et al. (2000) Use of conventional or replicating nucleic acid-based vaccines and recombinant Semliki forest virus-derived particles for the induction of immune responses against hepatitis C virus core and E2 antigens. Vaccine 276:259-270).
Идентификация некоторых эпитопов для T CD4+ и CD8+ в вирусном полипротеине HCV, которые могут быть важны для распознавания вируса, поддерживает стратегию использования синтетических пептидов в качестве вакцин-кандидатов против этого патогена (Berzofsky et al. US 5980899). Различные пептиды в чистом виде или липидированные, содержащие эпитопы ядерных, NS4 и NS5 белков HCV, индуцировали мощный Т цитотоксический ответ у мышей (Shirai et al. (1996) Use of intrinsic and extrinsic helper epitopes for in vivo induction of anti-hepatitis C virus cytotoxic T lymphocytes (CTL) with CTL epitope peptide vaccines. J. Infect. Dis. 173:24-31; Hiranuma et al. (1999) Helper T cell determinant peptide contributes to induction of cellular immune responses by peptide vaccines against hepatitis C virus. J. Gen. Virol. 80:187-193; Oseroff et al. (1998) Pools of lipidated HTL-CTL constructs prime for multiple HBV and HCV CTL epitope responses. Vaccine, 16:823-833).
Другая стратегия, используемая для разработки вакцины против HCV, основана на возможности образования антител к линейным эпитопам. Эта альтернатива была опробована главным образом в отношении образования антител к гипервариабельному участку 1 HCV (HVR-1) у кроликов и шимпанзе с некоторыми обнадеживающими результатами (Esumi et al. (1999) Experimental vaccine activities of recombinant E1 and E2 glycoproteins and hypervariable region 1 peptides of hepatitis C virus in chimpanzees. Arch Virol. 144:973-980; Shang et al. (1999) Broadly cross-reactive, high-affinity antibody to hypervariable region 1 of the hepatitis C virus in rabbits. Virology 258:396-405). Основной проблемой выбора HVR в качестве мишени для HCV вакцины является существование псевдовидов в этом участке генома.
Основным препятствием для концепции пептидных вакцин является то, что эти пептиды без хелперной функции могут быть низкоиммуногенными, и очень часто эффективность этой вакцины основана на индукции мультивалентного ответа с очень широким спектром в отношении различных антигенов. Эти ограничения являются недостатками этой стратегии.
Для разработки вакцины против HCV широко изучалась ДНК-иммунизация (Donnelly et al. US 6653125). Белок ядра включали в несколько векторов экспрессии, используя полную длину или усеченные варианты этого белка (Lagging et al. (1995) Immune responses to plasmid DNA encoding the hepatitis C virus core protein. J. Virol. 69:5859-5863; Chen et al. (1995) Genetic immunization of mice with plasmid containing hepatitis C virus core protein-encoding DNA. Vaccine Res. 4:135-144).
Другие генетические конструкции включали также 5ґ нетранслируемую область (Tokushige et al. (1996) Expression and immune response to hepatitis C virus core DNA-based vaccine constructs. Hepatology 24:14-20). Также были изучены слитые варианты в отношении поверхностного антигена HB и других вирусов (Major et al. (1995) DNA-based immunization with chimeric vectors for the induction of the immune responses against the hepatitis C virus nucleocapsid. J. Virol. 69:5798-805). Иммунизация этими векторами главным образом индуцировала заметные лимфопролиферативные и Т-клеточные цитотоксические реакции.
Для этого типа технологии белки оболочки HCV также представляли интересный объект исследования. В случае E2, гуморальный иммунный ответ, по-видимому, направлен на HVR-1 (Lee et al. (1998) Hepatitis C virus envelope DNA-based immunization elicits humoral and cellular immune responses. Mol. Cells 8:444-451). При проведении иммунизации векторами для секретируемых вариантов белков E1 и E2 никаких отличий в иммунном ответе по сравнению с несекретируемыми вариантами обнаружено не было (Lee et al. (1998) Optimal induction of hepatitis C virus envelope-specific immunity by bicictronic plasmid DNA inoculation with the granulocyte-macrophage colony-stimulating factor gene. J. Virol. 72:8430-8436). Заражение бицистронными плазмидами, экспрессирующими независимо гены, кодирующие GM-CSF, белки E1 и E2, вызывает и наращивает гуморальный и клеточный иммунный ответ. В последнее время иммуногенное действие этих белков было изучено при включении обоих в бицистронные векторы, где возможность образования гетеродимера in vivo была активизирована или исключена. Утверждалось, что при образовании таких комплексов антительный ответ не наблюдался. В полной противоположности с этим высокие титры антител к конформационным и линейным детерминантам вырабатывались при иммунизации животных плазмидами, экспрессирующими усеченные формы этих двух структурных белков. Следовательно, по-видимому, для получения хорошего антительного ответа при проведении иммунизации и тем, и другим антигенами необходимо избегать образования гетеродимеров (Fournillier et al. (1999) Expression of noncovalent hepatitis C virus envelope E1-E2 complexes is not required for the induction of antibodies with neutralizing properties following DNA immunization. J. Virol. 73:497-504).
По этой методике также были апробированы неструктурные белки. Кодирующую область C-концевого домена белка NS3 включали в вектор, обеспечивающий либо одновременную, либо независимую экспрессию этого белка и IL-2, с получением хороших результатов (Papa et al. (1998) Development of multigenetic plasmid vector for HCV DNA immunization. Res. Virol. 149:315-319). Белки NS4 и NS5 вызывали Т-цитотоксический и антительный ответ аналогичным путем (Encke et al. (1998) Genetic immunization generates cellular and humoral immune responses against the nonstructural proteins of the hepatitis C virus in murine model. J. Immunol. 161:4917-4923).
В последнее время подтвердилось, что использование генной конструкции, кодирующей вирусные неструктурные белки (NS3, NS4 и NS5, включая ген, кодирующий GM-CSF) вызывало мощный антительный ответ, а также усиление Т-клеточного пролифиративного ответа в отношении каждого из неструктурных белков (Cho et al. (1999) Enhanced cellular immunity to hepatitis C virus nonstructural proteins by codelivery of granulocyte macrophage-colony stimulating factor gene in intramuscular DNA immunization. Vaccine 17:1136-1144).
В целом сообщалось об эффективной экспрессии, а также выработке антител к различным антигенам HCV после ДНК иммунизации. Уровни располагались в интервале от 1:100 до 1:100000 в соответствии с исследуемой комбинацией (Inchauspe et al. (1997) DNA vaccination for the induction of immune responses against hepatitis C virus proteins. Vaccine 15:853-856). Также подтвердилось усиление специфической цитотоксичности и лимфопролиферации (Inchauspe et al. (1997) Plasmid DNA expressing a secreted or a nonsecreted form of hepatitis comparative studies of antibody and T-helper responses following genetic immunization. DNA and Cell Biology 16:185-195). Однако необходимо усовершенствование этой методики для достижения достаточно мощного гуморального и клеточного иммунного ответа на различные белки HCV. В этом смысле были опробованы некоторые варианты для улучшения индуцированного иммунного ответа после ДНК вакцинации, поскольку в них используют липосомы в качестве адъювантов (Gramzinski et al. (1998) Immune response to a hepatitis B DNA vaccine in Aotus Monkey: A comparison of vaccine formulation, route and method of administration. Mol. Medicine 4:109-118), монофосфорил липид А и сапонин QS-21 (Sasaki et al. (1998) Induction of systemic and mucosal immune responses to human immunodeficieny virus type 1 by a DNA vaccine formulated with QS-21 saponin adjuvant via intramuscular and intranasal routes. J. Virol. 72:4931-4939). С другой стороны, в качестве биологического адъюванта при ДНК иммунизации были изучены дендритные клетки. Были использованы вакцины, которые составляют дендритные клетки, полученные из костного мозга мышей, генетически модифицированные ex vivo для экспрессии опухолевых антигенов с использованием вирусных векторов, и была доказана их способность стимулировать специфический Т-клеточный ответ и опосредованный клетками профилактический иммунитет против опухолей у мышей (Specht et al. (1997) Dendritic cells retrovirally transduced with a model antigen gene are therapeutically effective against established pulmonary metastases. J. Exp. Med. 186:1213-1221; Brossart et al. (1997) Virus-mediated delivery of antigenic epitopes into dendritic cells as a means to induce CTL. J. Immunol. 158:3270-3276; Song et al. (1997) Dendritic cells genetically modified with an adenovirus vector encoding the cDNA for a model antigen induce protective and therapeutic antitumor immunity. J. Exp. Med. 186:1247-1256), o ARN (Boczkowski et al. (1996) Dendritic cells pulsed with RNA are potent antigen-presenting cells in vitro and in vivo. J. Exp. Med. 184:465-472).
В настоящее время усовершенствование векторов, в том числе вставка CpG мотивов для усиления иммунного ответа в отношении экспрессируемых антигенов и систем для высвобождения из плазмиды являются ключевыми целями изучения путей преодоления ограничений этой технологии (Hasan et al. (1999) Nucleic acid inmunization: concepts and techniques associated with third generation vaccines. J. Immunol. Meth. 229:1-22).
В результате трудностей, создаваемых HCV, и отсутствия четких определений иммунологических параметров, которые коррелируют с защитным действием против этого патогена, возможно, что эффективная вакцина против HCV требовала многоаспектного подхода, который стимулирует различные проявления иммунной реакции. Возможно решение этой проблемы лежит в объединении нескольких подходов к созданию вакцин, изученных к настоящему времени. В этом смысле были опробованы схемы иммунизации, которые объединяют начальные дозы ДНК вакцины и ревакцинирующие дозы либо с белками, либо с рекомбинантными вирусными векторами, даже при положительных результатах которых требуются дополнительные исследования для демонстрации того, что объединение этих подходов могло вызывать защитный иммунитет против HCV (Hu et al. (1999) Characterization of the humoral and cellular immune responses against hepatitis C virus core induced by DNA-based immunization. Vaccine 17:3160-3170; Pancholi et al. (2000) DNA prime-canarypox boost with polycistronic hepatitis C virus (HCV) genes generates potent immune responses to HCV structural and nonstructural proteins. J. Infect. Dis. 182:18-27).
Кроме того, для модели гепатита В был опробован вакцинный препарат, который составлен комплексом поверхностного антигена вируса гепатита В с моноклональным антителом против HBsAg и плазмиды, кодирующей этот антиген (Wen et al. US 6,221,664). Эта композиция позволяла осуществлять презентацию антигена различными путями и быструю индукцию иммунного ответа, более высокую, чем при использовании отдельных активных компонентов. Таким образом, разработка эффективных вакцин является крайне необходимой и помимо заметного успеха все еще остается текущей проблемой.
В настоящем изобретении описан вакцинный препарат, который составляют структурные антигены вируса гепатита С. В отличие от предыдущих вакцинных препаратов на основе белка, в которых использовались только белки Е1 и Е2 (отдельно или в комбинации), в вакцинный препарат по данному изобретению также включен ядерный антиген HCV. Универсальность этой вакцинной композиции лежит в интервалах количества антигена, используемого в этом вакцинном препарате, что дополнительно позволяет вызывать мощные иммунные реакции (гуморальные и клеточные) на различные антигены одновременно, а также защитную реакцию на заражение рекомбинантным вирусом осповакцины в моделе на мышах.
Подробное описание изобретения
По литературным данным хорошо известно, что существует крайняя необходимость в разработке надежной и эффективной терапевтической вакцины против HCV. Таким образом, настоящее изобретение направлено на получение вакцинного препарата, составленного из смеси структурных антигенов вируса гепатита С. В этом случае ядерный белок, структурный белок E1 и структурный белок E2 обладают способностью индуцировать гуморальный и клеточный специфический иммунный ответ против HCV, в частности, (но не только) у пациентов, с хронической формой HCV.
Новизна изобретения заключается в получении интервала антигенных соотношений и защитного эффекта, достигаемого после иммунизации смесями по изобретению. Изучаемые антигены являются мишенями, представляющими особый интерес, с помощью которых можно вызвать иммунный ответ на HCV.
В конкретном варианте осуществления, в вакцинной композиции используют интервал соотношений для антигенов, присутствующих в смеси, и составленный из числа (1,5-2,5):(1-2,5):(1-2) для белка ядра, Е1 и Е2 соответственно для формирования оптимального гуморального иммунного ответа. В другом варианте осуществления антигены используют в соотношениях (1,5:1,1:1) для белка ядра Е1 и Е2 соответственно.
В одном варианте осуществления изобретения в вакцинной композиции используется интервал соотношений для антигенов, присутствующих в смеси, составляющий (1-50):(120-180):(120-180) для белка ядра, Е1 и Е2 соответственно для формирования оптимального клеточного иммунного ответа. В другом варианте осуществления белковые антигены используют в соотношении (1:160:160) для белка ядра, Е1 и Е2 соответственно.
Вакцинные препараты по настоящему изобретению можно вводить в виде твердого продукта, жидкого продукта или аэрозоля любым традиционным способом введения вакцин, в том числе перорально и путем парентеральной инъекции (т.е. внутривенно, подкожно или внутримышечно), кроме того, эта композиция может быть получена либо путем смешивания белковых антигенов до их усиления или усилением антигенов отдельно и последующего их смешивания.
Антигены по изобретению могут быть получены из природного источника или технологией рекомбинантных ДНК в любой экспрессионной системе, подобной описанной ниже.
В одном варианте осуществления настоящего изобретения вакцинные препараты, включенные в это изобретение, можно вводить по различным схемам иммунизации.
Аналогичным образом иммунизация этими антигенными комбинациями, смешанными с другими полисахаридными антигенами (конъюгированными или нет) и/или вирусными антигенами и/или бактериальными антигенами, формирует суммарный иммунный ответ, следовательно, в отношении широкого спектра инфекционных организмов.
В другом варианте осуществления настоящего изобретения вакцинная композиция включает комбинации структурных антигенов HCV с плазмидами, которые кодируют антигены инфекционных организмов, против вирусных и/или бактериальных заболеваний.
Предпочтительные вакцинные композиции по изобретению представляют собой препараты, в которых другие вирусные антигены, включенные в них, представляют собой ядерные и/или поверхностные антигены вируса гепатита В, протеолипосому из N. meningitidis или очищенные белки наружной мембраны N. meningitidis в качестве бактериальных антигенов, и аналогичные полисахаридные антигены, конъюгированные или неконъюгированные с белками-носителями. Они могут быть использованы в качестве активных компонентов в композициях против вирусных и бактериальных организмов.
Описанные здесь вакцинные композиции можно вводить по схемам, объединенным с другими кандидатными вакцинами на основе ДНК вакцины; живыми рекомбинантными векторами, пептидами и белками. Их также можно использовать для индукции иммунитета против HCV у больных хроническим гепатитом С с циррозом и раком печени.
Краткое описание чертежей
Фиг.1: гуморальный иммунный ответ на структурные белки HCV по данным ELISA; (A) против ядерного антигена HCV, (B) против белка E1, (C) против белка E2.
Фиг.2: лимфопролиферативный иммунный ответ на структурные белки HCV в клетках селезенки мышей, иммунизированных исследуемыми комбинациями. HCcAg, ядерный антиген HCV, E2-coli, E2, полученный и очищенный из Escherichia coli, E2-lev, E2, полученный и очищенный из дрожжей Pichia pastoris, E1-coli, E1, полученный и очищенный из Escherichia coli.
Фиг.3: Функциональный ответ изучаемых препаратов, оцениваемый после заражения рекомбинантным вирусом осповакцины.
Фиг.4: Анализ влияния компонентов, присутствующих в вакцинных препаратах против HCV, на (A) гуморальный иммунный ответ, (B) лимфопролиферативный иммунный ответ, (C) заражение рекомбинантным вирусом осповакцины.
Фиг.5: влияние на гуморальный иммунный ответ интервалов соотношений антигенов, используемых в вакцинных препаратах против HCV: (A) против ядерного антигена HCV, (B) против белка E1, (C) против белка E2.
Фиг.6: влияние интервала соотношений антигенов, используемых в вакцинных препаратах против HCV на лифопролиферативный иммунный ответ на структурные белки HCV в клетках селезенки иммунизированных мышей. HCcAg ядерный антиген HCV, E2-coli, E2, полученный и очищенный из Escherichia coli, E2-lev, E2, полученный и очищенный из дрожжей Pichia pastoris, E1-coli, E1, полученный и очищенный из Escherichia coli.
Фиг.7: влияние на функциональный ответ, определяемый у мышей на заражение рекомбинантным вирусом осповакцины, интервала соотношений антигенов, используемых в вакцинных препаратах против HCV.
Фиг.8: гуморальный иммунный ответ на структурные белки HCV по данным ELISA после иммунизации в различные промежутки времени (различные схемы иммунизации), (A) против ядерного антигена HCV, (B) против белка E1, (C) против белка E2.
Фиг.9: лимфопролиферативный иммунный ответ на структурные белки HCV в клетках селезенки мышей, иммунизированных в различные промежутки времени (различные схемы иммунизации), HCcAg, ядерный антиген HCV, E2-coli, E2, полученный и очищенный из Escherichia coli, E2-lev, E2, полученный и очищенный из дрожжей Pichia pastoris, E1-coli, E1, полученный и очищенный из Escherichia coli.
Фиг.10: функциональный ответ на заражение рекомбинантным вирусом осповакцины у мышей, иммунизированных в различные промежутки времени.
Фиг.11: гуморальный иммунный ответ на структурные белки HCV по данным ELISA, у мышей, иммунизированных вакцинными препаратами против HCV, введенными различными путями. (A) против ядерного антигена HCV, (B) против белка E1, (C) против белка E2.
Фиг.12: лимфопролиферативный иммунный ответ на структурные белки HCV в клетках селезенки мышей, иммунизированных вакцинными препаратами против HCV, введенными различными путями. HCcAg, ядерный антиген HCV, E2-coli, E2, полученный и очищенный из Escherichia coli, E2-lev, E2, полученный и очищенный из дрожжей Pichia pastoris, E1-coli, E1, полученный и очищенный из Escherichia coli.
Фиг.13: функциональный иммунный ответ, определяемый на заражение рекомбинантным вирусом осповакцины у мышей, иммунизированных вакцинными препаратами против HCV, введенными различными путями.
Фиг.14: гуморальный иммунный ответ на структурные белки HCV по данным ELISA, у мышей, иммунизированных вакцинными препаратами против HCV с использованием различных адъювантов. (A) против ядерного антигена HCV, (B) против белка E1, (C) против белка E2.
Фиг.15: влияние различных адъювантов на лимфопролиферативный иммунный ответ против структурных белков HCV в клетках селезенки иммунизированных мышей. HCcAg, ядерный антиген HCV, E2-coli, E2, полученный и очищенный из Escherichia coli, E2-lev, E2, полученный и очищенный из дрожжей Pichia pastoris, E1-coli, E1, полученный и очищенный из Escherichia coli.
Фиг.16: влияние различных адъювантов на функциональный иммунный ответ на заражение рекомбинантным вирусом осповакцины иммунизированных мышей.
Фиг.17: гуморальный иммунный ответ по данным ELISA после иммунизации мышей смесью вакцинного препарата против HCV и вирусных антигенов, (A) против ядерного антигена HCV, (B) против белка E1, (C) против белка E2, (D) против HBsAg и (E) против HBcAg.
Фиг.18: лимфопролиферативный иммунный ответ на структурные белки HCV (ядерный, E1, E2), HBsAg и HBcAg в клетках селезенках мышей, иммунизированных комбинациями вакцинного препарата против HCV и вирусных антигенов. HCcAg, ядерный антиген HCV, E2-coli, E2, полученный и очищенный из Escherichia coli, E2-lev, E2, полученный и очищенный из дрожжей Pichia pastoris, E1-coli, E1, полученный и очищенный из Escherichia coli.
Фиг.19: функциональный иммунный ответ на заражение рекомбинантным вирусом осповакцины у мышей, иммунизированных комбинациями вакцинного препарата против HCV и вирусных антигенов.
Фиг.20: гуморальный иммунный ответ по данным ELISA после иммунизации смесью вакцинного препарата против HCV и бактериальных антигенов (белок наружной мембраны N. meningitidis), (A) против ядерного антигена HCV, (B) против белка E1, (C) против белка E2 и (D) против белков наружной мембраны N. meningitidis.
Фиг.21: лимфопролиферативный иммунный ответ на структурные белки HCV (ядерный, E1, E2) и белки наружной мембраны N. meningitidis в клетках селезенки мышей, иммунизированных комбинациями вакцинного препарата против HCV и бактериальных антигенов (OMP, белки наружной мембраны N. meningitidis). HCcAg, ядерный антиген HCV, E2-coli, E2, полученный и очищенный из Escherichia coli, E2-lev, E2, полученный и очищенный из дрожжей Pichia pastoris, E1-coli, E1, полученный и очищенный из Escherichia coli.
Фиг.22: функциональный иммунный ответ на заражение рекомбинантным вирусом осповакцины у мышей, иммунизированных комбинациями вакцинного препарата против HCV и бактериальных антигенов (белки наружной мембраны N. meningitidis).
Фиг.23: гуморальный иммунный ответ по данным ELISA у мышей, иммунизированных смесью вакцинного препарата против HCV и конъюгированного полисахарида капсулы, (A) против ядерного антигена HCV, (B) против белка E1, (C) против белка E2 и (D) против полисахарида капсулы N. meningitidis серогруппы С.
Фиг.24: лимфопролиферативный иммунный ответ на структурные белки HCV (ядерный, E1, E2) в клетках селезенки мышей, иммунизированных смесью вакцинного препарата против HCV и конъюгированного полисахарида капсулы. HCcAg, ядерный антиген HCV, E2-coli, E2, полученный и очищенный из Escherichia coli, E2-lev, E2, полученный и очищенный из дрожжей Pichia pastoris, E1-coli, E1, полученный и очищенный из Escherichia coli.
Фиг.25: функциональный иммунный ответ на заражение рекомбинантным вирусом осповакцины у мышей, иммунизированных смесью вакцинного препарата против HCV и конъюгированного полисахарида капсулы.
Фиг.26: гуморальный иммунный ответ по данным ELISA после иммунизации смесью вакцинного препарата против HCV и плазмид, кодирующих HBsAg и HBcAg, (A) против ядерного антигена HCV, (B) против белка E1, (C) против белки E2, (D) против HBsAg, и (E) против HBcAg.
Фиг.27: лимфопролиферативный иммунный ответ на структурные белки HCV (ядерный, E1, E2), HBsAg и HBcAg, в клетках селезенки мышей, иммунизированных комбинациями вакцинного препарата HCV и плазмид, кодирующих HBsAg и HBcAg. HCcAg, ядерный антиген HCV, E2-coli, E2, полученный и очищенный из Escherichia coli, E2-lev, E2, полученный и очищенный из дрожжей Pichia pastoris, E1-coli, E1, полученный и очищенный из Escherichia coli.
Фиг.28: функциональный иммунный ответ на заражение рекомбинантным вирусом осповакцины у мышей, иммунизированных комбинациями вакцинного препарата против HCV и плазмид, кодирующих антигены HBsAg и HBcAg.
Фиг.29: гуморальный иммунный ответ по данным ELISA у мышей, иммунизированных комбинациями ДНК и ревакцинирующей дозы с вакцинным препаратом против HCV, (A) против ядерного антигена HCV, (B) против белка E1, (C) против белка E2.
Фиг.30: лимфопролиферативный иммунный ответ на структурные белки HCV (ядерный, E1, E2), в клетках селезенки мышей, иммунизированных комбинациями ДНК и ревакцинирующей дозы с вакцинным препаратом против HCV. HCcAg, белок ядра HCV, E2-coli, E2, полученный и очищенный из Escherichia coli, E2-lev, E2, полученный и очищенный из дрожжей Pichia pastoris, E1-coli, E1, полученный и очищенный из Escherichia coli.
Фиг.31: функциональный иммунный ответ на заражение рекомбинантным вирусом осповакцины у мышей, иммунизированных комбинациями ДНК и ревакцинирующей дозы с вакцинным препаратом против HCV.
Фиг.32: гуморальный иммунный ответ на структурные белки HCV (ядерный, E1, E2), у мышей, иммунизированных вакцинными препаратами против HCV, полученными разными способами.
Фиг.33: лимфопролиферативный иммунный ответ на структурные белки HCV (ядерный, E1, E2) в клетках селезенки мышей, иммунизированных вакцинным препаратом против HCV, полученным различными способами. HCcAg, ядерный антиген HCV, E2-coli, E2, полученный и очищенный из Escherichia coli, E2-lev, E2, полученный и очищенный из дрожжей Pichia pastoris, E1-coli, E1, полученный и очищенный из Escherichia coli.
Фиг.34: функциональный иммунный ответ на заражение рекомбинантным вирусом осповакцины у мышей, иммунизированных вакцинным препаратом против HCV, полученным различными способами.
Подробное описание способов осуществления/Примеры
Пример 1: гуморальный, лимфопролиферативный и функциональный ответ на заражение рекомбинантным вирусом осповакцины у мышей, иммунизированных белковым вакцинным препаратом против HCV
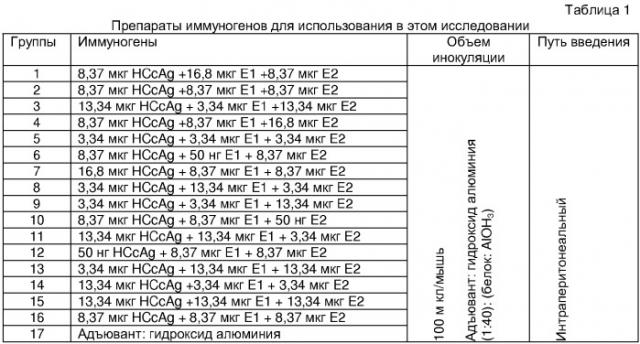
Для демонстрации формирования специфического и функционального иммунного ответа на HCV после введения вакцинного препарата самкам мышей BALB/c (группы из 10 животных) интраперитонеально вводили ядерный антиген HCV, E1 и E2 антигены после перемешивания и усиления гидроксидом алюминия. Схема иммунизации включала в себя 3 инокуляции в 0, 7, 14 дни. Гуморальный и клеточный (лимфопролиферативный ответ) иммунные ответы, а также защитную реакцию на заражение рекомбинантным вирусом осповакцины vvRE (который включал в себя структурные белки HCV) изучали через 15 дней после последней инокуляции. Группы этого исследования приведены в Таблице 1.
Гуморальный иммунный ответ на структурные белки HCV определяли с помощью иммуноферментного анализа (ELISA). Для статистического анализа результатов использовали однофакторный дисперсионный анализ Крускал-Валлиса и метод Данна в качестве повторной проверки. Результаты с p<0,05 считались статистически значимыми. На Фиг.1 показано, что возможно получить специфический гуморальный иммунный ответ на три структурных антигена HCV при их введении в определенных соотношениях. Некоторые комбинации давали высокие титры антител против белков HCV (ядерного, E1 и E2), и они были статистически выше, чем титры, полученные в контрольных группах, в которых мышей иммунизировали отдельными белками или одним адъювантом.
Было показано характерное изменение лимфопролиферативного ответа (Фиг.2) на структурные антигены HCV (ядерный, E1 и E2) для каждой комбинации. Эти данные впоследствии использовали для расчета оптимального варианта (соотношения антигенов) для формирования наилучшего иммунного ответа. Результаты представлены в виде индекса стимуляции клеток селезенки иммунизированных животных (рассчитан путем включения 3H-тимидина). Экспериментальные группы, представленные на Фиг.2, соответствуют группам, представленным в Таблице 1, также имеется отрицательный контроль (группа 17), который представляют мыши, иммунизированные только гидроксидом алюминия.
Функциональный иммунный ответ, вызываемый исследуемыми препаратами, оценивали после заражения vvRE. Животных заражали интраперитонеальным введением 106 бляшкообразующих единиц (pfu) vvRE через 15 дней после окончания проведения иммунизации, а присутствие вируса в яичниках мышей оценивали через 5 дней после инокуляции вируса. Полученные результаты представлены на Фиг.3, на которой в группе 13 показано 2-Log снижение титра вируса по сравнению с группой отрицательного контроля. Экспериментальные группы, представленные на Фиг.3, соответствовали группам, указанным в Таблице 1.
Проводя анализ поверхности отклика, полученного согласно функциональным свойствам используемых параметров (антительный ответ, лимфопролиферативный ответ и защитная реакция на заражение вирусом осповакцины (Фиг.4)), были рассчитаны наилучшие соотношения антигенов для получения оптимального ответа для каждого параметра. Для антительного ответа оптимальное используемое соотношение антигенов соответствует (1,5:1,1:1):(ядерный:E1:E2), тогда как для получения оптимального клеточного ответа наилучшее соотношение антигенов, используемое для иммунизации, составило (1:160:160):(ядерный:E1:E2).
Пример 2: Оценка иммунного ответа у мышей BALB/c после иммунизации препаратами белков HCV с различными интервалами соотношений антигенов
Для оценки интервала антигенов, используемых в вакцинных препаратах для получения хорошего иммунного ответа, мышей BALB/c иммунизировали внутрибрюшинно по той же схеме иммунизации, которая описана в примере 1. Соотношения антигенов HCV (ядерного, E1 и E2) приведены в Таблице 2. Количества антигена, используемого в этом исследовании, представляли собой результаты анализа поверхности отклика из примера 1. Для гуморального иммунного ответа исследуемые интервалы соотношений составили: (1,5-2.5):(1-2,5):(1-2):(ядерный:E1:E2), тогда как для клеточного иммунного ответа исследуемые интервалы соотношений составили: (1-50):(120-180):(120-180): (ядерный:E1:Е2).
Гуморальный иммунный ответ на структурные антигены HCV представлен на Фиг.5. Изучаемые соотношения вызывали специфический антительный ответ на антигены HCV (ядерный, Е1 и Е2). Не было обнаружено статистически значимых различий в гуморальном ответе, вызываемом различными вариантами (оптимальным вариантом для клеточного ответа и оптимальным вариантом для гуморального ответа) несмотря на изменения, наблюдаемые для каждого конкретного антигена. Экспериментальные группы, отмеченные на Фиг.5, соответствовали группам, указанным в Таблице 2.
Лимфопролиферативный ответ оценивали путем включения 3H-тимидина в клетки селезенки иммунизированных мышей после их стимуляции. У иммунизированных мышей формировался специфический лимфопролиферативный ответ на изучаемые антигены (Фиг.6). Группы, отмеченные на Фиг.6, соответствовали группам, указанным в Таблице 2, плюс другой отрицательный контроль (группа 17), который представляют неиммунизированные мыши. Между индексами стимуляции не наблюдалось статистически достоверных различий для каждого из изученных вариантов (оптимального варианта для клеточного ответа и оптимального варианта для гуморального ответа соответственно).
Иммунизированных мышей заражали внутрибрюшинным введением 106 pfu vvRE. Титр вируса оценивали в яичниках иммунизированных мышей через 5 дней после инокуляции вируса. На Фиг.7 показаны полученные защитные уровни. Снижение вирусной нагрузки было статистически значимым у мышей, иммунизированных смесями, по сравнению с отрицательным контролем, главным образом в тех группах, в которых животных иммунизировали оптимальным вариантом для формирования клеточного иммунного ответа (приблизительно 2,5-Log снижение титра вируса). Исследуемые группы, представленные на Фиг.7, соответствовали группам, указанным в Таблице 2, плюс дополнительный отрицательный контроль (группа 17), который представлен неиммунизированными мышами.
Пример 3: Оценка иммунного ответа, вызываемого у мышей BALB/c иммунизацией композициями белков HCV после использования различных схем иммунизации
Для анализа влияния времени между иммунизациями на формирование иммунного ответа самок мышей BALB/c иммунизировали внутрибрюшинно в различные интервалы времени вариантом вакцины для формирования оптимального клеточного ответа, как указано в примере 1. Группу 1 иммунизировали на 0, 1 и 2 неделях. Группу 2 иммунизировали на 0, 2 и 4 неделях. Группу 3 иммунизировали на 0, 3 и 6 неделях, тогда как группу 4 иммунизировали на 0, 4 и 8 неделях. Титры антител против ядерного белка HCV, белков E1 и E2 оценивали с помощью ELISA. Результаты представлены на Фиг.8. При оценке через 15 дней после последней иммунизации статистически достоверных различий в титрах антител против E1 и E2 не было. Статистически достоверные различия наблюдались в титрах антител против ядерного антигена между группой 1 (схема иммунизации на 0, 1, 2 неделе) и остальными группами при их сравнении.
Лимфопролиферативный ответ иммунизированных мышей оценивали через 15 дней после последней иммунизации. Аналогичным образом различия в индексах стимуляции между каждым из исследуемых вариантов не были статистически значимыми. Полученные результаты показаны на Фиг.9, где также была включена дополнительная группа отрицательного контроля (Группа 5), которую представляли неиммунизированные мыши.
Защитную реакцию иммунизированных мышей против вирусного заражения оценивали как описано ранее в других примерах. Животных заражали через 15 дней после окончания проведения иммунизации внутрибрюшинным введ