Способ лечения распространенного рака яичников
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к онкологии, и может найти применение при лечении больных злокачественными опухолями яичников III-IV стадий. Способ включает хирургическое вмешательство в доступном объеме и лучевую терапию в виде субтотального облучения тела больной в низкодозном или высокодозном режиме в суммарной дозе 1 или 9 Гр в зависимости от процентного содержания субпопуляции лимфоцитов CD2+35+в общей фракции мононуклеаров периферической крови с последующей химиотерапией по общепринятой схеме. И при содержании субпопуляции лимфоцитов 10% и более субтотальное облучение выполняют в дозе 0,1 Гр до суммарной дозы 1 Гр, при содержании их менее 10% - в дозе 3 Гр до суммарной дозы 9 Гр. Причем субтотальное облучение осуществляют ежедневно на линейном ускорителе электронов путем последовательного ротационного и статического облучения передне-задними полями, при этом ротационное облучение выполняют путем размещения больной непосредственно под изоцентром облучателя с начальным углом ротации α, определяемым по формуле: α=arcctg(2 L/A), где А - рост больной, L - расстояние от изоцентра до середины переднезаднего размера больной и конечным углом ротации γ, определяемым по формуле: γ=arcctg[2L/(2L-2B)], где В - расстояние от верхней точки головы до купола диафрагмы. Статическое облучение осуществляют с использованием клиновидного фильтра, направляя основание его к середине тела больной, при этом угол наклона консоли β со стороны нижних конечностей облучаемой больной определяют по формуле: β=arctg(A/4L), а химиотерапию выполняют препаратами группы таксанов в комбинации с препаратами платины. Способ обеспечивает получение стабильно высоких результатов лечения со средней длительностью ремиссии 39 мес и средней продолжительностью жизни 53 мес. 3 ил.
Реферат
Изобретение относится к медицине, а именно к онкологии, и может найти применение при лечении распространенного рака яичников.
Традиционным способом лечения первично-распространенного рака яичников в настоящее время является комбинированный метод, включающий операцию (ОП) и химиотерапию (XT). В лечении рецидивов заболевания используется, как правило, только химиотерапия (Нечаева И.Д. «Опухоли яичников». Л.: Медицина, 1987, 216 с.). В отдельных случаях при лечении первичных больных и больных с рецидивами применяется локальная лучевая терапия.
Операцией выбора при раке яичников III-IV стадий считается надвлагалищная ампутация матки с придатками и большим сальником, однако на практике в силу распространенности опухолевого процесса нередко выполняется лишь циторедуктивная операция. Химиотерапия проводится в виде 6-9 курсов преимущественно препаратами платины, таксанами, алкилирующими агентами.
Результаты современного химиохирургического лечения остаются весьма ограниченными. Частота объективного эффекта (полная ремиссия, частичная ремиссия, стабилизация опухолевого процесса) по данным различных авторов составляет 24-60% при средней продолжительности жизни больных 8-24 мес (Русский медицинский журнал, спец. выпуск «Онкология», 1998, т.6, №10, с.671-676). Показатели пятилетней выживаемости больных распространенным раком яичников варьируют от 5 до 25% (Материалы IX Российского онкологического конгресса, Москва, 2005, с.22-24).
Локальная лучевая терапия при раке яичников III-IV стадий используется лишь при минимальных остатках опухоли после хирургического вмешательства или при локализованном рецидиве заболевания. При этом пятилетняя выживаемость больных распространенным раком яичников после циторедуктивной операции, химиотерапии и облучения составляет не более 14-17% (Int. J. Radiat. Oncol. Biol. Phys.,1999, V.128 (6), P.617-665).
Неудовлетворительные результаты традиционного химиохирургического лечения и ограниченные возможности локального облучения при раке яичников III-IV стадий предопределяют актуальность разработки принципиально новых методов лечения указанной категории больных.
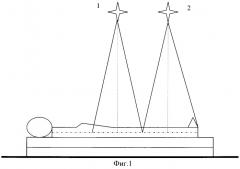
Нами ранее разработана технология лечения больных злокачественными опухолями яичников (патент РФ №2078598 от 10 мая 1997 г. «Способ лечения злокачественных опухолей яичников», МКИ A61N 5/10), которая взята в качестве прототипа. Способ включает хирургическое вмешательство с последующим проведением субтотального облучения тела (СТОТ) в низкодозном или высокодозном режиме с суммарными дозами 1 Гр или 8-9 Гр и химиотерапию препаратами тиофосфамид и 5-фторурацил. Выбор режима субтотального облучения осуществляли в зависимости от процентного содержания субпопуляции ЕАС-розеткообразующих лимфоцитов периферической крови, определяемого перед началом лечения больной. При значениях их в пределах 22-32% проводили СТОТ в разовой дозе от 2 до 3 Гр ежедневно до суммарной дозы 8-9 Гр, а при значениях ниже 22% или выше 32% СТОТ выполняли в разовой дозе 0,1 Гр через 2-3 дня в суммарной дозе 1 Гр. Облучение низкими разовыми дозами (0,1 Гр) осуществляли на гамма-терапевтической установке Рокус-АМ, при этом применялась методика билатерального облучения. Для равномерного распределения поглощенной дозы в облучаемом объеме использовали фильтры-компенсаторы из тканьэквивалентного материала, изготовленные в ЦНИРРИ по усредненным размерам и контурам боковой поверхности тела пациенток. Облучение высокими разовыми дозами (2-3 Гр) выполнялось на линейном ускорителе электронов СЛ 75-5МТ (6 МэВ) двумя передне-задними полями в статическом режиме (фиг.1).
Химиотерапия проводилась тиофосфамидом и 5-фторурацилом в общепринятом режиме и дозах.
По способу-прототипу было пролечено 59 больных. При этом удалось достичь увеличения длительности ремиссии в 1,5-2 раза со средним значением - 12,4±1,7 мес, что является основным достоинством способа.
Тем не менее, способ-прототип не лишен недостатков. Так продолжительность жизни больных одной клинической стадии заболевания и при одинаковом лечении существенно различается и варьирует от 1 года до 5 лет, что, как показали наши дальнейшие исследования, связано с недостаточной точностью выбора режима СТОТ (1 Гр или 9 Гр), а также недостаточной равномерностью распределения поглощенной дозы вдоль тела больной при его осуществлении. Полностью добиться равномерного распределения этой дозы в прототипе не позволяет использование фильтров-компенсаторов, изготовленных по усредненным размерам больных, нередко значительно различающихся между собой по конституции. Кроме того, к недостаткам прототипа следует отнести и тот факт, что при облучении больных на гамма-терапевтической установке в условиях постоянного распада радиационного источника с целью коррекции времени облучения требуется многократная прямая дозиметрия перед сеансами СТОТ для обеспечения необходимой дозы, что технически и организационно вызывает трудности.
Все это приводит к тому, что достигаемые в способе-прототипе высокие результаты лечения оказываются нестабильными.
Задача настоящего изобретения состояла в повышении стабильности результатов лечения за счет уточнения выбора адекватного режима СТОТ, выполнения его с учетом индивидуальных размеров и конфигурации тела больной и при равномерном распределении поглощенной дозы в облучаемой зоне.
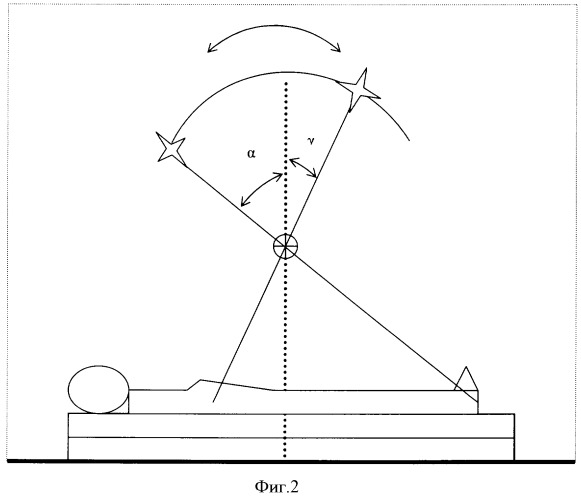
Эта задача решена тем, что в способе лечения распространенного рака яичников, включающем хирургическое вмешательство в доступном объеме, лучевую терапию в виде субтотального облучения тела больной в низкодозном или высокодозном режиме в суммарной дозе 1 или 9 Гр в зависимости от процентного содержания субпопуляции лимфоцитов в общей фракции мононуклеаров периферической крови с последующей химиотерапией по общепринятой схеме, согласно изобретению оценивают содержание субпопуляции лимфоцитов CD2+35+ и при их содержании 10% и более субтотальное облучение выполняют в дозе 0,1 Гр до суммарной дозы 1 Гр, при содержании их менее 10% - в дозе 3 Гр до суммарной дозы 9 Гр, причем субтотальное облучение осуществляют ежедневно на линейном ускорителе электронов путем последовательного ротационного и статического облучения передне-задними полями, при этом ротационное облучение (фиг.2) выполняют путем размещения больной непосредственно под изоцентром облучателя с начальным углом ротации α, определяемым по формуле:
где А - рост больной, L - расстояние от изоцентра до середины передне-заднего размера больной и конечным углом ротации γ, определяемым по формуле:
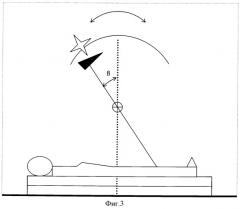
где В - расстояние от верхней точки головы до купола диафрагмы. Статическое облучение (фиг.3) осуществляют с использованием клиновидного фильтра, направляя основание его к середине тела больной, при этом угол наклона консоли β со стороны нижних конечностей облучаемой больной определяют по формуле:
а химиотерапию выполняют препаратами группы таксанов в комбинации с препаратами платины.
Оценка содержания в периферической крови субпопуляции лимфоцитов CD2+35+ в процентах к общей фракции мононуклеаров крови уточняет выбор варианта СТОТ, обеспечивая подведение адекватной дозы облучения для каждой больной, и позволяет получать стабильно высокие результаты лечения. Как показали наши многолетние исследования с использованием разных субпопуляций лимфоцитов, именно CD2+35+ оказались наиболее информативными, позволяющими адекватно оценить индивидуальный соматический статус больных с учетом ресурсности костного мозга и выбрать соответствующий по цитостатической нагрузке вариант СТОТ.
Осуществление СТОТ как в высокодозном, так и в низкодозном режимах на линейном ускорителе электронов позволяет за счет более высокой проникающей способности электромагнитного излучения (6 МэВ) добиться более равномерного распределения поглощенной дозы в облучаемой зоне, а также повысить комфортность облучения для больной путем сокращения времени его проведения и избежать многократной прямой дозиметрии перед сеансами СТОТ, что способствует получению стабильно высоких результатов лечения.
Осуществление СТОТ как в высокодозном, так и в низкодозном режимах путем комбинации последовательного ротационного и статического облучения передне-задними полями позволяет при низкодозном СТОТ исключить билатеральную схему облучения, применяемую при выполнении СТОТ на Рокусе с использованием блоков-компенсаторов, изготавливаемых по усредненным размерам больных, отличающихся между собой ростом, весом и конституцией, что неизбежно приводит к ошибкам в величине поглощенной дозы при лечении конкретной больной, а при высокодозном СТОТ позволяет избежать колебаний поглощенной дозы, наблюдаемых при использовании статического облучения крупными полями, необходимыми для облучения тела больной от купола диафрагмы до стоп. Причем использование ротационного облучения обеспечивает облучение большого объема тела больной, а последующее статическое облучение позволяет компенсировать возникающую при этом неравномерность распределения дозы вдоль продольной оси тела больной.
Расчеты углов ротации (начального и конечного) и угла наклона консоли ускорителя при статическом облучении с учетом конституции каждой больной по разработанным нами формулам обеспечивает индивидуализацию и точность подведения требуемой дозы при осуществлении СТОТ.
Проведение ежедневных сеансов СТОТ с точки зрения снижения репопуляции опухолевых клеток дополнительно способствует улучшению результатов лечения.
Применение для проведения химиотерапии современных высокоактивных цитостатиков (таксаны и препараты платины) также способствует получению более высоких результатов лечения.
Все это позволило нам впервые достичь не только длительной ремиссии (30-60 месяцев вплоть до клинического выздоровления), но и высокой 5-летней выживаемости больных (60%). При этом у всех пролеченных нами больных были получены стабильно высокие результаты.
Сущность способа заключается в следующем.
Больной с диагнозом «Рак яичников» определяют в крови концентрацию CD2+35+ лимфоцитов и выбирают адекватный режим субтотального облучения тела: при содержании их 10% и более субтотальное облучение выполняют в дозе 0,1 Гр до суммарной дозы 1 Гр, при содержании их менее 10% - в дозе 3 Гр до суммарной дозы 9 Гр.
Лечение начинают с хирургического вмешательства в доступном объеме и через 10-14 дней проводят СТОТ в выбранном режиме.
Перед облучением замеряют рост больной, расстояние от купола диафрагмы до верхней точки головы, определяют средний передне-задний размер тела в зоне облучения. Затем для подготовки ротационного облучения рассчитывают начальный угол ротации α по формуле и конечный угол ротации γ по формуле Для статического облучения определяют угол наклона консоли ускорителя с использованием стандартного клиновидного фильтра по формуле β=arctg(A/4L).
При осуществлении низкодозного СТОТ разовая доза составляет 0,1 Гр, суммарная доза - 1,0 Гр. Через 3-5 дней после облучения и контроля клинического анализа крови проводят химиотерапию таксанами и препаратами платины. Доза таксанов составляет 175 мг/м2, доза препаратов платины рассчитывается по клиренсу креатинина по общепринятой методике.
При выполнении высокодозного СТОТ разовая доза равна 3,0 Гр, суммарная - 9 Гр. После облучения выполняется контрольный анализ крови. Химиотерапия начинается только после нормализации показателей крови (лейкоцитов, эритроцитов, тромбоцитов) и проводится также таксанами и препаратами платины по традиционной схеме.
Сущность способа поясняется примерами.
ПРИМЕР 1. Больная И., 1956 г.р., и/б №2266 впервые поступила в клинику ЦНИРРИ 12.09.2002 г. с диагнозом: Рак яичников, асцит, гидроторакс. Стадия-IV T3cNxM1.
При клиническом обследовании в ЦНИРРИ обнаружено:
- 13.09.02 г. при гинекологическом осмотре после эвакуации 8 литров асцитической жидкости справа от неувеличенной матки пальпировалось плотное, бугристое образование 10×8×8 см, исходящее из правого яичника. Левые придатки несколько увеличены. В дугласовом пространстве - бугристость 5×3 см;
- 16.09.02 г. по данным УЗИ: В брюшной полости значительное количество жидкости. В печени 3 метастатических образования - в 4 сегменте 4×4 см, в 6 сегменте 3×4,5 см, в 7 сегменте 3×3 см. В малом тазу кистозно-солидный конгломерат 10×9×8 см;
20.09.02 г. рентгенологически: В легких без инфильтративных изменений. В левой плевральной полости в заднем синусе определялся выпот;
- 17.09.02 г. опухолевый маркер СА-125=1178 Е/мл;
- 14.09.02 г. иммунологическое определение процентного содержания CD2+35+ лимфоцитов, которое составило 16%;
- клинические анализы крови и мочи в пределах нормы.
В процессе клинического обследования диагноз подтвержден - Рак яичников с метастазами в печень, по брюшине и плевре. Асцит. Гидроторакс. Стадия IV T3cNxM1.
29.09.02 г. выполнена операция в объеме надвлагалищной ампутации матки с придатками и большим сальником. При ревизии во время операции было обнаружено 7 литров асцитической жидкости. Оба яичника превращены в кистозно-солидные опухоли с прорастанием капсулы, размерами: правый - 10×8×6 см, левый - 6×5×5 см. Матка не изменена. Множественные метастазы по брюшине дугласова пространства (7×3×1,5 см), малого таза и брюшной полости (от 0,5 до 2 см). Большой сальник в виде опухолевого конгломерата 22×15×5 см.
Гистологическое исследование операционного материала №О-165267-273 «Серозная папиллярная цистаденокарцинома яичников с метастазами в большой сальник».
Послеоперационный период протекал без осложнений.
13.10.02 г. осмотрена гинекологически: Культя шейки матки не увеличена. В дугласовом пространстве пальпировалась опухолевая площадка 5×3×1 см, в культе большого сальника - опухолевый тяж 20×4×2 см. Асцит не определялся.
14.10.02 г. была выполнена компьютерная томография органов малого таза, брюшной и грудной полости для оценки состояния опухолевого процесса после операции. Подтверждено наличие опухолевых остатков в малом тазу (4×4 см), метастазов в печени (4,3×4 см, 3×3 см, 2,7×4,5 см), асцита и гидроторакса.
По результатам анализа иммунологических данных (CD2+35+=16%) было принято решение о целесообразности выполнения системной лучевой терапии в виде низкодозного варианта субтотального облучения тела в разовой дозе 0,1 Гр и суммарной дозе - 1,0 Гр в объеме от купола диафрагмы до стоп на линейном ускорителе электронов СЛ 75-5МТ (6 МэВ) в режиме тормозного излучения.
Предварительно была проведена предлучевая подготовка.
Замерены телеметрические данные больной: рост - 164 см, расстояние от купола диафрагмы до верхней точки головы - 54 см, передне-задний размер тела на уровне купола диафрагмы - 20 см, на уровне центра брюшной полости - 19 см, на уровне центра малого таза - 21,5 см, при этом средний передне-задний размер составил (20+19+21,5)/3=20,2 см. Затем был определен начальный угол ротации α по формуле α=arcctg(2L/A), где А - рост пациентки, равный 164 см, L - расстояние от источника до середины передне-заднего размера больной, которое в нашем центре является фиксированной величиной и равно 184 см: α=arcctg(2×184/164)=40°.
Рассчитан конечный угол ротации γ по формуле γ=arcctg[2L/(2L-2В)], где В - расстояние от верхней точки головы до купола диафрагмы составляло 54 см: γ=arcctg[2×184/(2×184-2×54)]=14°.
Сектор ротационного облучения, таким образом, был ограничен следующими параметрами: от 346° (360°-14°, с учетом перехода сектора ротации через нулевое значение) до 40° и составил 54°.
Определен угол наклона консоли ускорителя для статического облучения с использованием стандартного клиновидного фильтра по формуле:
β=arctg(A/4L)=arctg(164/(4×180°))=25°.
Субтотальное облучение выполнялось следующим образом.
Больную расположили на терапевтическом столе лежа на спине так, чтобы центр тела совпадал с центром головки линейного ускорителя при вертикальном положении консоли. Облучение начинали в ротационном режиме с сектором качаний от 346 до 40°. Далее проводили облучение в статическом режиме с использованием клиновидного фильтра при наклоне консоли ускорителя под углом 25°. Затем больную перевернули на живот и облучение повторили. Разовая доза СТОТ составляла 0,1 Гр (по 0,05 Гр спереди и сзади).
С 15.10.02 г. по 26.10.02 г. было проведено 10 сеансов субтотального облучения тела до суммарной дозы 1,0 Гр. После окончания субтотального облучения осуществлен контроль клинического анализа крови, показатели которого оказались в пределах нормы. 05.11.02 г. проведен первый курс химиотерапии препаратами таксол и карбоплатин. Оба препарата вводились внутривенно, капельно в течение одного дня. Доза таксола рассчитывалась по принципу - 175 мг на 1 м2 поверхности тела, доза карбоплатина - по клиренсу креатинина (79 мкмоль/л). Больная получила 300 мг таксола и 620 мг карбоплатина. Лечение перенесла удовлетворительно. 11.11.02 г. больная была выписана домой в удовлетворительном состоянии с явкой для контрольного осмотра через 3 недели.
С 20.11.02 г. проведено контрольное обследование в стационаре (и/б №3022) (гинекологический осмотр, УЗИ, рентгенография грудной клетки). При гинекологическом осмотре 21.11.02 г. обнаружили уменьшение опухолевых узлов в дугласовом пространстве до 5×3×1 см и культе большого сальника до 20×4×2 см. По данным УЗИ от 29.11.02 г. отметили исчезновение двух из трех ранее определяемых метастатических узлов в печени в 6 и 7 сегментах. Опухолевый маркер СА-125 снизился 21.11.02 г. до 1007 Е/мл, а 10.12.02 г. - до 118 Е/мл. Установлена стабилизация опухолевого процесса с тенденцией к ремиссии.
25.11.02 г. проведен второй и 24.12.02 г. - третий курс химиотерапии препаратами таксол в дозе 300 мг и карбоплатин - 620 мг. Больная была выписана в удовлетворительном состоянии, тошноты и рвоты не было.
08.01.03 г. осуществлена повторная госпитализация больной (и/б №49). При гинекологическом осмотре 19.01.03 г. обнаружили уменьшение опухолевых узлов в дугласовом пространстве до 3×2,5×1 см и культе большого сальника до 12×3×1 см. По результатам компьютерной томографии органов малого таза, брюшной и грудной полости 14.01.03 г. было установлено исчезновение асцита, гидроторакса и двух метастатических очагов в 6 и 7 сегментах печени. Данные УЗИ 22.01.03 г. подтвердили исчезновение двух из трех ранее определяемых метастатических узлов в печени в 6 и 7 сегментах. Опухолевый маркер СА-125 снизился 16.01.03 г. до 41 Е/мл, а 10.02.03 г. - до 22 Е/мл.
22.01.03 г. Установлена частичная ремиссия.
23.01.03 г. проведен четвертый, 13.02.03 г. - пятый курс химиотерапии препаратами таксол (300 мг) и карбоплатин (620 мг).
При гинекологическом осмотре 05.03.03 г. отметили дальнейшее уменьшение опухолевого узла в малом тазу 1×1×0,5 см и культе большого сальника до 7×3×1 см. 11.03.03 г. проведен шестой курс химиотерапии по той же схеме. Больная была выписана в удовлетворительном состоянии с явкой для осмотра через 3 недели.
С 02.04.03 г. в стационаре (и/б №1015) было проведено очередное клиническое обследование. При гинекологическом осмотре 04.04.03 г. узел в малом тазу остался в прежних размерах (1×1×0,5 см), а в культе большого сальника - уменьшился до 6×2×1 см. По данным компьютерной томографии 04.04.03 г. отмечено полное исчезновение метастазов в печени. Опухолевый маркер от 03.04.03 г. равнялся 12 Е/мл. Подтверждена частичная ремиссия.
04.04.03. г. проведен седьмой курс химиотерапии препаратами таксол (300 мг) и карбоплатин (620 мг). Больная была выписана в удовлетворительном состоянии.
С 11.06.03 г. по 24.06.03 г. осуществлена повторная госпитализация больной (и/б 1733). Гинекологический осмотр 18.06.03 г. показал, что в малом тазу и в брюшной полости опухолевые очаги отсутствовали. При компьютерной томографии 17.06.03 г. опухолевых остатков и метастазов в брюшной полости и метастазов не обнаружено. Опухолевый маркер 18.06.03 г. равнялся 12 Е/мл.
18.06.03 г. установлена полная клиническая ремиссия. Первичное лечение больной закончено. Больная выписана с явкой для обследования через 3 месяца.
С 16.09.03 г. проведено клиническое обследование в стационаре (и/б №2202). При гинекологическом осмотре 17.09.03 и при компьютерной томографии 16.09.03 г. опухолевых очагов в малом тазу и брюшной полости не выявлено. Опухолевый маркер от 23.09.03 г. равнялся 10 Е/мл. На основании проведенного исследования ремиссия была подтверждена. Явка на осмотр через 3 месяца.
С 22.12.03 г. проведено очередное клиническое обследование (и/б №3124). При гинекологическом осмотре 24.12.03 и при компьютерной томографии 28.12.03 г. опухолевых очагов в малом тазу и брюшной полости также не было выявлено. Опухолевый маркер 22.12.03 г. равнялся 11 Е/мл. Подтверждена ремиссия. Явка на осмотр через 3 месяца.
В дальнейшем больная наблюдалась амбулаторно. Каждые 3 месяца осматривалась гинекологически, выполнялось ультразвуковое исследование, контролировался уровень опухолевого маркера. Данных за рецидив заболевания выявлено не было. Последний раз больная осмотрена в марте 2006 г., по результатам осмотра было подтверждено состояние ремиссии.
В дальнейшем, в связи с переменой места жительства, на осмотры и обследование больная не приезжала. Со слов родственников больной 18 мая 2007 г. был обнаружен рецидив заболевания, а 15 августа 2007 г. пациентка умерла от генерализации опухолевого процесса. Таким образом, полная клиническая ремиссия длилась 47 мес, продолжительность жизни от начала лечения составила 58,5 мес.
ПРИМЕР 2. Больная З., 1937 г.р., и/б №2478 впервые поступила в клинику ЦНИРРИ 02.10.2002 г. с диагнозом: Рак яичников, асцит. Стадия - III T3cMxM0.
При клиническом обследовании в ЦНИРРИ обнаружено:
- 02.10.02 г. при гинекологическом осмотре обнаружен опухолевый конгломерат, заполняющий малый таз и выходящий в брюшную полость с верхней границей на уровне пупка, асцит.
02.10.02 г. по данным УЗИ: В брюшной полости умеренное количество жидкости. Матка не увеличена. Справа от нее - кистозно-солидный конгломерат 17×15 см.
- 02.10.02 г. СА-125=94 Е/мл;
- 02.10.02 г. иммунологическое определение процентного содержания CD2+35+ лимфоцитов, которое составило 7%;
- клинические анализы крови и мочи в пределах нормы.
В процессе клинического обследования диагноз подтвержден - Рак яичников. Асцит. Стадия III T3cNxM0.
07.10.02 г. выполнена операция в объеме надвлагалищной ампутации матки с придатками и большим сальником. При ревизии во время операции обнаружено 3 литра асцитической жидкости. Оба яичника превращены в кистозно-солидные опухоли с прорастанием капсулы, размерами: правый - 25×15×10 см, левый - 45×10×7 см. Матка не изменена. В дугласовом пространстве - опухолевая площадка 3×3×1 см. На брюшине брюшной полости видимых метастазов не выявлено. Большой сальник с 2 метастазами 4×3 см и 3×3 см.
Гистологическое исследование операционного материала №016581926 «Серозная папиллярная цистаденокарцинома яичников с распространением на маточную трубу и с метастазами в большой сальник».
Послеоперационный период протекал без осложнений.
17.10.02 г. осмотрена гинекологически: Культя шейки матки не увеличена. В дугласовом пространстве пальпировалась опухолевая площадка 3×3×4 см. Асцит не определялся.
17.10.02 г. выполнена компьютерная томография органов малого таза, брюшной и грудной полости для оценки состояния опухолевого процесса после операции. Подтверждено наличие опухолевых остатков в малом тазу (5×5 см), обнаружено метастатическое поражение поясничных лимфатических узлов (слева 7×5,4 см, справа - 1×0,8 см) и левых паховых лимфоузлов (2×2 см).
По результатам анализа иммунологических данных (CD2+35+=7%) принято решение о целесообразности выполнения системной лучевой терапии в виде высокодозного варианта субтотального облучения тела в разовой дозе 3 Гр и суммарной дозе 9 Гр в объеме от купола диафрагмы до стоп на линейном ускорителе электронов СЛ 75-5МТ (6 МэВ) в режиме тормозного излучения.
Предварительно, как и в примере 1, была проведена предлучевая подготовка. Топометрические данные больной: рост - 167 см, расстояние от купола диафрагмы до верхней точки головы - 50 см, передне-задний размер тела на уровне купола диафрагмы - 27 см, на уровне центра брюшной полости - 25,5 см, на уровне центра малого таза - 25см, при этом средний передне-задний размер составил 25,8см. Определены начальный угол ротации α, который равен 47°; конечный угол ротации γ, равный 40°; сектор ротационного облучения при этом составил 87° (40°+47°). Рассчитан угол наклона консоли ускорителя для статического облучения, составивший 29°.
Субтотальное облучение выполнялось следующим образом.
Расположение больной на терапевтическом столе было таким же, как в примере 1. Облучение начинали в ротационном режиме с сектором качаний от 320 до 47°. Далее проводили облучение в статическом режиме при наклоне консоли ускорителя под углом 29°. Больную облучали сначала спереди, затем сзади. Разовая доза составила 3 Гр.
С 21.10.02 г. по 23.10.02 г. проведено 3 сеанса субтотального облучения тела до суммарной дозы 9,0 Гр. В первый и второй дни облучения отмечалась тошнота, на третий день жалоб не было. После окончания субтотального облучения осуществлен контроль клинического анализа крови, отмечена умеренная лейкопения (2,0×109/л) и тромбоцитопения (125×109/л). 05.11.02 г. после нормализации показателей крови проведен первый курс химиотерапии препаратами таксол (300 мг) и карбоплатин (600 мг). Дозы препаратов рассчитывались, как в примере 1. Оба препарата вводились внутривенно, капельно в течение одного дня. Химиотерапию больная перенесла удовлетворительно.
22.11.02 г. при контрольном гинекологическом осмотре по-прежнему в дугласовом пространстве определялась опухолевая площадка 3×3×4 см. Опухолевый маркер СА-125 21.11.02 г. нормализовался и достиг 17 Е/мл. Установлена стабилизация опухолевого процесса.
26.11.02 г. проведен второй курс химиотерапии препаратами таксол в дозе 300 мг и карбоплатин 600 мг. Химиотерапию больная перенесла удовлетворительно, была отмечена лишь умеренная лейкопения (2,2×109/л), которая была купирована к 17.12.02 г. (4,1×109/л).
17.12.02 г. при очередном гинекологическом осмотре было отмечено уменьшение опухолевого узла в дугласовом пространстве до 2×2×1 см. Опухолевый маркер СА-125 17.12.02 г. снизился до 8 Е/мл.
17.12.02 г. установлена частичная ремиссия.
24.12.02 г. проведен третий курс химиотерапии таксолом и карбоплатином в тех же дозах. Больная перенесла его без осложнений.
С 09.01.03 г. осуществлено контрольное клиническое обследование. При гинекологическом осмотре 22.01.03 г. отмечено некоторое уменьшение опухолевого узла в дугласовом пространстве до 1,5×1,5×1 см. Опухолевый маркер СА-125 16.01.03 г. оставался низким (8 Е/мл). Поданным компьютерной томографии 13.01.03 г. установлено исчезновение метастазов в левых паховых лимфатических узлах и правых поясничных, уменьшение опухолевых остатков в малом тазу (1,5×1 см), уменьшение метастазов в поясничных лимфатических узлах слева до 3,7×1,5см.
23.01.03 г. проведен четвертый курс химиотерапии препаратами таксол (300 мг) и карбоплатин (600 мг). Осложнений и побочных реакций отмечено не было. Состояние больной удовлетворительное.
12 02.03 г. при гинекологическом осмотре было обнаружено дальнейшее уменьшение опухолевых остатков до 1×1×1 см. СА-125 от 10.02.03 г. - в пределах нормы (7 Е/мл).
13.02.03 г. проведен пятый курс химиотерапии таксолом и карбоплатином в тех же дозах. Больная перенесла его хорошо, осложнений не было.
При гинекологическом осмотре 06.03.03 г. было отмечено дальнейшее уменьшение опухолевого узла в малом тазу 1×0,5×0,5 см. СА-125 от 11.03.03 г. в норме (7 Е/мл).
17.03.03 г. выполнен шестой курс химиотерапии по той же схеме. Больная перенесла очередной курс химиотерапии без осложнений и была выписана с явкой для осмотра через месяц.
С 08.04.03 г. проведено очередное клиническое обследование в стационаре (и/б №1056). При гинекологическом осмотре 08.04.03 г. в малом тазу опухолевых очагов не выявлено. По данным компьютерной томографии 04.04.03 г. отмечено полное исчезновение метастазов в малом тазу и лимфатических узлах. Опухолевый маркер от 08.04.03 г. равнялся 8 Е/мл.
08.04.03 г. установлена полная клиническая ремиссия. Первичное лечение больной закончено. Больная выписана с явкой для обследования через 3 месяца.
С 16.06.03 г. проведено клиническое обследование в стационаре (и/б №1765). При гинекологическом осмотре 21.06.03 г. и при компьютерной томографии 17.06.03 г. опухолевых очагов в малом тазу и брюшной полости не выявлено. Опухолевый маркер от 18.06.03 г. равнялся 7 Е/мл. Ремиссия была подтверждена. Явка на осмотр через 3 месяца.
С 17.09.03 г. проведено клиническое обследование в стационаре (и/б №2201). При гинекологическом осмотре 17.09.03 и при компьютерной томографии 18.09.03 г. опухолевых очагов в малом тазу и брюшной полости также выявлено не было. Опухолевый маркер от 23.09.03 г. равнялся 6 Е/мл. Ремиссия подтверждена. Явка на осмотр через 3 месяца.
С 22.12.03 г. проведено очередное клиническое обследование (и/б №3126). При гинекологическом осмотре 24.12.03 и при компьютерной томографии 29.12.03 г. опухолевых очагов в малом тазу и брюшной полости также выявлено не было. Опухолевый маркер 22.12.03 г. равнялся 7 Е/мл. Подтверждена ремиссия. Явка на осмотр через 3 месяца.
В дальнейшем больная наблюдалась амбулаторно. Каждые 3 месяца осматривалась гинекологически, выполнялось ультразвуковое исследование, контролировался уровень опухолевого маркера. Данных за рецидив заболевания выявлено не было. Последний раз больная осмотрена 25 октября 2007 г., подтверждено состояние ремиссии.
Таким образом, ремиссия длится 53,5 мес, а продолжительность жизни от начала лечения - 60,5 мес. Пациентка хорошо себя чувствует, активна, много работает по дому и на даче.
К настоящему времени предлагаемым способом пролечено 15 больных с диагнозом Рак яичников III-IV стадий. У всех достигнута клиническая ремиссия, средняя длительность которой составляет 38,75 мес, а средняя продолжительность жизни к настоящему времени достигла 52,80 мес, причем 9 из 15 пациенток живут 5 и более лет в состоянии стойкой ремиссии и продолжают наблюдаться.
Предлагаемый способ по сравнению с известными имеет ряд преимуществ:
1. Обеспечивает получение высоких результатов в виде возрастания средней длительности ремиссии в сравнении с прототипом с 12,4 до 38,75 мес и существенного увеличения пятилетней выживаемости больных с 5-25 (по данным литературы) до 60%.
2. Повышает стабильность результатов лечения, а именно даже у самой тяжелой категории больных (IV стадии заболевания) обеспечивает достижение длительной клинической ремиссии не менее 30 месяцев и достаточно высокой продолжительности жизни - не менее 3 лет. При этом 9 из 15 пролеченных нами больных живут без рецидива 5 и более лет. Это свидетельствует о получении в предлагаемом способе лечения достаточно однородных и стабильно высоких результатов, в то время как в известных способах лечения длительность ремиссии варьирует в пределах от 1-2 до 24-36 мес, а продолжительность жизни колеблется от 1 года до 5 лет.
Способ разработан в отделении Радиохирургической гинекологии совместно с отделом Медицинской физики и лабораторией Повышения эффективности лучевой терапии и прошел апробацию у 15 больных раком яичников III-IV стадий с положительным результатом.
Способ лечения распространенного рака яичников, включающий хирургическое вмешательство в доступном объеме, лучевую терапию в виде субтотального облучения тела больной в низкодозном или высокодозном режиме в суммарной дозе 1 или 9 Гр в зависимости от процентного содержания субпопуляции лимфоцитов в общей фракции мононуклеаров периферической крови с последующей химиотерапией по общепринятой схеме, отличающийся тем, что оценивают содержание субпопуляции лимфоцитов CD2+35+ и при их содержании 10% и более субтотальное облучение выполняют в дозе 0,1 Гр до суммарной дозы 1 Гр, при содержании их менее 10% - в дозе 3 Гр до суммарной дозы 9 Гр, причем субтотальное облучение осуществляют ежедневно на линейном ускорителе электронов путем последовательного ротационного и статического облучения передне-задними полями, при этом ротационное облучение выполняют путем размещения больной непосредственно под изоцентром облучателя с начальным углом ротации α, определяемым по формулеα=arcctg(2L/A),где А - рост больной;L - расстояние от изоцентра до середины переднезаднего размера больной, и конечным углом ротации у, определяемым по формулеγ=arcctg[2L/(2L-2B)],где В - расстояние от верхней точки головы до купола диафрагмы, статическое облучение осуществляют с использованием клиновидного фильтра, направляя основание его к середине тела больной, при этом угол наклона консоли β со стороны нижних конечностей облучаемой больной определяют по формулеβ=arctg(A/4L),а химиотерапию выполняют препаратами группы таксанов в комбинации с препаратами платины.