Катализатор и способ углекислотной конверсии легких углеводородов
Иллюстрации
Показать всеИзобретение относится к химической промышленности, в частности к катализаторам и способам конверсии легких углеводородов, и может быть использовано в нефтехимической, нефтеперерабатывающей промышленности для производства катализаторов и организации процесса получения синтез-газа. Катализатор представляет собой двухфазный продукт, основной фазой которого является алюминид железа Fe3Al и присутствует фаза свободного железа в количествах 90-95 мас.% и 5-10 мас.% соответственно. Катализатор получен самораспространяющимся высокотемпературным синтезом, возможно с предварительной механической активацией экзотермической порошковой смеси, и использован в способе углекислотной конверсии легких углеводородов. Катализатор обладает высокой каталитической активностью, теплопроводностью, механической прочностью, термостабильностью, устойчивостью к агрессивным средам и повышает производительность процесса углекислотной конверсии легких углеводородов, например метана, получен из недорогих, широко используемых металлов. 2 н. и 1 з.п. ф-лы, 2 ил., 2 табл.
Реферат
Изобретение относится к химической промышленности, в частности к катализаторам и способам конверсии легких углеводородов, и может быть использовано в нефтехимической, нефтеперерабатывающей и других отраслях промышленности для производства катализаторов и организации процесса получения синтез-газа.
Существует три метода окислительной конверсии метана в синтез-газ (О.В.Крылов. Углекислотная конверсия метана в синтез-газ. Российский химический журнал, 2000, т.44, №1, с.19-33):
- паровая конверсия СН4+1/2Н2O↔СО+2Н2 (количественный состав образующегося синтез-газа СО:Н2=1:3);
- парциальное окисление кислородом CH4+1/2O2↔СО+2Н2 (количественный состав образующегося синтез-газа СО:Н2=1:2);
- углекислотная конверсия СН4+CO2↔2СО+2Н2 (количественный состав образующегося синтез-газа СО:Н2=1:1).
Традиционным способом получения синтез-газа является эндотермический процесс паровой конверсии природного газа на нанесенных никелевых катализаторах (J.R. Rostrup-Nielsen, Production of synthesis gas, Catalysis Today, 1993, v. 18, 305-324). Конверсия метана с водяным паром используется в промышленности для производства синтез-газа с высоким мольным соотношением Н2/СО (≈3), что неблагоприятно для синтеза ряда органических веществ (диметилового эфира, метилметакрилата и др.). Более того, данный процесс характеризуется чрезвычайно высокой капиталоемкостью, высокими эксплуатационными затратами.
Конверсия с углекислым газом предпочтительнее, чем с водой, так как она может быть применена на территориях, где вода не является доступной, поскольку образуется синтез-газ с более низким отношением Н2/СО, что служит предпочтительным сырьем для синтеза длинноцепочечных углеводородов.
Катализаторы, используемые в данных процессах, однотипны и представляют собой либо благородные металлы (до 10 мас.% Pt, Pd, Rh, Ru), либо элементы семейства железа, нанесенные на оксидную керамику. В качестве носителей используются, например, Al2O3, MgO, ZrO2, гексаалюминат кальция или бария и др.
Недостатками при использовании вышеуказанных катализаторов являются высокая стоимость катализаторов вследствие большого содержания благородных металлов и использования в качестве носителей дорогостоящей пенокерамики на основе циркония, зауглероживание катализаторов с использованием оксидов алюминия (особенно с высокой удельной поверхностью), ограничивающие их практическое применение.
В промышленности синтез-газ методом углекислотной конверсии не получают.
Известно, что для процесса углекислотной конверсии метана (УКМ) предлагают использовать в качестве катализаторов следующие соединения: нанесенные, как правило, на оксидную керамику никелевые и кобальтовые катализаторы, но их существенный недостаток - потеря активности вследствие закоксовывания (Bradford M.C.J., Vannice М.А. CO2 reforming of methane. Catal. Revs. 1999, v. 41, №1, p.1-42). Высокой активностью обладают порошки Fe, Со и Ni, смешанные с ультрадисперсной керамикой в отношении 1:10. Металлы платиновой группы в углекислотной конверсии метана более активны, чем Fe, Со, Ni, и менее подвержены углеотложению из-за меньшей растворимости в них углерода. Реакция протекает на них со значительной скоростью уже при 500°С. Основное и существенное препятствие их широкому применению - высокая стоимость.
В работах Крылова О.В., Мамедова А.Х. (патент РФ 96100764, 1998; Крылов О.В., Мамедов А.Х. Гетерогенно-каталитические реакции диоксида углерода. Успехи химии. - 1995, т.64, №9, с.935-959) показано, что катализаторами углекислотной конверсии метана могут быть и оксидные катализаторы. Предложены и такие, которые состоят из оксидного носителя (Al2O3, SiO2, ZrO2, ВаО, СаО и др.) и покрытия из металлов (Pt, Pd, Ru, Rh, Ni и др.) Несмотря на то, что они обладают достаточной активностью, все они подвергаются закоксовыванию. Со временем это приводит к дезактивации катализаторов, что требует их регенерации и приводит к увеличению затрат на производство. Недостатком известных катализаторов и носителей является еще и то, что при высоких температурах в условиях окислительно-восстановительной среды они окисляются, что существенно снижает прочность контакта между частицами.
В публикацях (Крылов О.В., Мамедов А.Х. Успехи химии, 1995, т.64, №9.; Крылов О.В. Углекислотная конверсия метана в синтез-газ. Рос. хим. журнал, 2000, №1, с.19-33) авторами показано, что среди трех активных компонентов (Ni, Со, Fe), нанесенных на А12ТО3, самым малоактивным является катализатор Fe/Al2O3, который показал 3,4% конверсии смеси (СН4 и CO2).
Вообще, системы, включающие синтез водорода и монооксида углерода из углекислого газа и метана, не обеспечены разработанной технологией. Системы, основанные на никелевом катализаторе, обычно используемые в процессе парового риформинга, не обладают достаточной селективностью и быстро дезактивируются вследствие образования углерода, который покрывает активные металлические центры в ходе катализа, и накапливаются в порах катализатора, вызывая фрагментацию.
Для многих процессов, протекающих при высоких температурах, реакция осуществляется в диффузионной области, поэтому очень высокая удельная поверхность не требуется. Гораздо важнее, чтобы данные катализаторы были устойчивы к термоударам и, по возможности, имели повышенную теплопроводность для уменьшения вероятности локальных перегревов. Такими свойствами обладают некоторые интерметаллиды переходных металлов.
Все традиционные способы получения интерметаллидов характеризуются значительными энергетическими затратами, сложностью и многостадийностью технологических циклов, обусловленной длительностью синтеза, малой производительностью, дорогостоящим оборудованием, недостаточной чистотой продукта. От большинства этих недостатков оказываются свободными методы высокотемпературного синтеза, основанные на использовании внутренней химической энергии исходных реагентов.
Известно получение однофазных интерметаллидов методом самораспространяющегося высокотемпературного синтеза (СВС), в том числе алюминидов переходных металлов семейства железа (В.И.Итин, Ю.С.Найбороденко. Высокотемпературный синтез интерметаллических соединений. Томск, Изд-во Том. ун-та, 1989, 214 с). В зависимости от условий синтеза (соотношение компонентов, размер частиц, начальная температура, давление и т.д.) процесс горения может протекать в различных режимах (стационарный, пульсирующий, послойный или тепловой взрыв) с формированием конечных продуктов. Однако механизм и динамика структурообразования образующегося материала мало исследована и поэтому условия получения интерметаллидов с заданной структурой, определяющей их технические характеристики, подбираются экспериментально.
Эти соединения используются в качестве защитных и жаростойких покрытий, геттеров, материалов с памятью формы для медицины, а также для скелетных катализаторов типа никеля Ренея.
В литературе практически не известно использование катализаторов-интерметаллидов для процесса углекислотной конверсии легких углеводородов. Такие исследования только начинаются.
Наиболее близким по технической сущности и достигаемому результату является катализатор, представляющий собой систему на основе интерметаллида Ni3Al, где содержание диспергированного металла составляет 5-10 мас.% (Л.А.Аркатова, Т.С.Харламова, Л.В.Галактионова и др. Углекислотная конверсия метана на алюминидах никеля. Журнал физической химии, 2006, т.80, №8, с.1403-1406). Известный катализатор получен самораспространяющимся высокотемпературным синтезом, обеспечивает при температуре 1223 К конверсию по CO2 82.2%, а по СН4 79.6%). При этом выход синтез-газа составил СО 43.1 мол.%, Н2 37.8%. Интерметаллид Ni3Al в данном случае выполняет роль носителя (матрицы), обеспечивая высокую теплопроводность по зерну катализатора и диспергирование активного металлического никеля.
Недостатком известного катализатора является науглероживание, сопровождаемое образованием карбида никеля и графитоподобного углерода, что приводит к потере активности (его дезактивации).
Задача, решаемая данным изобретением, состоит в разработке эффективного катализатора, устойчивого к перепадам температур и термоударам, имеющего повышенную теплопроводность для уменьшения вероятности локальных перегревов, и способа углекислотной конверсии метана, при котором исключается углеотложение и соответственно повышается производительность процесса получения легких углеводородов.
Задача решается заявляемым катализатором получения синтез-газа путем каталитического превращения реакционной смеси метан (природный газ) и диоксид углерода, который является химическим соединением двух металлов, представляющий собой интерметаллид Fe3Al и свободное железо, причем фазы содержатся в следующих количествах, мас.%: Fe3Al 90-95, свободное железо 5-10. Фазовый состав катализатора и количественное соотношение фаз обусловлено условиями осуществления способа получения катализатора, которые подобраны экспериментально.
Каталитическая система согласно данному изобретению характеризуется тем, что образована интерметаллидом железа, причем активный компонент катализатора образуется непосредственно в ходе катализа - фаза металлического железа.
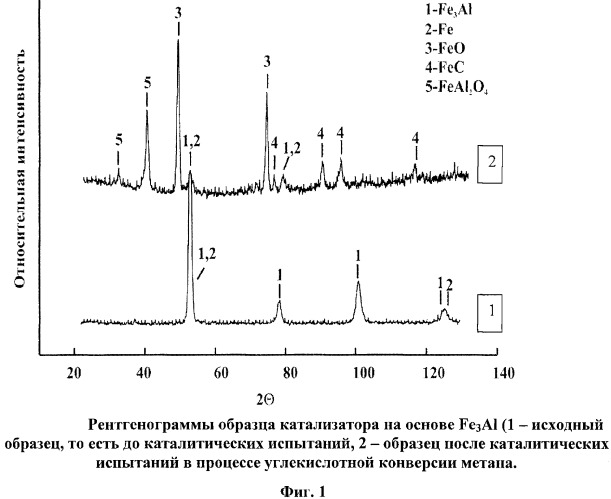
Каталитические и термомеханические характеристики катализатора обусловлены его фазовым составом и структурой. По данным РФА интерметаллидный катализатор состоит из фаз Fe3Al и металлического Fe. На фиг.1 представлены рентгенограммы образца катализатора на основе Fe3Al. РФА показывает наличие следующих фаз: основная фаза - Fe3Al, самый большой пик находится на 29=52° интенсивностью 100%. Существование этой фазы подтверждается и другими пиками. Присутствует незначительное количество железа. При испытании катализатора в процессе углекислотной конверсии метала произошло существенное изменение состава многокомпонентной системы с образованием FeO, FeAl2O4, FeC.
Принципиальной разницей является матрица, поведение которой в ходе процесса углекислотной конверсии метана принципиально различно у Ni3Al и Fe3Al.
Фаза Fe3Al, проявляя свойства матрицы с вкрапленным активным компонентом, является также прообразом самого активного компонента, так как в процессе каталитических испытаний эта фаза подвергается разложению с выделением фазы металлического железа, которое, обладая высокой дисперсностью, и является активным центром. Этот факт обеспечивает высокую чистоту выделяемого в ходе катализа активного компонента. Кроме того, наиболее высокие каталитические данные в данной работе получены на катализаторе, синтезированном с использованием предварительной (т.е. до синтеза) механической активации исходной смеси.
Термостабильность катализатора, имеющего невысокую удельную поверхность (0.1-10 м2/г), устойчивого к локальным перегревам и термоударам, работающего при средних временах контакта 0.1-1 с в реакции углекислотной конверсии метана, обусловлена способом его получения.
Коэффициент теплопроводности заявляемого катализатора на основе Fe3Al составляет 95-115 Вт/(м·К) (приводится диапазон, так как величина зависит от плотности и пористости образцов). Данная величина очень высока, что является неоспоримым преимуществом заявляемого катализатора в связи с отсутствием градиента температур по слою, а следовательно, с отсутствием возможности разрушения катализатора под действием тепловых ударов вследствие резких перепадов температур.
Как следует из приведенной на фиг.1 рентгенограммы, кокс не образуется, то есть катализатор не подвергается углеродной эрозии за счет закоксования. Кроме того, при исследовании катализаторов методом растровой электронной микроскопии было также доказано, что углеродных отложений также не наблюдается, более того, катализатор практически не меняет свою структуру после работы в процессе углекислотной конверсии метана (см.фиг.2). Данный факт подтверждает преимущество заявляемого катализатора по сравнению как с традиционными никелевыми катализаторами, нанесенными на оксидную керамику, так и с катализатором-прототипом.
Механическую прочность (σсж) определяли на разрывной машине Р-10. Для заявляемых прессованных катализаторах эта величина равна σсж=189 МПа. На литых катализаторах значение данной характеристики будет еще выше.
Под устойчивостью к агрессивным средам подразумевается устойчивость катализатора к разрушению (химических взаимодействий, ведущих к эрозии, и соответственно к потере каталитической активности). Катализатор Fe3Al достаточно устойчив к той среде, в которой проводится процесс углекислотной конверсии метана (а именно CO2, СО, Н2, CH4 - данная среда окислительно-восстановительная и соответственно агрессивная, то есть способная вызвать протекание цикла окислительно-восстановительных реакций). Заявляемый катализатор устойчив в вышеуказанной среде, так как стабилен во времени и не теряет каталитической активности в лабораторных условиях более 30 суток.
Катализатор получают в процессе горения исходных реагентов. Сущность способа получения данного катализатора заключается в том, что после локального инициирования реакции взаимодействия в тонком слое смеси исходных реагентов (алюминий, железо) фронт горения самопроизвольно распространяется по всей системе благодаря теплопередаче от горячих продуктов к ненагретым исходным веществам, в которых также инициируется реакция. Фактически осуществляется процесс горения, в котором образование продуктов является и причиной, и следствием горения, причем продуктом такого горения оказываются не газы, а вновь образованные тугоплавкие вещества и материалы. Процесс горения протекает в послойном режиме. Метод СВС характеризуется низкими энергетическими затратами, короткими временами синтеза, простотой оборудования, возможностью одностадийного превращения неорганических материалов в конечные продукты, чистота которых определяется чистотой исходных компонентов, что способствует широкому использованию его для получения различных материалов, в том числе и каталитических систем.
Задача решается также способом получения синтез-газа путем углекислотной конверсии легких углеводородов с использованием описанного выше катализатора.
Процесс углекислотной конверсии легких углеводородов проводят предпочтительно с использованием указанной выше каталитической системы при температуре 600-1000°С, предпочтительно 950°С, при атмосферном давлении.
Изобретение предусматривает процесс каталитического риформинга легких углеводородов, предпочтительно метана, который позволяет получать смеси Н2 и СО с мольными соотношениями компонентов 0,5-1,5, преимущественно 1. Может быть использован природный газ. При использовании метана требуемое объемное соотношение CO2:СН4 составляет 0,5 - 1.0, предпочтительно 1.0.
Процесс можно проводить в присутствии пара, если конкретное применение полученного синтез-газа требует этого.
Реакционная смесь, содержащая легкие углеводороды, например метан (природный газ) и диоксид углерода, перед входом в реактор нагревается. В процессе запуска и работы катализатора контролируется температура газа на входе в реактор, температура каталитического блока. Эффективность работы катализатора характеризуется величиной степеней превращения метана и углекислого газа, а также количеством полученного синтез-газа, выраженного в объемных процентах. Состав исходной реакционной смеси и продукты реакции анализируется хроматографически. Изобретение иллюстрируется следующими примерами.
Пример 1. Из предварительно просушенных в инертной атмосфере (Ar) смесей порошков металлов алюминия марки АСД-4 и железа марки ОСЧ для получения оптимальной плотности, влияющей на протекание процесса СВС, готовят заготовку цилиндрической формы путем двустороннего прессования на настольном прессе с разборной пресс-формой и плавающим поршнем. Вследствие малой экзотермичности сгорания смеси порошков алюминия и железа теплового импульса недостаточно для полного осуществления реакции, поэтому проводится предварительный нагрев спрессованной заготовки и дальнейшая реакция протекает в режиме теплового взрыва.
СВС прессованных образцов проводят в бомбе постоянного давления объемом 3 л. Горение осуществляется в атмосфере аргона, давление которого составляет 0.1 МПа. К торцовой части прессованной заготовки подводится тепловой импульс с помощью вольфрамовой спирали, воспламеняя заготовку. При этом в поверхностном слое возбуждается химическая реакция, которая самопроизвольно распространяется в виде волны горения, бегущей вдоль оси заготовки, оставляя за собой остывающий продукт. Полученный в виде штабика образец затем дробится и просеивается. Для каталитических исследований отбирается фракция с размером частиц в пределах 600-400 мкм.
Реакцию риформинга осуществляют в кварцевом реакторе с неподвижным слоем катализатора, содержащем 1 см3 катализатора, путем подачи предварительно нагретого эквимолярного потока метана и углекислого газа при давлении 1 атм. Газохроматографический анализ и линии потока выходящего газа проводят, начиная с 600°С, и продолжают до 950°С. Время контакта 0,6 с. Объемная скорость исходной газовой смеси поддерживается 100 мл/мин. Мольное соотношение СО2:СН4=1:1. Активность катализатора приведена в таблице 1.
Пример 2. Синтез катализатора ведут аналогично описанному в примере 1, но перед сгоранием образцов дополнительно проводят механическую активацию смеси в течение 2 минут в шаровых мельницах с диаметром стальных шаров 5 мм.
Каталитические данные для катализатора приведены в таблице 2.
Таким образом, осуществление настоящего изобретения существенно расширяет сортимент катализаторов конверсии углеводородов, обладающих высокой каталитической активностью, теплопроводностью, механической прочностью, термостабильностью, устойчивостью к агрессивным средам, и повышает производительность процесса углекислотной конверсии метана при использовании этих катализаторов, получаемых из недорогостоящих, широко используемых металлов.
| Таблица 1 | ||||
| Каталитические данные для системы Fe3Al | ||||
| Катализатор Fe3Al | Т, К | Конверсия, % | Выход, мол.% | |
| CO2 | СН4 | СО | H2 | |
| 1223 | 96 | 94 | 44 | 48 |
| Таблица 2 | ||||
| Каталитические данные для системы Fe3Al, полученной СВС с предварительной механической активацией | ||||
| Катализатор Fe3Al | Т, К | Конверсия, % | Выход, мол.% | |
| CO2 | СН4 | СО | H2 | |
| 1223 | 99 | 94 | 49 | 45 |
1. Катализатор для процесса углекислотной конверсии легких углеводородов на основе интерметаллида, полученного самораспространяющимся высокотемпературным синтезом из экзотермической спрессованной порошковой смеси, отличающийся тем, что он представляет собой двухфазный продукт, основной фазой которого является алюминид железа - Fe3Al, причем фазы содержатся в следующих количествах, мас.%:
| Fe3Al | 90-95 |
| свободное железо | 5-10 |
2. Катализатор по п.1, отличающийся тем, что он получен самораспространяющимся высокотемпературным синтезом с предварительной механической активацией экзотермической порошковой смеси.
3. Способ углекислотной конверсии легких углеводородов с использованием катализатора на основе интерметаллида, полученного самораспространяющимся высокотемпературным синтезом из экзотермической порошковой смеси, отличающийся тем, что процесс проводят в присутствии катализатора по п.1 или 2.