Гетероциклилэфирзамещенные имидазохинолины
Иллюстрации
Показать всеИзобретение относится к имидазохинолинам, имеющим формулу (I) и (II), а также тетрагидроимидазохинолинам, имеющим формулу (III), в которых радикалы и символы имеют значения, указанные в формуле изобретения. Данные соединения и фармацевтические составы на их основе, представляющие предмет настоящего изобретения, могут стимулировать биосинтез различных цитокинов, в частности α-интерферона, и использоваться в лечении некоторых заболеваний, включая вирусные болезни и опухолевые заболевания. Объектами изобретения также являются способы лечения вирусных и опухолевых заболеваний и промежуточные соединения. 25 н. и 16 з.п. ф-лы, 2 табл.
Реферат
Настоящее изобретение касается имидазохинолиновых соединений, имеющих простую эфирную и гетероциклильную или гетероарильную группы в положении 1, и фармацевтических составов, содержащих такие соединения. Другой аспект настоящего изобретения затрагивает применение данных соединений в качестве иммуномодуляторов для стимулирования биосинтеза цитокинов в организме животных и для лечения заболеваний, включая вирусные болезни и опухолевые заболевания.
Первый надежный отчет о циклической системе 1Н-имидазо[4,5-с]хинолина (Бакман и др., J.Org.Chem. 15, 1278-1284 (1950)) описывает синтез 1-(6-метокси-8-хинолинил)-2-метил-1H-имидазо[4,5-с]хинолина для возможного применения в качестве противомалярийного средства. Далее поступило сообщение о синтезе различных замещенных 1H-имидазо[4,5-с]хинолинов. Так, например, было синтезировано соединение 1-[2-(4-пиперидил)этил]-1Н-имидазо[4,5-с]хинолин (Джейн и др., J.Med.Chem. 11, стр. 87-92 (1968)) в качестве предполагаемого противосудорожного и сердечно-сосудистого средства. Имелись также сообщения о ряде 2-оксоимидазо[4,5-с]хинолинов (Баранов и др., Chem.Abs. 85, 94362 (1976), Берени и др., J.Heterocyclic Chem. 18,1537-1540 (1981)).
Позже было обнаружено, что некоторые 1H-имидазо[4,5-с]хинолин-4-амины и их 1- и 2-замещенные производные могут найти применение как противовирусные средства, бронхолитические средства и иммуномодуляторы. В числе прочих публикаций можно сослаться на патенты США №№4689338, 4698348, 4929624, 5037986, 5268376, 5346905 и 5389640; все эти патенты приведены здесь в качестве ссылок.
Продолжают вызывать интерес имидазохилиновые циклические системы. Известны некоторые 1Н-имидазо[4,5-с]нафтиридин-4-амины, 1Н-имидазо[4,5-с]пиридин-4-амины и 1Н-имидазо[4,5-с]хинолин-4-амины, имеющие заместитель с простой эфирной группой в положении 1. Они описаны в патентах США №№5268376, 5389640 и 5494916 и в международной заявке WO 99/29693.
По-прежнему имеется потребность в соединениях, которые обладают способностью модулировать иммунную реакцию путем стимулирования биосинтеза цитокинов или под воздействием иных механизмов.
Краткое изложение сущности изобретения
Авторами был обнаружен новый класс соединений, способных стимулировать биосинтез цитокинов в организме животных. В соответствии с этим настоящее изобретение предлагает соединения имидазо[4,5-с]хинолин-4-амина и тетрагидроимидазо[4,5-с]хинолин-4-амина, имеющие заместитель с простой эфирной группой в положении 1. Согласно данным ИК-спектроскопии, эти соединения могут быть описаны формулами (I), (II), (III) и (IV). Ниже приведена общая структурная формула этих соединений
При этом X, R1, R2 и R определены для каждого класса соединений, имеющих формулы (I), (II), (III) и (IV).
Соединения, представленные формулами (I), (II), (III) и (IV), могут применяться в качестве модификаторов иммунной реакции вследствие их способности стимулировать биосинтез цитокинов и иными способами модулировать иммунную реакцию при введении в организм животных. Эти свойства делают указанные соединения полезными для лечения ряда заболеваний, таких как вирусные болезни и опухоли, реагирующие на изменения в иммунной реакции.
Настоящее изобретение касается также фармацевтических составов, содержащих соединения, модифицирующие иммунную реакцию, и способов стимулирования биосинтеза цитокинов в организме животных, лечения вирусной инфекции у животных и (или) лечения опухолевых заболеваний у животных путем введения им соединений формулы (I), (II), (III) или (IV).
Кроме того, настоящее изобретение затрагивает способы синтеза соединений, представленных в нем, и промежуточных продуктов, используемых при синтезе данных соединений.
Подробное описание изобретения
Как указывалось выше, обнаружены некоторые соединения, стимулирующие биосинтез цитокинов и модифицирующие иммунную реакцию в организме животных. Такие соединения представлены формулами (I), (II), (III) и (IV), приведенными ниже.
Имидазохинолиновые соединения, составляющие предмет настоящего изобретения и имеющие простую эфирную группу, а также гетероциклильный или гетероарильный заместитель в положении 1, представлены формулой (I):
где Х представляет собой -CHR3-, -CHR3-алкильную- или -CHR3-алкенильную группу;
R1 выбран из группы, содержащей радикалы:
- гетероарил;
- гетероциклил;
- R4-гетероарил, а также
- R4-гетероциклил;
- R2 выбран из группы, содержащей радикалы:
- водород;
- алкил;
- алкенил;
- арил;
- гетероарил;
- гетероциклил;
- алкил-Y-алкил;
- алкил-Y-алкенил;
- алкил-Y-арил, а также
- алкил или алкенил, с одним или несколькими заместителями, выбранными из группы, содержащей радикалы:
- ОН;
- галоген;
- N(R3)2;
- CO-N(R3)2;
- СО-С1-10алкил;
- CO-O-C1-10алкил;
- N3;
- арил;
- гетероарил;
- гетероциклил;
- СО-арил, а также
- СО-гетероарил;
R4 представляет собой алкил или алкенил, в который может войти одна или несколько -О-групп;
каждый R3 представляет собой независимо Н или C1-10алкил;
каждый Y представляет собой независимо -О- или -S(O)0-2-;
значение n может изменяться от 0 до 4, а также каждый R выбран независимо из группы, состоящей из радикалов C1-10алкил, C1-10алкокси, гидрокси, галоген и трифторметил;
или же соль фармацевтического качества указанных соединений. Настоящее изобретение также включает в себя имидазохинолиновые соединения, несущие простую эфирную группу в положении 1, причем заместитель с простой эфирной группой также содержит алкинильную группу и гетероциклильную или гетероарильную группу. Такие соединения представлены формулой (II):
где Х представляет собой -CHR3-, -CHR3-алкильную- или -CHR3-алкенильную группу;
R10 выбран из группы, содержащей гетероарильный или гетероциклильный радикалы;
R2 выбран из группы, содержащей радикалы:
- водород;
- алкил;
- алкенил;
- арил;
- гетероарил;
- гетероциклил;
- алкил-Y-алкил;
- алкил-Y-алкенил;
- алкил-Y-арил, а также
- алкил или алкенил с одним или несколькими заместителями, выбранными из группы, содержащей радикалы:
- ОН;
- галоген;
- N(R3)2;
- СО-N(R3)2;
- CO-C1-10алкил;
- СО-О-C1-10алкил;
- N3;
- арил;
- гетероарил;
- гетероциклил;
- СО-арил, а также
- СО-гетероарил;
n может иметь значение от 0 до 4;
каждый Rз представляет собой независимо Н или C1-10алкил;
каждый Y представляет собой независимо -О- или -S(O)0-2-, а также каждый R выбран независимо из группы, состоящей из радикалов C1-10алкил, C1-10алкокси, гидрокси, галоген и трифторметил;
или же соль фармацевтического качества указанных соединений.
Настоящее изобретение также включает в себя тетрагидроимидазохинолиновые соединения, несущие простую эфирную группу и гетероциклильный или гетероарильный заместитель в положении 1. Такие тетрагидроимидазохинолиновые соединения представлены формулой (III):
где Х представляет собой -CHR3-, -CHR3-алкильную- или -CHR3-алкенильную группу;
R1 выбран из группы, содержащей радикалы:
- гетероарил;
- гетероциклил;
- R4-гетероарил, а также
- R4-гетероциклил;
R2 выбран из группы, содержащей радикалы:
- водород;
- алкил;
- алкенил;
- арил;
- гетероарил;
- гетероциклил;
- алкил-Y-алкил;
- алкил-Y-алкен ил;
- алкил-Y-арил, а также
- алкил или алкенил с одним или несколькими заместителями, выбранными из группы, содержащей радикалы:
- ОН;
- галоген;
- N(R3)2;
- СО-N(R3)2;
- CO-C1-10алкил;
- CO-O-C1-10алкил;
- N3;
- арил;
- гетероарил;
- гетероциклил;
- СО-арил, а также
- СО-гетероарил;
R4 представляет собой алкил или алкенил, в который может войти одна или несколько -О-групп;
каждый R3 представляет собой независимо Н или C1-10алкил;
каждый Y представляет собой независимо -О- или -S(O)0-2-;
n может иметь значение от 0 до 4;
каждый R выбран независимо из группы, состоящей из радикалов C1-10алкил, C1-10 алкокси, гидрокси, галоген и трифторметил;
или же соль фармацевтического качества указанных соединений.
Дополнительным классом соединений-модификаторов иммунной реакцией в настоящем изобретении являются тетрагидроимидазохинолиновые соединения, несущие простую эфирную группу в положении 1, причем заместитель с простой эфирной группой также содержит алкинильную группу и гетероциклильную или гетероарильную группу. Такие тетрагидроимидазохинолиновые соединения представлены формулой (IV):
где
Х является -CHR3-, -CHR3-алкильной- или -CHR3-алкенильной группой;
R10 выбран из группы, содержащей гетероарильный и гетероциклильный радикалы;
R2 выбран из группы, содержащей радикалы:
- водород;
- алкил;
- алкенил;
- арил;
- гетероарил;
- гетероциклил;
- алкил-Y-алкил;
- алкил-Y-алкенил;
- алкил-Y-арил, а также
- алкил или алкенил с одним или несколькими заместителями, выбранными из группы, содержащей радикалы:
- ОН;
- галоген;
- N(R3)2;
- CO-N(R3)2;
- CO-C1-10алкил;
- CO-O-C1-10алкил;
- N3;
- арил;
- гетероарил;
- гетероциклил;
- СО-арил, а также
- СО-гетероарил;
каждый R3 представляет собой независимо Н или C1-10алкил;
каждый Y представляет собой независимо -О- или -S(O)0-2-;
n может иметь значение от 0 до 4, а также
каждый R выбран независимо из группы, состоящей из радикалов C1-10алкил, C1-10алкокси, гидрокси, галоген и трифторметил;
или же соль фармацевтического качества указанных соединений.
Получение соединений
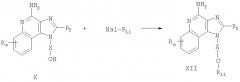
Соединения, представляющие собой предмет настоящего изобретения, можно получить по реакционной схеме I, в которой R, R2, Х и n определены выше, a R11 представляет собой алкил, замещенный гетероарильной группой, причем эта гетероарильная группа может быть незамещенной или иметь заместители, как определено ИК-спектроскопией; или же R11 может быть замещенным гетероарилом, как определено ИК-спектроскопией, с условием, что если R11 является замещенным гетероарилом, то по меньшей мере один заместитель должен быть сильной электроноакцепторной группой, расположенной в положении орто- или пара- к простой эфирной связи.
В схеме 1 реакции 4-амино-1H-имидазо[4,5-с]хинолин-1-иловый спирт (формула X) алкилируют галогенидом (формула XI), получая 1Н-имидазо[4,5-с]хинолин-4-амин (формула XII), являющийся подвидом соединения формулы I. Из спирта (формула X) в результате реакции с гидридом натрия в соответствующем растворителе, например N,N-диметилформамиде, получают алкоксид. Далее галогенид добавляют к реакционной смеси. Реакцию можно проводить при температуре окружающей среды или при осторожном нагревании (прибл. 50°С) в случае необходимости. Продукт или его соль фармацевтического качества могут быть выделен обычными способами.
Известны многие соединения формулы X, например соединения, полученные Герстером (патент США №4689338) и Герстером и др. (патент США №5605899). Сущность этих патентов включена в настоящий документ в качестве ссылок. Другие соединения могут быть получены без затруднений с применением известных приемов синтеза: см., например, патенты США №5578727 (Андре и др.), 5175296 (Герстер), 5395937 (Николаидес и др.), 5741908 (Герстер и др.), сущность которых раскрыта в настоящем документе в качестве ссылок. Многие галогениды формулы XI коммерчески доступны; прочие можно получить без затруднений с применением известных способов синтеза.
Схема I реакции
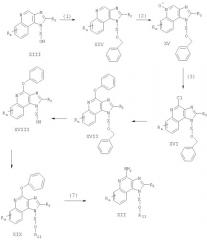
Соединения, представляющие собой предмет настоящего изобретения, можно получать в соответствии со схемой II реакции, где R, R2, R11, X и n определены выше.
На стадии (1) процесса (схема II реакции) гидроксильная группа 1H-имидазо[4,5-с]хинолин-1-илового спирта формулы XIII защищена бензильной группой. Спирт формулы XIII реагирует с гидридом натрия в соответствующем растворителе, например в N,N-диметилформамиде, образуя алкоксид. Далее алкоксид алкилируют бензилбромидом и получают соединение формулы XIV.
Реакцию можно проводить при температуре окружающей среды. Известны многие соединения формулы XIII, например соединение, полученное Герстером (патент США 4689338); другие можно получить, используя известные способы синтеза; см., например, данные Герстера и др. (патент США №5605899) и данные Герстера (патент США №5175296).
На стадии (2) процесса (схема II реакции) соединение формулы XIV окисляют до 1H-имидазо[4,5-с]хинолин-5N-оксида (формула XV) с применением обычного окислителя, способного образовывать N-оксиды. Предпочтительно проводить окисление раствора соединения формулы XIV в хлороформе или дихлорметане с применением 3-хлорпероксибензойной кислоты при температуре окружающей среды.
На стадии (3) процесса (схема II реакции) 1H-имидазо[4,5-с]хинолин-5N-оксид (формула XV) подвергают хлорированию и получают 4-хлор-1Н-имидазо[4,5-с]хинолин (формула XVI). Предпочтительно раствор соединения формулы XV в соответствующем растворителе, например в толуоле, обработать оксихлоридом фосфора при температуре окружающей среды.
На стадии (4) процесса (схема II реакции) 4-хлор-1Н-имидазо[4,5-с]хинолин формулы XVI взаимодействует с фенолом, образуя 4-фенокси-1Н-имидазо[4,5-хинолин формулы XVII. Данный фенол реагирует с гидридом натрия в соответствующем растворителе, например диглиме, образуя феноксид. Далее феноксид реагирует при повышенной температуре с соединением формулы XVI.
На стадии (5) процесса (схема II реакции) защитную бензильную группу удаляют из состава соединения формулы XVII и получают 4-фенокси-1Н-имидазо[4,5-с]хинолин-1 -иловый спирт формулы XVIII. Реакцию предпочтительно проводить путем осторожного добавления трифторуксусной кислоты к раствору соединения формулы XVII в соответствующем растворителе, таком как дихлорметан, при температуре окружающей среды.
На стадии (6) процесса (схема II реакции) 4-фенокси-1Н-имидазо[4,5-с]хинолин-1 -иловый спирт формулы XVIII алкилируют галогенидом Hal-R11, получая 4-фенокси-1Н-имидазо[4,5-с]хинолин-1-иловый простой эфир формулы XIX. Алкоксид соединения формулы XVIII получают путем добавления указанного спирта к двухфазной смеси 50 %-ного водного раствора гидроксида натрия и инертного растворителя, такого как дихлорметан, в присутствии катализатора фазового переноса, например бензилтриметиламмонийхлорида. Далее алкоксид алкилируют. Реакцию можно проводить при температуре окружающей среды.
На стадии (7) процесса (схема II реакции) 4-фенокси-1Н-имидазо[4,5-хинолин-1-иловый простой эфир формулы XIX аминируют и получают 1Н-имидазо[4,5-с]хинолин-4-амин формулы XII, являющийся подвидом соединения формулы I. Реакцию можно проводить путем добавления соединения формулы XIX к ацетату аммония и нагревания полученной смеси при температуре около 150°С. Продукт или его соль фармацевтического качества могут быть выделены с применением обычных способов.
Схема II реакции
Тетрагидроимидазохинолины, представляющие собой предмет настоящего изобретения, можно получать в соответствии со схемой III реакции, где R, R2, R11, X и n определены выше.
В схеме III реакции 4-амино-6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин-1-иловый спирт формулы XX алкилируют галогенидом формулы XI и получают 6,7,8,9-тетрагидро-1H-имидазо[4,5-с]хинолин-4-амин формулы XXI, являющийся подвидом соединения формулы III. Спирт формулы XX реагирует с гидридом натрия в соответствующем растворителе, таком как N,N-диметилформамид, образуя алкоксид. Далее алкоксид реагирует с упомянутым галогенидом. Реакцию можно проводить при температуре окружающей среды. Продукт или его соль фармацевтического качества можно выделить, пользуясь известными способами.
Известны многие тетрагидро-1H-имидазо[4,5-с]хинолины формулы XX; см., например, патент США №5352784 (Николаидес и др.). Другие соединения можно получить, используя известные способы синтеза; см., например, патент США №5693811 (Линдстром). Сущность этих патентов раскрыта в настоящем документе в качестве ссылок.
Схема III реакции
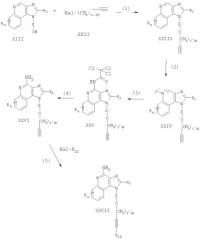
Соединения, представляющие собой предмет настоящего изобретения, могут быть получены в соответствии со схемой IV реакции, где R, R2, Х и n определены выше, a R12 является гетероарильной группой, которая может быть незамещенной или замещенной, как определено ИК-спектроскопией.
На стадии (1) процесса (схема IV реакции) 1Н-имидазо[4,5-с]хинолин-1-иловый спирт (формула XIII) алкилируют галогенидом (формула XXII), получая 1Н-имидазо[4,5-с]хинолин-1-иловый простой эфир (формула XXIII). Соединение формулы XIII и галогенид (формула XXII) взаимодействуют в двухфазной смеси 50 %-ного водного раствора гидроксида натрия и подходящего растворителя, например дихлорметана, в присутствии катализатора фазового переноса, такого как бензилтриметиламмонийхлорид. Реакцию можно проводить при температуре окружающей среды.
На стадии (2) процесса (схема IV реакции) 1Н-имидазо[4,5-с]хинолин (формула XXIII) окисляют до 1H-имидазо[4,5-с]хинолин-5N-оксида (формула XXIV) по способу, описанному на стадии (2) схемы II реакции.
На стадии (3) процесса (схема IV реакции) 1Н-имидазо[4,5-с]хинолин-5N-оксид (формула XXIV) взаимодействует с трихлорацетилизоцианатом, образуя 1Н-имидазо[4,5-с]хинолин-4-ил-ацетамид (формула XXV). Предпочтительно вводить изоцианат с осторожностью в раствор 5N-оксида в соответствующем растворителе, например дихлорметане, при температуре окружающей среды.
На стадии (4) процесса (схема IV реакции) 1Н-имидазо[4,5-с]хинолин-4-ил-ацетамид (формула XXV) гидролизуют до 1Н-имидазо[4,5-с]хинолин-4-амина (формула XXVI). Гидролиз можно выполнять обычными способами, предпочтительно путем обработки раствора соединения формулы XXV в метаноле метоксидом натрия.
На стадии (5) процесса (схема IV реакции) 1Н-имидазо[4,5-с]хинолин-4-амин (формула XXVI) реагирует с галогенидом формулы Hal-R12 в присутствии катализатора - соединения переходного металла - с образованием 1Н-имидазо[4,5-с]хинолин-4-амина (формула XXVII), являющегося подвидом соединения формулы II. Реакцию между соединением формулы XXVI и галогенидом предпочтительно осуществлять в присутствии йодида меди (I), дихлорбис(трифенилфосфин)палладия (II) и избытка триэтиламина в соответствующем растворителе, например в N,N-диметилформамиде или ацетонитриле. Предпочтительно проводить эту реакцию при повышенной температуре (60-80°С). Продукт или его соль фармацевтического качества можно выделить, пользуясь известными способами.
Схема IV реакции
Соединения, представляющие собой предмет настоящего изобретения, можно получать в соответствии со схемой V реакции, где R, R2, R12, Х и n определены выше, а ВОС является трет-бутоксикарбонилом.
На стадии (1) процесса (схема V реакции) аминогруппа 1Н-имидазо[4,5-с]хинолин-4-амина формулы XXVI защищена трет-бутоксикарбонильными группами. Соединение формулы XXVI взаимодействует с ди-трет-бутилдикарбонатом в соответствующем растворителе, например в N,N-диметилформамиде, в присутствии 4-(диметиламино)пиридина и триэтиламина. Реакцию выполняют при повышенной температуре (80-85°С).
На стадии (2) процесса (схема V реакции) защищенный 1Н-имидазо[4,5-с]хинолин-4-амин формулы XXVIII реагирует с галогенидом формулы Hal-R12 в присутствии катализатора - соединения переходного металла - с образованием защищенного 1H-имидазо[4,5-с]хинолин-4-амина формулы XXIX. Реакцию между соединением формулы XXVIII и галогенидом предпочтительно осуществлять в присутствии йодида меди (I), дихлорбис(трифенилфосфин)палладия (II) и избытка триэтиламина в соответствующем растворителе, например в N,N-диметилформамиде или ацетонитриле. Реакция может быть проведена при температуре окружающей среды или при повышенной температуре (40-80°С).
На стадии (3) процесса (схема V реакции) защитные группы убирают путем гидролиза в кислотной среде и получают 1H-имидазо[4,5-с]хинолин-4-амин формулы XXVII, являющийся подвидом соединения формулы II. Предпочтительно соединение формулы XXIX обработать трифторуксусной кислотой в подходящем растворителе, например в дихлорметане. Реакцию можно проводить при температуре окружающей среды или пониженной (0°С) температуре. Продукт или его соль фармацевтического качества можно выделить, пользуясь известными способами.
На стадии (4) процесса (схема V реакции) алкинную связь защищенного 1Н-имидазо[4,5-с]хинолин-4-амина формулы XXIX восстанавливают до защищенного 1Н-имидазо[4,5-с]хинолин-4-амина формулы XXX. Предпочтительно проводить восстановление с применением обычно используемого гетерогенного катализатора гидрогенизации, такого как оксид платины, платина на углероде или палладий на углероде. Реакцию удобно осуществлять в аппарате Парра в соответствующем растворителе, например метаноле.
На стадии (5) процесса (схема V реакции) удаляют защитные группы соединения формулы XXX таким же способом, как на стадии (3), получая 1Н-имидазо[4,5-с]хинолин-4-амин формулы XXXI, являющийся подвидом соединения формулы I. Продукт или его соль фармацевтического качества можно выделить, пользуясь известными способами.
Схема V реакции
Соединения, представляющие собой предмет настоящего изобретения, можно получать в соответствии со схемой VI реакции, где R, R2, R12, X и n определены выше, a CBZ является бензилоксикарбонилом.
На стадии (1) процесса (схема VI реакции) аминогруппа 1Н-имидазо[4,5-с]хинолин-4-амина формулы XXVI защищена бензилоксикарбонильными группами. Соединение формулы XXVI взаимодействует с дибензилдикарбонатом в соответствующем растворителе, например в N,N-диметилформамиде. Реакцию можно проводить при температуре окружающей среды или слегка повышенной (40°С) температуре.
На стадии (2) процесса (схема VI реакции) защищенный 1H-имидазо[4,5-с]хинолин-4-амин формулы XXXII реагирует с галогенидом формулы Hal-R12 в присутствии катализатора - соединения переходного металла - с образованием защищенного 1H-имидазо[4,5-с]хинолин-4-амина формулы XXXIII. Реакцию между соединением формулы XXXII и галогенидом предпочтительно осуществлять в присутствии йодида меди (I), дихлорбис(трифенилфосфин)палладия (II) и избытка триэтиламина в соответствующем растворителе, например в N,N-диметилформамиде или ацетонитриле. Реакция может быть проведена при температуре окружающей среды или при повышенной температуре (40-80°С).
На стадии (3) процесса (схема VI реакции) защитные группы убирают путем гидролиза и в результате получают 1H-имидазо[4,5-с]хинолин-4-амин формулы XXVII, являющийся подвидом соединения формулы II. Предпочтительно соединение формулы XXXIII обработать метоксидом натрия в подходящем растворителе, например в метаноле. Реакцию можно проводить при температуре окружающей среды. Продукт или его соль фармацевтического качества можно выделить, пользуясь известными способами.
На стадии (4) процесса (схема VI реакции) защитные группы соединения формулы XXXIII удаляют гидрогенолизом; при этом алкинная связь восстанавливается, что в результате приводит к образованию 1Н-имидазо[4,5-с]хинолин-4-амина формулы XXXI, являющегося подвидом соединения формулы I. Предпочтительно проводить гидрогенолиз/восстановление с применением гидроксида палладия на углероде. Реакцию удобно осуществлять в аппарате Парра в соответствующем растворителе, например в метаноле. Продукт или его соль фармацевтического качества можно выделить, пользуясь известными способами.
Схема VI реакции
Соединения, представляющие собой предмет настоящего изобретения, можно получать в соответствии со схемой VII реакции, где R, R1, R2, X и n определены выше.
На стадии (1) процесса (схема VII реакции) 2,4-дихлор-3-нитрохинолин (формула XXXIV) реагирует с амином формулы R1-O-X-NH2, образуя 2-хлор-3-нитрохинолин-4-амин формулы XXXV. Реакцию можно проводить путем добавления амина к раствору соединения формулы XXXIV в соответствующем растворителе, например в хлороформе или дихлорметане, при возможном нагревании. Известны различные хинолины формулы XXXIV; некоторые можно получать, пользуясь известными способами (см., например, патент США №4988815, выданный на имя Андре и др., и ссылки, содержащиеся в нем).
На стадии (2) процесса (схема VII реакции) 2-хлор-3-нитрохинолин-4-амин формулы XXXV восстанавливают до 2-хлорхинолин-3,4-диамина (формула XXXVI). Реакцию предпочтительно проводить с применением обычного гетерогенного катализатора гидрогенизации, например платины на углероде или палладия на углероде. Реакцию удобно осуществлять в аппарате Парра в подходящем растворителе, например в изопропаноле или толуоле.
На стадии (3) процесса (схема VII реакции) 2-хлорхинолин-3,4-диамин (формула XXXVI) реагирует с карбоновой кислотой или ее эквивалентом, образуя 4-хлор-1Н-имидазо[4,5-с]хинолин формулы XXXVII. В число подходящих эквивалентов карбоновой кислоты входят сложные ортоэфиры и 1,1-диалкоксиалкилалканоаты. Карбоновую кислоту или ее эквивалент выбирают так, чтобы в состав соединения формулы XXXVII входил требуемый заместитель R2. Так, например, при введении триэтилортоформиата образуется соединение, в котором R2 является водородом; в присутствии триэтилортоацетата R2 представляет собой метил. Реакцию можно проводить в отсутствие растворителя или в инертном растворителе, таком как толуол. Реакция протекает с разогревом, достаточным для того, чтобы любой спирт или вода, образующиеся как побочные продукты, улетучились. В качестве варианта можно воспользоваться катализатором, таким как пиридингидрохлорид.
В качестве альтернативы можно выполнить стадию (3) путем (I) проведения реакции между диамином формулы XXXVI и ацилгалогенидом формулы R2C(O)CI и (ii) циклизации. В части (i) ацилгалогенид добавляют к раствору диамина в инертном растворителе, например в ацетонитриле, пиридине или дихлорметане. Эту реакцию можно проводить при температуре окружающей среды. В части (ii) продукт части (i) нагревают в спиртовом растворе в присутствии основания. Предпочтительно нагревать этанольный раствор продукта части (i) в присутствии избытка триэтиламина при нагревании с обратным холодильником или же нагревать в метанольном растворе аммиака. С другой стороны, если часть (i) была проведена в пиридине, то часть (ii) можно осуществить путем нагревания реакционной смеси после того, как анализ укажет на завершение части (i).
На стадии (4) процесса (схема VII реакции) 4-хлор-1H-имидазо[4,5-с]хинолин формулы XXXVII аминируют, получая 1H-имидазо[4,5-с]хинолин-4-амин формулы I. Реакцию осуществляют при нагревании (например, при температуре 125-175°С) соединения формулы XXXVII под давлением в герметизированном реакторе в присутствии раствора аммиака в алканоле. Продукт или его соль фармацевтического качества можно выделить, пользуясь известными способами.
Схема VII реакции
Соединения, представляющие собой предмет настоящего изобретения, можно получать в соответствии со схемой VIII реакции, где R, R1, R2, Х и n определены выше.
По схеме VIII реакции 1Н-имидазо[4,5-с]хинолин-4-амин формулы XXXVIII алкилируют галогенидом формулы XXXIX, получая 1H-имидазо[4,5-с]хинолин-4-амин формулы I. Соединение формулы XXXVIII обрабатывают гидридом натрия в соответствующем растворителе, например в N,N-диметилформамиде. Далее галогенид вводят в реакционную смесь. Реакцию можно проводить при повышенной температуре (прибл. 100°С). Алкилирование происходит по атомам азота N1 и N3; требуемый N1-изомер можно легко отделить от N3-изомера, применяя известные способы, такие как хроматографию на колонке и рекристаллизацию.
Известны многие 1H-имидазо[4,5-с]хинолин-4-амины формулы XXXVIII; другие могут быть приготовлены с использованием известных способов синтеза: см., например, патент США №5756747 (Герстер) и приведенные в нем ссылки.
Схема VIII реакции
Соединения, представляющие собой предмет настоящего изобретения, можно получать в соответствии со схемой IX реакции, где R, R1, R2, Х и n определены выше.
На стадии (1) процесса (схема IX реакции) 4-нитротетразоло[1,5-а]хинолин-5-ол формулы XL хлорируют, получая 5-хлор-4-нитротетразоло[1,5-а]хинолин (формула XLI). Можно применять обычные хлорирующие вещества. Предпочтительно проводить эту реакцию с применением оксихлорида фосфора в соответствующем растворителе, например в N,N-диметилформамиде. 4-Нитротетразоло[1,5-а]хинолин-5-олы формулы XL хорошо известны или могут быть получены, используя известные способы синтеза (см., например, патент США №5741908 (Герстер) и приведенные в нем ссылки).
На стадии (2) процесса (схема IX реакции) 5-хлор-4-нитротетразоло[1,5-а]хинолин (формула XLI) реагирует с амином формулы R1-O-X-NH2, образуя 4-нитротетразоло[1,5-а]хинолин-5-амин (формула XLII). Реакцию можно выполнять путем добавления амина к раствору соединения формулы XLI в соответствующем растворителе, например в дихлорметане, в присутствии триэтиламина.
На стадии (3) процесса (схема IX реакции) 4-нитротетразоло[1,5-а]хинолин-5-амин (формула XLII) восстанавливают по способу, описанному для стадии (2) схемы VII реакции, получая тетразоло[1,5-а]хинолин-4,5-диамин (формула XLIII).
На стадии (4) процесса (схема IX реакции) тетразоло[1,5-а]хинолин-4,5-диамин (формула XLIII) циклизуют по способу, описанному для стадии (3) схемы VII реакции, получая 6Н-имидазо[4,5-с]тетразоло[1,5-а]хинолин (формула XLIV).
На стадии (5) процесса (схема IX реакции) 6Н-имидазо[4,5-с]тетразоло[1,5-а]хинолин (формула XLIV) восстанавливают, получая 1Н-имидазо[4,5-с]хинолин-4-амин формулы I. Стадия (5) включает в себя (i) взаимодействие соединения формулы XLIV с трифенилфосфином и (ii) гидролиз. Часть (i) можно выполнить путем проведения реакции между соединением формулы XLIV и трифенилфосфином в подходящем растворителе, таком как 1,2-дихлорбензол, при нагревании. Часть (ii) представляет собой гидролиз продукта части (i). Гидролиз можно выполнить, используя известные способы, такие как нагревание в присутствии воды или низшего алканола; в качестве варианта можно ввести катализатор, например гидроксид щелочного металла или низший алкоксид. Продукт или его соль фармацевтического качества можно выделить, пользуясь известными способами.
Схема IX реакции
Тетрагидроимидазохинолины, представляющие собой предмет настоящего изобретения, можно получать в соответствии со схемой Х реакции, где R, R2, R12, Х и n определены выше.
На стадии (1) процесса (схема Х реакции) 4-амино-6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин-1-иловый спирт формулы XX алкилируют по способу, описанному для схемы III реакции, применяя галогенид формулы Hal-(CH2)1-10-CH=CH, получая 6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин-4-амин формулы XLV.
На стадии (2) процесса (схема Х реакции) 6,7,8,9-тетрагидро-1Н-имидазо[4,5-хинолин-4-амин формулы XLV взаимодействует с галогенидом формулы Hal-R12 по способу, описанному для стадии (5) схемы IV реакции, образуя 6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин-4-амин формулы XLIV, являющийся подвидом соединения формулы IV. Продукт или его соль фармацевтического качества можно выделить, пользуясь известными способами.
Схема Х реакции
Соединения, представляющие собой предмет настоящего изобретения, можно получать в соответствии со схемой XI реакции, где R, R1, R2, Х и n определены выше.
На стадии (1) процесса (схема XI реакции) 2,4-дигидрокси-3-нитро-6,7,8,9-тетрагидрохинолин (формула XLVII) хлорируют, получая 2,4-дихлор-3-нитро-6,7,8,9-тетрагидрохинолин (формула XLVIII). Здесь можно использовать обычные хлорирующие вещества. Предпочтительно проводить реакцию путем смешивания соединения формулы XLVII с оксихлоридом фосфора с последующим нагреванием (55-85°С). Соединения формулы XLVII хорошо известны или могут быть получены, используя стандартные способы синтеза (см., например, патент США №5352784 (Николаидес и др.) и содержащиеся в нем ссылки).
На стадии (2) процесса (схема XI реакции) 2,4-дихлор-3-нитро-6,7,8,9-тетрагидрохинолин (формула XLVIII) взаимодействует с амином формулы R1-O-X-NH2, образуя 2-хлор-3-нитро-6,7,8,9-тетрагидрохинолин-4-амин (формула XLIX). Реакцию можно проводить путем добавления амина к раствору соединения формулы XLVIII в подходящем растворителе, например в N,N-диметилформамиде, при нагревании (55-65°С).
На стадии (3) процесса (схема XI реакции) 2-хлор-3-нитро-6, 7,8,9-тетрагидрохинолин-4-амин (формула XLIX) реагирует с фенолом по способу, описанному для стадии (4) схемы II реакции, с образованием 2-фенокси-3-нитро-6,7,8,9-тетрагидрохинолин-4-амина (формула L).
На стадии (4) процесса (схема XI реакции) 2-фенокси-3-нитро-6,7,8,9-тетрагидрохинолин-4-амин (формула L) восстанавливают по способу, описанному для стадии (2) схемы VII реакции, получая 2-фенокси-6,7,8,9-тетрагидрохинолин-3,4-диамин (формула LI).
На стадии (5) процесса (схема XI реакции) 2-фенокси-6,7,8,9-тетрагидрохинолин-3,4-диамин (формула LI) циклируют по способу, описанному для стадии (3) схемы VII реакции, получая 4-фенокси-6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин (формула LII).
На стадии (6) процесса (схемы XI реакции) 4-фенокси-6,7,8,9-тетрагидро-1H-имидазо[4,5-с]хинолин (формула LII) аминируют по способу, описанному для стадии (7) схемы II реакции, получая 6,7,8,9-тетрагидро-1H-имидазо[4,5-с]хинолин-4-амин (формула III).
Схема XI реакции
Настоящее изобретение также включает в себя новые соединения, которые можно использовать в качестве промежуточных продуктов при синтезе соединений формул (I), (II), (III) и (IV). Эти промежуточные соединения характеризуются структурными формулами (V)-(IX) и (XLIV) и описаны более подробно ниже.
Один класс промежуточных соединений имеет формулу (V):
где Х является -CHR3-, -CHR3-алкильной- или -CHR3-алкенильной группой;
R1 выбран из группы, содержащей радикалы:
- гетероарил;
- гетероциклил;
- R4-гетероарил;
- R4-гетероциклил; а также
- (CH2)1-10-C=C-R10; R2 выбран из группы, содержащей радикалы:
- водород;
- алкил;
- алкенил;
- арил;
- гетероарил;
- гетероциклил;
- алкил-Y-алкил;
- алкил-Y-алкенил;
- алкил-Y-арил, а также
- алкил или алкенил с одним или несколькими заместителями, выбранными из группы, содержащей радикалы:
- ОН;
- галоген;
- N(R3)2;
- СО-N(R3)2;
- CO-C1-10алкил;
- СО-О-C1-10алкил;
- N3;
- арил;
- гетероарил;
- гетероциклил;
- СО-арил, а также
- СО-гетероарил;
R4 представляет собой алкил или алкенил, в который может войти одна или несколько -О-групп;
каждый r3 представляет собой независимо Н или C1-10алкил;
R10 представляет собой гетероарил или гетероциклил;
каждый Y представляет собой независимо -О- или -S(O)0-2-;
n может иметь значение от 0 до 4;
каждый R выбран независимо из группы, состоящей из радикалов C1-10алкил, C1-10алкокси, гидрокси, галоген и трифторметил;
или же соль фармацевтического качества указанных соединений.
Еще одним классом промежуточных продуктов являются имидазохинолин-4-фенокси-соединения формулы (VI):
где Х является -CHR3-, -CHR3-алкильной- или -CHR3-алкенильной группой;
R1 выбран из группы, содержащей радикалы:
- гетероарил;
- гетероциклил;
- R4-гетероарил;
- R4-гетероциклил, а также
- (CH2)1-10-C=C-R10;
R2 выбран из группы, содержащей радикалы:
- водород;
- алкил;
- алкенил;
- арил;
- гетероарил;
- гетероциклил;
- алкил-Y-алкил;
- алкил-Y-алкенил;
- алкил-Y-арил; а также
- алкил или алкенил с одним или несколькими заместителями, выбранными из группы, содержащей радикалы:
- ОН;
- галоген;
- N(R3)2;
- CO-