Гидронопольные производные в качестве агонистов по отношению к orl1 рецепторам человека
Иллюстрации
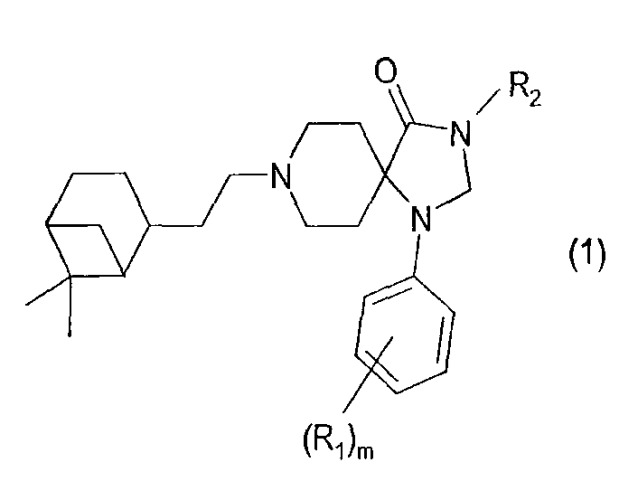
Показать всеИзобретение относится к новым соединениям общей формулы (1)
в которой: R1 представляет собой атом водорода, галоген, CF3, (1-3С)алкоксигруппу, m является целым числом от 1 до 4, при условии, что, когда m равно 2, 3 или 4, заместители R1 могут быть или одинаковыми или различными, R2 представляет собой атом водорода, алкильную (1-6С) группу, необязательно замещенную алкоксигруппой, циклоалкильную (3-6С) группу, -СН2ОН, -СН2ОСН3, ацетильную группу, бензильную группу, необязательно замещенную аминогруппой, или группу Q следующей структуры (2):
в которой: []n символически изображает -(СН2)n-, где n является целым числом от 0 до 7, R3 представляет собой атом водорода или алкильную (1-3С) группу, R4 представляет собой атом водорода, алкильную (1-6С) группу, необязательно замещенную одной или более группами, выбранными из алкильной группы, арильной группы, фтора, хлора, брома, гидроксильной группы, алкилоксигруппы, арилоксигруппы, ацилоксигруппы, аминогруппы, алкиламиногруппы, диалкиламиногруппы, ариламиногруппы, тиогруппы, алкилтиогруппы, арилтиогруппы, цианогруппы, оксогруппы, нитрогруппы, ацильной группы, амидогруппы, алкиламидогруппы, диалкиламидогруппы, карбоксильной группы, насыщенное, ненасыщенное или частично насыщенное моно- или дициклическое 5-10-членное кольцо, необязательно замещенное одной или более группами, выбранными из алкильной группы, арильной группы, фтора, хлора, брома, гидроксильной группы, алкилоксигруппы, арилоксигруппы, ацилоксигруппы, аминогруппы, алкиламиногруппы, диалкиламиногруппы, ариламиногруппы, тиогруппы, алкилтиогруппы, арилтиогруппы, цианогруппы, оксогруппы, нитрогруппы, ацильной группы, амидогруппы, алкиламидогруппы, диалкиламидогруппы, карбоксильной группы, или алкильную (1-3С) группу, замещенную насыщенным, ненасыщенным или частично насыщенным пяти- или шестичленным кольцом, которое необязательно содержит один или более гетероатомов, таких как атом азота, атом кислорода или атом серы, необязательно замещенным одной или более группами, выбранными из алкильной группы, арильной группы, фтора, хлора, брома, гидроксильной группы, алкилоксигруппы, арилоксигруппы, ацилоксигруппы, аминогруппы, алкиламиногруппы, диалкиламиногруппы, ариламиногруппы, тиогруппы, алкилтиогруппы, арилтиогруппы, цианогруппы, оксогруппы, нитрогруппы, ацильной группы, амидогруппы, алкиламидогруппы, диалкиламидогруппы, карбоксильной группы, или (R3+R4) вместе с атомом азота, к которому они присоединены, представляют собой насыщенное, ненасыщенное или частично насыщенное моно- или дициклическое пяти- или шестичленное кольцо, которое необязательно содержит один или более гетероатомов, таких как атом азота, атом кислорода или атом серы, необязательно замещенным одной или более группами, выбранными из алкильной группы, арильной группы, фтора, хлора, брома, гидроксильной группы, алкилоксигруппы, арилоксигруппы, ацилоксигруппы, аминогруппы, алкиламиногруппы, диалкиламиногруппы, ариламиногруппы, тиогруппы, алкилтиогруппы, арилтиогруппы, цианогруппы, оксогруппы, нитрогруппы, ацильной группы, амидогруппы, алкиламидогруппы, диалкиламидогруппы, карбоксильной группы, и ко всем стереоизомерам, а также к фармакологически приемлемым солям. Изобретение также относится к фармацевтическим композициям и к применению соединений. Технический результат - получение новых биологически активных соединений, проявляющих агонистическую активность к ORL1 рецепторам. 3 н. и 6 з.п. ф-лы, 3 табл.
Реферат
Настоящее изобретение относится к группе гидронопольных производных, которые являются агонистами (веществами, обладающими сродством) к ORL1 (ноцицептиновым) рецепторам человека. Изобретение также относится к получению этих соединений, к фармацевтическим композициям, содержащим фармакологически активное количество, по меньшей мере, одного из этих новых производных гидронопола в качестве активного ингредиента, а также к применению этих фармацевтических композиций для лечения расстройств, связанных с ORL1 рецепторами.
′Opioid Receptor-Like 1′ (ORL1) рецептор идентифицировали из библиотеки кДНК человека. Было установлено, что этот 'сиротский рецептор' имеет близкую гомологию с µ-, κ- и δ-опиоидными рецепторами (Mollereau et al., FEBS Lett., 341, 33-38, 1994; Bunzow et al., FEBS Lett., 347, 284-288, 1994). Несмотря на близкое сходство его последовательности и структурное сходство с опиоидными рецепторами классические лиганды опиоидного рецептора не взаимодействуют с ORL1 рецепторами. В 1995 г. 17-аминокислотный нейропептид выделили из экстрактов (вытяжки) мозга и впоследствии показали, что он является природным лигандом G-протеин-связанного ORL1 рецептора (Reinscheid et al., Science, 270, 792-794, 1995; Meunier et al., Nature, 377, 532-535, 1995). Пептид назвали сиротой FQ или ноцицептином, и он не присоединяется к трем традиционным опиоидным рецепторам. Эти открытия дали начало фундаментальному исследованию функциональной роли ORL1 рецептора и новых лигандов для ORL1 рецептора. Это привело к нескольким сотням публикаций, включая несколько обзоров (смотри, например, Grond et al., Anaesthesist, 51, 996-1005, 2002), и к десяткам патентных заявок, описывающих как пептидные, так и непептидные лиганды, варьированные по силе и селективности (ORL-1 в сравнении с µ-опиатом). Поскольку рецепторы µ-опиата широко распределяются по всему телу, отсутствие селективности может привести к ряду нежелательных опиатоподобных побочных эффектов, например к седации, угнетению дыхания, запору, привыканию и зависимости (Drug News Perspect, 14, 335, 2001).
Производные 1,3,8-триазаспиро[4,5]декан-4-она описаны в патентной заявке JP-A-2000/169476, опубликованной 20 июня 2000 г.; в патентной заявке WO 01/07050 A1, опубликованной 1 февраля 2001 г., и в патентной заявке US 2003/0109539 A1, опубликованной 12 июня 2003 г. Однако ни в одной из заявок, приведенных выше, не указаны рецепторы µ-опиата. В патентной заявке EP 0 997 464 A1, опубликованной 3 мая 2000 г., указывают, что соединения 1,3,8-триазаспиро[4,5]деканона в качестве агонистов ORL1 рецептора обладают селективным сродством к ORL1 рецепторам, но конкретная информация о сродстве рецептора µ-опиата была ограничена утверждением того, что: «особенно предпочтительные соединения показали большее сродство к ORL-1 рецепторам, чем к мю-рецепторам (то есть, IC50 для ORL1-рецепторов/IC50 для мю-рецепторов были меньше, чем 1,0)». Более конкретной является патентная заявка US 2001/0041711, опубликованная 15 ноября 2001г. Эта патентная заявка описывает триазоспиро-соединения, имеющие сродство к рецептору ноцицептина. Соединения также были испытаны на рецепторах µ-, κ- и δ-опиата, но только за несколькими исключениями обнаружено, что они являются более сильнодействующими по отношению к рецепторам µ-опиата, чем к ORL1 рецепторам. Исключения были селективны по отношению к ORL1 рецепторам менее чем в два раза. Таким образом, ближайший известный уровень техники (прототип) не указывает, как создавать сильнодействующие (эффективные) ORL1 лиганды с точно выраженной селективностью по сравнению с рецепторами µ-опиата, то есть с селективностью, имеющей показатель, по меньшей мере, 10, не говоря уже о таких соединениях, которые также имеют хорошее бионакопление. Наконец, производные 1,3,8-триазаспиро[4,5]декан-4-она, замещенные гидроксиалкилом, полезные для лечения расстройств, опосредуемых (обусловленных) ORL1 рецептором, были опубликованы 18 марта 2004 г. в патентной заявке WO 2004/022558, зарегистрированной 5 сентября 2003г.
Неожиданно обнаружено, что в сериях гидронопольных производных группа соединений, как было показано, имеет очень высокое сродство к рецепторам ORL1 человека. Более того, эти соединения показывают хорошую селективность к рецепторам ORL1 относительно рецепторов µ-опиата и легко усвояемы после орального введения.
Изобретение относится к соединениям общей формулы (1)
в которой:
R1 представляет собой атом водорода, галоген, CF3, алкильную (1-6С) группу, циклоалкильную (3-6С) группу, фенильную группу, аминогруппу, алкил(1-3С)аминогруппу, диалкил(1-3С)аминогруппу, гидроксильную группу, гидроксиалкильную (1-3С) группу, (1-3С)алкоксигруппу, OCF3, карбоксильную группу, аминокарбонильную или (1-3С)алкилсульфонильную группу,
m является целым числом от 1 до 4, при условии, что, когда m равно 2, 3 или 4, заместители R1 могут быть одинаковыми или различными,
R2 представляет собой атом водорода, необязательно замещенную алкильную (1-6С) группу, циклоалкильную (3-6С) группу, -CH2OH, -CH2OCH3, карбоксильную группу, ацетильную группу, необязательно замещенную бензильную группу или группу Q следующей структуры (2):
в которой:
[]n изображает символически -(CH2)n-, где n является целым числом от 0 до 7,
R3 представляет собой атом водорода или алкильную (1-3С) группу,
R4 представляет собой атом водорода, необязательно замещенную алкильную (1-6С) группу, насыщенное, ненасыщенное или частично насыщенное моно-, ди- или трициклическое необязательно замещенное кольцо, или алкильную (1-3С) группу, замещенную насыщенным, ненасыщенным или частично насыщенным необязательно замещенным пяти- или шестичленным кольцом, которое необязательно содержит один или более гетероатомов, или
(R3+R4) вместе с атомом азота, к которому они присоединены, представляют собой насыщенное, ненасыщенное или частично насыщенное моно-, ди- или трициклическое необязательно замещенное кольцо,
и к их фармакологически приемлемым солям и пролекарствам.
В описании заместителей аббревиатура 'алкильная (1-3С) группа' означает 'метильная группа, этильная группа, n-пропильная группа или изопропильная группа'. 'Необязательно замещенная' означает, что группа может быть дополнительно замещена или не замещена одной или более группами, выбранными из алкильной группы, алкенильной группы, алкинильной группы, арильной группы, фтора, хлора, брома, гидроксильной группы, алкилоксигруппы, алкенилоксигруппы, арилоксигруппы, ацилоксигруппы, аминогруппы, алкиламиногруппы, диалкиламиногруппы, ариламиногруппы, тиогруппы, алкилтиогруппы, арилтиогруппы, цианогруппы, оксогруппы, нитрогруппы, ацильной группы, амидогруппы, алкиламидогруппы, диалкиламидогруппы, карбоксильной группы, или два необязательных заместителя вместе с атомами углерода, к которому они присоединены, могут образовывать 5- или 6-членное ароматическое или неароматическое кольцо, содержащее 0, 1 или 2 гетероатома, выбранных из азота, кислорода или серы. В рамках контекста объяснения выражения 'необязательно замещенная', 'алкильная группа' означает С1-3-алкильная группа, 'алкенильная группа' означает С1-3-алкенильная группа, 'алкинильная группа' означает С1-3-алкинильная группа, 'ацильная группа' означает С1-3-ацильная группа и 'арильная группа' означает фурильная группа, тиенильная группа, пирролильная группа, оксазолильная группа, тиазолильная группа, имидазолильная группа, пиразолильная группа, изоксазолильная группа, изотиазолильная группа, пиридильная группа, пиридазинильная группа, пиримидинильная группа, пиразинильная группа, 1,3,5-триазинильная группа, фенильная группа, индазолильная группа, индолильная группа, индолизинильная группа, изоиндолильная группа, бензо[b]фуранильная группа, бензо[b]тиофенильная группа, бензимидазольная группа, бензтиазолильная группа, пуринильная группа, хинолинильная группа, изохинолильная группа, хинолильная группа, фталазинильная группа, хиназолинильная группа, хиноксалинильная группа, 1,8-нафтиридинильная группа, пиридинильная группа, нафтильная группа или азуленильная группа, предпочтительно фенильная группа, пиридильная группа или нафтильная группа. Необязательные заместители сами могут нести дополнительные необязательные заместители. Предпочтительные необязательные заместители включают С1-3-алкильную группу, такую как, например, метильная группа, этильная группа и трифторметильная группа, фтора, хлора, брома, гидроксильную группу, С1-3-алкилоксигруппу, такую как, например, метоксигруппа этоксигруппа и трифторметоксигруппа, и аминогруппу. 'Гетероатом' означает атом, такой как атом азота, атом кислорода или атом серы. 'Пяти- или шестичленные кольца' представляют собой, например: фурановые кольца, тиофеновые кольца, пиррольные кольца, оксазольные кольца, тиазольные кольца, имидазольные кольца, пиразольные кольца, изоксазольные кольца, изотиазольные, 1,2,3-оксадиазольные кольца, 1,2,3-триазольные кольца, 1,3,4-тиадиазольные кольца, пиридиновые кольца, пиридазиновые кольца, пиримидиновые кольца или пиразиновые кольца.
К изобретению относятся все соединения, имеющие формулу (1), рацематы, смеси диастереомеров и выделенные стереоизомеры. Таким образом, соединения, в которых заместители на потециально асимметричных атомах углерода находятся или в R-конфигурации, или в S-конфигурации, относятся к изобретению.
Пролекарства являются терапевтическими средствами (веществами), которые сами по себе являются неактивными, но превращаются в один или более активных метаболитов. Пролекарства являются биообратимыми производными молекул лекарственных веществ, используемыми для преодоления некоторых барьеров к (извлечению) полезности родительской молекулы лекарственного вещества. Эти барьеры включают в себя растворимость, проницаемость, стабильность, пресистематический метаболизм и ограничения по нацеливанию лекарства, но не ограничены этим (Medicinal Chemistry: Principles and Practice, 1994, ISBN 0-85186-494-5, Ed.: F. D. King, p. 215; J. Stella, “Prodrugs as therapeutics”, Expert Opin. Ther. Patents, 14(3), 277-280, 2004; P. Ettmayer et al., “Lessons learned from marketed and investigational prodrugs”, J.Med.Chem., 47, 2393-2404, 2004). Пролекарства, то есть соединения, которые при введении в человека любым известным способом подвергаются биотрансформации в соединения, имеющие формулу (1), относятся к изобретению. В частности, это относится к соединениям с первичными или вторичными аминогруппами или гидроксильными группами. Такие соединения могут быть подвергнуты реакции с органическими кислотами, давая соединения, имеющие формулу (1), в которой присутствует дополнительная группа, которая легко удаляется после введения, но которая не ограничивается, например, амидиновой группой, энаминовой группой, основанием Манниха, гидроксилметиленовым производным, O-(ацилоксиметиленкарбамат)-производным, карбаматной группой, сложноэфирной группой, амидогруппой или энаминоновой группой.
В частности изобретение относится к соединениям, имеющим формулу (1), в которой: R1 представляет собой атом водорода, галоген, CF3, алкильную (1-6С) группу, гидроксильную группу, (1-3С)алкоксигруппу или OCF3, m=1, и все другие радикалы имеют значения, приведенные выше.
В большей степени изобретение относится к соединениям, имеющим формулу (1), в которой: R1 представляет собой атом водорода, галоген, CF3, алкильную (1-6С) группу, гидроксильную группу, (1-3С)алкоксигруппу или OCF3, m=1, R2 представляет собой группу Q, имеющую общую формулу (2), и все другие радикалы имеют значения, приведенные выше.
В еще большей степени изобретение относится к соединениям, имеющим формулу (1), в которой: R1 представляет собой атом водорода, галоген, CF3, алкильную (1-6С) группу, гидроксильную группу, (1-3С)алкоксигруппу или группу OCF3, m=1, R2 представляет собой группу Q, имеющую общую формулу (2), R3 представляет собой метильную группу, R4 представляет собой алкильную (1-3С) группу, замещенную насыщенным, необязательно замещенным шестичленным кольцом, которое необязательно содержит один или более гетероатомов, и []n имеет значения, приведенные выше.
Наиболее предпочтительными соединениями изобретения являются соединения, имеющие формулу (1), в которой: R1 представляет собой атом водорода, галоген, CF3, алкильную (1-6С) группу, гидроксильную группу, (1-3С)алкоксигруппу или OCF3, m=1, R2 представляет собой группу Q, имеющую общую формулу (2), R3 представляет собой метильную группу, R4 представляет собой метиленовую группу, замещенную необязательно замещенным пиперидиновым кольцом, и []n имеет значения, приведенные выше.
Фармацевтически приемлемые соли могут быть получены путем использования стандартных способов, хорошо известных в данной области, например, смешением соединения настоящего изобретения с подходящей кислотой, например, неорганической кислотой, такой как соляная (хлористоводородная) кислота, или с органической кислотой.
Соединения настоящего изобретения общей формулы (1), а также их соли проявляют агонистическую активность к ORL1 рецепторам. Они являются полезными для лечения расстройств, связанных с ORL1 рецепторами, или, которые можно лечить посредством манипулирования этими рецепторами, особенно, но не ограничиваясь этим: состояний острой и хронической боли, нарушений обмена веществ, таких как нервная анорексия и нейрогенная булимия, ожирение; желудочно-кишечных расстройств, в частности, синдрома раздраженной толстой кишки, воспалительной болезни кишечника (гранулематозного энтерита и язвенного колита), поноса, запора, боли в животе, воспаления мочевого тракта, почечных расстройств, характеризующихся нарушениями баланса удержания/выделения воды или выделения соли; расстройств сердечно-сосудистой системы, таких как инфаркт миокарда, аритмия, повышенное кровяное давление, тромбоз, анемия, артериосклероз, стенокардия; офтальмологических расстройств, таких как глаукома; расстройств дыхательной системы, включающих хроническое обструктивное заболевание легких, бронхит и кистозный фиброз; заболеваний иммунной системы и вирусных инфекций.
Агонистические свойства соединений изобретения по отношению к ORL1 рецептору in vitro и in vivo определили, используя методики, приведенные ниже.
Сродство к ORL1 рецепторам человека
Сродство соединений к ORL1 рецепторам человека определили, используя реакцию связывания рецептора in vitro, описанный Ardati et al., Mol. Pharmacol., 51, 816, 1997. Кратко, препараты мембран были получены из клеток CHO (яичника китайского хомяка), в которых ORL1 рецептор человека стабильно выражен. Мембраны выдерживали с [3H]-ноцицептином в отсутствии или в присутствии тестовых соединений в различных концентрациях, разведенных в подходящем буфере. Неспецифическое связывание определили как связывание, остающееся в присутствии 10-6 М ноцицептина. Отделение связанной радиоактивности от свободной осуществили фильтрацией через стекловолоконные фильтры Паккарда GF/B с несколькими промываниями ледяным буфером, используя коллектор клеток Паккарда. Связанную радиоактивность измеряли сцинтилляционным счетчиком (Topcount, Packard), используя жидкий коктейль для сцинтилляционного счета (Microscint 0, Packard). Измеренную радиоактивность наносили на графике в зависимости от концентрации вытесняющего тестового соединения и кривые вытеснения рассчитывали логистической регрессией с четырьмя параметрами, получая в результате значения IC50, то есть значения IC50 для такой концентрации вытесняющего соединения, при которой вытеснено 50% радиолиганда. Значения сродства pK1 вычисляли c учетом поправок значений IC50 для концентрации радиолиганда и его сродства к ORL1 рецептору человека в соответствии с уравнением Ченга-Прусоффа:
pK1=-log(IC50/(1+S/Kd))
в котором IC50 представляет собой то же, что описано выше, S является концентрацией [3H]-ноцицептина, использованной в образце для анализа, выраженной в моль/л (обычно 0,2 нМ), и Kd является равновесной константой диссоциации [3H]-ноцицептина по отношению к ORL1 рецепторам человека (0,4 нМ).
Соединения изобретения имеют высокое сродство к ORL1 рецепторам в реакции связывания, описанной выше. Это свойство делает их полезными в лечении расстройств, связанных с ORL1 рецепторами, или которые можно лечить посредством манипулирования этими рецепторами.
Сродство к µ-опиатным рецепторам
Сродство соединений к µ-опиатным рецепторам определяли, используя реакцию связывания рецептора in vitro, описанную Wang et al., FEBS Letters, 338, 217, 1994. Кратко, препараты мембран получали из клеток CHO (яичника китайского хомяка), в которых µ-опиатный рецептор человека стабильно выражен, и выдерживали со специфическим лигандом µ-опиата [3H]-DAMGO (D-Ala2, N-Me-Phe4, глицинол5-Энкефалин) в отсутствии или в присутствии тестовых соединений в различных концентрациях, разведенных в подходящем буфере. Неспецифическое связывание определяли как связывание, остающееся в присутствии 10-6 М налоксона. Отделение связанной радиоактивности от свободной осуществляли таким же способом, как описано выше, и сродство соединений вычисляли подобным образом.
Соединения изобретения имеют низкое сродство к µ-опиатным рецепторам в реакции связывания, описанной выше. Таким образом, маловероятно, что они индуцируют нежелательные побочные эффекты, которые, как известно, имеют место с опиатами, такими как морфин.
Агонизм ORL1 рецептора in vitro
Активация G-протеин-связанного ORL1 рецептора ингибирует активность аденилатциклазы и снижает внутриклеточную концентрацию вторичного посланника (мессенджера) - циклоаденозинмонофосфата (cAMP). Активность соединений по отношению к ORL1 рецепторам измеряли, используя методику анализа, описанную Jenck et al., Proc. Natl. Acad. Sci. USA, 97, 4938-4943, 2000. Показано, что они являются сильнодействующими (эффективными) агонистами со значениями pEC50, соответствующими значениям их pKi.
Диарея, вызванная касторовым маслом, у мышей, находящихся в сознании
Показано, что пока есть пептид ноцицептин после подкожного введения, то соединения изобретения могут снижать диарею, вызванную касторовым маслом, у мышей. Поскольку периферически введенный пептид не проникает через гематоэнцефалический барьер указано, что снижение диареи, обусловленное ORL1, является периферически обусловленным.
Используемые животные: для этой модели диареи, вызванной касторовым маслом, использовали самцов мышей NMRI (Naval Medical Research Institute). Во всех экспериментах группа состояла из 10-12 животных.
Экспериментальные методики: в день эксперимента мыши получали или соединение, или носитель (с двухнедельными интервалами). По истечении 30 минут вводили орально касторовое масло (8 мл/кг массы тела) и животных помещали отдельно в клетках со свободным доступом к воде. Фекалии собирали по истечении 5 часов. В течение этого периода времени каждые 20 минут определяли визуальным осмотром качество фекалий. Бальная оценка диареи колебалась в диапазоне от 0 до 4, 0=нет выброса, 1=нормальный выброс (масса), 2=слабая диарея, 3=умеренная диарея, 4=сильная диарея. Таким образом, эта оценка по баллам отражает начало проявления и интенсивность диареи. В этих экспериментах определяли средний балл диареи и сухой вес фекалий.
Анализ данных: действие соединений приведено в виде относительных чисел (процент от контрольных значений). Исходные данные, регистрируемые в экспериментах, сравнивали с контрольными данными (без соединения) для одних и тех же животных посредством парных двусторонних критериев Стьюдента (t-tests) или с контрольной группой посредством непарного критерия Стьюдента (t-test). Значения p<0,05 принимали как статистически значимые.
Толстокишечный транзит (транзит по толстой кишке) у крыс, находящихся в сознании
Показано, что соединения изобретения не оказывают влияния на нормальный (регулярный) транзит по толстой кишке у крыс. Это также имело место в случае для пептида (Ноцицептина) после подкожного введения. Поскольку периферически введенный пептид не проникает через гематоэнцефалический барьер указано, что периферическая активация ORL1 рецептора не ухудшает нормальный желудочно-кишечный транзит. Напротив, периферическая активация µ-опиатного рецептора может сильно ухудшить транзит в этой модели. Таким образом, это исследование показывает селективность соединений изобретения по отношению к ORL1 рецептору.
Используемые животные: для экспериментов использовали самцов крыс Sprague Dawley. Во всех экспериментах группа состояла из 10-12 животных.
Экспериментальные методики: до проведения экспериментов крысам сделали постоянный титановый свищ слепой кишки под общей анестезией. Животным дали возможность восстановиться после хирургического вмешательства и приучили к кормлению в режиме свободного доступа для осуществления процесса поглощения еды в течение 3 часов в день. В день экспериментов после периода кормления через свищ в слепую кишку вводили вещество-маркер (2 мл суспензии, содержащей 80% сульфата бария) и животные получали или соединение, или носитель. Позже их помещали в метаболические клетки и собирали фекальные пеллеты ежечасно в течение 21 часа, используя автоматическую систему для сбора. В течение этого периода времени животные имели свободный доступ к воде. Содержание сульфата бария в фекалиях анализировали радиографически, а фекалии взвешивали. Зависимость содержания маркера в фекалиях от времени и количество фекалий позволили оценить среднее время удерживания сульфата бария, то есть время толстокишечного транзита. Были определены среднее время удерживания сульфата бария, содержащегося в пеллетах, и общая масса (выброс) фекалий.
Анализ данных: действие соединений приведено в виде относительных чисел (процент от контрольных значений). Исходные данные, регистрируемые в экспериментах, сравнивали с контрольными данными (без соединения) для одних и тех же животных посредством парных двусторонних критериев Стьюдента (t-tests). Значения p<0,05 принимали как статистически значимые. В модели толстокишечного транзита контрольные данные представляют собой среднее значение из двух контрольных экспериментов (до и после введения соединения, с недельными интервалами).
Висцеральная гиперчувствительность, вызванная уксусной кислотой, у крыс, находящихся в сознании
Показано, что соединения изобретения могут снижать висцеральную гиперчувствительность у крыс, пока имеется в наличии пептид Ноцицептин после подкожного введения. Поскольку периферически введенный пептид не проникает через гематоэнцефалический барьер указано, что снижение висцеральной гиперчувствительности, обусловленное ORL1, периферически обусловлено.
Используемые животные: взрослые самки крыс Sprague Dawley, вес тела: в диапазоне от 200 до 250 г. Группа состоит из 5-10 животных.
Экспериментальная методика: до проведения экспериментов животных подвергли голоданию в течение 24 часов со свободным доступом к воде. В толстую кишку (на 10 см, проксимальные к анальному отверстию) ввели уксусную кислоту (0,6%, 1,5 мл). По истечении 50 минут в дистальную толстую кишку ректально ввели резиновый шарик длиной 5 см (объемом 6-7 мл ) и закрепили путем связывания лентой с трубочкой (пробиркой), привязанной к хвосту крысы. Колоректальное растяжение осуществляли путем установления давления в шарике до 100 мбар (104 Па) в течение 10 минут. В течение этого периода времени путем визуального осмотра отслеживали число брюшных сужений (перетяжек). Продолжали эксперименты только на тех животных, которые реагировали на колоректальное растяжение более чем 10-ю брюшными перетяжками. Эти животные получали разовую дозу вещества или носителя и протокол колоректального растяжения повторяли в течение 30, 60, 90 и 120 минут после введения.
Анализ данных: результаты приведены как среднее значение ± статистическое отклонение. Число брюшных перетяжек, возникших в течение 30, 60, 90 и 120 минут после введения вещества или носителя, а также средние значения (30-120 мин) сравнили с предзначениями путем парных двусторонних критериев Стьюдента (t-тестов). Относительное количество брюшных перетяжек (% от предзначений), возникших в течение 30, 60, 90 и 120 минут в случае введения вещества и в случае введения носителя, и относительные средние значения (30-120 мин) для обоих случаев сравнивали между собой путем непарных двусторонних критериев Стьюдента (t-тестов). Значения p<0,05 были приняты как статистически значимые.
Агонизм ORL1 рецептора in vivo: отсутствие проникновения в центральную нервную систему (CNS)
Показано, что большинство соединений изобретения не проявляют активности при воздействии ультразвукового голосового сигнала, вызывающего стресс у взрослых особей (AUV), что описано Van der Poel et al., Psychopharmacology, 97, 147-148, 1989. Это показывает, что соединения не проникают через гематоэнцефалический барьер. В этом анализе пептид ноцицептин также является активным, но для того, чтобы продемонстрировать его действенность, необходимо его вводить непосредственно в мозг (внутримозговой (меж)желудочковой инъекцией).
ПРИМЕРЫ СИНТЕЗОВ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ И КОНЕЧНЫХ ПРОДУКТОВ
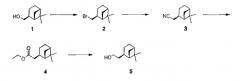
(-)-транс-2-(6,6-Диметил-бицикло[3.1.1]гепт-2-ил)-этанол (5)
Миртанилбромид (2)
Трифенилфосфин (116 г, 0,44 моль) растворили в ацетонитриле (1 л) и охладили в ледяной бане в атмосфере N2. По каплям добавили бром (22,5 мл, 0,44 моль). Температуру экзотермической реакции поддерживали ниже 10°С. По завершении добавления ледяную баню удалили и медленно добавили (-)-транс-миртанол (1) (2,686 г, 0,44 моля), растворенный в ацетонитриле (250 мл). По завершении добавления светло-желтый раствор кипятили, используя прибор с насадкой Дина-Старка, в течение 3 часов. Во время реакции растворитель отгоняли в ловушку для воды и затем 20 раз удаляли (приблизительно 200 мл растворителя в итоге). Газохроматографический (GC) анализ показал полную конверсию исходного вещества. Смесь упарили досуха. Сырую (необработанную) смесь очистили на колонке с силикагелем (элюент: дихлорметан/диэтиловый эфир 1/1, объем/объем). Это дало 87,8 г бромида (2) (91%) в виде светло-желтого масла.
Миртанилцианид (3)
Миртанилбромид (2) (87,8 г, 0,41 моль) растворили в диметилформамиде (1 л). Добавили цианид натрия (40 г, 0,81 моль) и смесь перемешивали при кипячении с обратным холодильником в течение 5 часов. Газохроматографический анализ показал полную конверсию. Смесь разбавили водой (3 л) и экстрагировали трет-бутилметиловым эфиром (TBME, 3× 1,5 л). Органический слой промыли рассолом (насыщенным раствором NaCl), осушили над Na2SO4 и концентрировали досуха. Сырую смесь очистили на колонке с силикагелем (элюент: гептан/дихлорметан, 1/1, объем/объем) и получили 52,4 г (80%) цианида (3) в виде бесцветной жидкости.
Этиловый эфир (сложный) (4)
Этанол (500 мл) охладили на ледяной бане. Добавили по каплям серную кислоту (190 мл). Добавили цианид (3) (52,4 г, 0,32 моля), растворенный в этаноле (100 мл), и смесь перемешивали при кипячении с обратным холодильником в течение ночи. Газохроматографический анализ показал полное присоединение. Смесь охладили и добавили воду (1,5 л). Смесь экстрагировали трет-бутилметиловым эфиром (3×1,5 л). Органический слой промыли NaHCO3 (нас. 1 л), осушили над Na2SO4 и концентрировали. Выход: 54,2 г сложного эфира 5 (80%) в виде почти бесцветной жидкости. Сырой продукт (4) использовали в следующей реакции без очистки.
(-)-транс-2-(6,6-Диметил-бицикло[3.1.1]гепт-2-ил)-этанол (5)
К суспензии литийалюмогидрида (20 г, 0,52 моля) в тетрагидрофуране (1 л) добавили сложный эфир (4) (54,2 г, 0,26 моля), растворенный в тетрагидрофуране (500 мл). По завершении добавления смесь кипятили с обратным холодильником в течение 1 часа. Газохроматографический анализ показал полную конверсию исходного вещества. Смесь охладили на ледяной бане и осторожно добавили соляную кислоту (1М, 1 л). По завершении добавления смесь разбавили водой (1 л) и экстрагировали трет-бутилметиловым эфиром (3×1,5 л). Органический слой промыли рассолом (насыщенным раствором NaCl), осушили над Na2SO4 и концентрировали досуха. Сырую смесь подвергли очистке перегонкой Кугельрота (температура кипения 85°С, 3·10-2 мбар (3 Па)). Выход: 35,9 г соединения 1 (65%) в виде бесцветного масла.
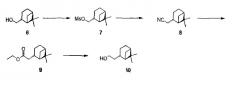
(+)-транс-2-(6,6-Диметил-бицикло[3.1.1]гепт-2-ил)-этанол (10)
Миртанилмезилат (7)
18,1 г (0,12 моля) (+)-транс-миртанола (6) добавили к раствору 18,5 мл мезилхлорида (2 экв., 0,24 моль, 27,5 г) и 49 мл пиридина (5 экв., 0,60 моля, 47,5 г) в 400 мл дихлорметана (DCM). Реакционную смесь перемешивали всю ночь при комнатной температуре. Добавили воду и реакционную смесь перемешивали в течение одного часа. Органический слой экстрагировали и водный слой экстрагировали еще два раза. Объединенные органические слои промыли (насыщенным NaHCO3, водой, рассолом (насыщенным раствором NaCl)), высушили (Na2SO4) и упарили в вакууме с получением 25,9 г (91%) мезилата (7) в виде бесцветного масла.
Миртанилцианид (8)
Миртанилмезилат (7) (25,9 г, 0,11 моля) растворили в диметилсульфоксиде (DMSO) (250 мл). Добавили цианид калия (4 экв., 29,2 г, 0,45 моля) и смесь перемешивали при 70°С в течение 2 дней. Газохроматографический анализ показал полную конверсию. Смесь разбавили водой (750 мл) и экстрагировали трет-бутилметиловым эфиром (3×300 мл). Органический слой промыли рассолом, высушили над Na2SO4 и концентрировали досуха, что дало 17,7 г (количественный выход) цианида (8) в виде бесцветного масла.
Этиловый эфир (сложный) (9)
Этанол (200 мл) охладили на ледяной бане. По каплям добавили серную кислоту (80 мл). Добавили цианид (8) (17,7 г, 0,11 моля), растворенный в этаноле (40 мл), и смесь перемешивали при кипячении с обратным холодильником в течение всей ночи. Газохроматографический анализ показал полное присоединение. Смесь охладили и добавили воду (1 л). Смесь экстрагировали трет-бутилметиловым эфиром (3×500 мл). Органический слой промыли NaHCO3 (нас., 500 мл), высушили над Na2SO4 и концентрировали. Выход: 20,4 г сложного эфира (9) (88%) в виде желтого масла. Сырой продукт (9) использовали в следующей реакции без очистки.
(+)-транс-Дигидронопол (10)
К суспензии литийалюмогидрида (7,4 г, 0,19 моля) в тетрагидрофуране (350 мл) добавили сложный эфир (9) (20,1 г, 0,09 моля), растворенный в тетрагидрофуране (200 мл). По завершении добавления смесь кипятили с обратным холодильником в течение 2 часов. Смесь охладили на ледяной бане и осторожно добавили соляную кислоту (1М, 1 л). По завершении добавления смесь разбавили водой (300 мл) и экстрагировали трет-бутилметиловым эфиром (3×500 мл). Органический слой промыли рассолом, осушили над Na2SO4 и концентрировали досуха. Сырую смесь подвергли очистке перегонкой Кугельрота (температура кипения 85°С, 8·10-2 миллибар (8 Па)). Выход: 9,2 г соединения (10) (61%) в виде бесцветного масла.
(-)-цис-2-(6,6-Диметил-бицикло[3.1.1]гепт-2-ил)-этанол (11)
Синтез цис-аналога: (+)-цис-2-(6,6-диметил-бицикло[3.1.1]гепт-2-ил)-этанола (18), с (-)-β-пиненом в качестве исходного вещества описан в J. Amer. Chem. Soc. 68, 638, 1946, и в патентах US 2,427,343, 2,427,344 и 2,427,345.
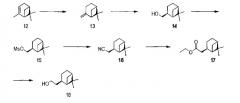
(+)-β-пинен (13)
В сухой стеклянной посуде трет-бутилоксид калия (KOt-Bu, 49,4 г, 0,44 моля) добавили к n-бутиллитию (176 мл, 2,5М в гексане). Суспензию охладили до -78°С. По каплям добавили (+)-α-пинен (12) (50 г, 0,37 моля). Реакционной смеси дали нагреться до комнатной температуры и затем перемешивали в течение 45 часов. Реакционную смесь охладили до -78°С и по каплям добавили B(OMe)3 (137 мл, 1,20 моля). Реакционной смеси дали нагреться до комнатной температуры (экзотермическая реакция!). По каплям добавили 10% HCl (водный, 250 мл) и реакционную смесь перемешивали в течение 1 часа. Слои разделили и водный слой экстрагировали гептаном (2×200 мл). Объединенные органические слои высушили над Na2SO4 и упарили досуха, что дало 36,7 г желтого масла. Сырой продукт подвергли очистке, используя перегонку Кугельрота (8-12 мбар (800-1200 Па), 50-60°С), что дало 36,6 г (0,27 моля, выход=73%, 88% чистоты) (+)-β-пинена (13) в виде бесцветного масла.
Миртанол (14)
(+)-β-пинен (13) (36,6 г,0,27 моля) растворили в тетрагидрофуране (100 мл) и охладили до 0°С. По каплям добавили BH3·диметилсульфид (BH3·DMS) в тетрагидрофуране (2 М, 47,3 мл). Реакционную смесь перемешивали в течение получаса. Добавили этанол (90 мл). Добавили 1 М NaOH (вод.) (95 мл). Реакционную смесь охладили до 0°С. По каплям добавили 33 мл 30% H2O2, при этом температуре не давали подниматься выше 35°С. Реакционную смесь кипятили с обратным холодильником в течение 1 часа и вылили в воду (1 л). Раствор экстрагировали трет-бутилметиловым эфиром. Объединенные органические слои промыли водой и рассолом, осушили над Na2SO4 и упарили досуха. Остающийся α-пинен отогнали, используя перегонку Кугельрота (8-9 мбар (800-900 Па), 50-60°С), получая 38,6 г (0,25 моля, выход=93%) (+)-цис-миртанола (14) в виде бесцветного масла.
Миртанилмезилат (15)
15,0 г (0,10 моля) (+)-цис-миртанола (14) добавили к раствору 15 мл мезилхлорида (экв., 0,20 моля) и 40 мл пиридина (5 экв., 0,50 моля) в 300 мл дихлорметана (DCM). Реакционную смесь перемешивали всю ночь при комнатной температуре. Добавили воду и реакционную смесь перемешивали в течение 1 часа. Органический слой экстрагировали и водный слой экстрагировали еще два раза. Объединенные органические слои промыли (насыщенным NaHCO3, водой, рассолом), осушили (Na2SO4) и упарили в вакууме с получением 21,6 г (выход=93%) мезилата (15) в виде бесцветного масла.
Миртанилцианид (16)
Миртанил мезилат (15) (21,6 г, 0,093 моля) растворили в диметилсульфоксиде (DMSO) (230 мл). Добавили цианид калия (4 экв., 24,2 г, 0,37 моля) и смесь перемешивали при 70°С в течение 8 дней. Газохроматографичекий анализ показал полную конверсию. Смесь разбавили водой и экстрагировали гептаном. Органический слой промыли рассолом, высушили над Na2SO4 и концентрировали досуха с получением 15,8 г (количественный выход) цианида (16) в виде бесцветного масла.
Этиловый эфир (сложный) (17)
Этанол (150 мл) охладили на ледяной бане. По каплям добавили серную кислоту (60 мл). Добавили цианид (16) (16 г), растворенный в этаноле (30 мл), и смесь перемешивали при кипячении с обратным холодильником всю ночь. Газохроматографичекий анализ показал полную конверсию. Смесь охладили и добавили воду (1 л). Смесь экстрагировали трет-бутилметиловым эфиром (3×500 мл). Органический слой промыли насыщенным NaHCO3 (водный, 500 мл), высушили над Na2SO4 и концентрировали досуха. Выход: 20,6 г сложного эфира (17) (количественный выход) в виде желтого масла. Сырой продукт (17) использовали в следующей реакции без очистки.
(+)-цис-Дигидронопол (18)
К суспензии литийалюмогидрида (8,3 г, 0,22 моля) в тетрагидрофуране (400 мл) добавили сложный эфир (17) (23,6 г, 0,11 моля), растворенный в тетрагидрофуране (200 мл). По завершении добавления смесь кипятили с обратным холодильником в течение 2 часов. Смесь охладили на ледяной бане и осторожно добавили соляную кислоту (1М, 1 л). По завершении добавления смесь разбавили водой (300 мл) и экстрагировали трет-бутилметиловым эфиром (3×500 мл). Органический слой промыли рассолом, осушили над Na2SO4 и концентрировали досуха, получая желтое масло (13,4 г). Сырую смесь подвергли очистке перегонкой Кугельрота (температура кипения 85°С, 8·10-2 мбар (8 Па)). Выход: 8,7 г соединения (18) (51 ммоль, y=47%) в виде бесцветного масла.
1-Мезил-2-(6,6-диметил-бицикло[3.1.1]гепт-2-ил)-этанол (20) (для всех стереоизомеров дигидронопола)
К суспензии 67 г (0,4 моля) (-)-цис-2-(6,6-Диметил-бицикло[3.1.1]гепт-2-ил)-этанола (19) в 300 мл дихлорметана при 0°С добавили 139 мл (1 моль) триэтиламина. К этой смеси добавили по каплям 55,2 г (0,48 моля) мезилхлорида в 100 мл дихлорметана. По истечении 5 часов при комнатной температуре реакция была завершена, и были добавлены 300 мл 1н. водного раствора HCl. После отделения водный слой промыли дихлорметаном дважды и объединенные органические слои пром