Способ получения l-треонина с использованием бактерии, принадлежащей к роду escherichia
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой способ получения L-треонина путем ферментации глюкозы с использованием бактерии, принадлежащей к роду Escherichia, которая модифицирована таким образом, что в указанной бактерии увеличена активность высокоаффинного переносчика D-аллозы, кодируемого опероном alsABC. Изобретение позволяет получать L-треонин с высокой степенью эффективности. 2 н. и 8 з.п. ф-лы, 7 ил., 2 табл.
Реферат
Область техники
Настоящее изобретение относится к способу получения L-аминокислоты путем ферментации и, в частности, к генам, которые способствуют процессу ферментации. Эти гены являются полезными для улучшения продуктивности L-аминокислот, таких, например, как L-треонин, L-лизин, L-лейцин, L-гистидин, L-цистеин, L-фенилаланин, L-аргинин, L-триптофан, L-глутаминовая кислота, L-валин, и L-изолейцин.
Описание предшествующего уровня техники
Обычно L-аминокислоты получают в промышленном масштабе с помощью методов ферментации, используя штаммы микроорганизмов, выделенных из природных источников, или их мутанты. В большинстве случаев микроорганизмы модифицируют таким образом, чтобы увеличить производственный выход L-аминокислот.
К настоящему времени описано много способов увеличения производственного выхода L-аминокислот, включающих трансформацию микроорганизмов с помощью рекомбинантной ДНК (см., например, патент США 4,278,765). Другие способы увеличения производственного выхода включают усиление активности ферментов, участвующих в биосинтезе аминокислоты, и/или уменьшение чувствительности фермента-мишени к ингибированию по типу обратной связи конечной L-аминокислотой (см., например, заявку РСТ WO 95/16042 или патенты США 4,346,170; 5,661,012 и 6,040,160).
Штаммы, используемые для получения L-треонина, известны, включая штаммы с увеличенной активностью ферментов, участвующих в биосинтезе L-треонина (патенты США 5,175,107; 5,661,012; 5,705,371; 5,939,307 и европейский патент ЕР 0219027), штаммы, устойчивые к химическим продуктам, таким как L-треонин и его аналоги (заявка РСТ WO 01/14525A1, европейская заявка ЕР 301572 А2, патент США 5,376,538), штаммы, в которых ключевые ферменты не чувствительны к ингибированию продуцируемой L-аминокислотой или ее производными по типу обратной связи (патенты США 5,175,107; 5,661,012), и штаммы, в которых ферменты, участвующие в разрушении треонина, инактивированы (патенты США 5,939,307; 6,297,031).
В настоящее время одним из наиболее известных продуцентов треонина является штамм-продуцент треонина Escherichia coli VKPM В-3996 (патенты США 5,175,107 и 5,705,371). При конструировании штамма VKPM В-3996 несколько мутаций и плазмида, описанная ниже, были встроены в родительский штамм Е.coli К-12 (VKPM B-7). Мутантный ген thrA (мутация thrA442) кодирует аспартокиназу-гомосериндегидрогеназу I, которая является устойчивой к ингибированию треонином по типу обратной связи. Мутантный ген ilvA (мутация ilvA442) кодирует треонин-дезаминазу, которая обладает повышенной активностью, что приводит к снижению скорости биосинтеза изолейцина и к проявлению фенотипа типа «leaky» изолейцинового голодания. В бактерии, содержащей мутацию ilvA442, транскрипция оперона thrABC не угнетается изолейцином; поэтому эта мутация приводит к очень эффективной продукции треонина. Инактивация гена tdh, кодирующего треониндегидрогеназу, приводит к предотвращению разрушения треонина. Генетическая детерминанта ассимиляции сахарозы (гены scrKYABR) была перенесена в этот штамм. Для усиления экспрессии генов, контролирующих биосинтез треонина, плазмида pVIC40, содержащая мутантный треониновый оперон thrA442BC, была введена в промежуточный штамм TDH6. Количество L-треонина, накапливаемое в процессе ферментации штамма, может достигать 85 г/л.
При оптимизации главного пути биосинтеза желаемого соединения дальнейшее улучшение штаммов-продуцентов L-аминокислот может быть достигнуто путем снабжения бактерии повышенным количеством сахаров в качестве источника углерода, например глюкозы или арабинозы. Несмотря на эффективный транспорт глюкозы системой PTS, снижение высокопродуктивного штамма источником углерода, тем не менее, может быть недостаточным.
Известно, что активный транспорт сахаров и других метаболитов в бактериальных клетках осуществляется несколькими транспортными системами. Одной из них является переносчик AlsABC.
Транспортные системы ABC, предназначенные для введения или выведения питательных веществ и других субстанций через клеточную мембрану, широко распространены в природе. Для большинства бактериальных систем основным фактором, определяющим специфичность транспортного комплекса в целом, является периплазматический компонент (Chaudhuri BN, Ко J, Park C, Jones ТА, Mowbray SL.; J Mol Biol. 1999 Mar 12; 286(5):1519-31).
Периплазматические белок-связывающие транспортные системы состоят из периплазматического субстрат-связывающего белка, из двух (иногда из одного) очень гидрофобных интегральных мембранных белков, и одного (иногда двух) гидрофильного поверхностного мембранного белка, который связывает и гидролизует АТФ. Эти системы образуют надсемейство АВС-переносчиков (Saurin W, Dassa E.; Protein Sci. 1994 Feb; 3(2):325-44).
Переносчик AlsABC принадлежит к надсемейству АТФ-связывающих кассетных транспортных белков (ABC-ATP-binding Cassette). Он отвечает за усвоение D-аллозы, гексозы с гидроксильными группами в цис-положении, которая может использоваться бактерией E.coli в качестве единственного источника углерода. Делеция генов als приводила к неспособности бактерии к росту на D-аллозе. Методом флуоресцентной спектроскопии установлено, что белок AlsB является периплазатическим белком, который связывает D-аллозу с константой диссоциации Kd=0.33 мкМ. По данным анализа сходства последовательности, белок AlsA является АТФ-связывающим компонентом, а белок AlsC является мембранным компонентом АВС-переносчика. Система AlsABC также переносит рибозу с низкой аффинностью. Комплементационный анализ als-мутантов показал, что клонированные гены als могут восстанавливать рост бактерии на минимальной среде с рибозой. Изучение транскрипционно «слитых» с β-галактозидазой белков привело к предположению, что белок AlsR является негативным регулятором генов alsABC, a транскрипция гена alsR регулируется аллозой (Kim С, Song S, Park С.; J Bacteriol. 1997 Dec; 179(24):7631-7).
Оперон, ответственный за метаболизм D-аллозы, был локализован на 92.8 минуте на карте сцепления генетических признаков E.coli. Он состоит из шести генов, alsRBACEK, которые индуцируются D-аллозой и находятся под контролем репрессорного гена-регулятора alsR, кодирующего белок-репрессор. Этот оперон также подвержен катаболитной репрессии. Три гена, alsB, alsA, и alsC, необходимы для транспорта D-аллозы. D-аллоза-связывающий белок, который кодируется геном alsB, является периплазматическим белком с Mr=32,779, который обладает аффинностью к D-аллозе с Kd=0.33 мкМ. По аналогии с другим промежуточным связывающим белком АВС-переносчиков было установлено, что транспортная система аллозы включает АТФ-связывающий компонент (AlsA) и трансмембранный белок (AlsC). Белок AlsA имеет молекулярную массу Mr=56,614 и кодируется геном alsA, который расположен после гена alsB. Белок с молекулярной массой Mr=34,185 кодируется геном alsC, который расположен после гена alsA. Было установлено, что белок AlsE (предположительно D-аллоза-6-фосфат-3-эпимераза), но не белок AlsK (предположительно киназа D-аллозы) необходим для метаболизма аллозы. Переносчик D-аллозы частично участвует в низкоаффинном транспорте D-рибозы (Kirn С, Song S, Park С.; J Bacteriol. 1997 Dec; 179(24):7631-7).
Однако в настоящее время нет сообщений, описывающих использование бактерий семейства Enterobacteriaceae, обладающих усиленной экспрессией оперона alsABC для увеличения продукции L-амино кислот путем ферментации глюкозы.
Краткое описание чертежей
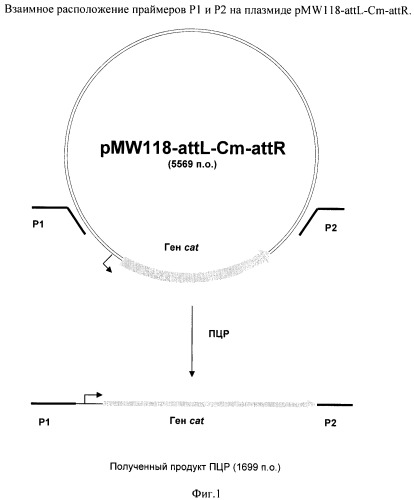
На Фиг.1 изображено взаимное расположение праймеров Р1 и Р2 на плазмиде pMW 118-attL-Cm-attR.
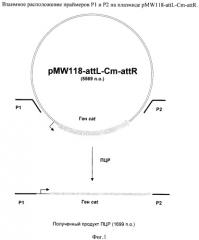
На Фиг.2 изображено конструирование фрагмента хромосомной ДНК, содержащего инактивированный оперон ptsHI-crr.
На Фиг.3 изображена замена области природного промотора оперона alsABC в Е.coli на гибридный промотор РL-tac.
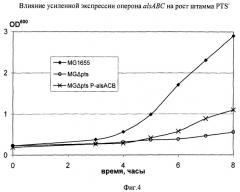
На Фиг.4 изображено влияние PL-tacalsABC на рост PTS- штамма. MG1655 означает штамм Е.coli MG1655; MGΔpts означает штамм Е.coli MG1655ΔptsHI-crr; и MGΔpts-P-alsABC означает штамм Е.coli MG1655 ΔptsHI-crr PL-tacalsABC.
На Фиг.5 показан результат выравнивания первичных последовательностей AlsB из Yersinia pseudotuberculosis (YERPS), Yersinia pestis (YERPE), Bacillus subtilis (BACSU), Bacillus cereus (BACC1), Escherichia coli (ECOLI), Symbiobacterium thermophilum (SYMTH). Выравнивание было осуществлено с использованием PIR Multiple Alignment program (http://pir.georgetown.edu). Идентичные аминокислоты отмечены звездочкой (*), сходные аминокислоты отмечены двоеточием (:).
На Фиг.6 показан результат выравнивания первичных последовательностей AlsA из Yersinia pestis (YERPE), Bacillus cereus (BACC1), Bacillus subtilis (BACSU), Yersinia pseudotuberculosis (YERPS), Escherichia coli (ECOLI), Symbiobacterium thermophilum (SYMTH). Выравнивание было осуществлено с использованием PIR Multiple Alignment program (http://pir.georgetown.edu). Идентичные аминокислоты отмечены звездочкой (*), сходные аминокислоты отмечены двоеточием (:).
На Фиг.7 показан результат выравнивания первичных последовательностей Als С из Escherichia coli (ECOLI), Symbiobacterium thermophilum (SYMTH), Bacillus cereus (BACC1), Bacillus subtilis (BACSU), Yersinia pestis (YERPE), Yersinia pseudotuberculosis (YERPS). Выравнивание было осуществлено с использованием PIR Multiple Alignment program (http://pir.georgetown.edu). Идентичные аминокислоты отмечены звездочкой (*), сходные аминокислоты отмечены двоеточием (:).
Описание изобретения
Целями настоящего изобретения являются повышение продуктивности штаммов-продуцентов L-аминокислоты и предоставление способа получения неароматических и ароматических L-аминокислот с использованием этих штаммов бактериальных клеток.
Вышеупомянутые цели были достигнуты путем установления того факта, что усиление экспрессии оперона alsABC, кодирующего переносчик D-аллозы, может привести к повышению продуктивности L-аминокислот, таких как L-треонин, L-лизин, L-лейцин, L-гистидин, L-цистеин, L-глутаминовая кислота, L-фенилаланин, L-триптофан, L-валин, L-изолейцин и L-аргинин путем ферментации с использованием глюкозы в качестве источника углерода. Недостаток источника углерода был смоделирован путем удаления транспортной системы PTS (ptsHI-crr) в штамме-продуценте L-аминокислоты.
Целью настоящего изобретения является предоставление бактерии-продуцента L-аминокислоты семейства Enterobacteriaceae, модифицированной таким образом, что в указанной бактерии усилена экспрессия оперона alsABC.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом указанная экспрессия оперона alsABC усилена путем модификации последовательности, контролирующей экспрессию оперона alsABC таким образом, что экспрессия гена усиливается, или путем увеличения количества копий оперона alsABC.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом указанная бактерия выбрана из группы, состоящей из бактерий рода Escherichia, Enterobacter, Erwinia, Klebsiella, Pantoea, Providencia, Salmonella, Serratia, Shigella and Morganella.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, при этом указанный оперон кодирует:
(А) белок, включающий аминокислотную последовательность SEQ ID NO:2 или его вариант;
(Б) белок, включающий аминокислотную последовательность SEQ ID NO:4 или его вариант; и
(С) белок, включающий аминокислотную последовательность SEQ ID NO:6 или его вариант;
при этом в случае, когда указанные варианты присутствуют в указанном опероне, такие варианты обладают активностью высокоаффинных переносчиков D-аллозы, когда указанные варианты сочетаются вместе.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, при этом указанный оперон включает:
(А) фрагмент ДНК, содержащий нуклеотидную последовательность с номерами нуклеотидов с 1 по 936 в SEQ ID NO:1, или фрагмент ДНК, который гибридизуется с указанной последовательностью или с зондом, синтезированным на основе указанной последовательности, в жестких условиях;
(Б) фрагмент ДНК, включающий нуклеотидную последовательность с номерами нуклеотидов с 1 по 1533 в SEQ ID NO:3, или фрагмент ДНК, который гибридизуется с указанной последовательностью или с зондом, синтезированным на основе указанной последовательности, в жестких условиях; и
(С) фрагмент ДНК, включающий нуклеотидную последовательность с номерами нуклеотидов с 1 по 981 в SEQ ID NO:5, или фрагмент ДНК, который гибридизуется с указанной последовательностью или с зондом, синтезированным на основе указанной последовательности, в жестких условиях; и
при этом случае, когда в указанном опероне присутствуют указанные фрагменты ДНК, которые гибридизуются с указанными последовательностями или с указанными зондами, такие фрагменты ДНК кодируют белки, обладающие активностью высокоаффинного переносчика D-аллозы, когда указанные белки сочетаются вместе.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, при этом указанные жесткие условия представляют собой такие условия, при которых отмывка проводится при температуре 60°С при концентрации соли 1×SSC и 0,1% SDS, приблизительно в течение 15-ти минут.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, при этом указанная бактерия дополнительно модифицирована таким образом, чтобы увеличить активность глюкокиназы.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, при этом указанная бактерия дополнительно модифицирована таким образом, чтобы увеличить активность изомеразы ксилозы.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, при этом указанная бактерия является бактерией-продуцентом L-треонина.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, при этом указанная бактерия дополнительно модифицирована таким образом, что у такой бактерии усилена экспрессия гена, выбранного из группы, включающей:
- мутантный ген thrA, который кодирует аспартокиназа-гомосериндегидрогеназу I и является устойчивой к ингибированию треонином по типу обратной связи;
- ген thrB, который кодирует гомосеринкиназу;
- ген thrC, который кодирует треонинсинтазу;
- ген rhtA, который кодирует предположительно трансмембранный белок;
- ген asd, который кодирует аспартат-β-полуальдегиддегидрогеназу;
- ген aspC, который кодирует аспартатаминотрансферазу (аспартаттрансаминазу); и
комбинацию этих генов.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, при этом указанная бактерия является бактерией-продуцентом L-лизина.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, при этом указанная бактерия является бактерией-продуцентом L-гистидина.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, при этом указанная бактерия является бактерией-продуцентом L-фенилаланина.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, при этом указанная бактерия является бактерией-продуцентом L-аргинина.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, при этом указанная бактерия является бактерией-продуцентом L-триптофана.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, при этом указанная бактерия является бактерией-продуцентом L-глутаминовой кислоты.
Также целью настоящего изобретения является предоставление способа получения L-аминокислоты, который включает в себя выращивание описанной выше бактерии в питательной среде, содержащей глюкозу в качестве источника углерода, и выделение L-аминокислоты из культуральной жидкости.
Также целью настоящего изобретения является предоставление способа, описанного выше, при этом указанная L-аминокислота является L-треоином.
Также целью настоящего изобретения является предоставление способа, описанного выше, при этом указанная L-аминокислота является L-лизином.
Также целью настоящего изобретения является предоставление способа, описанного выше, при этом указанная L-аминокислота является L-гистидином.
Также целью настоящего изобретения является предоставление способа, описанного выше, при этом указанная L-аминокислота является L-фенилаланином.
Также целью настоящего изобретения является предоставление способа, описанного выше, при этом указанная L-аминокислота является L-аргинином.
Также целью настоящего изобретения является предоставление способа, описанного выше, при этом указанная L-аминокислота является L-триптофаном.
Также целью настоящего изобретения является предоставление способа, описанного выше, при этом указанная L-аминокислота является L-глутаминовой кислотой.
Подробное описание наилучшего способа осуществления изобретения
Согласно настоящему изобретению «бактерия-продуцент L-аминокислоты» означает бактерию, обладающую способностью к продукции и выделению L-аминокислоты в питательную среду, когда бактерия согласно настоящему изобретению выращивается в указанной питательной среде. Способность бактерии продуцировать L-аминокислоту может быть придана или увеличена путем выведения. Используемый здесь термин «бактерия-продуцент L-аминокислоты» также означает бактерию, которая способна к продукции L-аминокислоты и вызывает накопление L-аминокислоты в ферментационной среде в больших количествах, по сравнению с природным или родительским штаммом Е.coli, таким как штамм Е.coli K-12, и, предпочтительно означает, что указанный микроорганизм способен накапливать в среде целевую L-аминокислоту в количестве не менее чем 0.5 г/л, более предпочтительно, не менее чем 1.0 г/л. Термин «L-аминокислота» включает в себя L-аланин, L-аргинин, L-аспарагин, L-аспарагиновую кислоту, L-цистеин, L-глутаминовую кислоту, L-глутамин, L-глицин, L-гистидин, L-изолейцин, L-лейцин, L-лизин, L-метионин, L-фенилаланин, L-пролин, L-серин, L-треонин, L-триптофан, L-тирозин и L-валин. Аминокислоты L-треонин, L-лизин, L-гистидин, L-фенилаланин, L-аргинин, L-триптофан, и L-глутаминовая кислота являются предпочтительными.
Семейство Enterobacteriaceae включает в себя бактерии, принадлежащие к родам Escherichia, Enterobacter, Envinia, Klebsiella, Pantoea, Photorhabdus, Providencia, Salmonella, Serratia, Shigella, Morganella, Yersinia и т.д. Более конкретно, могут быть использованы бактерии, классифицируемые как принадлежащие к семейству Enterobacteriaceae в соответствии с таксономией, используемой в базе данных NCBI (National Center for Biotechnology Information) (http://www.ncbi.nlm.nih.gov/htbinpost/Taxonomy/wgetorg?mode=Tree&id=1236&lvl=3&keep=1&srchmode=1&unlock). Бактерия, принадлежащая к родам Escherichia или Pantoea, предпочтительна.
Термин "бактерия, принадлежащая к роду Escherichia" означает, что бактерия относится к роду Escherichia в соответствии с классификацией, известной специалисту в области микробиологии. В качестве примера микроорганизма, принадлежащего к роду Escherichia, использованного в настоящем изобретении, может быть упомянута бактерия Escherichia coli (Е.coli).
Круг бактерий, принадлежащих к роду Escherichia, которые могут быть использованы в настоящем изобретении, не ограничен каким-либо образом, однако, например, бактерии, описанные в книге Neidhardt, F.C. et al. (Escherichia coli and Salmonella typhimurium, American Society for Microbiology, Washington D.C., 1208, Таблица 1), могут быть включены в число бактерий согласно настоящему изобретению.
Термин «бактерия, принадлежащая к роду Pantoea» означает, что бактерия относится к роду Pantoea в соответствии с классификацией, известной специалисту в области микробиологии. Недавно несколько видов Enterobacter agglomerans были классифицированы как Pantoea agglomerans, Pantoea ananatis, Pantoea stewartii или подобные им, на основе анализа нуклеотидной последовательности 16S рРНК и т.д. (Int. J. Syst. Bacteriol., 43, 162-173 (1993)).
Бактерия, согласно настоящему изобретению, включает в себя штамм семейства Enterobacteriaceae, который способен продуцировать L-аминокислоту и модифицирован таким образом, что экспрессия оперона alsABC у этой бактерии усилена. Кроме того, бактерия, согласно настоящему изобретению, включает штамм семейства Enterobacteriaceae, который способен продуцировать L-аминокислоту и трансформирован с помощью фрагмента ДНК, кодирующего оперон alsABC таким образом, что компоненты переносчика D-аллозы, кодируемые этим фрагментом ДНК, экспрессируются.
Фраза «активность высокоаффинного переносчика D-аллозы» означает активность переноса сахаров, таких как D-аллоза и глюкоза, в клетку. Активность высокоаффинного переносчика D-аллозы может быть обнаружена и измерена с использованием мембранных везикул, таких, которые описаны в работах Daruwalla et al (Biochem J., 200(3), 611-27 (1981)) или путем комплементации штамма с делегированными генами оперона alsABC высокоаффинного переносчика D-аллозы (Horazdovsky, B.F. and Hogg, R.W., J. Bacteriol; 171(6):3053-9(1989)).
Термин «усиление экспрессии оперона» означает, что уровень экспрессии генов, составляющих оперон, выше, чем у немодифицированного штамма, например, природного штамма. Примеры такой модификации включают в себя увеличение числа копий гена(ов) оперона в расчете на клетку и/или повышение уровня экспрессии гена(ов) оперона и тому подобное. Количество копий гена оперона измеряется, например, с помощью ряда известных методов, таких как блотинг по Саузерну с использованием зондов, синтезированных на основе нуклеотидной последовательности генов оперона, флуоресцентной гибридизации in situ (FISH), и подобными им методами. Уровень экспрессии генов оперона может быть измерен с помощью ряда известных методов, включающих блотинг по Нозерну, количественный ОТ-ПЦР и подобные им. Кроме того, природные штаммы, которые могут выступать в качестве контроля, включают, например, штаммы Escherichia coli К-12 или Pantoea ananatis FERM ВР-6614 (заявка РСТ WO 2004099426, AU 2004236516 A1). Штамм Pantoea ananatis FERM ВР-6614 был депонирован в Национальном Институте Биологических Наук и Человеческих Технологий, Агенство Промышленной Науки и Технологии (National Institute of Bioscience and Human- Technology, Agency of Industrial Science and Technology), в настоящее время называющийся Национальный Институт Прогрессивной Промышленной Науки и Технологии, Международный Депозитарий Организмов для Целей Патентования, 19 февраля 1998 года и получил инвентарный номер PERM P-16644. Затем было произведено международное депонирование этого штамма согласно условиям Будапештского Договора от 11 января 1999 года и штамм получил инвентарный номер PERM BP-6614. Хотя этот штамм при выделении был идентифицирован как Enterobacter, тем не менее, позднее он был классифицирован как Pantoea ananatis на основе нуклеотидной последовательности 16S рРНК и других доказательств, приведенных ранее. В результате увеличения внутриклеточной активности переносчика D-аллозы, L-аминокислоты, например, L-треонин, L-лизин, L-гистидин, L-фенилаланин, L-триптофан или L-глутаминовая кислота, обнаруживаются в культуральной среде.
Оперон alsABC включает три гена в следующей последовательности. Ген alsB (синонимы - ЕСК4081, b4088, yjcX) кодирует белок, связывающий D-аллозу (синонимы - В4088, YjcX). Ген alsB (нуклеотиды, комплементарные нуклеотидам с номерами с 4,309,130 по 4,310,065 в нуклеотидной последовательности с инвентарным номером NC_000913 в базе данных GenBank; gi: 49175990) расположен на хромосоме штамма Е.coli К-12 между генами rpiR и alsA. Ген alsA (синонимы - ЕСК4080, b4087, yjcW) кодирует слитые субъединицы переносчика D-аллозы надсемейства АВС:АТФ-связывающие компоненты переносчика D-аллозы (синонимы - B4087, YjcW). Ген alsA (нуклеотиды, комплементарные нуклеотидам с номерами с 4,307,471 по 4,309,003 в нуклеотидной последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 16131913) расположен на хромосоме штамма Е.coli K-12 между генами alsB и alsC. Ген alsC (синонимы - yjcV, ECK4079, b4086, JW4047) кодирует субъединицу переносчика D-аллозы (синонимы - B4086, YjcV). Ген alsC (нуклеотиды, комплементарные нуклеотидам с номерами с 4,306,512 по 4,307,492 в нуклеотидной последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990) расположен на хромосоме штамма Е.coli K-12 между генами alsA и alsE. Другие опероны alsABC известны как: оперон alsABC из Shigella dysenteriae serotype I, Shigella sonney, Erwinia carotovora subsp. atroseptica, Yersinia pestis, Yersiniapseudotuberculosis, Pseudomonas pseudomallei, Pseudomonas mallei, Pseudomonas solanacearum. Нуклеотидные последовательности генов alsB, alsA, и alsC из Escherichia coli приведены в Перечне последовательностей под номерами: SEQ ID NO:1, SEQ ID NO:3, и SEQ ID NO:5, соответственно. Аминокислотные последовательности, кодируемые генами alsB, alsA, и alsC приведены в Перечне последовательностей под номерами SEQ ID NO:2, SEQ ID NO:4, и SEQ ID NO:6, соответственно,
Будучи транспортированной в клетку глюкоза фосфорилируется глюкокиназой, которая кодируется геном glk. Поэтому желательно модифицировать бактерию таким образом, чтобы усилить активность глюкокиназы. Ген glk, который кодирует глюкокиназу в Escherichia coli, известен (номера нуклеотидов с 2506481 по 2507446 в нуклеотидной последовательности с инвентарным номером NC_000913.1 в базе данных GenBank; gi: 16127994) расположен на хромосоме штамма Е.coli K-12 между рамками считывания b2387 и b2389.
При определенных условиях, изомераза ксилозы, кодируемая геном xylA, также эффективно катализирует конверсию D-глюкозы в D-фруктозу (Wovcha, M.G. et al, AppI Environ Microbiol. 45(4): 1402-4 (1983)). Поэтому желательно модифицировать бактерию таким образом, чтобы усилить активность изомеразы ксилозы. Ген ху1А, который кодирует изомеразу ксилозы в Escherichia coli, известен (номера нуклеотидов с 3728788 по 3727466 в нуклеотидной последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990) расположен на хромосоме штамма Е.coli K-12 между генами xylB и xylF.
Гены alsABC, glk и xylA могут быть получены с помощью ПЦР (полимеразная цепная реакция; ссылка на White, T.J. et al., Trends Genet., 5, 185 (1989)) с использованием праймеров, синтезированных на основе известных нуклеотидных последовательностей генов. Гены, кодирующие переносчик D-аллозы из других микроорганизмов, могут быть получены подобным образом.
Примерами генов оперона alsABC являются выделенные из Escherichia coli фрагменты ДНК, которые кодируют следующие белки:
(A) белок, включающий аминокислотную последовательность, приведенную в Перечне последовательностей под номером SEQ ID NO:2 и ее варианты;
(Б) белок, включающий аминокислотную последовательность, приведенную в Перечне последовательностей под номером SEQ ID NO:4 и ее варианты;
(B) белок, включающий аминокислотную последовательность, приведенную в Перечне последовательностей под номером SEQ ID NO:6 и ее варианты.
Термин «вариант белка» в значении, в котором она используется в настоящем изобретении, означает белок, который имеет изменения в аминокислотной последовательности, а именно делеции, вставки, добавления или замены аминокислот, при условии, что при этом сохраняется необходимый уровень активности белка, например, такой уровень активности, который обеспечивает усиленную продукцию L-аминокислоты. Ряд изменений в варианте белка зависит от положения или от типа аминокислотного остатка в трехмерной структуре белка. Количество изменений может составлять от 1-го до 30-ти, предпочтительно от 1-го до 15-ти и наиболее предпочтительно от 1-го до 5-ти изменений в последовательностях белка под номерами 2, 4, 6 (SEQ ID NO:2, 4, 6). Эти изменения могут иметь место в областях белка, которые не являются критичными для его функции. Это становится возможным благодаря тому, что аминокислоты обладают высокой гомологией друг с другом, и поэтому третичная структура или активность белка не нарушаются при таком изменении. Поэтому в качестве варианта белка может выступать белок, который имеет гомологию не менее чем 70%, предпочтительно не менее чем 80%, более предпочтительно, не менее чем 90% и наиболее предпочтительно, не менее чем 95% по отношению к полной аминокислотной последовательности, представленной на SEQ ID NOs.2, 4, 6 при условии, что активность переносчика D-аллозы сохраняется, когда этот белок сочетается с соответствующими компонентами высокоаффинного переносчика D-аллозы. В качестве примера компонентов, с которыми может комбинироваться высокоаффинный переносчик D-аллозы, могут служить следующие компоненты: вариант белка, приведенный в Перечне последовательностей под номером SEQ ID NO:2, комбинируется с белками, имеющими аминокислотную последовательность, приведенную в Перечне последовательностей под номерами SEQ ID NO:4 и SEQ ID NO:6, вариант белка, приведенный в Перечне последовательностей под номером SEQ ID NO:4, комбинируется с белками, имеющими аминокислотную последовательность, приведенную в Перечне последовательностей под номерами SEQ ID NO:2 и SEQ ID NO:6, и вариант белка, приведенный в Перечне последовательностей под номером SEQ ID NO:6, комбинируется с белками, имеющими аминокислотную последовательность, приведенную в Перечне последовательностей под номерами SEQ ID NO:2 и SEQ ID NO:4. Гомология между аминокислотными последовательностями может быть установлена с использованием хорошо известных методов, например с помощью выравнивания последовательностей в компьютерной программе BLAST 2.0, которая вычисляет три параметра: счет, идентичность и сходство.
Замена, делеция, инсерция, добавление или инверсия одного или нескольких аминокислотных остатков будут представлять собой консервативную мутацию или консервативные мутации при условии, что активность белка при этом сохраняется. Примером консервативной мутации(ий) является консервативная замена(ы). Примеры консервативных замен включают замену Ala на Ser или Thr, замену Arg на Gin, His или Lys, замену Asn на Glu, Gin, Lys, His или Asp, замену Asp на Asn, Glu или Gin, замену Cys на Ser или Ala, замену Gin на Asn, Glu, Lys, His, Asp или Arg, замену Glu на Asn, Gin, Lys или Asp, замену Gly на Pro, замену His на Asn, Lys, Gin, Arg или Tyr, замену Не на Leu, Met, Val или Phe, замену Leu на He, Met, Val or Phe, замену Lys на Asn, Glu, Gin, His или Arg, замену Met на Ile, Leu, Val или Phe, замену Phe на Trp, Tyr, Met, He или Leu, замену Ser на Thr или Ala, замену Thr на Ser или Ala, замену Trp на Phe или Tyr, замену Tyr на His, Phe или Trp и замену Val на Met, He или Leu.
Результаты сравнения первичных аминокислотных последовательностей белков alsABC из Escherichia coli (ECOLI), Symbiobacterium thermophilum (SYMTH), Bacillus cereus (BACC1), Bacillus subtilis (BACSU), Yersinia pestis (YERPE), Yersinia pseudotuberculosis (YERPS) выявили высокий уровень гомологии среди этих белков (см. Фиг.5, Фиг.6, Фиг.7). С этой точки зрения, замены или делеции аминокислотных остатков, которые являются идентичными (отмеченные звездочками (*)) во всех вышеуказанных белках могут быть критическими для их функции. Возможно, что замена сходных аминокислотных остатков (отмеченных двоеточием (:)) на сходные аминокислотные остатки не приведет к нарушению активности белка. Но модификации других неконсервативных аминокислотных остатков могут не привести к нарушению активности высокоаффинного переносчика D-аллозы.
Фрагменты ДНК, которые кодируют по существу те же белки, которые являются компонентами переносчика D-аллозы, могут быть получены, например, путем модификации нуклеотидных последовательностей фрагментов ДНК, кодирующих компоненты переносчика D-аллозы (SEQ ID NO:1, SEQ ID NO:3 или SEQ ID NO:5 соответственно), например, посредством метода сайт-направленного мутагенеза, так, что один или несколько аминокислотных остатков в определенном сайте будут вовлечены в делецию, замену, инсерцию или добавление. Фрагменты ДНК, модифицированные как описано выше, могут быть получены с помощью традиционных методов мутагенной обработки. Такая обработка включает в себя обработку гидроксиламином молекул ДНК, кодирующих белки согласно настоящему изобретению или обработку бактерий, содержащих указанную ДНК, УФ-лучами или реагентом, таким как N-метил-N'-нитро-N-нитрозогуанидин или азотистая кислота,
Фрагменты ДНК, которые кодируют по существу те же белки, которые являются компонентами переносчика D-аллозы, могут быть получены путем экспрессирования фрагментов ДНК, имеющих мутацию, описанную выше, в соответствующей клетке, и установления активности экспрессируемого продукта. Фрагменты ДНК, которые кодируют по существу те же белки, которые являются компонентами переносчика D-аллозы, могут быть также получены путем выделения фрагментов ДНК, которые гибридизовали с зондами, имеющими нуклеотидную последовательность, которая содержит, например, любую из нуклеотидных последовательностей, приведенных в Перечне последовательностей под номерами SEQ ID NO:1, SEQ ID NO:3, и SEQ ID NO:5 в жестких условиях, и кодирует белки, обладающие активностью компонентов переносчика D-аллозы. "Жесткие условия", в том значении, которое приписывается этому выражению в рамках настоящего изобретения, означает такие условия, при которых так называемые специфические гибриды образуются, а неспецифические гибриды не образуются. Например, демонстрацией жестких условий могут быть такие условия, при которых фрагменты ДНК, имеющие высокую гомологию, например фрагменты ДНК, имеющие гомологию не менее чем 50%, предпочтительней не менее чем 60%, более предпочтительней не менее, чем 70%, еще более предпочтительней не менее чем 80%, еще более предпочтительней не менее чем 90% и наиболее предпочтительней не менее чем 95% способны гибридизоваться друг с другом, а фрагменты ДНК, имеющие гомологию более низкую, чем описано выше, неспособны гибридизоваться друг с другом. Кроме того, демонстрацией жестких условий могут служить такие условия, при которых фрагменты ДНК гибридизуются при концентрации соли, эквивалентной условиям однократной отмывки при гибридизации по Саузерну, которые составляют 1×SSC, 0.1% SDS, предпочтительно 0.1×SSC, 0.1% SDS, при 60°С. Продолжительность отмывки зависит от типа мембраны, используемой для блотинга и, как правило, рекомендуется производителем набора. Например, рекомендуемая продолжительность отмывки для мембраны Hybond™ N+ nylon (Amersham, США), в жестких условиях составляет приблизительно 15 минут. Желательно отмывку повторять 2-3 раза. В качестве зондов могут быть также использованы неполные нуклеотидные последовательности, приведенные в Перечне последовательностей под номерами SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5. Зонды могут быть приготовлены с помощью ПЦР с использованием праймеров, синтезированных на основе нуклеотидных последовательностей, приведенных в Перечне последовательностей под номерами SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5 и на основе фрагментов ДНК, содержащих нуклеотидные последовательности, приведенные в Перечне последовательностей под номерами SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5 в качестве матрицы. В тех случаях, когда фрагмент ДНК, имеющий длину около 300 п.о., используется в качестве зонда, условия отмывки в процессе гибридизации включают, например, 50°С, 2×SSC и 0.1% SDS.
Замена, делеция, инсерция или добавление нуклеотидов, так как они описаны выше, также включает мутацию, которая имеет место в природе (мутант или вариант), например, обусловленную изменчивостью видов или родов бактерий, которые содержат компоненты переносчика D-аллозы.
«Трансформация бактерии с помощью фрагмента ДНК, кодирующего белок» означает введение фрагмента ДНК в бактерию, например, хорошо известными методами. Трансформация этой ДНК приведет к усилению экспрессии гена, кодирующего белок согласно настоящему изобретению и к увеличению активности белка в бактериальной клетке. Методы трансформации включают любые известные методы, которые описаны до настоящего времени. Например, метод обработки реципиентных клеток хлоридом кальция для того, чтобы увеличить проницаемость клеток для ДНК, был описан для штамма Escherichia coli К-12 (Mandel, M. and Higa, A., J. Mol. Biol., 53, 159 (1970)) и может быть использован.
Способы усиления экспрессии гена включают увеличение количества копий гена. Встраивание гена в вектор, который способен функционировать в бактерии семейства Enterobacteriaceae увеличивает количество копий этого гена. Предпочтительней использовать низкокопийные вектора. Примерами низкокопийных векторов могут служить, но не ограничиваются только ими, плазмиды pSC101, pMW118, pMW119 и подобные им. Термин «низкокопийный вектор» применяется для обозначения векторов, количество копий которых не превышает пяти копий на клетку.
Усиление экспрессии гена может также быть достигнуто путем внедрения множественных копий гена в хромосому бактерии с помощью, например, метода гомологичной рекомбинации, Mu интеграции и подобными им. К примеру, один цикл Mu интеграции позволяет встроить до трех копий гена в хромосому бактерии.
Усиление экспрессии генов оперона alsABC может быть также достигнуто путем внедрения множественных копий генов оперона alsABC в хромосому бактерии. Для внедрения множественных копий указанного оперона в хромосому бактерии проводится гомологичная рекомбинация с использованием последовательности, чьи множественные копии присутствуют в качестве мишеней в хромосомной ДНК. Последовательности, имеющие множественные копии в хромосомной ДНК, включают, но не ограничиваются только ими, повторяющиеся ДНК или инвертированные повторы, присутствующие на конце транспозабельного элемента. Так же, как это описано в патенте США 5,595,889, возможно внедрить оперон alsABC в транспозон и благодаря этому переносить и внедрять множество копий гена в хромосомную ДНК.
Усиление экспрессии генов указанного оперона может быть также произведено путем контроля экспрессии генов с помощью сильного промотора. Например, промоторы lac, trp и trc, а также промоторы PR или PL фага лямбда, известны в качестве сильных промоторов. Использование сильного промотора может сочетаться