Способ определения активных форм o2, н2 и их соединений в кислородонасыщенной воде
Иллюстрации
Показать всеИзобретение относится к области физической и коллоидной химии водных растворов. В способе используют катионы многовалентного металла (в частности, катионы Ag+), вызывающие переход воды, содержащей анионы Cl-, Br- и I- в окрашенное коллоидно-химическое состояние (в частности, для ионов соли AgCl в белую водную суспензию), и аномальные коллоидно-химические свойства насыщенной парогазовой смесью Н2O2+O2 воды по отношению к коллоидно-химическим свойствам воды, насыщенной в адекватных условиях кислородом воздуха, увеличивать не менее чем в 2,5-3,0 раза время устойчивого состояния окрашенной водной суспензии, помещенной под УФ-свет ртутной лампы (λ=254 нм). Окрашенная водная суспензия приготавливается смешением исследуемой кислородонасыщенной воды с водным раствором многовалентного металла. Технический результат - повышение чувствительности физико-химического способа определения активных форм O2, Н2 и их соединений в кислородонасыщенной воде для возможности определения активных форм О2 и их соединений при концентрациях от 10-4 до 10-8 М. 1 ил.
Реферат
Изобретение относится к области физической и коллоидной химии водных растворов, водоподготовки, более конкретно - физико-химическому анализу кислородонасыщенных вод.
Изобретение может быть использовано в пищевой промышленности, водном, сельском и коммунальном хозяйствах и находиться на стадии внедрения в опытно-промышленном производстве бутилированной кислородонасыщенной питьевой воды и напитков с торговыми марками «СУПЕРВОДА-О2», «ОКСИ» и других, содержащих растворенные кислород, водород и их активные формы.
В 1998 году ООО «Экосервис» совместно с ООО «Пальмира-Юг» был разработан плазмохимотронный способ получения парогазовой смеси Н2О2+О2 [1].
В отличие от известных энергосодержащих газовых и парогазовых смесей [2, 3], таких как воздух +О3, гремучая смесь Н2+О2 и других, парогазовая смесь Н2О2+О2, полученная плазмохимотронным способом из водного раствора электролита, не была изучена.
Согласно теории биполярного плазменного электрода (БПЭ) [1, 4], раскрывающего физико-химические свойства пленочной химотронной плазмы в высоковольтных электролизерах, аномальные свойства парогазовой смеси Н2О2+О2 по отношению к известным [2, 3] объясняются наличием в химотронной плазме заряженной (энергонасыщенной) кластерной формы пероксида водорода Н4О4 [1].
Особенности кластерного пероксида водорода Н4О4 определены уравнениями физико-химических реакций его распада в парогазовой смеси Н2О2+О2 и кислородонасыщенной воде (1)-(6):
где Е hν, Е* hν, Е** hν - дополнительная энергия, выделяющаяся из кластерного пероксида водорода;
Δε0-Δε6 - энергия физико-химических реакций;
(*) - энергообогащенные активными формами О2 и Н2 соединения.
Свойства пероксида водорода Н2O2 [1,5÷7] хорошо известны и регламентированы для питьевой воды и организма человека интервалом концентраций 10-6 М≤СН2O2≤10-4 М.
Известен биохимический хемилюминесцентный способ определения активных форм кислорода в оксигенированной питьевой воде [8].
В известном способе [8] использованы ВМС (люминол) и комплексообразующие катионы (например, Fe2+). Поскольку интенсивность хемилюминесцентных вспышек при внесении в кислородонасыщенный раствор, содержащий люминол катионов Fe2+, изменяется во времени и зависит от многих факторов (см. фотохимические реакции уравнений 1, 4, 6), то не наблюдается воспроизведение результатов в данном методе, необходимых для количественного анализа активных форм О2, Н2 и их соединений, растворимых в кислородонасыщенной воде.
Поэтому известный биохимический способ служит только для оценки интервала концентраций активных форм О2, H2 и их соединений, растворимых в кислородонасыщенной воде (конкретно для воды «ОКСИ» определен интервалом от 10-6 до 10-4 М).
Наиболее близким по сущности к заявленному способу является физико-химический способ определения Н2О2 в питьевой воде [5]. Он основан на измерении окраски катионов многовалентного металла (марганца) при взаимодействии с Н2О2:
KMnO4 - цветное соединение катионов марганца.
Известный физико-химический способ определения Н2О2 в питьевой воде [5] является самым надежным и простым в исполнении. Согласно методике анализа [5] уровень чувствительности физико-химического метода достигает 10-6 М (0,1 мг Н2О2/л H2O).
Источники информации о количественном определении активных форм O2, Н2 и их соединений, растворимых в кислородонасыщенной воде, физико-химическими способами автором заявки не были обнаружены.
Поэтому заявителем и автором было проведено исследование кислородонасыщенной питьевой воды постоянного химического состава, полученной смешением точных объемов кислородосодержащего газа (парогазовой кислородосодержащей смеси) с питьевой водой. Во всех экспериментах:
Vгаза/VH2O=Vпгс/VH2O=1 л газа / 1 л H2O=1 л пгс / 1 л H2O,
где V пгс - объем парогазовой кислородосодержащей смеси,
VH2O - объем питьевой воды.
Параметры воздуха:
температура 20±2°С; содержание свободного кислорода - до 21%.
Параметры парогазовой смеси 2Н2+О2 патента [3]:
температура 75±5°С; содержание свободного кислорода - до 30%.
Параметры парогазовой смеси Н2О2+О2 патента [1]:
температура 75±5°С; содержание свободного кислорода - до 20%.
Концентрация свободного кислорода определена фотометрическим методом. Погрешность метода ±20%.
В таблице 1 представлены экспериментальные результаты исследований.
Для выявления пороговой концентрации Н2О2+О2 в кислородонасыщенной питьевой воде, при которой количественно можно определить С H2O2, автором было проведено исследование влияния добавки в кислородонасыщенную питьевую воду фиксированного объема 3% раствора пероксида водорода (Н2О2).
Полученные экспериментальные данные представлены в таблице 2.
Проведенное исследование (см. данные таблиц 1, 2) выявило недостатки известного технического решения [5]:
- отсутствие чувствительности метода к кластерным формам активированных плазмохимотронным методом О2, Н2 и их соединений;
- количественное определение концентраций активных форм О2, Н2 и их соединений в кислородосодержащей воде по активному соединению Н2О2 - до 5·10-4 М. Целью изобретения является повышение чувствительности физико-химического метода анализа по активным формам О2, Н2 и их соединений в кислородонасыщенной воде и, как следствие, возможности их количественного определения при концентрации менее 5·10-4 М.
Техническая задача решается на основе открытия аномальных коллоидно-химических свойств пересыщенной кислородом парогазовой смеси Н2О2+О2 патента [1] питьевой воды по отношению к питьевой воде, насыщенной в адекватных условиях кислородом воздуха, увеличивать не менее чем в 2,5-3,0 раза время устойчивого состояния освещенной УФ-светом ртутной лампы (λ=254 нм) белой водной суспензии AgCl, приготовленной смешиванием исследуемой питьевой воды с прозрачным водным раствором AgNO3, имеющим фиксированную концентрацию.
Нижняя граница чувствительности заявленного метода определена растворимостью водной суспензии соли AgCl в питьевой воде - 1,3·10-5 М (1,4 мг Ag+/ л Н2О).
Для водных растворов AgBr и AgI нижняя граница чувствительности метода смещается в интервал концентраций 10-8-10-6 M
Верхняя граница чувствительности метода определена растворимостью окиси серебра (Ag2O) в питьевой воде - 1,3·10-4 М (14 мг Ag+/ л H2O).
В окрашенной водной суспензии (например, белой суспензии AgCl), освещенной УФ-светом кварцевой лампы (λ=254 нм), Ag2O и металлическое серебро (Ag) образуется за счет фотохимических реакций уравнений (7)-(8):
,
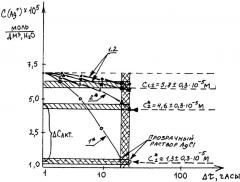
Экспериментальные данные по определению активных форм О2, Н2 и их соединений в кислородонасыщенной воде заявленным способом представлены на чертеже.
Возможность определения количества выделенного по фотохимическим реакциям (7), (8) серебра из водной суспензии до ее полного просветления (при постоянных температуре водной суспензии, концентрации AgCl, времени воздействия УФ-светом кварцевой лампы на водную суспензию серебра) позволяет использовать эффект увеличения во времени устойчивого состояния освещенной УФ-светом водной суспензии серебра, приготовленной на воде пересыщенной кислородом парогазовой смеси патента Н2О2+О2 [1], для определения активных форм О2, Н2 и их соединений в кислородонасыщенной воде
Ход анализа.
Отбирают в четыре сосуда фиксированные объемы проб питьевой воды, насыщенной одновременно кислородом воздуха и парогазовой смесью Н2О2+О2, в условиях эксперимента (табл.1).
Две пробы (см. чертеж, поз.1) - вода, насыщенная кислородом воздуха.
Две пробы (см. чертеж, поз.2) - вода, насыщенная парогазовой смесью Н2О2+О2.
Пробы воды смешивают с фиксированным объемом водного раствора AgNO3, обеспечивающего образование белой водной суспензии AgCl.
Уровень концентрации Ag+ определяет концентрация ионов Cl- в питьевой воде (от 20 до 30 мг Cl-/ л Н2О).
Концентрацию ионов Ag+ измеряют титрометрическим методом [2], предварительно отделив белый коллоидно-механический осадок AgCl ультрафильтрационной мембраной, с последующим его растворением в слабом (10-3 М) водном растворе азотной кислоты.
Ставят одновременно на анализ четыре пробы. Контрольные пробы поз.1, 2 (см. чертеж) помещают в темноту. Исследуемые пробы поз.1*, 2* (см. чертеж) помещают под УФ-свет ртутной лампы (λ=254 нм).
Концентрацию активных форм O2, Н2 и их соединений в кислородонасыщенной воде (ΔСакт) определяют при фиксированном во времени полном просветлении белой водной суспензии AgCl, приготовленной на питьевой воде, насыщенной кислородом воздуха, помещенной под УФ-свет ртутной лампы.
Уровень просветления белой водной суспензии AgCl фиксируют отсутствием изменений на шкале барабана фотометрического прибора (например, КФК-2) при сравнительном измерении оптической окраски исследуемого водного раствора и исходной питьевой воды.
где C1 и С2 - соответственно концентрация суспензии AgCl в
кислородонасыщенной питьевой воде, помещенной в темноту;
С2* и C1* - соответственно концентрация суспензии AgCl в
кислородонасыщенной питьевой воде, помещенной в УФ-свет от ртутной лампы.
Индекс «1» - питьевая вода, насыщенная кислородом воздуха;
Индекс «2» - питьевая вода, насыщенная парогазовой смесью Н2О2+О2.
Определенная из условий эксперимента (чертеж и табл.1) концентрация активных форм О2, Н2 и их соединений в кислородонасыщенной парогазовой смесью Н2О2+О2 питьевой воде оценивается величиной: ΔCакт=(3,3±0,6)·10-5 М (см. чертеж). Уровень погрешности заявленного метода колеблется от ±20 до ±30%.
Полученный нами результат доказывает, что при низких концентрациях Н2О2 (не превышающих 5·10-4 М) устойчивые активные формы О2, Н2 и их соединений реально существуют и входят в состав кислородонасыщенной воды. Они влияют на размер оболочки структурированной воды окружающей коллоидные частицы водной суспензии и, как следствие, дисперсность коллоидных частиц в кислородонасыщенной воде, увеличивая время распада частиц водной суспензии в УФ-свете от ртутной лампы в 2,5-3,0 раза.
Способ был использован при пуске и эксплуатации опытного производства бутилированной кислородонасыщенной питьевой воды «ОКСИ» (для анализа воды и подбора экологически чистого водного раствора электролита патента [1]). На основании рассмотренного выше материала заявитель считает, что техническая задача решена в полном объеме. Разработанный способ является конкурентоспособным на рынке оборудования для анализа бутилированных кислородонасыщенньгх вод, содержащих устойчивые энергонасыщенные формы О2, H2 и их соединений.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. Зыков Е.Д., Щербак В.Н. Плазмохимотронный способ получения парогазовой смеси Н2O2+O2. Патент России №2171863 (С2) С25В 1/30, С25В 1/04, C02F 1/46, 30.07.1998 г.
2. Кульский Л.А. Основы химии и технологии воды. - Киев, «Наукова Думка», 1991, 568 с.
3. Вердиев М.Г. и др. Электролизер для получения смеси кислорода и водорода. Патент России №2091508, (С1), С25В 1/04, 27.09.97 г.
4. Гришин В.Г., Давыдов А.Д. Плазмодинамический реактор для нейтрализации протонов и дейтронов в природной воде. Материалы 9-й Росс.конф. по холодной трансмутации ядер химических элементов (РХТЯ-9), Дагомыс, Сочи, 30 сентября - 7 октября 2001 г. - М., 2002, с.107-110.
5. Перекись водорода и перекисные соединения. Под ред. Позина М.Е. М.-Л., Изд-во «ГНТИ химической литературы», 1951,432 с.
6. Уильям Дуглас. Целительные свойства перекиси водорода. Санкт-Петербург, Изд-во «Питер», 1998, 192 с.
7. Коургио Эн-мэрик и другие. Перекись водорода (Н2O2) индуцирует актин и некоторые белки теплового шока в клетках дрозофилы.
«Eut. J. Biochem», 1988, 171, №1-2, p.163-170 (Аннотация статьи, см. Реферативный журнал «Биология», 7Т440, 1988 г.).
8. Воейков В.Л., Новиков К.Н. Хемилюминесцентный анализ питьевой воды, оксигенированной в плазмохимотронном реакторе. Международная конференция «Новые технологии в защите биоразнообразия в водных экосистемах. М., МГУ им. Ломоносова, май 2002 г., с.16-22 (тезисы докладов).
Способ определения активных форм O2, Н2 и их соединений в кислородонасыщенной воде, содержащей анионы Cl-, Br- и I-, с применением катионов металла, отличающийся тем, что путем смешивания исследуемой воды с прозрачным водным раствором соли металла, вызывающим окрашивание воды, готовят водную суспензию, которую помещают под УФ-свет, и, используя переход кислородонасыщенной воды в окрашенное коллоидно-химическое состояние, определяют концентрацию активных форм O2, Н2 и их соединений в кислородонасыщенной воде при фиксированном во времени полном просветлении водной суспензии путем сравнительных измерений оптической окраски исследуемого водного раствора и исходной питьевой воды, при этом исследуют питьевую воду, насыщенную кислородом воздуха, и питьевую воду, насыщенную парогазовой смесью Н2O2+O2, и используют аномальные коллоидно-химические свойства воды, насыщенной парогазовой смесью Н2O2+O2, по отношению к коллоидно-химическим свойствам воды, насыщенной кислородом воздуха в адекватных условиях, обеспечивающие увеличение не менее чем в 2,5-3,0 раза времени устойчивого состояния окрашенной водной суспензии.