Высокоспецифическая противоопухолевая фармакологическая лекарственная система, синтез лекарственного средства и способ моделирования лекарственного средства
Иллюстрации
Показать всеФармацевтическая противоопухолевая лекарственная система включает биологически инертное прото-лекарство и биологически инертное активационное лекарственное средство. После периода отсрочки, который способствует дифференциальному концентрированию прото-лекарств в опухолевых или инвазивных тканях- или клетках-мишенях, нетоксическое лекарственное средство модифицируется посредством активационного лекарственного средства, чтобы избирательно достичь токсических уровней фармакологически активного средства в тканях-мишенях. Новая противоопухолевая система обладает по сравнению с уже известными системами достаточно высокой эффективностью и пониженным уровнем токсичности. 15 н. и 19 з.п. ф-лы.
Реферат
Предпосылки изобретения
Несмотря на успехи, достигнутые в области создания противоопухолевых средств, рак остается заболеванием с очень неблагоприятным прогнозом. В литературе постоянно появляются сообщения о веществах, проявляющих in vitro и in vivo противоопухолевую активность, но лишь ничтожное количество таких веществ проходит фазу II клинического испытания. Кроме того, показатели эффективности лекарственных средств, используемых в лечении опухолевых заболеваний, неприемлемо низки, и побочные эффекты таких лекарственных средств весьма серьезны. Токсическое действие лекарственных средств на опухолевые ткани только в малой степени превышает их токсическое действие на нормальные, здоровые клетки организма, которые должны быть защищены от воздействия лекарственных средств. Кроме того, недостаточную эффективность противоопухолевых средств можно отнести за счет отсутствия способов, позволяющих заранее, на этапе разработки лекарственных средств, осуществлять контроль побочных эффектов, специфичности и высокой активности указанных средств в отношении ткани-мишени человека. Необходим способ, позволяющий создавать потенциальные соединения, удовлетворяющие всем требованиям, предъявляемым к системе доставки лекарственных средств и противоопухолевой эффективности. Достижение этой цели осуществляется посредством настоящего изобретения.
Исследования в области химиотерапии злокачественных опухолей в значительной степени были направлены на поиск лекарственных средств, проявляющих способность токсина разрушать неопластическую ткань в организме, не превышая степени токсического воздействия, причиняющей вред здоровым тканям, то есть направлены на поиск цитотоксических лекарственных препаратов, которые концентрируются в неопластических тканях, или средств, которые в процессе метаболизма превращаются в такие токсины. Хотя в этом направлении были предприняты серьезные попытки, результаты были достигнуты только для некоторых типов злокачественных опухолей. Для большинства типов злокачественных опухолей успех был незначительным.
Развитие современных противоопухолевых лекарственных средств началось с обнаружения того факта, что отравляющий газ, применяемый в Первую мировую войну, действительно оказывал побочное противоопухолевое действие. Процесс развития противоопухолевых лекарственных средств начался на этом этапе в основном со случайного поиска среди известных токсинов, так и токсинов, у которых путем проверки их воздействия удается выяснить, обладает ли такой токсин дифференциальной токсичностью, которая могла бы способствовать осуществлению контроля или лечению злокачественных заболеваний. При таком подходе внимание направлено на поиск «однофрагментных» соединений.
В 1930-х годах были созданы более сложные соединения, так чтобы функция противоопухолевого средства была разделена на две части или чтобы соединение состояло из двух фрагментов, где один фрагмент должен служить для концентрирования лекарственного средства в злокачественной клетке или опухолевой ткани, а второй фрагмент должен служить для разрушения злокачественных клеток, в которых сконцентрировано соединение. Главным достижением в данной области было выявление химической природы соединения, обусловливающей избирательность в отношении опухоли. Предыдущие сообщения о такой специфичности исследователей Lewis, et al. в публикации в Cancer Res., 9:736, 1949, которые касались красителя нильского голубого, подтолкнули к идее модификации этого бензофеноксазина, заключающейся во введении токсина, такого как азотистый иприт, в качестве интегральной части молекулы (Sen, et al., Int. Union against Cancer Acta, 26, 774 (1960)). Эти попытки модифицировать средство, проявляющее избирательность в отношении пораженной злокачественной опухолью ткани, посредством токсического фрагмента не имели значительного успеха. Было высказано предположение, что неудача таких подходов связана с модификацией тканевой избирательности исходного соединения в результате добавления токсического фрагмента. Однако причина неудачи более фундаментальна, и ее объяснение связано с другими концепциями, касающимися доставки лекарственных средств, в частности концепцией о противоопухолевых пролекарствах.
В начале 1950-ых годов модель двухфрагментного лекарственного средства, состоящая из концентрирующего фрагмента и токсического фрагмента, была модифицирована с образованием двухфрагментной модели “пролекарства”, где один фрагмент предназначен модифицировать или “маскировать” или “покрывать” токсичность второго токсического фрагмента лекарственного соединения до тех пор, пока лекарственное средство не поступит в злокачественные клетки. На этом этапе с помощью химической реакции, которую проводят в присутствии ферментов, специфичных в отношении злокачественных клеток, удаляют маскирующий или покрывающий фрагмент, с тем чтобы токсический фрагмент уничтожил злокачественные клетки. Но и здесь идея доставки противоопухолевого пролекарства также не имела значительного успеха.
Идея создания пролекарств, объединяющих в себе концентрирующий фрагмент и токсический фрагмент, а также идея создания пролекарств, которые предназначены метаболизировать предпочтительно в опухолевых тканях, сталкивается с проблемами, которые исходят из природы самой опухоли: злокачественные клетки и ткани не являются чужеродными биологическими организмами, химическая природа которых отличается от природы нормальной ткани. Эти ткани, в случае опухолей человека, являются тканями человека. Нормальная и неопластическая ткань имеют, по сути, одинаковую химическую природу; то есть большей частью обе состоят из одинаковых химических молекул и в сходных концентрациях.
В 1980 году исследователь Evan Harris Walker в публикации Perspectives in Biology and Medicine, Spring Issue, 424-438 (1980), доказывал, что концепция пролекарства и концепция комбинации токсина с концентрирующим фрагментом не имела успеха в связи с фундаментальными законами фармакокинетики, касающимися доставки лекарственного средства. Период действия лекарственных средств зависит от скоростей их метаболического поглощения и элиминации. В случае, если скорости в злокачественных клетках ниже, чем в нормальных клетках, лекарственные средства, по-видимому, будут концентрироваться. То есть после достаточного периода времени лекарственные средства должны быть метаболизированы и выведены из нормальных тканей, в то время как в злокачественных клетках и тканях они все еще будут присутствовать в значительных концентрациях. Проблема создания эффективного противоопухолевого лекарственного средства не является проблемой достижения дифференциальной концентрации или проблемой получения лекарственного средства, которое активируется ферментами в клетках, а скорее проблемой, связанной с возможностью подавлять токсичность лекарственного средства в нормальных клетках и тканях до тех пор, пока дифференциальная концентрация лекарственного средства не станет благоприятной.
Для того чтобы воспользоваться преимуществом различия концентраций лекарственного средства между нормальной и пораженной злокачественной опухолью тканью, исследователь Walker в публикации Perspectives in Biology and Medicine, Spring Issue, 424-438 (1980) предложил модель, состоящую из двух лекарственных средств, пролекарства и “активационного” лекарственного средства. Как пролекарство (которое имеет конструкцию, ограниченную токсином плюс покрывающим или маскирующим фрагментом), так и активационное лекарственное средство были созданы таким образом, чтобы оказывать незначительное токсическое или другое действие на организм или вовсе его не иметь (т.е. быть в значительной степени биологически инертными) при введении одного из них. Однако в комбинации указанные два соединения должны взаимодействовать в организме с образованием соединения, проявляющего токсичность по отношению к клеткам, в которых соединение было образовано. Данных два лекарственных средства следует вводить последовательно, с отсрочкой во времени между их введением, чтобы позволить нормальным клеткам метаболизировать и элиминировать пролекарство из организма до введения активационного лекарственного средства. В этот момент - после периода отсрочки дифференциальной доставки лекарственного средства - должна быть достигнута дифференциальная концентрация пролекарства. Удаление маскирующего или покрывающего фрагмента пролекарства в это время - когда пролекарство должно быть дифференциально сконцентрировано в опухолевых тканях - должно приводить к доставке включенного противоопухолевого токсина при высоких уровнях. Таким способом противоопухолевые токсины должны быть доставлены к злокачественным клеткам и тканям без ущерба для нормальных клеток и тканей.
Пролекарства такого типа, который предложен исследователем Walker, были разработаны и синтезированы авторами настоящего изобретения. Одним из таких пролекарств был 5-фторурацил-N-глюкозид, который может быть активирован ферментом β-глюкозидазой. После создания пролекарства такого типа авторы настоящего изобретения обнаружили, что более сложная система пролекарства и активационного лекарственного средства необходима для обеспечения всех требований, предъявляемых к избирательному и эффективному противоопухолевому фармацевтическому препарату. В частности, авторы настоящего изобретения обнаружили, что модель пролекарства и активационного лекарственного средства такого типа также имеет ограничения в том, что дифференциальная концентрация, достигаемая в рамках данной модели, была недостаточно высокой. Другими словами, эффект дифференциальной концентрации, обусловленный полностью дифференциальной диффузией без добавленного фрагмента для повышения концентрационной разницы, оказался недостаточным. Исходя из вышеизложенного, следует, что необходима более сложная система лекарственного средства, а также необходим способ создания такой системы лекарственного средства.
Сущность изобретения
Настоящее изобретение относится к комбинации, содержащей химические компоненты и химические фрагменты, способу создания комбинации, продуктов или устройств, необходимых для осуществления и оценки этого способа, химическим системам, созданным с помощью способов, которые служат в качестве примеров отдельных комбинаций, и к способам, необходимым для успешного применения комбинации и конкретных примеров комбинаций, созданных способом, раскрытым в данном описании.
Комбинация согласно настоящему описанию определена как сложная система прото-лекарства и активационного лекарственного средства. Прото-лекарство включает в себя один или более дифференциально избирательных фрагментов, один или более токсических фрагментов и один или более фрагментов, которые служат для обеспечения «маскировки» или «покрытия» токсических фрагментов.
Настоящее описание также охватывает активационное лекарственное средство, которое определено как один или более химических компонентов, выполняющих функцию активации прото-лекарства в комбинации. Активационное лекарственное средство способствует удалению маскирующего или покрывающего фрагмента или достаточного количества «маскировки» или «покрытия» или изменению химической природы всей молекулы прото-лекарства, с тем чтобы по существу исключить функцию маскировки или покрытия прото-лекарства, что делает образовавшееся соединение токсическим, фармакологически активным средством. Кроме того, в настоящем изобретении описано введение "связей", которые предназначены для химического связывания фрагментов с образованием единого соединения, которое само по себе является по существу биологически инертным. Связями могут быть химические связи между связанными фрагментами или комбинация атома(ов) и связей, которые соединяют фрагменты прото-лекарства.
Настоящее описание относится к способу, с помощью которого предполагается создать и проанализировать систему (т.е. комбинацию) прото-лекарства и активационного лекарственного средства. То есть вероятность того, что такая сложная система химических компонентов, обладающих набором необходимых свойств, может быть создана посредством бессистемного экспериментирования, является нулевой. Из вышесказанного следует, что необходимо разработать способ создания таких химических систем.
Настоящее описание также относится к новым продуктам или устройствам, используемым в настоящем способе.
Настоящее описание также включает в себя отдельные примеры систем прото-лекарства и активационного лекарственного средства (т.е. комбинаций), которые получают путем успешного применения способа.
Подробное описание изобретения
Комбинация, способ создания комбинации, продукты или устройства, требующиеся для осуществления и оценки способа, и процедуры, необходимые для успешного применения примеров химической системы, описанных в данном изобретении, направлены на получение высокоизбирательного и эффективного противоопухолевого фармацевтического препарата. Примеры и соответствующие данные, приведенные ниже, служат в качестве примеров конкретных комбинаций и демонстрируют успешное применение описанного способа. Способ не ограничивается созданием противоопухолевого средства, но также может применяться и для разработки других фармацевтических препаратов, токсичность которых в отношении популяции клеток-мишеней должна сочетаться с низкотоксичными сопутствующими побочными эффектами.
Целью настоящего изобретения является получение комбинации, которая включает в себя прото-лекарство и активационное лекарственное средство, где прото-лекарство состоит по меньшей мере из одного дифференциально концентрирующего фрагмента, по меньшей мере одного токсического фрагмента и по меньшей мере одного покрывающего фрагмента. Подробное описание компонентов прото-лекарства приведено ниже:
1. Дифференциально избирательный фрагмент или фрагменты (также называемый «дифференциально концентрирующим фрагментом») химического соединения, обладающего свойствами, позволяющими соединению дифференциально концентрироваться в опухолевых тканях по сравнению с нормальными тканями подвергаемого лечению организма животного или человека. Употребляемый в тексте термин "дифференциально концентрироваться" означает, что в какой-то момент фармакокинетического процесса отношение концентрации указанного соединения в опухолевой ткани к концентрации этого соединения в нормальных тканях станет повышаться в результате различия между поглощением, распределением, метаболизмом и элиминацией лекарственного средства в опухолевых клетках и нормальных клетках.
2. Токсический фрагмент или фрагменты химического соединения, обладающие свойствами, позволяющими соединению уничтожить клетки или ткани, в которых оно концентрируется.
3. Маскирующий или покрывающий фрагмент или фрагменты химического соединения, обладающие свойствами, позволяющими пролекарству не проявлять токсичность, то есть прото-лекарство не действует как токсин в клетке или ткани, в которой оно локализовано, до тех пор, пока прото-лекарство не будет активировано путем аппликации или введения активационного лекарственного средства. Употребляемый в тексте термин "маскирующий или покрывающий фрагмент" означает любую модификацию в прото-лекарстве, которая способствует ослаблению или устранению токсичности всего соединения, где такой покрывающий фрагмент удаляется позже или модифицируется активационным лекарственным средством. Термин «маскировка» или «покрытие» не должен означать или ограничиваться значением химический фрагмент, который буквально покрывает прото-лекарство или химически связывается непосредственно с токсическим фрагментом или токсическим участком прото-лекарства.
4. Связи, означающие химические связи или комбинацию атомов и связей между элементами отдельных фрагментов прото-лекарства, которое включает в себя по меньшей мере один фрагмент каждого из дифференциально избирательного фрагмента, токсического фрагмента и покрывающего фрагмента. Примеры связей, составляющих комбинацию атомов и связей, включают в себя, не ограничиваясь ими, единичные атомы, такие как кислород, которые могут образовывать связь -О- с двумя связывающими участками для присоединения двух из требуемых фрагментов, или группы различных атомов, такие как амин (>N-CH2-), которые могут присоединять три фрагмента, или азин (>C:NN:C<), который, если потребуется, может соединить вместе четыре фрагмента с образованием одной молекулы.
Активационное лекарственное средство комбинации представляет собой одно или более химических соединений, отделенных от прото-лекарства. Активационное лекарственное средство служит активатором прото-лекарства путем физической или химической модификации, чтобы сделать образованное соединение токсичным, фармакологически активным средством, или чтобы прото-лекарство высвобождало токсический фрагмент. Как прото-лекарство, так и активационное лекарственное средство моделируют таким образом, чтобы они оказывали незначительный токсический или другой эффект на организм или вовсе его не оказывали (т.е. по существу были биологически инертными) при введении по отдельности. Однако в комбинации прото-лекарство и активационное лекарственное средство будут взаимодействовать в организме, образуя соединение, токсичное в отношении клеток, в которых такое соединение образуется.
Тот факт, что прото-лекарство и активационное лекарственное средство моделированы так, что они должны проявлять незначительное токсическое действие на организм или вовсе его не проявлять при введении по отдельности, однозначно свидетельствует о том, что описанный способ моделирования лекарственного средства отличается от ранее описанных способов создания лекарственного средства. Данный способ позволяет переместить отдельные элементы химической модели из области биохимии в прогнозируемую область органической химии. Настоящим изобретением достигается модификация моделирования стандартного прото-лекарства. Стандартные прото-лекарства зависят от специфики биохимических реакций, протекающих в тканях организма, в которых они превращаются в фармакологически активные соединения. Прото-лекарство согласно настоящему изобретению, по существу, является биологически инертным соединением, которое подвергается взаимодействию, например, с неорганическим соединением, так что, хотя реакция протекает в среде биологической системы, оно не поддается реакции с эндогенными молекулами самой биологической системы. В случае, когда прото-лекарство и активационное лекарственное средство взаимодействуют друг с другом, полученные в результате такой реакции продукты и их метаболиты становятся соединениями, обладающими хорошо известными биологическими активностями, которые позволяют сохранить их хорошо установленные и хорошо изученные свойства и при добавлении многих химических фрагментов. Что будет происходить с указанными химическими компонентами, которые участвуют в создании прото-лекарства, можно предсказать в широком диапазоне химических модификаций. Мехлорэтамин, как особый пример, остается токсином для биологических тканей, в которых он накапливается, при большом количестве модификаций - модификаций, которые хорошо изучены и истолкованы. Таким образом, как «абиологическая» химия предшественников прото-лекарства, так и химия их соответствующих фармакологически активных продуктов реакции достаточно изучены, чтобы определить модификации, которые служат основой для любого числа специфических вариаций в настоящем описании, и это число будет увеличиваться в области знаний.
Способ детального моделирования комбинации включает в себя следующие стадии:
Выбор дифференциально концентрирующего фрагмента: Стадия способа, посредством которой химические фрагменты соединения, обладающие свойствами повышать дифференциальную концентрацию, означающую, что отношение концентрации указанного соединения в опухолевой или другой ткани-мишени или тканях-мишенях к концентрации соединения в нормальных тканях в некое время фармакокинетического процесса станет повышаться в результате различия между поглощением, распределением, метаболизмом и элиминацией лекарственного средства в опухолевых и нормальных тканях, идентифицируют с помощью специфических процедур. Одним способом отбора соединений, включающих в себя дифференциально избирательный фрагмент, является ВЭЖХ. Указанные процедуры ВЭЖХ включают в себя, не ограничиваясь ими, определение скоростей диффузии для потенциальных соединений, содержащих дифференциально концентрирующий фрагмент (или состоящих полностью из данного фрагмента), посредством различных типов колонок ВЭЖХ, для того, чтобы выбрать из соединений такие, которые имеют низкие скорости диффузии (то есть высокие скорости удерживания). Примерами используемых в этих целях колонок для ВЭЖХ являются ВЭЖХ-колонки с сорбированной РНК злокачественных клеток, ВЭЖХ-колонки с сорбированной ДНК злокачественных клеток и ВЭЖХ-колонки с сорбированными злокачественными клетками, суспензией злокачественных клеток и экстрактом злокачественных клеток (иначе называемые «колонками ракового типа»). Дифференциально концентрирующий фрагмент также оценивают посредством контрольной колонки, означающей ВЭЖХ-колонку с сорбированной РНК или ДНК из нормальных клеток или с сорбированными нормальными клетками, суспензией нормальных клеток или экстрактом нормальных клеток. Соединение, содержащее дифференциально концентрирующий фрагмент, выбирают путем сравнения скорости диффузии соединения на ВЭЖХ-колонке ракового типа со скоростью диффузии на контрольной колонке. Соединения, имеющие низкие скорости диффузии (т.е. высокие скорости удерживания на колонках ракового типа), являются потенциальными дифференциально избирательными фрагментами.
Второй способ отбора соединений, содержащих дифференциально избирательный фрагмент, включает в себя методы хроматографии, отличные от ВЭЖХ. Указанные процедуры включают в себя, не ограничиваясь указанными, определение скоростей диффузии для потенциальных соединений, содержащих дифференциально концентрирующий фрагмент (или состоящих полностью из указанного фрагмента), с помощью хроматографических колонок, листов, слоев, поверхностей с сорбированной РНК или ДНК злокачественных клеток или других типов хроматографии с целью отбора соединений, имеющих низкие скорости диффузии (то есть высокие скорости удерживания), относительно скоростей диффузии, определяемых с помощью контрольной хроматографической системы. Потенциальные соединения, содержащие фрагмент (или состоящие полностью из фрагмента), также могут быть подвергнуты определению скоростей диффузии с помощью хроматографических колонок, листов, слоев, поверхностей с сорбированными злокачественными клетками, суспензий злокачественных клеток или экстрактов злокачественных клеток или других типов хроматографии. Как и в методе ВЭЖХ, дифференциально концентрирующее соединение выбирают путем сравнения скорости диффузии соединения на системе с сорбированным опухолевым материалом со скоростью диффузии на контрольной системе.
Третьим способом, посредством которого выбирают соединения, содержащие дифференциально избирательный фрагмент, является методология in vivo. Для оценки потенциального соединения с дифференциально концентрирующим фрагментом используют методы in vivo, включающие в себя введение материала модельным животным, у которых вызывают рост опухоли, и проверку биопсий, взятых при различных временах отсрочки, или умерщвление животных при очередном времени отсрочки, что предпринято с целью возможного определения концентрации потенциального материала как функции от времени в опухолевых тканях и в нормальных тканях.
Механизм, посредством которого потенциальные соединения, содержащие дифференциально избирательные фрагменты, могут быть отобраны для того, чтобы пройти через вышеописанные методологии отбора, включает в себя выбор таких соединений из перечня красителей, обладающих высокими окрашивающими свойствами, применяемых в диагностике злокачественных опухолей. В этом отношении следует отметить, что красители используют для окрашивания образцов ткани, взятых у больных с целью выявления наличия опухоли, поскольку злокачественным клеткам свойственно высокое поглощение отдельных красителей, применяемых для этой цели. Примерами таких красителей являются гематоксилиновый и эозиновый красители, используемые в методах картирования железы Вирхова с целью исследования образцов ткани грудной железы онкологических больных, и цитокератин, используемый при иммуногистохимическом окрашивании образца ткани, взятого из лимфатических узлов для диагностики микрометастатического заболевания (Pendas, et al., Annals of Surgical Oncology 7(1), 15-20, 2000, January-February). Другие красители, имеющие тканевую избирательность, которая превращается в опухолевую избирательность, включают в себя нильский голубой (Lewis, et al., Cancer Res. 9, 736, 1949). Кроме того, авторы отмечают, что желтые тиоксантоны проявляют тканевую избирательность (Miller, et al., патент США No. 5346917). Избирательность данных красителей в сочетании с их благоприятными физико-химическими свойствами делает их хорошими кандидатами для избирательной доставки лекарственных средств.
Перечень таких красящих материалов, которые являются соединениями, содержащими потенциальные дифференциально избирательные фрагменты или полностью состоящими из них, включает в себя, не ограничиваясь перечисленным, следующие: нильский голубой; тиоксантоны; гематоксилиновый краситель; эозиновый краситель; цитокератиновый краситель; красители ДНК/РНК, включая трипановый синий, метиловый зеленый, этидийбромид, лейкофуксиновый краситель, метиленовый голубой; материалы в ссылках Handbook of Fluorescent Probes and Research Chemicals [by Richard P. Haugland, Sixth Edition], включая красители акридиновый гомодимер, акридиновый оранжевый, актиномицин D, 7-аминоактиномицин D, 9-амино-6-хлор-2-метоксиакридин, 4,6-диамидино-2-фенилиндол, дигидроэтидий, 4′,6-(диимидазолин-2-ил)-2-фенилиндол, гетеродимер этидия-акридина, этидийдиазид, этидия гомодимер-1 и -2, этидиймоноазид, гидроксистилбемидин, метансульфонат; биологические красители общего назначения, такие как сафранин, малахитовый зеленый, эозиновый желтоватый, кристаллический фиолетовый, метиленовый голубой, гематоксилин, основный коричневый, карминовые квасцы, метиловый зеленый и нейтральный красный, краситель Giemsa, краситель Gram и химические соединения, которые, как известно, “прилипают”, но не связываются с ДНК и РНК, называемые иногда нестойкими красками.
Перечень потенциальных красителей и биологических красок для дифференциально избирательного фрагмента достаточно длинный. Выбор предпочтительных кандидатов для химического фрагмента, обладающего способностью повышать дифференциальную концентрацию, должен быть подтвержден одним или более предварительно описанными методами отбора.
Представляет особый интерес то, что выбранный материал имеет низкую токсичность по отношению к нормальной ткани и в пределах, в которых он проявляет любую токсичность, что токсичность является дифференциально избирательной против опухолевых тканей (в противном случае указанная особенность будет направлена против всей модели лекарственного средства). Эти положения, а также выбор дифференциально концентрирующего фрагмента пролекарства формул I и II представлены ниже.
Выбор токсического фрагмента: Стадия способа, посредством которой химический фрагмент, проявляющий способность вызывать или повышать цитотоксичность или гибель клетки, выявляют с помощью тестов in vitro, тестов in vivo или выбирают из существующих перечней соединений, которые проявляют цитотоксичность и которые содержат цитотоксический фрагмент.
Выбор покрывающего фрагмента: Стадия способа, посредством которой химические фрагменты, обладающие способностью маскировать, покрывать, ослаблять или исключать цитотоксичность токсического фрагмента одновременно с тем, что такой покрывающий фрагмент химически не удаляется путем ферментативных или других метаболических процессов в организме больного, выявляют с помощью тестов in vitro или выбирают из существующих перечней реагентов с токсическим фрагментом, выбранным, как описано выше. Соответствие покрывающего фрагмента устанавливают после образования полного прото-лекарства (включая выбранные связи, как описано в тексте ниже). Точнее, прото-лекарство проверяют на соответствие либо in vitro, либо на модели животных, либо на человеке. Продукты метаболизма, побочные продукты или экстракты из тестируемой системы оценивают посредством ВЭЖХ или других аналитических методов для подтверждения того, что прото-лекарство не подвергалось метаболизму или модификации таким путем, который приводит к образованию токсина, когда применяют или вводят только прото-лекарство (т.е. в отсутствие активационного лекарственного средства).
Выбор активационного лекарственного средства: стадия способа, посредством которой одно или более химических соединений, отделенных от прото-лекарства, обладающих способностью удалять маскирующий или покрывающий фрагмент или достаточное количество «маскировки» или «покрытия», или также модифицировать химическую природу всей молекулы пролекарства с тем, чтобы в значительной степени исключить функцию маскировки или покрытия, осуществляемую маскирующим или покрывающим фрагментом, тем самым делая остаточное соединение токсичным, или с тем, чтобы способствовать высвобождению токсического фрагмента из прото-лекарства в организме онкологического больного и в окружающие злокачественные клетки области.
Выбор связей прото-лекарства: выбранный химический фрагмент или фрагменты, проявляющие способность повышать дифференциальную концентрацию прото-лекарства, выбранный химический фрагмент или фрагменты, обладающие токсическими свойствами, или выбранный химический фрагмент или фрагменты, проявляющие способность «покрывать» цитотоксичность всего химического соединения (т.е. прото-лекарства), должны быть связаны или химическими связями, или посредством комбинации химических связей и атомов между несколькими фрагментами, которые должны удерживать фрагменты вместе, давая возможность осуществлять каждому фрагменту индивидуальную функцию, ради которой каждый фрагмент был выбран. Указанные сочленения между фрагментами называют связями. В общем, способ связывания каждой пары фрагментов будет выбран с учетом практических знаний, касающихся способов образования связей, которые позволяют избежать изменений индивидуальных свойств выбранных фрагментов, например, следует признать, что покрывающий фрагмент служит в целях ингибирования активности токсического фрагмента до добавления активационного лекарственного средства. Вообще для каждого соединения, выбранного для того, чтобы стать (после соединения или связывания) фрагментом нового прото-лекарства, выявляют участки, ответственные за желаемые свойства выбранного соединения; важно, что эти участки по существу не разрушаются или не модифицируются при связывании. Модификация молекулы у некоторых доступных положений соединения позволяет проверить и установить участки, ответственные за желаемые свойства. Индивидуальные молекулы, выбранные для проявления дифференциально концентрирующих и токсических способностей прото-лекарства, затем присоединяют к соединениям в положениях, расположенных на некотором расстоянии от активных участков, ответственных за отдельную функцию, для осуществления которой выбирают фрагмент; индивидуальную молекулу, несущую покрывающий фрагмент, затем присоединяют у положения таким образом, чтобы ингибировать активность токсического фрагмента. Указанную процедуру выполняют в способе согласно изобретению и описывают в примерах, приведенных в настоящем изобретении.
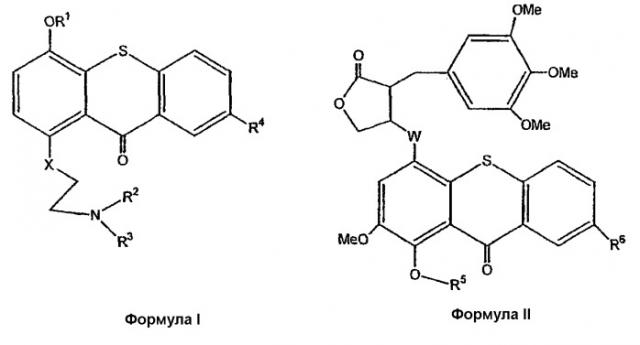
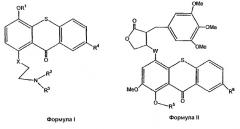
В результате способа согласно изобретению, осуществляемого для создания комбинации, получают прото-лекарства формулы I и II
где
R1 является SiZ3;
R2 означает метил, хлорэтил, гидроксиэтил или бромэтил;
R3 означает хлорэтил, гидроксиэтил или бромметил;
R4 означает Н, SO3H или таурин;
R5 является SiZ3;
R6 означает Н, SO3H или таурин;
каждый Z из Z3 независимо означает трет-бутил или метил;
Х означает углерод, кислород или азот, и
W означает углерод, кислород или азот.
В настоящем изобретении предлагается способ избирательной доставки цитотоксического соединения к опухолевой ткани путем использования прото-лекарства, имеющего фрагмент, который дифференциально концентрирует прото-лекарство, а также цитотоксический фрагмент и покрывающий фрагмент, где прото-лекарство доставляет токсический фрагмент таким образом, чтобы предотвратить значительное повреждение нормальных тканей посредством сохранения покрывающего фрагмента на прото-лекарстве до тех пор, пока прото-лекарство дифференциально не сконцентрируется в опухолевой ткани в течение периода отсрочки, и после такого периода отсрочки из прото-лекарства не образуется цитотоксическое соединение при введении активационного лекарственного средства.
Другой целью настоящего изобретения является разработка способа избирательной доставки цитотоксического соединения к опухолевой ткани путем введения прото-лекарства формулы I или II
где
R1 является SiZ3;
R2 означает метил, хлорэтил, гидроксиэтил или бромэтил;
R3 означает хлорэтил, гидроксиэтил или бромметил;
R4 означает Н, SO3H или таурин;
R5 является SiZ3;
R6 означает Н, SO3H или таурин;
каждый Z из Z3 независимо означает трет-бутил или метил;
Х означает углерод, кислород или азот, и
W означает углерод, кислород или азот,
так что прото-лекарства формул I и II доставляют токсический фрагмент таким образом, чтобы предотвратить повреждение нормальных тканей путем сохранения интактным покрывающего прото-лекарство фрагмента до тех пор, пока прото-лекарство не сконцентрируется дифференциально в опухолевой ткани в течение периода отсрочки, и после такого периода отсрочки из прото-лекарства не образуется цитотоксическое соединение при введении фтористой соли.
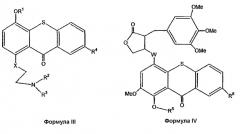
Другой целью изобретения является получение соединений формул III и IV
где
R1 является Н;
R2 означает метил, хлорэтил, гидроксиэтил или бромэтил;
R3 означает хлорэтил, гидроксиэтил или бромметил;
R4 означает Н, SO3H или таурин;
R5 является Н;
R6 означает Н, SO3H или таурин;
Х означает углерод, кислород или азот, и
W означает углерод, кислород или азот
или фармацевтически приемлемой аддитивной соли основания формул III и IV.
В данном изобретении также предложен способ оценки противоопухолевой активности соединений формул I и II с активационным соединением (или, в случае формул III и IV, без такого соединения), такой способ следует использовать в связи со способом детального моделирования комбинации и применять на стадиях способа, как описано выше, или для in vitro и in vivo оценки противоопухолевой активности любого другого химического вещества.
В настоящем изобретении также предлагается применение соединения формулы I или II с активационным соединением или, в случае соединения формул III и IV, без активационного соединения для производства лекарственного средства с целью лечения опухолей. Кроме того, в данном изобретении предлагается фармацевтический препарат для лечения опухолей, содержащий эффективное количество соединения формулы I или II вместе с фармацевтически приемлемыми наполнителями и активирующее количество фторис