Иммуногенная композиция на основе антигена chlamydia trachomatis (варианты) и ее использование
Иллюстрации
Показать всеИзобретение относится к композициям, включающим в себя антигены Chlamydia trachomatis (CT) и к их применению в вакцинах. Конкретные комбинации антигенов в составе композиций могут быть выбраны из первой группы антигенов РерА, LcrE, ArtJ, DnaK и СТ398 и второй группы антигенов РерА, LcrE, ArtJ, DnaK, CT398, OmpH-подобного антигена, L7/L12, OmcA, AtoS, CT547, Eno, HtrA и MurG. Изобретение также относится к применению комбинаций адъювантов в сочетании с антигеном или антигенами, ассоциированными с переносимым половым путем заболеванием, такими как антигены Chlamydia trachomatis. Предпочтительные комбинации адъювантов включают в себя минеральные соли, такие как соли алюминия, и олигонуклеотиды, включающие в себя CpG-мотив. Комбинации антигенов CT по изобретению являются протективными в отношении заражения хламидиями, способны индуцировать антительный ответ, по меньшей мере, в плане Th1-клеточных профилей, которые могут быстро реагировать на воздействие хламидий. 11 н. и 17 з.п. ф-лы, 10 ил., 4 табл.
Реферат
Все цитируемые здесь документы полностью включены в настоящее описание в качестве ссылки.
Перекрестная ссылка на связанные заявки, на основе которой заявляется приоритет
Данная заявка включает в себя полностью в качестве ссылки заявку на выдачу патента Великобритании № 0315020.8, поданную 26 июня 2003 г.; предварительную заявку на выдачу патента США с серийным № 60/497649, поданную 25 августа 2003 г.; заявку на выдачу патента Великобритании № 0402236.4, поданную 2 февраля 2004 г., и предварительную заявку на выдачу патента США с серийным № 60/576375, поданную 1 июня 2004 г.
Область техники, к которой относится изобретение
Данное изобретение относится к области иммунологии и вакцинологии. В частности, оно относится к антигенам, происходящим из Chlamydia trachomatis, и их применению при иммунизации.
Предпосылки изобретения
Хламидии являются облигатными внутриклеточными паразитами эукариотических клеток, которые ответственны за эндемичные переносимые половым путем инфекции и различные другие патологические синдромы. Они представляют собой исключительную филогенетическую ветвь эубактерий, не имеющую близкого отношения к любым другим известным организмам.
Исторически хламидии были классифицированы в собственный порядок (Chlamydiales), составленный из единственного семейства (Chlamydiaceae), которое, в свою очередь, содержит единственный род (Chlamydia, также обозначенный как Chlamydophila). После этого данный порядок разделили по меньшей мере на четыре семейства, включающие в себя Chlamydiaceae, Parachlamydiaceae, Waddiaceae и Simkaniaceae. В данной более современной классификации семейство Chlamydiaceae включает в себя роды Chlamydophila и Chlamydia, причем Chlamydia trachomatis является видом в роде Chlamydia. См., Bush et al., (2001) Int.J. Syst. Evol. Microbiol. 51: 203-220.
Особенной характеристикой хламидий является их уникальный жизненный цикл, в котором бактерия чередует две морфологически различные формы: внеклеточная инфекционная форма (элементарные тельца, EB) и внутриклеточная неинфекционная форма (сетчатые тельца, RB). Жизненный цикл завершается реорганизацией RB в EB, которые покидают разрушенные клетки хозяина готовыми инфицировать дальнейшие клетки.
В настоящее время известны геномные последовательности по меньшей мере пяти видов хламидий или хламидофил: C. trachomatis, C. pneumoniae, C. muridarum, C. pecorum и C. psittaci (см. Kalman et al., (1999) Nature Genetics 21: 385-389; Read et al. (2000) Nucleic Acids Res. 28:1397-1406; Shirai et al. (2000) Nucleic Acids Res 28: 2311-2314; Stephens et al. (1998) Science 282: 754-759; и публикации Международного патента WO99/27105, WO00/27994 и WO99/28475).
Человеческие сероварианты (“серовары”) C. trachomatis разделяются на два биоварианта (“биовара”). Серовары A-K вызывают эпителиальные инфекции первично в тканях глаза (A-C) или в урогенитальном тракте (D-K). Серовары L1, L2 и L3 представляют собой агенты, вызывающие инвазивный паховый лимфогрануломатоз (LGV).
Хотя хламидийная инфекция сама вызывает заболевание, полагают, что тяжесть симптомов у некоторых пациентов на самом деле является следствием аномального иммунного ответа хозяина. Неспособность удалить инфекцию приводит к персистирующей иммунной стимуляции, и вместо помощи хозяина, она приводит к хронической инфекции с тяжелыми последствиями, такими как бесплодие и слепота. См., например, Ward, (1995) Apmis. 103: 769-96. Кроме того, защита, возникающая вследствие природной хламидийной инфекции, является обычно неполной, преходящей и штаммоспецифической.
Более 4 миллионов новых случаев заражения хламидийными переносящимися половым путем инфекциями диагностируются в Соединенных Штатах каждый год, и стоимость их лечения оценивается ежегодно в 4 миллиарда долларов, причем 80% относится к инфекции и заболеванию у женщин. Хотя хламидийные инфекции можно вылечить некоторыми антибиотиками, большинство женских инфекций являются бессимтомными и противомикробная терапия может задерживаться или быть неадекватной для предотвращения долгосрочных осложнений, особенно в странах с плохими условиями гигиены. Также были сообщения о штаммах Chlamydia с множественной устойчивостью к антибиотикам (Somani, et al., 2000). Более того, сообщалось, что устойчивость к лечению антибиотиками может приводить к образованию аберрантных форм C.trachomatis, которые могут реактивироваться позже (см. Hammerschlag M. R., (2002) Semin. Pediatr. Infect. Dis. 13: 239-248).
К несчастью, основные детерминанты патогенеза хламидиоза являются сложными и до сих пор не поняты, преимущественно из-за сложности работы с данным патогенным микроорганизмом и отсутствием адекватных способов генетической манипуляции с ним. В частности, очень мало известно об антигенной композиции поверхности элементарных тел, которая представляет собой участок, существенный для взаимодействий хозяин - патогенный микроорганизм и, вероятно, несет антигены, способные вызывать протективный иммунный ответ.
Из-за серьезной природы заболевания есть потребность в создании подходящих вакцин. Они могут использоваться (a) для иммунизации против хламидийной инфекции или против индуцируемого хламидиями заболевания (профилактическая вакцинация) или (b) для эрадикации установившейся хронической хламидийной инфекции (терапевтическая вакцинации). Будучи внутриклеточным паразитом, эта бактерия, однако, в общем, может избегать опосредованных антителом иммунных реакций.
Описаны различные антигенные белки C. trachomatis, и клеточная поверхность, в частности, была мишенью подробного исследования. См., например, Moulder (1991) Microbiol Rev 55(1): 143-190. Они включают в себя, например, Pgp3, MOMP, Hsp60 (GroEL) и Hsp70 (Dna-K-подобный). Ссылки, описывающие Pgp3, включают в себя Comanducci et al. (1994) Infect Immun 62 (12): 5491-5497 и публикации патентов EP 0499681 и WO95/28487). Ссылки, описывающие MOMP, включают в себя Murdin et al. (1993) Infect Immun 61: 4406-4414. Ссылки, описывающие Hsp60 (GroEL), включают в себя Cerrone et al. (1991) Infect Immun 59(1): 79-90). Ссылки, описывающие Hsp70 (DnaK-подобный), включают в себя Raulston et al. (1993) J. Biol. Chem. 268: 23139-23147. Однако не все из них подтвердились как эффективные вакцины и были идентифицированы дальнейшие кандидаты. См. WO03/049762.
Вакцины против патогенных микроорганизмов, таких как вирус гепатита B, дифтерия и столбняк, обычно содержат единственный белковый антиген (например, поверхностный HBV-антиген или столбнячный анатоксин). В отличие от них клеточные вакцины против коклюша обычно содержат по меньшей мере три белка B. pertussis, а вакцина против пневмококка Prevnar™ содержит семь отдельных конъюгированных сахаридных антигенов. Другие вакцины, например клеточные вакцины от коклюша, вакцины против кори, инактивированная вакцина против полиомиелита (IPV) и вакцины против менингококка OMV, представляют собой по своей истинной природе очень сложные смеси большого количества антигенов. Поэтому то, может ли защита быть вызвана единичным антигеном, маленьким количеством определенных антигенов или комплексной смесью неопределенных антигенов, зависит от данного патогенного организма.
Целью изобретения является предоставление дальнейших и улучшенных композиций для предоставления иммунитета против хламидийного заболевания и/или инфекции. Композиции основаны на комбинации двух или большего количества (например, трех или большего количества) антигенов C. trachomatis. Кроме того, композиции также могут основываться на применении антигенов C. trachomatis с комбинацией адъювантов, составленной так, чтобы они вызывали усиленный иммунный ответ. Предпочтительно комбинация адъювантов включает в себя соль алюминия и олигонуклеотид, включающий в себя CpG-мотив.
Сущность изобретения
Среди ~900 белков, ранее описанных для генома C. trachomatis (см., например, Stephens et al. (1998) Science 282: 754-759), авторы изобретения обнаружили группу из пяти антигенов Chlamydia trachomatis, которые особенно подходят для целей иммунизации, в частности, при использовании в комбинации. Поэтому изобретение относится к композиции, включающей в себя комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация состоит из двух, трех, четырех или всех пяти антигенов Chlamydia trachomatis первой группы антигенов, причем указанная первая группа антигенов состоит из: (1) PepA (CT045); (2) LcrE (CT089); (3) ArtJ (CT381); (4) DnaK (CT396); и (5) CT398. Данные антигены обозначаются здесь как “первая группа антигенов”. Предпочтительно данная комбинация включает в себя LcrE (CT089).
Изобретение также относится к несколько большей группе из 13 антигенов Chlamydia trachomatis, которые особенно подходят для целей иммунизации, в частности при использовании в комбинации. (Данная вторая группа антигенов включает в себя пять антигенов Chlamydia trachomatis первой группы антигенов.) Данные 13 антигенов Chlamydia trachomatis образуют вторую группу антигенов: (1) PepA (CT045); (2) LcrE (CT089); (3) ArtJ (CT381); (4) DnaK (CT396); (5) CT398; (6) OmpEI-подобный (CT242); (7) L7/L12 (CT316); (8) OmcA (CT444); (9) AtoS (CT467); (10) CT547; (11) Eno (CT587); (12) HtrA (CT823) и (13) MurG (CT761). Данные антигены обозначаются здесь как “вторая группа антигенов”. Предпочтительно комбинация включает в себя один или несколько из LcrE(CT089) и OmpH-подобный белок (CT242).
Поэтому изобретение относится к композиции, содержащей комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати или тринадцати антигенов Chlamydia trachomatis из второй группы антигенов. Предпочтительно комбинация выбрана из группы, состоящей из двух, трех, четырех или пяти антигенов Chlamydia trachomatis из второй группы антигенов. Еще более предпочтительно комбинация состоит из пяти антигенов Chlamydia trachomatis из второй группы антигенов.
Композиции согласно изобретению могут включать в себя один или несколько иммунорегуляторных средств. Такие иммунорегуляторные средства включают в себя адъюванты. Предпочтительно адъюванты выбирают из группы, состоящей из TH1-адъюванта и TH2-адъюванта. Еще более предпочтительно адъюванты выбирают из группы, состоящей из солей алюминия и олигонуклеотидов, включающих в себя CpG-мотив. Поэтому изобретение относится к композиции, состоящей из антигена Chlamydia trachomatis или антигена, ассоциированного с переносимым половым путем заболеванием олигонуклеотида, содержащего CpG-мотив, и минеральной соли, такой как соль алюминия.
Краткое описание чертежей
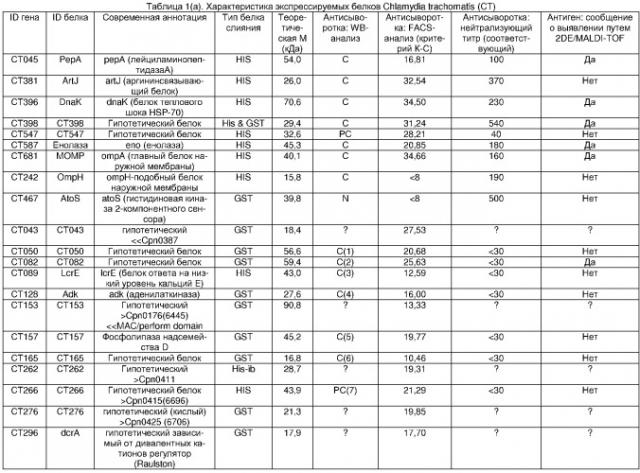
На фигуре 1 показан вестерн-блот-анализ общих белковых экстрактов из EB C. trachomatis, проведенный с использованием мышиных иммунных сывороток против рекомбинантных антигенов. Показаны только FACS-позитивные, не нейтрализующие сыворотки. Для идентификации антигена, пожалуйста, см. таблицу 1(a). Идентификационные номера панели соответствуют номерам, находящимся в колонке анализа WB в таблице 1(a). На каждой панели полоса справа показывает результаты, полученные с антигенспецифичной иммунной сывороткой (I), и полоса слева показывает результаты, полученные с соответствующей преиммунной сывороткой (P).
На фигуре 2 проиллюстрованы титры сывороток, дающих 50%-ную нейтрализацию инфективности для 9 описанных в тексте рекомбинантных антигенов C. trachomatis (PepA, ArtJ, DnaK, CT398, CT547, енолаза, MOMP, OmpH-подобный и AtoS). Каждый титр оценивали в 3 отдельных экспериментах (показаны значения стандартной ошибки среднего).
Фигура 3 включает в себя FACS-анализ связывания антител с цельными ЕВ C. trachomatis. Серые гистограммы (события импульсов в каналах флуоресценции) представляют собой выходные данные FACS для EB, окрашенных фоновыми контрольными антителами. Белые гистограммы представляют собой выходные данные FACS для EB, окрашенных антигенспецифичными антителами. Положительный контроль представлен мышиной гипериммунной сывороткой против цельных ЕВ C.trachomatis, с соответствующей преиммунной сывороткой мыши в качестве контроля фона; отрицательные контроли получали путем окрашивания EB мышиной гипериммунной сывороткой против HIS или против GST с соответствующей преиммунной сывороткой в качестве фонового контроля. Для каждой сыворотки фоновый контроль был представлен мышиной гипериммунной сывороткой против GST или против HIS в зависимости от белка слияния, применяемого для иммунизации. Данные вестерн-блоттинга, полученные с общим белком EB, окрашенным той же антисывороткой, что использовали для анализа FACS, также показаны в каждой панели.
На фигуре 4 показан ускоренный клиренс Chlamydia trachomatis (CT) через 21 сутки после стимуляции мышей, вакцинированных смесью CT242 (OmpH-подобного) и CT316 (L7/L12) в комбинации с CFA, по сравнению с мышами, вакцинированными только CFA.
На фигуре 5 показан ускоренный клиренс Chlamydia trachomatis (CT) через 21 сутки после стимуляции мышей, вакцинированных смесью CT467 (AtoS) и CT444(OmcA) в комбинации с CFA, по сравнению с клиренсом СТ мышей, вакцинированными только CFA.
На фигуре 6 показан ускоренный клиренс Chlamydia trachomatis (CT) через 21 сутки после стимуляции мышей, вакцинированных смесью CT812 (PmpD) and CT082 (гипотетический) в комбинации с CFA, по сравнению с клиренсом СТ мышей, вакцинированными только CFA.
На фигурах 7(a) и 7(b) показан статистически значимый клиренс Chlamydia trachomatis через 14 суток после стимуляции мышей, вакцинированных смесью CT242 и CT316 в комбинации с CFA, по сравнению с клиренсом СТ мышей, вакцинированными только CFA.
На фигуре 7(c) показан титр нейтрализации мышей, вакцинированных смесью CT242 и CT316 в комбинации с CFA.
На фигурах 8(а) и 8(b) показан ускоренный клиренс Chlamydia trachomatis через 14 суток после стимуляции мышей, вакцинированных смесью пяти антигенов СТ, которые представляют собой CT045, CT089, CT396, CT398 и CT381, в комбинации с AlOH и CpG, по сравнению с клиренсом СТ мышей, вакцинированными только AlOH и CpG.
На фигуре 8(c) показаны изотипы специфичных в отношении Chlamydia антител IgG (IgG1 и IgG2a) для сывороток перед повторной иммунизацией из (i) мышей, вакцинированных смесью пяти антигенов CT, которые представляют собой CT045, CT089, CT396, CT398 и CT381, в сочетании с AlOH и CpG, и (ii) мышей, вакцинированных смесью пяти антигенов CT, которые представляют собой CT045, CT089, CT396, CT398 и CT381, в комбинации с CFA.
На фигурах 9(a) и 9(b) показан клиренс Chlamydia trachomatis через 7, 14 и 21 сутки после стимуляции мышей, вакцинированных смесью пяти антигенов СТ, которые представляют собой CT045, CT089, CT396, CT398 and CT381, в комбинации с AlOH и CpG, по сравнению с клиренсом СТ мышей, вакцинированными только AlOH и CpG.
На фигуре 9(c) показан титр нейтрализации и изотипы специфичных в отношении Chlamydia антител IgG (IgG1 и IgG2) для сывороток перед повторной иммунизацией из мышей, вакцинированных смесью пяти антигенов СТ, которые представляют собой CT045, CT089, CT396, CT398 и CT381, в комбинации с AlOH и CpG.
На фигурах 10(a) и (b) показан титр нейтрализации для мышей, вакцинированных смесью из пяти антигенов CT, которые представляют собой CT045, CT089, CT396, CT398 и CT381, в комбинации с AlOH и CpG, по сравнению с титром нейтрализации, полученным на мышах, вакцинированных только AlOH и CpG.
Подробное описание изобретения
Как описано выше, изобретение относится к композициям, включающим в себя комбинацию антигенов Chlamydia trachomatis, где комбинации могут быть выбраны из групп антигенов, которые, как выявлено настоящими заявителями, особенно подходят для целей иммунизации, в частности при использовании в комбинации. В одном из вариантов осуществления изобретение относится к композиции, содержащей комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация состоит из двух, трех, четырех или всех пяти антигенов Chlamydia trachomatis из первой группы антигенов, причем указанная первая группа антигенов состоит из: (1) PepA (CT045); (2) LcrE (CT089); (3) ArtJ (CT381); (4) DnaK (CT396); и (5) CT398. Данные антигены обозначены здесь как “первая группа антигенов”.
Предпочтительно композиция согласно изобретению содержит комбинацию антигенов Chlamydia trachomatis, причем данная комбинация выбрана из группы, состоящей из: (1) PepA & LcrE; (2) PepA & ArtJ; (3) PepA & DnaK; (4) PepA & CT398; (5) LcrE & ArtJ; (6) LcrE & DnaK; (7) LcrE &CT398; (8) ArtJ & DnaK; (9) ArtJ & CT398; (10) DnaK & CT398; (11) PepA, LcrE & ArtJ; (12) PepA, LcrE & DnaK; (13) PepA, LcrE & CT398; (14) PepA, ArtJ & DnaK; (15) PepA, ArtJ and CT398; (16) PepA, DnaK & CT398; (17) LcrE, ArtJ & DnaK; (18) LcrE, ArtJ & CT398; (19) LcrE, DnaK & CT398; (20) ArtJ, DnaK & CT398; (21) PepA, LcrE, ArtJ & DnaK; (22) PepA, LcrE, DnaK & CT398; (23) PepA, ArtJ, DnaK & CT398; (24) PepA, LcrE, ArtJ & CT398; (25) LcrE, ArtJ, DnaK & CT398; и (26) PepA, LcrE, ArtJ, DnaK & CT398. Предпочтительно композиция антигенов Chlamydia trachomatis состоит из PepA, LcrE, ArtJ, DnaK & CT398. Предпочтительно комбинация включает в себя LcrE (CT089).
Изобретение также относится к несколько большей группе из 13 антигенов Chlamydia trachomatis, которые особенно подходят для целей иммунизации, в частности, при использовании в комбинации. (Данная вторая группа антигенов включает в себя пять антигенов Chlamydia trachomatis первой группы антигенов.) Данные 13 антигенов Chlamydia trachomatis образуют вторую группу антигенов: (1) PepA (CT045); (2) LcrE (CT089); (3) ArtJ (CT381); (4) DnaK (CT396); (5) CT398; (6) OmpH-подобный (CT242); (7) L7/L12 (CT316); (8) OmcA (CT444); (9) AtoS (CT467); (10) CT547; (11) Eno (CT587); (12) HtrA (CT823) и (13) MurG (CT761). Данные антигены обозначаются здесь как “вторая группа антигенов”.
Поэтому изобретение относится к композиции, содержащей комбинацию антигенов Chlamydia trachomatis, причем указанная комбинация выбрана из группы, состоящей из двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати или тринадцати антигенов Chlamydia trachomatis из второй группы антигенов. Предпочтительно комбинация выбрана из группы, состоящей из двух, трех, четырех или пяти антигенов Chlamydia trachomatis из второй группы антигенов. Еще более предпочтительно комбинация состоит из пяти антигенов Chlamydia trachomatis из второй группы антигенов. Предпочтительно комбинация включает в себя один из LcrE(CT089) и OmpH-подобного белка (CT242) или оба данных белка.
Каждый из антигенов Chlamydia trachomatis из первой и второй группы более подробно описан ниже.
(1) Белок лейциламинопептидаза А PepA (CT045). Один из примеров белка “PepA” описан как SEQ ID NO: 71 & 72 в WO 03/049762 (инвентарный номер GenBank: AAC67636, GI:3328437; “CT045”; SEQ ID NO:1 в прилагаемом списке последовательностей). Полагают, что он катализирует удаление незамещенной N-концевой аминокислоты из различных полипептидов. Предпочтительные белки PepA для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 1; и/или (b), которая представляет собой фрагмент по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 1, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки PepA включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 1. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 1. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 1. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Белок PepA может содержать ионы марганца.
(2) Белок ответа на низкий уровень кальция Е LcrE (CT089). Один из примеров белка “LcrE” описан как SEQ ID NO: 61 & 62 в WO 03/049762 (инвентарный номер GenBank: AAC67680, GI:3328485; “CT089”; SEQ ID NO: 2 в прилагаемом списке последовательностей). Предпочтительные белки LcrE для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 2; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 2, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки LcrE включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 2. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 2. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 2. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
(3) Аргининсвязывающий белок ArtJ (CT381). Один из примеров белка “ArtJ” описан как SEQ ID NO: 105 & 106 в WO 03/049762 (инвентарный номер GenBank: AAC67977, GI:3328806; “CT381”; SEQ ID NO:3 в прилагаемом списке последовательностей). Предпочтительные белки ArtJ для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 3; и/или (b), которая представляет собой фрагмент по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 3, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки ArtJ включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 3. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 3. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 3. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Белок ArtJ может связываться с малой молекулой, такой как аргинин или другая аминокислота.
(4) Белок теплового шока 70 (шаперон) DnaK (CT396). Один из примеров белка “DnaK” описан как SEQ ID NO: 107 & 108 в WO 03/049762 (инвентарный номер GenBank: AAC67993, GI:3328822; “CT396”; SEQ ID NO: 4 в прилагаемом списке последовательностей). Другие последовательности описаны в Birkelund et al. (1990) Infect Immun 58: 2098-2104; Danilition et al. (1990) Infect Immun 58: 189-196; and Raulston et al. (1993) J Biol Chem 268: 23139-23147. Предпочтительные белки DnaK для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 4; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 4, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки DnaK включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 4. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 4. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 4. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Белок DnaK может быть фосфорилирован, например, по треонину или тирозину.
(5) белок CT398 (гипотетический белок). Один из примеров белка “CT398” описан как SEQ ID NO: 111 & 112 в WO 03/049762 (инвентарный номер GenBank: AAC67995, GI:3328825; SEQ ID NO: 5 в прилагаемом списке последовательностей). Предпочтительные белки CT398 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 5; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 5, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки CT398 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 5. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 5. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 5. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
(6) OmpH-подобный белок наружной мембраны (CT242). Один из примеров “OmpH-подобного” белка описан как SEQ ID NO: 57 & 58 в WO 03/049762 (инвентарный номер GenBank: AAC67835, GI:3328652; “CT242”; SEQ ID NO: 6 в прилагаемом списке последовательностей). Последовательность варианта описана в Bannantine & Rockey (1999) Microbiology 145: 2077-2085. Предпочтительные OmpH-подобные белки для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 6; и/или (b), которая представляет собой фрагмент по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 6, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные OmpH-подобные белки включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 6. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 6. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более; предпочтительно 19 или более, для удаления сигнального пептида) с N-конца SEQ ID NO: 6. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, как описано выше, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
(7) Рибосомальный белок L7/L12 (CT316). Один из примеров белка “L7/L12” находится в GenBank под инвентарным номером AAC67909 (GI: 3328733; “CT316”; SEQ ID NO: 7 в прилагаемом списке последовательностей). Предпочтительные белки L7/L12 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 7; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 7, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки L7/L12 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 7. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 7. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 7. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Белок L7/L12 может модифицироваться с N-конца.
(8) Богатый цистеином липопротеин OmcA (CT444). Один из примеров белка “OmcA” описан как SEQ ID NO: 127 & 128 в WO 03/049762 (инвентарный номер GenBank: AAC68043, GI: 3328876; “CT444”, “Omp2A”, “Omp3”; SEQ ID NO: 8 в прилагаемом списке последовательностей). Вариант последовательности описан в Allen et al. (1990) Mol. Microbiol. 4: 1543-1550. Предпочтительные белки OmcA для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 8; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 8, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки OmcA включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 8. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 8. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более; предпочтительно 18 или более, для удаления сигнального пептида) с N-конца SEQ ID NO: 8. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, как описано выше, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Данный белок может липоилироваться (например, N-ацилдиглицеридом) и может, таким образом, иметь N-концевой цистеин.
(9) Белок гистидинкиназа, сенсор двухкомпонентной регуляторной системы, AtoS (CT467). Один из примеров белка “AtoS” описан как SEQ ID NO: 129 & 130 в WO 03/049762 (инвентарный номер GenBank: AAC68067, GI:3328901; “CT467”; SEQ ID NO: 9 в прилагаемом списке последовательностей). Предпочтительные белки AtoS для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 9; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 9, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки AtoS включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 9. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 9. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 9. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
(10) Белок CT547 (Гипотетический белок). Один из примеров белка “CT547” описан как SEQ ID NO: 151 & 152 в WO 03/049762 (инвентарный номер GenBank: AAC67995, GI: 3328825; SEQ ID NO: 10 в прилагаемом списке последовательностей). Предпочтительные белки CT547 для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 10; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 10, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки CT547 включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 10. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 10. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 10. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена).
(11) Белок енолаза (2-фосфоглицератдегидратаза) (CT587). Один из примеров белка “Eno” описан как SEQ ID NO: 189 & 190 в WO 03/049762 (инвентарный номер GenBank: AAC68189, GI:3329030; “CT587”; SEQ ID NO: 11 в прилагаемом списке последовательностей). Предпочтительные белки Eno для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 11; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 11, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки Eno включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 11. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 11. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 11. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Белок Eno может содержать ионы марганца и может находиться в виде гомодимера.
(12) Белок DO-протеаза HrtA (CT823). Один из примеров белка “HrtA” описан как SEQ ID NO: 229 & 230 в WO 03/049762 (инвентарный номер GenBank: AAC68420, GI:3329293; “CT823”; SEQ ID NO: 12 в прилагаемом списке последовательностей). Предпочтительные белки HrtA для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 12; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 12, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки HrtA включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 12. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 12. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более; предпочтительно, по меньшей мере 16, для удаления сигнального пептида) с N-конца SEQ ID NO: 12. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, как описано выше, цитоплазматического домена, трансмембранного домена или внеклеточного домена). В отношении SEQ ID NO: 12 отдельные домены представляют собой остатки: 1-16; 17-497; 128-289; 290-381; 394-485; и 394-497.
(13) Белок пептидогликантрансфераза MurG (CT761). Один из примеров белка “MurG” описан как SEQ ID NO: 217 & 218 в WO 03/049762 (инвентарный номер GenBank: AAC68356, GI: 3329223; “CT761”; SEQ ID NO: 13 в прилагаемом списке последовательностей). Он представляет собой UDP-N-ацетилглюкозамин-N-ацетилмурамил(пентапептид)-пирофосфорилундекапренол-N-ацетилглюкозаминтрансферазу. Предпочтительные белки MurG для применения согласно изобретению включают в себя аминокислотную последовательность: (a), которая характеризуется идентичностью 50% или более (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) в отношении SEQ ID NO: 13; и/или (b), которая представляет собой фрагмент, по меньшей мере из n следующих друг за другом аминокислот SEQ ID NO: 13, где n представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Данные белки MurG включают в себя варианты (например, аллельные варианты, гомологи, ортологи, паралоги, мутанты, и т.д.) SEQ ID NO: 13. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 13. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 13. Другие фрагменты лишены одного или нескольких доменов белка (например, пропуск сигнального пептида, описано выше, цитоплазматического домена, трансмембранного домена или внеклеточного домена). Белок MurG может липоилироваться, например, ундекапренилом.
Иммуногенность других известных антигенов Chlamydia trachomatis может быть улучшена путем комбинации с двумя или большим количеством антигенов Chlamydia trachomatis из первой группы антигенов или из второй группы антигенов. Такие другие известные антигены Chlamydia trachomatis включены в третью группу антигенов, состоящую из (1) PGP3, (2) одного или нескольких PMP, (3) MOMP (CT681), (4) Cap1 (CT529); (5) GroEL-подобный белок hsp60 (Omp2); и (6) богатый цистеином белок массой 60 кДа (omcB). Данные антигены обозначаются здесь как “третья группа антигенов”.
Таким образом, изобретение относится к композиции, содержащей комбинацию антигенов Chlamydia trachomatis, причем данная комбинация выбрана из группы, состоящей из двух, трех, четырех или пяти антигенов Chlamydia trachomatis из первой группы антигенов, и одного, двух, трех, четырех, пяти или шести антигенов Chlamydia trachomatis из третьей группы антигенов. Предпочтительно комбинация выбрана из группы, состоящей из трех, четырех или пяти антигенов Chlamydia trachomatis из первой группы антигенов и трех, четырех или пяти антигенов Chlamydia trachomatis из третьей группы а