Способ модуляции пролиферации клеток медуллярной карциномы щитовидной железы
Иллюстрации
Показать всеНастоящее изобретение относится к способу уменьшения скорости пролиферации клеток медуллярной карциномы щитовидной железы, который предусматривает взаимодействие клеток медуллярной карциномы щитовидной железы с агонистом SSTR2, представляющим собой соединение формулы цикло[Tic-Tyr-D-Trp-Lys-Abu-Phe]. 3 н.п. ф-лы, 8 ил., 2 табл.
Реферат
Предпосылки изобретения
Было показано, что соматостатин (SS), тетрадекапептид, обнаруженный Brazeau et al., оказывает сильное ингибирующее действие на разные секреторные процессы в тканях таких органов, как гипофиз, поджелудочная железа и желудочно-кишечный тракт. Соматостатин является также нейромодулятором в центральной нервной системе. Указанные биологические действия соматостатина ингибирующей природы опосредованы рядом сопряженных с G-белком рецепторов, из которых охарактеризованы пять разных подтипов (SSTR1-SSTR5) (Reubi JC, et al., Cancer Res 47: 551-558, Reisine T, et al., Endocrine Review 16: 427-442, Lamberts SW, et al., Endocr Rev 12: 450-482, 4 Patel YC, 1999 Front Neuroendocrinology 20: 157-198). Пять указанных подтипов обладают одинаковым сродством к эндогенным соматостатиновым лигандам, но по-разному распределены в разных тканях. Соматостатин связывается с рецепторами (SSTR) пяти разных подтипов с относительно высоким и одинаковым сродством к каждому подтипу.
Имеются свидетельства, что соматостатин регулирует пролиферацию клеток, останавливая рост клеток посредством рецепторов SSTR подтипов 1, 2, 4 и 5 (Buscail L, et al., 1995 Proc Natl Acad Sci USA 92: 1580-1584; Buscail L, et al., 1994, Proc Natl Acad Sci USA 91: 2315-2319; Florio T, et al., 1999 Mol Endocrinol 13: 24-37; Sharma K, et al., 1999 Mol Endocrinol 13: 82-90) или вызывая апоптоз посредством рецептора SSTR подтипа 3 (Sharma K, et al., 1996, Mol. Endocrinol 10: 1688-1696). Было показано, что соматостатин и различные аналоги ингибируют пролиферацию нормальных и опухолевых клеток in vitro и in vivo (Lamberts SW, et al., Endocr Rev 12: 450-482) посредством специфичных рецепторов SS (SSTR) (Patel YC, 1999 Front Neuroendocrinology 20: 157-198) и, возможно, в результате разных пострецепторных действий (Weckbecker G, et al., Pharmacol Ther 60: 245-264; Bell GI, Reisine T, 1993 Trends Neurosci 16: 34-38; Patel YC, et al., Biochem Biophys Res Commun 198: 605-612; Law SF, et al., Cell Signal 7: 1-8). Кроме того, существуют данные, свидетельствующие об экспрессии рецепторов SSTR разных подтипов в нормальных и опухолевых тканях человека (Virgolini I, et al., Eur J Clin Invest 27: 645-647), что обеспечивает разное сродство тканей к разным аналогам соматостатина и разную клиническую реакцию на их терапевтическое воздействие.
Связывание с рецепторами соматостатина разных подтипов ассоциируется с лечением разных состояний и/или заболеваний. Например, ингибирование гормона роста приписывается рецептору соматостатина типа 2 ("SSTR2") (Raynor, et al., Molecular Pharmacol. 43:838 (1993); Lloyd, et al., Am. J. Physiol. 268:G102 (1995)), в то время как ингибирование инсулина приписывается рецептору соматостатина типа 5 ("SSTR5") (Coy, et al., 197: 366-371 (1993)). Активация рецепторов типов 2 и 5 подавляет гормон роста, в частности, аденомы, секретирующие гормон роста (акромегалия), и аденомы, секретирующие тиреостимулирующий гормон. Активация рецептора типа 2, но не типа 5 позволяет лечить пролактинсекретирующие аденомы. Другие показания, связанные с активацией рецепторов соматостатина разных подтипов, включают ингибирование инсулина и/или глюкагона при лечении сахарного диабета, ангиопатии, пролиферативной ретинопатии, феномена пробуждения и нефропатии; ингибирование секреции желудочного сока, в частности, при лечении пептической язвы, тонкокишечных и панкреатических свищей, синдрома раздраженной толстой кишки, демпинг-синдрома, водянистого стула, СПИД-ассоциированной диареи, диареи, вызванной химиотерапией, острого или хронического панкреатита и опухолей, секретирующих желудочно-кишечный гормон; лечение злокачественной опухоли, такой как гепатома; ингибирование ангиогенеза; лечение воспалительных заболеваний, таких как артрит; ретинопатию; хроническое отторжение аллотрансплантата; пластику сосудов; предотвращение кровотечения из сосудистого трансплантата и желудочно-кишечное кровотечение. Предпочтительно располагать аналогом, который избирательно воздействовал бы на рецепторы соматостатина определенного подтипа или подтипов, ответственные за желаемую биологическую реакцию, таким образом, сокращая взаимодействия с рецепторами других подтипов, которые могут вызывать нежелательные побочные эффекты.
Соматостатин (SS) и его рецепторы (SSTR1-SSTR5) экспрессируются в нормальных парафолликулярных С-клетках и клетках медуллярной карциномы щитовидной железы (МТС) человека. МТС представляет собой опухоль, образующуюся из парафолликулярных С-клеток щитовидной железы и продуцирующую кальцитонин (СТ), соматостатин и несколько других пептидов (Moreau JP, et al., Metabolism 45 (8 Suppl 1): 24-26). Mato et al. недавно обнаружили, что SS и SSTR экспрессируются в МТС человека (Mato E, et al., J. Clin Endocrinol Metab 83: 2417-2420). В научной литературе описано, что SS и его аналоги снижают содержание кальцитонина в плазме и улучшают состояние субъектов, страдающих МТС. Однако до настоящего времени не было достаточно четко продемонстрировано антипролиферативное воздействие аналогов SS на опухолевые клетки (Mahler C, et al., Clin Endocrinol 33: 261-9; Lupoli G, et al., Cancer 78: 1114-8; Smid WM, et al., Neth J Med 40: 240-243). Таким образом, создание аналогов SSTR разных подтипов, избирательно воздействующих на рост клеток МТС, позволяет получить полезное средство для применения в клинических условиях. До настоящего времени в научной литературе не были представлены данные, свидетельствующие об участии рецепторов SSTR определенных подтипов в регуляции роста клеток МТС.
Настоящее изобретение относится к открытию того, что линия ТТ-клеток МТС человека, обладающая характеристиками клеток МТС (Zabel M, et al., 1992 Histochemistry 102: 323-327, 2 Gagel RF, et al., 1986 Endocrinology 118: 1643-1651, Liu JL, et al., 1995 Endocrinology 136: 2389-2396) и стабильно экспрессирующая рецепторы SSTR всех подтипов, реагирует на активацию SSTR2 и SSTR5 избирательными по подтипу агонистами двумя различными профилями включения [3H]thy и количества клеток. Предпочтительные агонисты SSTR2 значительно подавляют включение [3H]thy, то есть ингибируют синтез ДНК и уменьшают пролиферацию клеток. Селективные агонисты SSTR5 значительно увеличивают включение [3H]thy в ТТ-клетки, то есть увеличивают синтез ДНК, но при этом не влияют на пролиферацию клеток. Кроме того, антагонисты SSTR2 препятствуют воздействию предпочтительных агонистов SSTR2 на ТТ-клетки. Увеличение концентрации селективного агониста SSTR5 в зависимости от дозы предотвращает подавление включения [3H]thy и пролиферации ТТ-клеток, вызываемое предпочтительным агонистом SSTR2, и наоборот, что свидетельствует об антагонизме между указанными агонистами.
Недавно было продемонстрировано наличие гетеро- и гомодимерного взаимодействий между подтипами семейств опиатных (Jordan BA, et al., 1999 Nature 399: 697-700) и SS рецепторов (Rocheville M, et al., 2000 J. Biol. Chem. 275: 7862-7869). Исследования культивируемых клеток аденомы гипофиза показывают, что рецепторы SSTR подтипов 2 и 5 оказывают синергическое действие при подавлении секреции гормона роста и пролактина (Shimon I, et al., 1997 J. Clinical Invest. 100: 2386-2392, Jaquet P, et al., 2000 J. Clin Endocrinol Metab. 85: 781-792). Открытие того, что активация SSTR5 уменьшает антипролиферативную активность, опосредуемую SSTR2, отличается от результатов, полученных при исследовании других тканей (Patel YC, 1999 Front Neuroendocrinology 20: 157-198, Buscail L, et al., 1995 Proc Natl Acad Sci USA 92: 1580-1584. Buscail L, et al., 1994 Proc Natl Acad Sci USA 91: 2315-2319, Sharma K, et al., 1996 Mol Endocrinol 10: 1688-1696). Это является первым свидетельством того, что рецепторы SSTR подтипов 2 и 5 могут действовать как антагонисты при регулировании роста клеток.
Таким образом, предпочтительные агонисты SSTR2 и SSTR5 оказывает разное действие на пролиферацию линии медуллярных ТТ-клеток щитовидной железы человека в зависимости от их специфической избирательности в отношении SSTR. Пролиферацию линии ТТ-клеток можно уменьшить при помощи селективных агонистов SSTR2, чего нельзя добиться при помощи агонистов SSTR5, и при этом агонист SSTR5 может предотвращать антипролиферативное действие, опосредуемое SSTR2. Основное ингибирующее действие SSTR2 на пролиферацию клеток МТС свидетельствует о том, что аналоги с повышенным сродством и избирательностью относительно SSTR2 в отличие от SSTR5 должны быть полезными в качестве антипролиферативных средств при лечении МТС.
Сущность изобретения
В основе настоящего изобретения лежит открытие того, что агонисты соматостатина, избирательно воздействующие на SSTR2, эффективны в уменьшении скорости пролиферации клеток медуллярной карциномы щитовидной железы, а агонисты соматостатина, избирательно воздействующие на SSTR5, эффективно ослабляют вызываемое агонистом SSTR2 уменьшение скорости пролиферации.
Одним объектом настоящего изобретения является способ модуляции скорости пролиферации клеток МТС, который предусматривает взаимодействие клеток МТС с одним или несколькими агонистами SSTR2 и одним или несколькими агонистами SSTR5, в результате чего указанный агонист SSTR2 уменьшает скорость пролиферации клеток МТС, а указанный агонист SSTR5 ослабляет вызываемое агонистом SSTR2 уменьшение скорости пролиферации.
В соответствии с одним вариантом осуществления данное изобретение относится к описанному выше способу, в котором указанный агонист SSTR5 представляет собой D-Phe-Phe-Trp-D-Trp-Lys-Thr-Phe-Thr-NH2 (SEQ ID No.1) или его фармацевтически приемлемую соль.
В соответствии с другим вариантом осуществления данное изобретение относится к способу уменьшения скорости пролиферации клеток медуллярной карциномы щитовидной железы, который предусматривает взаимодействие клеток медуллярной карциномы щитовидной железы с одним или несколькими агонистами SSTR2 или их фармацевтически приемлемой солью.
В предпочтительном примере указанного выше варианта осуществления изобретения агонист SSTR2 является избирательным агонистом SSTR2. В более предпочтительном примере агонист SSTR2 или его фармацевтически приемлемая соль имеет значение Ki для SSTR5, которое по крайней мере в 2 раза больше подобного значения для SSTR2, более предпочтительно указанное значение по крайней мере в 5 раз больше подобного значения для SSTR2, еще предпочтительнее указанное значение по крайней мере в 10 раз больше подобного значения для SSTR2.
В другом предпочтительном примере указанного выше варианта осуществления изобретения агонист SSTR2 или его фармацевтически приемлемая соль имеет значение Ki менее 5 нМ, более предпочтительно менее 1 нМ.
В еще одном предпочтительном примере указанного выше варианта осуществления изобретения избирательный агонист SSTR2 является соединением, выбираемым из группы, включающей
D-Nal-цикло[Cys-Tyr-D-Trp-Lys-Val-Cys]-Thr-NH2 (SEQ ID No.2),
цикло[Tic-Tyr-D-Trp-Lys-Abu-Phe] (SEQ ID No.3),
4-(2-гидрокси-этил)-1-пиперазинилацетил-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Abu-Cys)-Thr-NH2 (SEQ ID No.4),
4-(2-гидроксиэтил)-1-пиперазин-2-этансульфонил-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Abu-Cys)-Thr-NH2 (SEQ ID No.5)
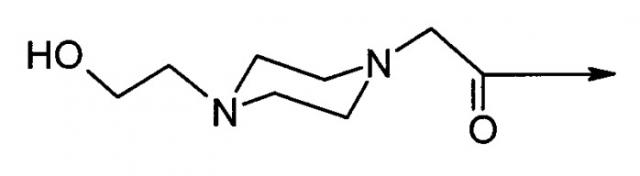
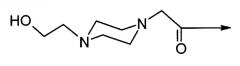
или их фармацевтически приемлемые соли, где "4-(2-гидроксиэтил)-1-пиперазинилацетил" имеет структуру:
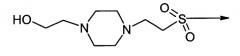
и "4-(2-гидроксиэтил)-1-пиперазин-2-этансульфонил" имеет структуру:
В соответствии с третьим вариантом осуществления данное изобретение относится к способу лечения медуллярной карциномы щитовидной железы, который предусматривает введение нуждающемуся в этом пациенту эффективного количества агониста SSTR2.
В предпочтительном примере третьего варианта осуществления изобретения агонист SSTR2 является избирательным агонистом SSTR2. В более предпочтительном примере агонист SSTR2 или его фармацевтически приемлемая соль имеет значение Ki для SSTR5, которое по крайней мере в 2 раза больше подобного значения для SSTR2, более предпочтительно указанное значение по крайней мере в 5 раз больше подобного значения для SSTR2, еще предпочтительнее указанное значение по крайней мере в 10 раз больше подобного значения для SSTR2.
В другом предпочтительном примере третьего варианта осуществления изобретения агонист SSTR2 или его фармацевтически приемлемая соль имеет значение Ki менее 5 нМ, более предпочтительно менее 1 нМ.
В еще одном предпочтительном примере третьего варианта осуществления изобретения избирательный агонист SSTR2 является соединением, выбираемым из группы, включающей
D-Nal-цикло[Cys-Tyr-D-Trp-Lys-Val-Cys]-Thr-NH2 (SEQ ID No.2),
цикло[Tic-Tyr-D-Trp-Lys-Abu-Phe] (SEQ ID No.3),
4-(2-гидроксиэтил)-1-пиперазинилацетил-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Abu-Cys)-Thr-NH2 (SEQ ID No.4),
4-(2-гидроксиэтил)-1-пиперазин-2-этансульфонил-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Abu-Cys)-Thr-NH2 (SEQ ID No.5)
или их фармацевтически приемлемые соли, где "4-(2-гидроксиэтил)-1-пиперазинилацетил" и "4-(2-гидроксиэтил)-1-пиперазин-2-этансульфонил" определенные выше.
Важно отметить, что, как известно в данной области, обычное лечение радиоактивным йодом, например, введение пациенту соли радиоактивного йода, неприемлемой для лечения медуллярной карциномы щитовидной железы, так как парафолликулярные клетки не поглощают йод. Таким образом, другим объектом данного изобретения является способ лечения медуллярной карциномы щитовидной железы, который предусматривает введение нуждающемуся в этом пациенту эффективного количества агониста SSTR2 или его фармацевтически приемлемой соли, причем указанный агонист SSTR2 или его фармацевтически приемлемая соль содержит остаток Tyr(I), а атом йода указанного остатка Tyr(I) представляет собой изотоп радиоактивного йода. Указанный изотоп йода предпочтительно представляет собой 125I, 127I или 131I.
В одном варианте осуществления изобретения клетки медуллярной карциномы щитовидной железы образуют метастазы за пределами щитовидной железы. В другом варианте осуществления изобретения указанные метастазы находятся в лимфе, легком, печени, головном мозге или костях.
Краткое описание чертежей
Фиг.1. Опосредуемая SSTR2 активация внутриклеточного кальция in vitro.
Клетки СНО-К1, экспрессирующие SSTR2 человека, собирают способом, описанным в разделе "Материалы и методы", и добавляют аналоги SS (10-7-10-6 М) для измерения активации внутриклеточного Са2+, выраженной в виде соотношения между концентрацией внутриклеточного кальция, измеренной после добавления аналогов SS, и концентрацией, определяемой на начальном уровне. Длины волн возбуждения и излучения равны соответственно 340 и 510 нм. Данные представлены в виде среднего значения ±стандартная ошибка средней (SEM).
Фиг.2. Опосредуемая SSTR5 активация внутриклеточного кальция in vitro.
Клетки СНО-К1, экспрессирующие SSTR5 человека, собирают способом, описанным в разделе "Материалы и методы", и добавляют аналоги SS (10-7-10-6 М) для измерения активации внутриклеточного Са2+, выраженной в виде соотношения между концентрацией внутриклеточного кальция, измеренной после добавления аналогов SS (соединение 1, соединение 5 и соединение 6), и концентрацией, определяемой на начальном уровне. Длины волн возбуждения и излучения равны соответственно 340 и 510 нм. Данные представлены в виде среднего значения ± стандартная ошибка средней (SEM).
Соединения, показанные на Фиг.2, имеют следующие структуры:
соединение 1: D-Nal-цикло[Cys-Tyr-D-Trp-Lys-Val-Cys]-Thr-NH2 (SEQ ID No.2);
соединение 2: цикло[Tic-Tyr-D-Trp-Lys-Abu-Phe] (SEQ ID No.3);
соединение 3: 4-(2-гидроксиэтил)-1-пиперазинилацетил-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Abu-Cys)-Thr-NH2 (SEQ ID No.4);
соединение 4: 4-(2-гидроксиэтил)-1-пиперазин-2-этансульфонил-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Abu-Cys)-Thr-NH2 (SEQ ID No.5);
соединение 5: D-Phe-Phe-Trp-D-Trp-Lys-Thr-Phe-Thr-NH2 (SEQ ID No.1) и
соединение 6: Сра-цикло(D-Cys-4-Pal-D-Trp-Lys-Thr-Cys)-Nal-NH2 (SEQ ID No.6).
Фиг.3. Ингибирование SS-стимулируемой активации внутриклеточного кальция антагонистом SSTR2 in vitro.
Клетки СНО-К1, экспрессирующие SSTR2 человека, собирают способом, описанным в разделе "Материалы и методы", после чего добавляют соединение 6 (10-9-10-6 М) и SS (10 нМ) для измерения воздействия соединения 6 на SS-стимулируемую (10-8 М) активацию внутриклеточного кальция, выраженного в процентах по сравнению с воздействием, оказываемым одним SS. Длины волн возбуждения и излучения равны соответственно 340 и 510 нм. Данные представлены в виде среднего значения ± стандартная ошибка средней (SEM).
Фиг.4. Экспрессия мРНК рецепторов соматостатина в ТТ-клетках.
Экстрагированную РНК (1 мкг/реакция) обрабатывают дезоксирибонуклеазой и подвергают обратной транскрипции, используя олиго(dT) в качестве праймера. Образцы, инкубируемые без обратной транскриптазы, служат в качестве контрольных образцов. Аликвоты полученной кДНК и отрицательных контрольных образцов подвергают последующей амплификации SSTR при помощи полимеразной цепной реакции (PCR), используя праймеры, указанные в таблице 1. Продукты PCR расщепляют на 2% агарозном геле. Предполагаемые продукты SSTR, полученные при помощи PCR, показаны в секторе А (полоса М, маркер PCR; G, продукт амплификации GAPDH при помощи PCR).
Фиг.5. Воздействие аналогов SS на включение [3H]thy в ТТ-клетки.
Клетки инкубируют на 24-луночных планшетах в течение 48 часов в культуральной среде, содержащей аналоги SS в разных концентрациях (10-9, 10-8, 10-7 и 10-6 М). Контрольные лунки обрабатывают раствором носителя и измеряют включение [3H]thy в виде радиоактивности осажденного ТХУК вещества. Данные шести отдельных экспериментов независимо оценивают для четырех одинаковых образцов в каждом эксперименте и выражают в виде среднего процентного значения ±SEM ингибирования включения [3H]thy по сравнению с необработанными контрольными клетками. *P<0,05 и **P<0,01 по сравнению с контрольным образцом.
Фиг.6. Воздействие аналогов SS на пролиферацию ТТ-клеток.
Клетки инкубируют на 96-луночных планшетах в течение 48 часов в культуральной среде, содержащей аналоги SS в разных концентрациях (10-9, 10-8, 10-7 и 10-6 М). Контрольные лунки обрабатывают раствором носителя. Пролиферацию ТТ-клеток измеряют в каждой лунке в виде оптической плотности при 490 нМ. Данные шести отдельных экспериментов независимо оценивают для восьми одинаковых образцов в каждом эксперименте и выражают в виде среднего процентного значения ±SEM ингибирования пролиферации клеток по сравнению с необработанными контрольными клетками. *P<0,05 и **P<0,01 по сравнению с контрольным образцом.
Фиг.7. Воздействие избирательного антагониста SSTR2 на включение [3H]thy в ТТ-клетки и пролиферацию клеток при обработке агонистом SSTR2.
Верхний блок. Клетки инкубируют на 24-луночных планшетах в течение 48 часов в культуральной среде, содержащей 100 нМ соединения 1 или соединения 2 с соединением 6 (10-7 М) или без него. Контрольные лунки обрабатывают раствором носителя. Включение [3H]thy измеряют в виде радиоактивности осажденного ТХУК вещества. Данные шести отдельных экспериментов независимо оценивают для четырех одинаковых образцов в каждом эксперименте и выражают в виде среднего процентного значения ±SEM ингибирования включения [3H]thy по сравнению с необработанными контрольными клетками. *P<0,05 и **P<0,01 по сравнению с контрольным образцом.
Нижний блок. Клетки инкубируют на 96-луночных планшетах в течение 48 часов в культуральной среде, содержащей 10-7 М соединения 1 или соединения 2 с соединением 6 (10-7 М) или без него. Контрольные лунки обрабатывают раствором носителя. Пролиферацию ТТ-клеток измеряют в каждой лунке в виде оптической плотности при 490 нМ. Данные шести отдельных экспериментов независимо оценивают для восьми одинаковых образцов в каждом эксперименте и выражают в виде среднего процентного значения ±SEM ингибирования пролиферации клеток по сравнению с необработанными контрольными клетками. *P<0,05 и **P<0,01 по сравнению с контрольным образцом.
Фиг.8. Воздействие избирательного антагониста SSTR5 на включение [3H]thy в ТТ-клетки и пролиферацию клеток при обработке избирательным агонистом SSTR2.
Верхний блок. Клетки инкубируют на 24-луночных планшетах в течение 48 часов в культуральной среде, содержащей соединение 2 (10-7 М) и соединение 5 с постоянной или увеличиваемой концентрацией (10-9, 10-8, 10-7 и 10-6 М), или в культуральной среде, содержащей соединение 5 (10-7 М) и соединение 2 с постоянной или уменьшаемой концентрацией (10-6, 10-7, 10-8 и 10-9 М). Контрольные лунки обрабатывают раствором носителя. Включение [3H]thy измеряют в виде радиоактивности осажденного ТХУК вещества. Данные шести отдельных экспериментов независимо оценивают для четырех одинаковых образцов в каждом эксперименте и выражают в виде среднего процентного значения ±SEM ингибирования включения [3H]thy по сравнению с необработанными контрольными клетками. *P<0,05 и **P<0,01 по сравнению с контрольным образцом.
Нижний блок. Клетки инкубируют на 96-луночных планшетах в течение 48 часов в культуральной среде, содержащей соединение 2 (10-7 М) и соединение 5 с постоянной или увеличиваемой концентрацией (10-9, 10-8, 10-7 и 10-6 М), или в культуральной среде, содержащей соединение 5 (10-7 М) и соединение 2 с постоянной или уменьшаемой концентрацией (10-6, 10-7, 10-8 и 10-9 М). Контрольные лунки обрабатывают раствором носителя и пролиферацию ТТ-клеток измеряют в каждой лунке в виде оптической плотности при 490 нМ. Данные шести отдельных экспериментов независимо оценивают для восьми одинаковых образцов в каждом эксперименте и выражают в виде среднего процентного значения ±SEM ингибирования пролиферации клеток по сравнению с необработанными контрольными клетками. *P<0,05 и **P<0,01 по сравнению с контрольным образцом.
Подробное описание изобретения
Предполагается, что специалист в данной области может в наиболее полной степени использовать преимущества настоящего изобретения, основываясь на приведенном описании изобретения. Поэтому рассмотренные ниже конкретные варианты осуществления изобретения имеют только иллюстративный характер и никоим образом не ограничивают объем данного изобретения.
За исключением особо оговоренных случаев все технические и научные термины, используемые в данном описании, имеют значения, хорошо известные специалистам в данной области. Кроме того, все приведенные в описании публикации, заявки на выдачу патента, патенты и другие материалы полностью включены в данное описание изобретения в качестве ссылки.
Выделено несколько рецепторов соматостатина (SSTR), например, SSTR-1, SSTR-2, SSTR-3, SSTR4 и SSTR-5. Таким образом, агонист соматостатина может представлять собой один или несколько агонистов SSTR-1, агонистов SSTR-2, агонистов SSTR-3, агонистов SSTR-4 или агонистов SSTR-5. Агонистом рецептора соматостатина типа 2 (т.е. агонистом SSTR2) является соединение, которое (1) обладает высоким сродством связывания (например, Ki меньше 100 нМ, предпочтительно меньше 10 нМ или меньше 1 нМ) с SSTR2 (например, по результатам описанного ниже анализа связывания с рецептором) и (2) уменьшает скорость пролиферации клеток медуллярной карциномы щитовидной железы (например, по результатам описанного ниже биологического анализа). Селективным агонистом рецептора соматостатина типа 2 является агонист рецептора соматостатина типа 2, который обладает более высоким сродством связывания (то есть имеет более низкое значение Ki) с SSTR2, чем с SSTR5. Агонистом рецептора соматостатина типа 5 является агонист соматостатина, который (1) обладает высоким сродством связывания (например, Ki меньше 100 нМ, предпочтительно меньше 10 нМ или меньше 1 нМ) с SSTR-5 (например, по результатам описанного ниже анализа связывания с рецептором) и (2) ослабляет вызываемое агонистом SSTR2 уменьшение скорости пролиферации клеток медуллярной карциномы щитовидной железы (например, по результатам описанного ниже биологического анализа). Избирательным агонистом рецептора соматостатина типа 5 является агонист рецептора соматостатина типа 5, который обладает более высоким сродством связывания (то есть имеет более низкое значение Ki) с SSTR5, чем с SSTR2.
В одном варианте осуществления изобретения агонист SSTR2 является также избирательным агонистом SSTR2. В другом варианте осуществления изобретения избирательный агонист SSTR2 имеет значение Ki для SSTR5, которое по крайней мере в 2 раза (например, по крайней мере в 5 раз или 10 раз) больше значения данного агониста для рецептора SSTR2 (например, по результатам описанного ниже анализа связывания с рецептором).
Примеры агонистов SSTR2, которые могут быть использованы при осуществлении настоящего изобретения, включают, не ограничиваясь ими: D-Nal-цикло[Cys-Tyr-D-Trp-Lys-Val-Cys]-Thr-NH2 (SEQ ID No.2) (соединение 1);
цикло[Tic-Tyr-D-Trp-Lys-Abu-Phe] (SEQ ID No.3) (соединение 2);
4-(2-гидроксиэтил)-1-пиперазинилацетил-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Abu-Cys)-Thr-NH2 (SEQ ID No.4) (соединение 3) и
4-(2-гидроксиэтил)-1-пиперазин-2-этансульфонил-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Abu-Cys)-Thr-NH2 (SEQ ID No.5) (соединение 4).
Пример агониста SSTR5, который может быть использован при осуществлении настоящего изобретения, включает, не ограничиваясь им:
D-Phe-Phe-Trp-D-Trp-Lys-Thr-Phe-Thr-NH2 (SEQ ID No.1) (соединение 5).
Другие примеры агонистов соматостатина включают соединения, которые имеют формулы, приведенные в следующих ниже публикациях, или описаны в указанных публикациях, включенных в данное описание изобретения в качестве ссылки.
Заявка на выдачу европейского патента № P5 164 EU (автор изобретения: G. Keri).
Van Binst, G. et al. Peptide Research 5:8 (1992).
Horvath, A, et al., Abstract, “Conformations of Somatostatin Analogs Having Antitumor Activity”, 22nd European peptide Symposium, September 13-19, 1992, Interlaken, Switzerland.
Патентная заявка РСТ WO 91/09056 (1991).
Заявка на выдачу европейского патента № 0363589 A2 (1990).
Патент США № 4904642 (1990).
Патент США № 4871717 (1989).
Патент США № 4853371 (1989).
Патент США № 4725577 (1988).
Патент США № 4684620 (1987).
Патент США № 4650787 (1987).
Патент США № 4603120 (1986).
Патент США № 4585755 (1986).
Заявка на выдачу европейского патента № 0203031 А2 (1986).
Патент США № 4522813 (1985).
Патент США № 4486415 (1984).
Патент США № 4485101 (1984).
Патент США № 4435385 (1984).
Патент США № 4395403 (1983).
Патент США № 4369179 (1983).
Патент США № 4360516 (1982).
Патент США № 4358439 (1982).
Патент США № 4328214 (1982).
Патент США № 4316890 (1982).
Патент США № 4310518 (1982).
Патент США № 4291022 (1981).
Патент США № 4238481 (1980).
Патент США № 4235886 (1980).
Патент США № 4224199 (1980).
Патент США № 4211693 (1980).
Патент США № 4190648 (1980).
Патент США № 4146612 (1979).
Патент США № 4133782 (1979).
Патент США № 5506339 (1996).
Патент США № 4261885 (1981).
Патент США № 4728638 (1988).
Патент США № 4282143 (1981).
Патент США № 4215039 (1980).
Патент США № 4209426 (1980).
Патент США № 4190575 (1980).
Европейский патент № 0389180 (1990).
Заявка на выдачу европейского патента № 0505680 (1982).
Заявка на выдачу европейского патента № 0083305 (1982).
Заявка на выдачу европейского патента № 0030920 (1980).
Патентная заявка РСТ № WO 88/05052 (1988).
Патентная заявка РСТ № WO 90/12811 (1990).
Патентная заявка РСТ № WO 97/01579 (1997).
Патентная заявка РСТ № WO 91/18016 (1991).
Заявка на выдачу патента Великобритании № GB 2095261 (1981) и
Заявка на выдачу патента Франции № FR 2522655 (1983).
Следует отметить, что во всех описываемых агонистах соматостатина любой аминокислотный остаток имеет формулу -NH-C(R)H-CO-, где R означает боковую цепь (например, СН3 для Ala). Линии между аминокислотными остатками означают пептидные связи, соединяющие аминокислоты. Кроме того, оптически активный аминокислотный остаток предположительно имеет конфигурацию L-формы, если специально не указана D-форма. Дисульфидные связи (например, дисульфидный мостик), существующие между двумя свободными тиолами остатков Cys, не показаны для простоты представления. Аббревиатуры обычных аминокислот приведены в соответствии с рекомендациями Международного союза теоретической и прикладной химии и Международного биохимического союза (IUPAC-IUB).
Синтез агонистов соматостатина
Способы синтеза агонистов соматостатина хорошо описаны в научной литературе и должны быть известны специалистам в данной области.
Синтез коротких аминокислотных последовательностей всесторонне описан в области синтеза пептидов. Например, описанное выше соединение, H-D-Phe-Phe-Phe-D-Trp-Lys-Thr-Phe-Thr-NH2, можно синтезировать способом по примеру I, приведенному в заявке на выдачу европейского патента 0395417 А1. Агонисты соматостатина с замещенным N-концом можно синтезировать способом, описанным в патентной заявке WO 88/02756, заявке на выдачу европейского патента № 0329295 и публикации РСТ № WO 94/04752.
Некоторые соединения по настоящему изобретению могут иметь по крайней мере один асимметричный центр. В молекуле могут присутствовать асимметричные дополнительные центры в зависимости от типа разных заместителей в данной молекуле. Каждый такой асимметричный центр образует два оптических изомера, и все такие оптические изомеры, представляющие разделенные, чистые или частично очищенные оптические изомеры, их рацемические или диастереомерные смеси, входят в объем настоящего изобретения.
Соединения по настоящему изобретению могут быть выделены в виде фармацевтически приемлемых кислотно-аддитивных солей, таких как соли, получаемые при использовании неорганических и органических кислот. Примерами таких кислот являются хлористоводородная, азотная, серная, фосфорная, муравьиная, уксусная, трифторуксусная, пропионовая, малеиновая, янтарная, D-винная, L-винная, малоновая, метансульфоновая и подобные кислоты. Кроме того, некоторые соединения, содержащие функциональную кислотную группу, такую как карбоксильная группа, могут быть выделены в виде неорганической соли, в которой противоион может быть выбран из натрия, калия, лития, кальция, магния и подобных, а также из органических оснований.
Фармацевтически приемлемые соли можно получить, осуществляя взаимодействие примерно 1 эквивалента агониста SSTR2, например, соединения 1, примерно с 1 или более эквивалентами соответствующей кислоты, образующей требуемую соль. Способы обработки и выделения образующейся соли хорошо известны специалистам в данной области.
Соединения по данному изобретению могут быть предназначены для перорального, парентерального (например, внутримышечного, внутрибрюшинного, внутривенного или подкожного введения в виде инъекции или имплантата), назального, вагинального, ректального, подъязычного или местного введения и использованы вместе с фармацевтически приемлемыми носителями для получены дозированных лекарственных форм, соответствующих каждому способу введения. В объем настоящего изобретения входят фармацевтические композиции, содержащие в качестве активного ингредиента по крайней мере один агонист SSTR2 в сочетании с фармацевтически приемлемым носителем.
Твердые дозированные лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых дозированных лекарственных формах активное соединение находится в смеси по крайней мере с одним инертным фармацевтически приемлемым носителем, таким как сахароза, лактоза или крахмал. Указанные дозированные лекарственные формы, как правило, могут содержать дополнительные вещества помимо инертных наполнителей, например, смазывающие вещества, такие как стеарат магния. В случае капсул, таблеток и пилюль дозированные лекарственные формы могут также содержать буферные вещества. На таблетки и пилюли может быть дополнительно нанесено энтеросолюбильное покрытие.
Жидкие дозированные лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы, эликсиры, содержащие инертные разбавители, обычно используемые в данной области, такие как вода. Помимо инертных разбавителей композиции могут также содержать адъюванты, такие как смачивающие вещества, эмульгирующие и суспендирующие агенты, а также подсластители, корригенты и отдушки.
Препараты по данному изобретению для парентерального введения включают стерильные водные или неводные растворы, суспензии или эмульсии. Примерами неводных растворителей или разбавителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое и кукурузное масло, желатин и инъецируемые сложные органические эфиры, такие как этилолеат. Такие дозированные лекарственные формы могут также содержать адъюванты, в частности, консервирующие, смачивающие, эмульгирующие и диспергирующие агенты. Указанные дозированные лекарственные формы могут быть стерилизованы, например, фильтрацией через задерживающий бактерии фильтр, введением стерилизующих агентов, облучением или нагреванием композиций. Указанные лекарственные формы могут быть также получены в виде стерильных твердых композиций, которые можно растворить в стерильной воде или какой-либо другой стерильной инъецируемой среде непосредственно перед использованием.
Композиции для ректального или вагинального введения предпочтительно представляют суппозитории, которые могут содержать помимо активного вещества такие эксципиенты, как масло какао или воск для суппозиториев.
Композиции для введения в нос или под язык также получают, используя стандартные эксципиенты, хорошо известные в данной области.
Эффективная доза активного ингредиента в композициях по данному изобретению может быть разной; однако необходимо, чтобы количество активного ингредиента было достаточным для получения приемлемой дозированной лекарственной формы. Доза может быть выбрана специалистом в данной области в зависимости от желаемого результата лечения, способа введения и продолжительности лечения. Требуемая доза, вводимая человеку и другим животным, например, млекопитающим, обычно составляет от 0,0001 до 100 мг/кг массы тела в сутки.
Предпочтительная доза находится в пределах от 0,01 до 10,0 мг/кг массы тела в сутки и может быть введена в виде одной дозы или разделена на несколько доз.
Материалы и методы
Экспрессию мРНК рецепторов SSTR всех пяти подтипов в линии ТТ-клеток МТС человека определяют при помощи анализа RT-PCR. Способность аналогов SS с разным сродством и специфичностью в отношении рецепторов подтипов 2 и 5 влиять на пролиферацию ТТ-клеток можно оценить, определяя включение [3H]thy в клетки, представляющее собой непрямой метод измерения активности синтеза ДНК, и количество жизнеспособных клеток.
Все предпочтительные агонисты SSTR2 способны существенно уменьшать количество ТТ-клеток при концентрациях от 10-9 М до 10-6 М. Соединение 3 и соединение 4 существенно (р<0,05) уменьшают включение [3H]thy при концентрации 10-9 М и не оказывают подобного действия при концентрациях 10-8 М и 10-7 М, когда имеет место максимальное уменьшение количества клеток. Все испытанные соединения SSTR2 характеризуются меньшей эффективностью при увеличении концентрации, однако, колоколообразные кривые присущи всем SS. Ингибирование включения [3H]thy и уменьшение количества ТТ-клеток соединением 1 и соединением 2 при концентрации 10-7 М не связано с каким-либо цитотоксическим действием, о чем свидетельствует окрашивание трипановым синим. Кроме того, указанное действие полностью аннулируется при одновременной обработке ТТ-клеток соединением 6, избирательным антагонистом SSTR2. Полученные результаты показывают, что аналоги SS с предпочтительной избирательностью в отношении SSTR2 подавляют пролиферацию ТТ-клеток в результате специфического взаимодействия с рецептором SSTR2.
Культура линии ТТ-клеток
Линию ТТ-клеток получают из Американской коллекции типовых культур (АТСС, Manassas, VA, USA). Линия ТТ-клеток включает анэуплоидно-трансформированные СТ-продуцирующие парафолликулярные клетки, которые характеризуются наличием мутации TGC в TGG (с заменой Cys на Trp) в экзоне 11 кодона 634 протоонкогена RET (Cooley LD, et al., 1995 Cancer Genet Cytogenet 80: 138-149), что подтверждено авторами данного изобретения в исследуемой линии клеток. Кроме того, в ТТ-клетках наблюдается нарушенная экспрессия супрессорного гена опухоли р53 (Velasco JA, et al., 1997 Int J Cancer 73:449-455). Иммуногистохимические исследования показывают, что ТТ-клетки экспрессируют СТ и рецептор СТ (Frendo JL, et al., 1994 FEBS Lett. 342: 214-216), карциноэмбриональный антиген (СЕА), SS, нейротензин, гастринвысвобождающий пептид (GRP), Leu- и Met-энкефалин, пептид, высвобождающий паращитовидный гормон (PTHrp), хромогранин А, SP-I, синаптофизин, нейронспецифическую енолазу (NSE), рецептор 1,25-дигидроксивитамина D3, тирозингидроксилазу, α-тубулин и цитохератин (Zabel M, et al., 1995 Histochemical J. 27: 859-868). ТТ-клетки секретируют значительное количество СТ и реагируют на изменения содержания ионизированного кальция (Zabel M, et al., 1992 Histochemistry 102: 323-327). Таким образом, линия ТТ-клеток пригодна для исследования парафолликулярной функции и реакций на эндокринные и фармакологические стимулирующие факторы.
Клетки вводят в питательную смесь Хэма F12 с глутамином (EuroClone Ltd, Torquay, UK), содержащую 10% фетальную телячью сыворотку (FBS, Life Technology, Milano, Italy), 100 ед./мл пенициллина, 0,1 мг/мл стрептомицина и 100 мкг/мл амфотерицина (EuroClone Ltd, Torquay, UK), при 37°С во влажной атмосфере с 5% СО2 и 95% воздуха.
Выделение РНК
Полную РНК экстрагируют из субконфлюэнтных ТТ-кле