Способ хранения днк
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии. Предложен способ хранения ДНК в бидистиллированной воде, содержащей консервант в виде сульфата марганца в концентрации 0,08125-8,125 мМ, при температуре -20°С. Изобретение позволяет предотвращать повреждение ДНК свободными радикалами при хранении и может быть использовано в области молекулярно-генетических исследований. 1 ил.
Реферат
Способ хранения ДНК относится к области молекулярно-генетических исследований и предназначен для консервации выделенных и очищенных препаратов нуклеиновых кислот, например, при создании генетических коллекций наследственного материала различного происхождения.
Для молекулярно-генетических исследований самых разных биологических объектов, а также для экспертных оценок, основанных на подобных методах, применяют препараты суммарной ДНК, выделенные из различных тканей. Такие препараты могут содержать фракции как высокомолекулярной ядерной, так и внеядерной ДНК (митохондриальной, хлоропластной). На практике удобно иметь очищенные препараты ДНК и/или набор ряда ампликонов. В этом случае исключаются деструктивные процессы, возникновение которых возможно в тканевых образцах - перекисное окисление липидов; эндонуклеазная активность; повреждение кристаллами льда при неравномерном замораживании проб и т.п.
В зависимости от состояния, типа исходной ткани и применяемых методов хранения ДНК может сохраняться некоторое время без существенной деградации даже при комнатной температуре. Степень сохранности ДНК при разных способах хранения очень сильно варьирует.
Охлаждение проб, содержащих нуклеиновые кислоты, до +4°С может лишь приостановить процессы биодеградации.
Для более длительного хранения используют низкие температуры - образец ткани может быть заморожен от -20°С до -195,8°С (например, в условиях промышленных холодильных установок или в жидком азоте) (1).
К недостаткам метода криоконсервации относятся следующие: потенциальная возможность сохранения патогенных возбудителей вместе с образцом, необходимость постоянного поддержания бесперебойной работы холодильного оборудования и обязательной организации фиксации терморежимов хранения и бесперебойного энергоснабжения (если речь идет о холодильных установках). Кроме того, по мнению ряда исследователей, в замороженном состоянии повреждающее действие свободных радикалов может быть более глубоким.
Известен метод FTA Gene Guard (2) для целей хранения с одновременным извлечением ДНК. Этот метод предполагает нанесение биологических жидкостей на фильтровальную бумагу, обработанную буфером, содержащим мощные денатурирующие вещества, которые также предотвращают рост бактерий и др. микроорганизмов. Клеточные элементы на FTA-бумаге подвергаются лизису. ДНК высвобождается из ядер лейкоцитов и иммобилизуется на матриксе бумаги. Связанная таким образом ДНК может быть освобождена от гема или др. ингибиторов ПЦР отмыванием, после чего FTA-бумага с иммобилизованной на ней ДНК может вводиться непосредственно в соответствующую амплификационную смесь.
Указанный способ имеет ряд ограничений.
1. Способ предназначен для работы с узким перечнем тканей (кровь и биологические жидкости).
2. Количество иммобилизуемой ткани (10 мкл крови человека) невелико.
3. Сохраняются не чистые препараты ДНК, а ее конгломерат с остатками фиксируемых тканей и реагентов.
4. Качество получаемых препаратов ДНК ограничивает их применение в исследованиях молекулярно-генетическими методами, предъявляющими жесткие требования к чистоте матрицы (RAPD, AFLP).
Наиболее близким к заявленному способу (прототип) является способ хранения ДНК на твердой матрице (например, на фильтровальной бумаге), состав или компонент которой противостоит разложению ДНК, которую данная матрица инкорпорирует или абсорбирует с возможностью восстановления ДНК или использования ДНК in situ (например, амплификация последовательности ДНК с помощью ПЦР). Для защиты ДНК от свободно-радикальных повреждений используется урат (NH2CONH2), причем, мочевая кислота или ее соль должны действовать как «свободно-радикальная» ловушка (3).
Однако эффективность анионных антиоксидантов, которыми являются мочевая кислота или ее соли, ограничивается тем, что ДНК тоже является полианионом. Положительный заряд фосфатных групп препятствует контакту анионов с молекулами ДНК, поэтому наиболее уязвимые части молекулы остаются незащищенными.
Основной задачей предлагаемого изобретения является надежная защита сохраняемых растворов ДНК от повреждения активными формами кислорода.
Это достигается за счет того, что образец ДНК помещают в бидистиллированную воду, содержащую консервант в виде сульфата марганца в концентрации 0,08125-8,125 мМ, и хранят при температуре -20°С.
Использование неорганических солей марганца, в частности сульфата марганца, является основой создания эффективных рецептур, защищающих ДНК при хранении, т.к. ионы солей марганца, как выявлено в процессе исследований, обладают двумя ценными свойствами: способностью сорбироваться на молекулах ДНК и подавлять генерацию повреждающих ДНК активных форм кислорода.
Двухвалентный марганец, взаимодействуя с супероксид анионом и двумя протонами, окисляется до трехвалентного состояния с образованием перекиси водорода (4). Последняя реагирует с Mn(III) с образованием Mn(II), кислорода и двух протонов. Таким образом, ионы марганца способны в достаточно широком диапазоне рН формировать цикл «дезактивации» супероксид аниона. Супероксид анион не способен непосредственно взаимодействовать с ДНК, однако этот радикал является предшественником более активных форм, в частности гидроксильного радикала.
Более того, супероксид анион является интермедиатом, обусловливающим образование цикла реакций Фентона/Хабера-Вейса, сопровождающегося генерацией гидроксильных радикалов в присутствии железа (5):
Сульфат марганца широко известен как антисептическое средство. В молекулярно-генетических исследованиях ранее использовался как компонент сред для культуры тканей.
Использование MnSO4 в качестве консерванта для длительного хранения ДНК не известно, так же как и других неорганических солей марганца.
Сульфат марганца выбран нами как дешевое, доступное и хорошо растворяющееся в воде вещество.
Проведенный анализ уровня техники позволил установить, что не обнаружен источник, характеризующийся признаками, тождественными всем существенным признакам заявленного изобретения.
Следовательно, заявленное изобретение соответствует критерию «новизна».
Дополнительный поиск известных решений показал, что заявленное изобретение не вытекает для специалиста явным образом из известного уровня техники. Введение сульфата марганца в качестве консерванта позволяет достичь наилучшего результата в защите от свободных радикалов.
Следовательно, заявленное изобретение соответствует критерию «изобретательский уровень».
Способ осуществляется следующим образом.
В пробирки с дистиллированной водой вводят сульфат марганца в концентрации 0,08125; 0,8125 и 8,125 мМ, помещают в них образцы ДНК и хранят при температуре -20°С.
Генерацию гидроксильных радикалов в растворе ДНК проводят в цикле реакций Фентона/Хабера-Вейса в присутствии железа и перекиси водорода(5).
Сохранность раствора ДНК, содержащего 20 нг/мкл ДНК русского осетра (Acipenser guldenstadti) в бидистиллированной воде, оценивают методом полимеразной цепной реакции (ПЦР). Каждая реакционная смесь содержит по 20 pmol праймеров (Rus L 5'-ССА-АСС-ТСС-TCT-CCG-CCT-TT-3', Rus R 5'-AAG-TAC-GGG-TGG-AAT-GTT-ACC-3'), 2,5 мкл 10хБуфера для Hot Taq полимеразы «Силекс, Москва», 2,5 мМ Mg2+ «Силекс, Москва»; 0,1 мМ dNTP «Силекс, Москва»; 0,04 ед Hot Taq полимеразы «Силекс, Москва»; деионизованную бидистиллированную воду до 25 мкл.
ПЦР проводят при помощи амплификатора РТС DNA Engine Dyad Cycler (MJ Research. Bio-Rad), в следующих режимах: первичная денатурация - 94°С 5 мин; последующие 36 циклов денатурация - 94.0°С 40 с, отжиг - 55°С 30 сек, элонгация - 72.0°С 30 сек; окончательная достройка - 72°С 3 мин.
Полученные ПЦР-продукты визуализируют в агарозном геле (1,8%) с добавлением бромистого этидия (10 мг/мл).
Пример 1. В соответствии с описанным выше способом для оценки сохранности ДНК использовали 15 мкл ДНК + 5 мкл Н2O.
Пример 2. Аналогично примеру 1 использовали 15 мкл ДНК + 5 мкл 5% Н2О2.
Пример 3. Аналогично примеру 1 использовали 15 мкл ДНК + 5 мкл 3.25 мМ FeSO4.
Пример 4. Аналогично примеру 1 использовали 10 мкл ДНК + 5 мкл 3.25 мМ FeSO4 + 5 мкл 5% Н2O2.
Пример 5. Аналогично примеру 1 использовали 5 мкл ДНК + 5 мкл 3.25 мМ FeSO4 + 5 мкл 5% Н2O2 + 5 мкл 8.125 мМ MnSO4.
Пример 6. Аналогично примеру 1 использовали 5 мкл ДНК + 5 мкл 3.25 мМ FeSO4 + 5 мкл 5% Н2O2 + 5 мкл 0,08125 мМ MnSO4.
Пример 7. Аналогично примеру 1 использовали 5 мкл ДНК + 5 мкл 3.25 мМ FeSO4 + 5 мкл 5% Н2O2 + 5 мкл 1 мМ NH2CONH2.
Пример 8. Аналогично примеру 1 использовали 5 мкл ДНК + 5 мкл 3.25 мМ FeSO4 + 5 мкл 5% Н2O2 + 5 мкл 0,8125 мМ MnSO4.
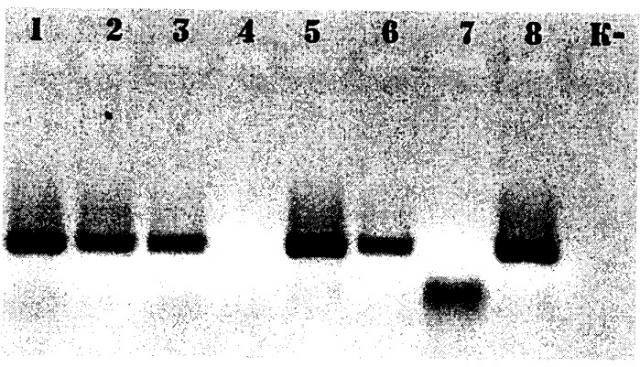
Приведенные на чертежее данные показывают, что:
1) необработанная ДНК служит матрицей для ПЦР с образованием достоверно идентифицируемого мономорфного ПЦР-продукта (полосы 1-3);
2) использованные концентрации перекиси водорода и железа разрушают ДНК до состояния, в котором она не может служить матрицей для ПЦР (полоса 4 - отсутствие продукта реакции);
3) введение в реакционную смесь 8.125 мМ MnSO4 защищает ДНК от разрушения (полоса 5);
4) введение в реакционную смесь 0,08125 мМ MnSO4 также защищает ДНК от разрушения, однако эффект менее выражен (полоса 6);
5) введение в реакционную смесь NH2CONH2 до насыщающей концентрации не позволяет снизить повреждение ДНК до состояния, пригодного для образования ПЦР-продуктов, идентичных продуктам ПЦР с интактной ДНК; образуются низкомолекулярные шмеры, ПЦР теряет специфичность (полоса 7 - отсутствие продукта реакции);
6) введение в реакционную смесь 0,8125 мМ MnSO4 защищает ДНК от разрушения (полоса 8).
Таким образом, MnSO4 в концентрации 0,08125 - 8,125 мМ является более надежным средством защиты от повреждения активными формами кислорода, чем урат.
Источники информации
1. Корниенко И.В. Подготовка биологического материала для молекулярно-генетических исследований при массовом поступлении неопознанных тел. Ростов-на-Дону, 2001.
2. Dobbs L.J., Madigan M.N., Carter A.B. Earls L Use of FTA Gene Guard filter paper for the storage and transportation of tumor cells for molecular testing / Arch of pathology and laboratory medicine. 2002, 126(1); 56-63.
3. Патент США 2005/0282180, Int. cl. C12Q 1/68, С12М 1/34. Solid medium and method for DNA storage. Inventor-Leigh A. Burgoyne. (Прототип).
4. Archibald F.S., Fridovich I. The scavenging of superoxide radical by manganous complexes: in vitro / Arch. Biochem. Biophys. - 1982, Apr.1; 214(2): 452-463.
5. Фридович И. Радикалы кислорода, пероксид водорода и токсичность кислорода. // Свободные радикалы в биологии. М.: Мир. - 1979. - С.190-226.
Способ хранения ДНК, включающий использование консерванта, отличающийся тем, что образец ДНК помещают в бидистиллированную воду, содержащую консервант в виде сульфата марганца в концентрации 0,08125-8,125 мМ и хранят при температуре -20°С.