Композиция антагониста vegf и антипролиферативного средства
Иллюстрации
Показать всеПредложено применение сочетания антагониста VEGF, представляющего собой VEGFR1R2-FcΔC1(a) или Flt1D2. Flk1D3. FcΔC1 (а) с антипролиферативным средством: паклитакселом, доцетакселом или цисплатиной, карбоплатиной, ипроплатиной, - для производства лекарственного средства для лечения злокачественных опухолей и/или снижения или ингибирования роста опухоли у нуждающегося в этом индивидуума (варианты), соответствующие способ, фармацевтическая композиция и набор для лечения злокачественных опухолей. Выявлен сверхсуммарный эффект заявленного сочетания (97% подавление опухоли) при отсутствии побочных эффектов. 6 н. и 4 з.п. ф-лы, 2 ил., 1 табл.
Реферат
Область техники, к которой относится изобретение
Область изобретения относится к способам лечения злокачественных опухолей у млекопитающих с применением антагониста фактора роста эндотелия сосудов (VEGF) в сочетании с антипролиферативным средством и к фармацевтическим композициям, содержащим антагонист VEGF и антипролиферативное средство.
Уровень техники
Фактор роста эндотелия сосудов признан важнейшим фактором, стимулирующим ангиогенез при патологических состояниях. Подходы к способам блокирования VEGF включают применение растворимых конструктов рецептора, антисмысловых молекул, аптамеров РНК и антител. Для описания ловушки на основе антагонистов рецептора VEGF см., например, PCT WO/0075319.
Для лечения злокачественных опухолей широко применяют противоопухолевые средства как по отдельности, так и в сочетании с хирургическим вмешательством и/или лучевой терапией. Известны способы комбинированного лечения (см., например, США 6342219) с применением антитела против VEGF и химиотерапевтических средств, таких как паклитаксел (ТаксолTM).
Раскрытие изобретения
В одном из аспектов изобретение относится к способу лечения злокачественных опухолей у индивидуума, нуждающегося в таком лечении, включающему введение индивидууму антагониста фактора роста эндотелия сосудов (VEGF) в сочетании с антипролиферативным средством, осуществляя лечение злокачественной опухоли. Хотя индивидуум, которому проводят лечение, может относиться к любому виду млекопитающих, предпочтительно нуждающимся индивидуумом является человек, страдающий злокачественной опухолью.
В частном осуществлении антагонист VEGF представляет собой ловушку VEGF, способную к высокоаффинному связыванию с VEGF. Более конкретно ловушка VEGF представляет собой Flt1D2.Flk1D3.Fc∆C1(a) (SEQ ID NO:1-2) или VEGFR1R2-Fc∆C1(a) (SEQ ID NO:3-4). В частном осуществлении антипролиферативное средство представляет собой средство, стабилизирующее микротрубочки, такое как паклитаксел или такое его производное, аналог, как доцетаксел (Таксотер®), или их смесь; такие химиотерапевтические соединения на основе платины, как цисплатин, карбоплатин, ипроплатин и родственные соединения; или другие общепринятые цитотоксические соединения. ТаксолTM (Bristol-Myers Squibb) представляет собой одну из доступных торговых форм паклитаксела.
Во втором аспекте изобретение относится к способу уменьшения, замедления или ингибирования роста опухоли у нуждающегося в этом индивидуума, включающему введение индивидууму антагониста фактора роста эндотелия сосудов (VEGF) в сочетании с антипролиферативным средством, осуществляя уменьшение, замедление или ингибирование роста злокачественной опухоли.
В третьем аспекте изобретение относится к способу уменьшения количества химиотерапевтического средства, необходимого для достижения желаемого терапевтического эффекта, включающему введение химиотерапевтического средства с антагонистом VEGF. Более конкретно химиотерапевтическое средство представляет собой такое антипролиферативное средство, как паклитаксел или его производное, аналог, или их смесь; такие химиотерапевтические соединения на основе платины, как цисплатин, карбоплатин, ипроплатин и родственные соединения; или другие общепринятые цитотоксические соединения; и антагонист VEGF представляет собой ловушку VEGF. В одном из вариантов осуществления количество химиотерапевтического средства, необходимое для достижения желаемого терапевтического эффекта, такого как, например, ингибирование роста опухоли, снижено по меньшей мере на 20% при совместном введении с ловушкой VEGF. В более частном осуществлении необходимое количество химиотерапевтического средства снижено приблизительно на 40-50% в присутствии ловушки VEGF.
В четвертом аспекте изобретение относится к фармацевтической композиции, содержащей антагонист фактора роста эндотелия сосудов (VEGF), антипролиферативное средство и фармацевтически приемлемый носитель. В более частном осуществлении антагонист VEGF представляет собой ловушку VEGF, способную к высокоаффинному связыванию с VEGF, и антипролиферативное средство представляет собой средство, стабилизирующее микротрубочки, такое как паклитаксел или его производное, аналог, или их смесь. Еще более конкретно ловушка VEGF представляет собой Flt1D2.Flk1D3.Fc∆C1(a) (SEQ ID NO:1-2), VEGFR1R2-Fc∆C1(a) (SEQ ID NO:3-4) или их функциональный эквивалент. В предпочтительном осуществлении фармацевтическая композиция представляет собой VEGFR1R2-Fc∆C1(a) (SEQ ID NO:3-4) и паклитаксел.
Другие задачи и преимущества будут очевидны из обзора последующего детального описания.
Краткое описание чертежей
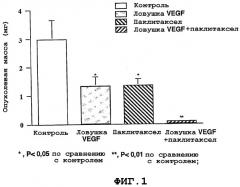
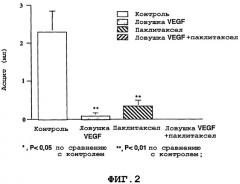
Фигуры 1-2 представляют собой гистограммы, на которых показано уменьшение опухоли (фиг.1) и объем асцитической жидкости (фиг.2) у животных, которым проводили лечение только индифферентным веществом (плацебо) (в качестве контроля), только ловушкой VEGF, только ТаксоломTM или ловушкой VEGF вместе с ТаксоломTM.
Детальное описание
Перед описанием настоящих способов и композиций необходимо понимать, что данное изобретение не ограничивается конкретными способами и описанными экспериментальными состояниями, поскольку такие способы и состояния могут изменяться. Также необходимо понимать, что используемая в данном описании терминология представлена только в целях описания конкретных осуществлений и не подразумевает ограничений объема настоящего изобретения, который ограничивается только приложенной формулой изобретения.
Как использовано в данном описании и приложенной формуле изобретения, форма единственного числа терминов "некоторый" и "этот" также относится и к множественному числу до тех пор, пока в контексте явно не указано иное. Таким образом, например, ссылка на “способ” включает один или более способов, и/или стадий способа, указанного и/или очевидного для специалистов в данной области из прочтения этой информации, и т.д.
Как используется в данном описании, все технические и научные термины до тех пор, пока не определены иначе, имеют то же значение, в котором их, как правило, понимает специалист в области, к которой относится настоящее изобретение. Настоящим описывают предпочтительные способы и вещества, хотя для практического использования или проверки настоящего изобретения можно применять любые способы и вещества, представляющие собой эквиваленты или подобные тем, которые описаны в данном описании. Все цитируемые публикации включены в настоящее описание в качестве ссылки для описания способов и/или веществ, в связи с которыми цитированы указанные публикации.
Общее описание
Изобретение основано на открытиях, что сочетанное введение антагониста VEGF, например, ловушки VEGF VEGFR1R2-Fc∆C1(a), вместе с антипролиферативным средством, например, таксолом, приводит в результате к значительному ингибированию роста опухоли. Неожиданное взаимоусиливающее действие сочетания ловушки VEGF и паклитаксела (ТаксолTM) на рост опухоли обеспечивает многообещающий терапевтический подход к лечению злокачественных опухолей у человека. Для описания ловушек VEGF на основе антагониста рецептора VEGF Flt1D2.Flk1D3.Fc∆C1(a) (SEQ ID NO:1-2) и VEGFR1R2-Fc∆C1(a) (SEQ ID NO:3-4) см. PCT WO/0075319, содержание которого полностью приведено в данном описании в качестве ссылки.
Паклитаксел представляет собой дитерпеновое противоопухолевое соединение, первоначально полученное из коры дерева Taxus brevifolia (тихоокеанский тис) (Wani et al. (1971) J. Am. Chem. Soc. 93:2325-2327). ТаксолTM представляет собой доступную торговую форму паклитаксела. Другие химиотерапевтические соединения, применяемые по способу изобретения в сочетании с антагонистом VEGF, включают, но не ограничиваются ими, доцетаксел (Таксотер®; Aventis Antony, Франция); нитрозомочевину, циклофосфамид, доксорубицин, эпирубицин, 5-фторурацил, топотекан и иринотекан, кармустин и эстрамустин. Предпочтительные химиотерапевтические средства включают такие соединения на основе платины, как цисплатин, карбоплатин и ипроплатин. Другие, подобные общепринятые цитотоксические химические соединения описаны Wiemann et al. (1985) в Medical Oncology (Calabresi et al., eds.), глава 10, McMillan Publishing.
Способы введения
Изобретение предоставляет способы лечения, включающие введение индивидууму эффективного количества фармацевтической композиции, содержащей такой антагонист VEGF, как ловушка VEGF, и такое антипролиферативное средство, как паклитаксел. Известны различные системы доставки, которые можно применять для введения композиции по изобретению, например инкапсулирование в липосомы, микрочастицы, микрокапсулы, рекомбинантные клетки, способные экспрессировать соединение, опосредуемый рецептором эндоцитоз (см., например, Wu and Wu, 1987, J. Biol. Chem. 262: 4429-4432), конструкцию нуклеиновой кислоты в качестве части ретровирусного или другого вектора и т.д. Способы введения могут быть энтеральными или парентеральными и включают, но не ограничиваются ими, внутрикожные, внутримышечные, внутрибрюшинные, внутривенные, подкожные, интраназальные, внутриглазные и пероральные способы введения. Соединения можно вводить вместе с другими биологически активными веществами и любым удобным способом, например, посредством инфузии или болюсной инъекции, всасывания через эпителиальную или кожно-слизистую оболочки (например, слизистую оболочку полости рта, слизистую оболочку кишечника, включая прямую кишку, и т.д.). Введение может быть системным или местным. Введение может быть однократным или длительным (например, ежесуточным, еженедельным, ежемесячным и т.д.), или в сочетании с другими средствами. Также можно применять ингаляционное введение, например, используя ингалятор или распылитель и препарат с аэрозольным средством.
В другом осуществлении активное вещество можно доставлять в везикуле, особенно в липосоме, в системах с контролируемым высвобождением или в насосе. В другом осуществлении, где активное вещество по изобретению представляет собой нуклеиновую кислоту, кодирующую белок, нуклеиновую кислоту для обеспечения экспрессии кодируемого ею белка можно вводить in vivo посредством конструирования ее в качестве части соответствующей нуклеиновой кислоты вектора экспрессии и введения ее таким образом, чтобы она попала внутрь клетки, например, применяя ретровирусный вектор (см., например, патент США №4980286), прямой инъекцией, или применяя бомбардировку микрочастицами, или покрытие липидами или рецепторами клеточной поверхности, или средствами для трансфекции, или введением ее, связанной с гомеобоксподобным пептидом, для которого известно, что он проникает в ядро (см., например, Joliot et al., 1991, Proc. Natl. Acad. Sci. USA 88:1864-1868) и т.д. Альтернативно для экспрессии нуклеиновую кислоту можно вводить внутриклеточно и включать посредством гомологичной рекомбинации в ДНК клетки хозяина.
В частном осуществлении может быть желательно местное введение фармацевтических композиций по изобретению в необходимую для лечения область; этого можно достичь, и не путем ограничения, например, местной инфузией в течение хирургического вмешательства, местным применением, например, инъекцией при помощи катетера или при помощи имплантата, где имплантат состоит из пористого, непористого или гелеобразного вещества, включая мембраны, такие как мембраны из силиконовой резины, волокна или коммерческие заместители кожи.
Композиция, пригодная для практического осуществления способов по изобретению, может представлять собой жидкость, содержащую в растворе, в суспензии или в них обоих средство по изобретению. Термин "раствор/суспензия" относится к жидкой композиции, где первая порция активного вещества находится в растворе, а вторая порция активного вещества находится в виде частиц, в суспензии жидкого раствора. Жидкая композиция также включает гель. Жидкая композиция может быть водной или в виде мази.
Водная суспензия или раствор/суспензия, пригодные для практического применения способов по изобретению, могут содержать в качестве суспендирующих средств один или более полимеров. Пригодные полимеры включают такие водорастворимые полимеры, как полимеры целлюлозы, и такие водонерастворимые полимеры, как карбоксилсодержащие полимеры с поперечными сшивками. Водная суспензия или раствор/суспензия по настоящему изобретению предпочтительно являются вязкими или мукоадгезивными или, еще более предпочтительно, и вязкими, и мукоадгезивными.
Метрономная химиотерапия
Метрономная химиотерапия развивается как улучшенный способ проведения химиотерапии. Традиционную химиотерапию проводили разовыми дозами или короткими курсами лечения, применяя максимально возможную в отсутствие достижения угрожающего жизни уровня токсичности дозу, например, максимально переносимую дозу (МПД). Лечение МПД требует продолжительных пауз длительностью 2-3 недели между следующими один за другим циклами лечения. Несмотря на многочисленные проведения такой химиотерапии и большое количество клинических испытаний, предпринятых для ее проверки, был достигнут незначительный, с точки зрения излечения или значительного продления жизни пациентов со злокачественной опухолью, прогресс (Kerbel & Kamen (2004) Nature Reviews Cancer 4: 423-436).
Метрономная химиотерапия относится к частому, даже ежесуточному, проведению химиотерапии в дозах, значительно ниже МПД, без продолжительных пауз в отсутствие лекарственного средства. Помимо снижения разовой токсичности представляется, что эффективность метрономной химиотерапии повышается при применении в сочетании с такими специфическими противоангиогенными лекарственными средствами, как ингибиторы VEGF (Kerbel & Kramen (2004), выше). Соответственно, настоящее изобретение относится к метрономной химиотерапии для лечения злокачественных опухолей у индивидуума, нуждающегося в таком лечении, включающей введение индивидууму антагониста фактора роста эндотелия сосудов (VEGF) в сочетании с антипролиферативным средством, осуществляя лечение злокачественной опухоли. В этом варианте осуществления изобретения антагонист VEGF и антипролиферативное средство можно вводить вместе или последовательно через относительно короткий промежуток времени, например 1-12 недель, с последующим регулярным введением антипролиферативного средства в течение продолжительного периода времени, например 6-24 месяцев.
Фармацевтические композиции
Настоящее изобретение предоставляет фармацевтические композиции, содержащие антагонист VEGF, антипролиферативное средство и фармацевтически приемлемый носитель. Термин “фармацевтически приемлемый” означает утвержденный контрольными органами федерального правительства или правительства штата, или указанный в фармакопее США или другой общепризнанной фармакопее, для применения для животных и более конкретно для человека. Термин “носитель” относится к растворителю, вспомогательному лекарственному средству, эксципиенту или индифферентному веществу, с которым вводят лекарственное средство. Такие фармацевтические носители могут представлять собой стерильные жидкости, такие как вода и масла, включающие масла нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и подобные им. Приемлемые фармацевтические эксципиенты включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое снятое молоко, глицерин, пропиленгликоль, воду, этанол и подобные им. При желании композиция может также содержать незначительные количества увлажнителей, или эмульгаторов, или pH буферных веществ. Эти композиции могут быть в виде растворов, суспензий, эмульсии, таблеток, драже, капсул, порошков, препаратов длительного высвобождения и подобных им. Примеры приемлемых фармацевтических носителей описаны в "Remington's Pharmaceutical Sciences" E.W. Martin.
Композиция по изобретению может быть получена в виде нейтрального вещества или в виде соли. Фармацевтически приемлемые соли включают такие образованные свободными аминогруппами соли, как производные хлористоводородной, фосфорной, уксусной, щавелевой, винной кислот и т.д., и такие образованные свободными карбоксильными группами соли, как производные изопропиламина, триэтиламина, 2-этиламиноэтанола, гистидина, прокаина, гидроксидов натрия, калия, аммония, кальция, железа и т.д.
Эффективное для предполагаемого применения в лечебных целях количество композиции по изобретению можно определять стандартными клиническими способами на основе настоящего описания. Кроме того, для определения оптимальных диапазонов доз можно, не обязательно, применять анализы in vitro. В целом, приемлемые для внутривенного введения диапазоны доз, как правило, приблизительно составляют 20-500 микрограмм активного соединения на килограмм массы тела. Как правило, приемлемые для интраназального введения диапазоны доз составляют приблизительно от 0,01 пг/кг массы тела до 1 мг/кг массы тела. Величины эффективных доз можно получить экстраполяцией кривых доза-ответ, полученных in vitro или из систем проверки на животных моделях.
Терапевтически эффективную дозу для системного введения первоначально можно оценивать, основываясь на анализах in vitro. Например, дозу для достижения диапазона циркулирующих концентраций, включающего IC50, определенную на культуре клеток, можно составлять на животных моделях. Такую информацию можно применять для более точного определения пригодных для человека доз. Также первоначальные дозы можно оценивать на основе данных, полученных in vivo, например, на животных моделях, применяя хорошо известные в данной области способы. Основываясь на данных животных моделей, специалист в данной области может легко подобрать оптимальное введение лекарственного средства человеку.
Чтобы обеспечить достаточный для поддержания терапевтического эффекта уровень соединений в плазме, количество дозы и интервал между ними можно определять индивидуально. В случаях местного введения или избирательного усвоения эффективная местная концентрация соединений может не соотносится с концентрацией в плазме. Специалист в данной области может без лишних экспериментов определить оптимальные терапевтически эффективные местные дозы.
Количество вводимого соединения, конечно, зависит от индивидуума, которому проводят лечение, от массы индивидуума, тяжести заболевания, способа введения и оценки назначающего лечение терапевта. Лечение можно периодически повторять, пока симптомы выявляют или даже когда их не выявляют. Лечение можно проводить в отдельности или в сочетании с другими лекарственными средствами.
Наборы
Также изобретение предоставляет набор, включающий упаковочный материал и содержащееся в упаковочном материале фармацевтическое средство, где фармацевтическое средство содержит по меньшей мере один антагонист VEGF и по меньшей мере одно антипролиферативное средство и где упаковочный материал содержит ярлык или листок-вкладыш, в котором указано, что антагонист VEGF и антипролиферативное средство можно применять для лечения злокачественных опухолей или снижения роста опухоли.
Частные варианты осуществления
Как указано в примере 1, для мышей, которым вводили инокуляцией клетки OVCAR3, проводили лечение только индифферентным веществом (в качестве контроля), только ловушкой VEGF, только ТаксоломTM или ловушкой VEGF вместе с ТаксоломTM. Из результатов следовало, что у мышей, получавших ловушку VEGF в отдельности или в сочетании с ТаксоломTM, отсутствовал доступный наблюдению асцит. Сочетание ловушки VEGF с ТаксоломTM приводило к повышению подавления опухоли на 97%, и мыши, которым проводили комбинированное лечение, выглядели такими же здоровыми и свободными от побочных эффектов, как обычные, не имеющие опухоли животные. Также в этом эксперименте было выявлено, что добавление ловушки VEGF ведет к уменьшению необходимого для достижения ингибирования роста опухоли количества антипролиферативного средства. Кроме того, как описано в примере 2, три из пяти животных, которым проводили комбинирование лечение (60%), остаются живыми и здоровыми на этот момент времени, после завершения периода лечения.
Другие признаки изобретения будут очевидны в ходе последующих описаний примеров осуществлений, иллюстрирующих изобретение и не подразумевающих его ограничения.
ПРИМЕРЫ
Следующий пример приведен для предоставления специалистам в данной области полной информации и описания осуществления и применения способов и композиций по изобретению и не подразумевает ограничения объема того, что авторы рассматривают в качестве своего изобретения. Предпринимали меры для обеспечения точности в отношении используемых чисел (например, количеств, температуры и т.д.), но следует принимать во внимание некоторые экспериментальные ошибки и отклонения. Доли представляют собой массовые доли, молекулярная масса представляет собой среднюю молекулярную массу, температура представляет собой температуру по стоградусной шкале Цельсия и давление представляет собой атмосферное или близкое к нему.
Пример 1. Лечение опухоли с применением ловушки VEGF с Таксолом TM и без него
Схема эксперимента. Два эксперимента, каждый с 4 группами безтимусных самок голых мышей (5-7 недель, 20 мышь/эксперимент, общее n=40), которым инокуляцией внутрибрюшинно вводили клетки OVCAR3. Через две недели после инокуляции 1 группе, в течение 4 недель, вводили подкожно ловушку VEGF, два раза в неделю, и внутрибрюшинно паклитаксел, три раза в неделю. Второй группе вводили только ловушку VEGF. Третьей группе вводили только паклитаксел. Оставшейся группе вводили индифферентное вещество. В конце экспериментов мышей подвергали эвтаназии, измеряли объем асцитической жидкости и удаляли и взвешивали всю видимую опухоль.
Контроль роста опухоли. По сравнению с контрольными образцами при применении ловушки VEGF с паклитакселом выявлено достоверное уменьшение опухолевой массы на 97,7% (p<0,01). В группах, где применяли только ловушку VEGF и только паклитаксел, по сравнению с контрольными образцами выявлено уменьшение опухолевой массы на 55,7% (p<0,05) и 54,8% (p<0,05) соответственно (фиг.1) (таблица).
Контроль развития асцита. В группах, где проводили комбинированное лечение или лечение только ловушкой VEGF, асцит, по существу, не развивался (фиг.2). По сравнению с контрольными образцами при применении только паклитаксела выявлено достоверное снижение развития асцита на 85,5% (p<0,01). В морфологических исследованиях показали, что в группе, где применяли ловушку VEGF с паклитакселом, бледные пятнистые опухоли были в значительной степени некротизированы и лишены сосудов. Девяносто процентов мышей в контрольной группе, в которой не проводили лечение, и группе, где применяли только ловушку VEGF, и 80% мышей в группе, где применяли только паклитаксел, имели опухоли на диафрагме. Девяносто процентов мышей в контрольной группе и 60% мышей в группах, где применяли только ловушку VEGF и только паклитаксел, имели опухоли в воротах печени. Однако в группах, где применяли сочетание ловушки VEGF с паклитакселом, опухолей в этих участках не выявили. Внешний вид и поведение мышей из группы, где применяли ловушку VEGF с паклитакселом, зрительно не отличались от таковых у обычных мышей того же возраста, которым не проводили инокуляцию. Эти данные позволяют предположить, что комбинированное лечение ловушкой VEGF с паклитакселом может представлять собой эффективный способ значительного уменьшения как опухолевой массы, так и развития асцита при распространенном эпителиальном раке яичника с минимально заметными побочными эффектами.
| Taxol TM | Ловушка VEGF | Ловушка VEGF+ Taxol TM | |
| % снижения развития асцита | 85,4 | 96,5 | 100 |
| % уменьшения опухолевой массы | 55,9 | 56,7 | 97,7 |
Пример 2. Влияние на время выживания лечения с применением ловушки VEGF с Таксолом TM и без него
В исследовании выживания двум группам безтимусных мышей вводили инокуляцией клетки клеточной линии рака яичника человека и через две недели вводили в течение четырех недель сочетание ловушки VEGF c паклитакселом или индифферентное вещество (в качестве контроля), как описано выше в примере 1. Однако вместо умерщвления мышей в конце четырех недель их наблюдали в течение 110 дней со времени инокуляции раковой клетки или до возникновения необходимости в эвтаназии. Всех мышей из контрольной группы подвергали эвтаназии через 5-13 суток после прекращения лечения. Наоборот, в группе мышей, где применяли ловушку VEGF с паклитакселом, три из пяти мышей в первой группе остаются живыми на 110 сутки после инокуляции раковой клетки (68 сутки после прекращения лечения) с обычными приемом пищи и физическим поведением. Одна из них имеет в области инокуляции опухоль 0,5×0,6 мм. Четвертую мышь, имевшую опухоль вокруг трахеи вследствие дыхательной недостаточности, подвергали эвтаназии на 89 сутки после инокуляции раковой клетки и пятую, имевшую геморрагический асцит и опухолевую массу 0,53 г, подвергали эвтаназии на 81 сутки после инокуляции раковой клетки. Поведение мышей второй группы, в настоящее время исследуемой на выживание, сходно с таковым в первой группе.
Настоящее изобретение можно осуществить другими специфическими способами, не отходя от существа или его неотъемлемых свойств.
1. Применение сочетания антагониста фактора роста эндотелия сосудов (VEGF) и антипролиферативного средства, предназначенного для лечения злокачественной опухоли, для приготовления лекарственного средства для лечения злокачественной опухоли, где антагонист VEGF представляет собой ловушку VEGF, выбранную из VEGFR1R2-FcΔC1 (а) и Flt1D2. Flk1D3. FcΔC1 (a), при этом антипролиферативное средство представляет собой средство, стабилизирующее микротрубочки, выбранное из группы, включающей паклитаксел, доцетаксел или их производные, аналоги, или их смесь, или антипролиферативное средство представляет собой химиотерапевтическое средство на основе платины, выбранное из группы, включающей цисплатин, карбоплатин и ипроплатин.
2. Применение по п.1, где антагонист VEGF представляет собой VEGFR1R2-FcΔC1 (а), и антипролиферативное средство представляет собой паклитаксел или доцетаксел.
3. Применение по п.1 или 2, где индивидуумом является человек.
4. Применение сочетания антагониста VEGF и антипролиферативного средства для приготовления лекарственного средства, уменьшающего рост опухоли у индивидуума, где антагонист VEGF представляет собой ловушку VEGF, выбранную из VEGFR1R2-FcΔCl (а) и Flt1D2. Flk1D3. FcΔC1(a), при этом антипролиферативное средство представляет собой средство, стабилизирующее микротрубочки, выбранное из группы, включающей паклитаксел, доцетаксел или их производные, аналоги, или их смесь, или антипролиферативное средство представляет собой химиотерапевтическое средство на основе платины, выбранное из группы, включающей цисплатин, карбоплатин и ипроплатин.
5. Способ ингибирования или уменьшения роста опухоли у нуждающегося в этом индивидуума, включающий введение индивидууму антагониста фактора роста эндотелия сосудов (VEGF), в сочетании с антипролиферативным средством, ингибируя рост опухоли, где антагонист VEGF представляет собой ловушку VEGF, выбранную из VEGFR1R2-FcΔC1 (а) и Flt1D2. Flk1D3. FcΔC1(a), при этом антипролиферативное средство выбирают из группы, включающей паклитаксел, доцетаксел или их производные, аналоги, или смесь паклитаксела и химиотерапевтического средства на основе платины, выбранного из группы, включающей цисплатин, карбоплатин и ипроплатин.
6. Фармацевтическая композиция, содержащая антагонист фактора роста эндотелия сосудов (VEGF), антипролиферативное средство и фармацевтически приемлемый носитель, в которой антагонист VEGF представляет собой ловушку VEGF, выбранную из VEGFR1R2-FcΔC1 (а) и Flt1D2. Flk1D3. FcΔC1(a), при этом антипролиферативное средство представляет собой средство, стабилизирующее микротрубочки, выбранное из группы, включающей паклитаксел, доцетаксел или их производные, аналоги, или их смесь, или антипролиферативное средство представляет собой химиотерапевтическое средство на основе платины, выбранное из группы, включающей цисплатин, карбоплатин и ипроплатин.
7. Применение сочетания антагониста VEGF и химиотерапевтического средства для лечения злокачественной опухоли, где сочетание снижает количество химиотерапевтического средства, необходимое для достижения желаемого эффекта, для приготовления лекарственного средства для лечения злокачественной опухоли, где антагонист VEGF представляет собой ловушку VEGF, выбранную из VEGFR1R2-FcΔC1 (а) и Flt1D2. Flk1D3. FcΔC1(a), при этом антипролиферативное средство представляет собой средство, стабилизирующее микротрубочки, выбранное из группы, включающей паклитаксел, доцетаксел или их производные, аналоги, или их смесь, или антипролиферативное средство представляет собой химиотерапевтическое средство на основе платины, выбранное из группы, включающей цисплатин, карбоплатин и ипроплатин.
8. Применение по п.7, где необходимое для достижения желаемого терапевтического эффекта количество химиотерапевтического средства снижено по меньшей мере на 20%.
9. Применение по п.8, где необходимое для достижения желаемого терапевтического эффекта количество химиотерапевтического средства снижено приблизительно на 30-50%.
10. Набор для лечения злокачественной опухоли, содержащий:(a) упаковочный материал; и(b) содержащееся в упаковочном материале фармацевтическое средство, где фармацевтическое средство содержит по меньшей мере одну дозу ловушки фактора роста эндотелия сосудов (VEGF) и по меньшей мере одно антипролиферативное средство, и где на упаковочном материале указано, что антагонист VEGF и антипролиферативное средство можно применять для лечения злокачественной опухоли или уменьшения роста опухоли, при этом антагонист VEGF представляет собой ловушку VEGF, выбранную из VEGFR1R2-FcΔC1 (а) и Flt1D2. Flk1D3. FcΔC1(a), и антипролиферативное средство представляет собой средство, стабилизирующее микротрубочки, выбранное из группы, включающей паклитаксел, доцетаксел или их производные, аналоги, или их смесь, или антипролиферативное средство представляет собой химиотерапетвическое средство на основе платины, выбранное из группы, включающей цисплатин, карбоплатин и ипроплатин.Приоритет по п.10 установлен от 23.07.2004.