Способ продления жизни больных прионными болезнями
Иллюстрации
Показать всеИзобретение относится к ветеринарии, а именно к лечению животных, больных таким инфекционным заболеванием как скрейпи, которое относится к прионным болезням. Для этого животному вводят экстракт бересты. Введение экстракта способствует задержке снижения массы тела и продлению жизни животного. 7 табл., 5 ил.
Реферат
Изобретение относится к области медицины и ветеринарии и более конкретно оно относится к изысканию средств, которые могли бы быть использованы по крайней мере для увеличения продолжительности жизни людей и животных, инфицированных прионами.
Прионы (сокращение от английских слов «protein infections» - белок инфекционный) являются новым классом инфекционных патогенов, открытие и изучение которых произошло и осуществляется лишь в последние 50 лет, хотя заболевания, ныне относимые к прионным, известны у животных более 200 лет, а у людей - с начала XX века.
Прионы отличаются от всех прочих инфекционных патогенов (вирусов, бактерий и др.) тем, что у них отсутствует какой-либо геном, то есть ДНК или РНК. Предполагается, что именно такие инфекционные агенты вызывают группу неизлечимых дегенеративных заболеваний центральной нервной системы человека и животных. Наиболее известные из них у человека - это болезнь Крейтцфельдта-Якоба (БКЯ) и синдром Гертсмана-Штраусслера-Шейнкера (ГШШ), а у животных - скрейпи овец и губчатая энцефалопатия крупного рогатого скота, называемые иногда в средствах массовой информации чесоткой овец и коровьим бешенством или губчатым энцефалитом. Эти заболевания, независимо от того, у кого они возникли - у человека или животных, сопровождаются морфологическими изменениями тканей мозга и появлением в них амилоидоподобных бляшек, содержащих палочкообразные белковые агрегаты. Уникальная особенность этих заболеваний состоит в том, что они возникают не только в результате инфекции: известны спорадические и наследственные БКЯ и ГШШ, причем вне зависимости от своего происхождения болезнь может передаваться далее инфекционным путем.
По данным Всемирной организации здравоохранения (ВОЗ) и Международного эпизоотического бюро за 1986-2000 годы зарегистрировано около 200 тысяч случаев спонгиоформной энцефалопатии крупного рогатого скота, а также выявлено 85 случаев болезни Крейтцфельдта - Якоба у людей молодого возраста.
Несмотря на крупномасштабные исследования прионов, отмеченные двумя нобелевскими премиями (К.Гайдушек - 1976 г. и С.Прузинер - 1997 г.) до сих пор многие аспекты возникновения и развития прионных инфекций не ясны (продление возбудителем межвидового барьера, патогенная картина заболевания и др.). Нет также каких-либо сведений о средствах профилактики и лечения прионных болезней.
Авторами настоящего изобретения была неожиданно обнаружена способность продлевать жизнь животных, зараженных скрейпи, у такого природного продукта, как экстракт верхнего слоя коры березы - бересты, что позволяет рассматривать его как перспективнвное средство для профилактики прионных инфекций и для лечения людей и животных, больных прионными болезнями.
Исследования проводились на модельных животных - сирийских хомячках, которые инфицировались скрейпи. Использовался экстракт бересты производства ООО «Березовый мир» (г.Москва). Основным компонентом экстракта (свыше 70%) является бетулин.
Материалы и методы исследования
В качестве лабораторной модели использовали 25 сирийских хомячков 3-х недельного возраста, обоего пола, массой 25-30 г.
Каждое животное, находящееся в опыте, было идентифицировано по окраске и/или с помощью красителя - бриллиантового зеленого. Животных разбили на 3 группы: две (1-я и 2-я) - контрольные, одна (3-я) - опытная.
1-я группа (контроль безвредности препарата, 5 особей). Животных разделили на 2 клетки: группа 1 а - 3 хомячка (получали испытуемый препарат) и группа 16-2 хомячка (не получали препарат). Животные содержались в другом помещении отдельно от хомячков других групп.
2-я группа (контроль экспериментальной инфекции, 10 особей). Животных содержали в 2-х клетках по 5 хомячков в каждой. Все животные - самки.
3-я группа - опытная (10 особей)
Все животные данной группы получали испытуемый препарат по выбранной лечебно-профилактической схеме. Животных содержали в 2-х клетках по 5 хомячков в каждой. Одна клетка - 5 самок, другая - 5 самцов.
В качестве возбудителя скрейпи использовали штамм 263 К, хранившийся при -20°С. Возбудитель прошел 2 пассажа на сирийских хомячках. Инфекционный титр - 6,5 Ig LD50/мл;
Схема проведения эксперимента включала:
1) Введение испытуемого препарата с профилактической целью.
2) Экспериментальное заражение контрольных и опытных животных возбудителем скрейпи.
3) Введение испытуемого препарата с лечебной целью.
4) Прижизненные и посмертные исследования животных опытной и контрольных групп.
Испытуемый препарат разводили на жидком крахмале и вводили хомячкам перорально (через зонд) из расчета 100 мкг/г веса животного по следующей лечебно-профилактической схеме: 5 раз до инфицирования возбудителем скрейпи, 5 раз спустя 35 дней после инфицирования и 5 раз в терминальной стадии болезни.
Препарат дважды вводили 3 хомячкам группы 1а (контроль безвредности препарата) и 10 хомячкам группы 3. Животным группы 1а (2 хомячка) и группы 3 (5-ти хомячкам, оставшимся в живых), находящимся в терминальной стадии заболевания, препарат вводили дополнительно (5 раз в течение 5 дней). При этом 2 хомяка (самцы) погибли уже после 2 введений препарата, 3 хомячка (самки) получили препарат в полном объеме.
Экспериментальное заражение контрольных и опытных животных.
Подготовка инфекционного материала.
Стерильно из центра мозга хомячка с экспериментальной инфекцией скрейпи отбирали 3 г образца, растирали в стерильной ступке и разводили в 2,7 мл раствора Хенкса с антибиотиками (100 ед. стрептомицина). Материал переносили в стерильный флакон и центрифугировали на настольной угловой центрифуге при 2000 об/мин в течение 15 мин. Из отобранной после центрифугирования надосадочной жидкости брали 0,3 мл раствора и разводили в 2,7 мл раствора Хенкса (разведение 10-2) и использовали непосредственно для заражения.
Сирийских хомячков (группы 2 и 3) заражали приготовленной ex tempore суспензией мозга хомячка с экспериментальной инфекцией скрейпи в разведении 10-2 на растворе Хенкса в объеме 0,03 мл на животное (примерно 100 летальных доз). Животных инфицировали интрацеребрально путем введения в правую гемисферу большого мозга под легким эфирным наркозом. Контрольным животным (группа 1) вводили по 0,03 мл суспензии мозга интактных животных (разведение 10-2), приготовленной, как описано выше.
Вся работа с лабораторными животными проводилась в соответствии с рекомендациями ВОЗ.
Продолжительность эксперимента: 4,5 месяца (9 августа-24 декабря 2004 г.).
Прижизненные исследования животных.
Включали в себя контроль за поведением, внешним видом и весом животных: Взвешивание хомячков осуществляли с использованием электронных весов ВЭ-15И (ОАО «Масса», С.-Петербург, Россия), утром, до кормления, с периодичностью 3-4 дня (2 раза в неделю).
Экспериментальных животных оценивали по следующим признакам:
1. Неспецифические признаки:
- состояние кожного покрова (волосяного покрова, блеск, тусклость, наличие и характер лишенных волос участков);
- состояние слизистых (глаза, ротовая полость, целостность, наличие эрозий, язв, рубцов, кровоизлияний);
- подвижность;
- аппетит.
2. Специфические признаки:
Начальная стадия:
изменение поведения (неадекватная реакция на внешние раздражители (свет, звук, прикосновение, причинение боли)
- возбуждение или заторможенность реакций. Стадия развития неврологической симптоматики заболевания:
- нарушение двигательных функций (нарушение координации, тремор, нарушение походки, слабость в конечностях, парезы);
- резкое похудание (кахексия).
Терминальная стадия (необратимые изменения):
- неподвижность;
- паралич конечностей и дыхательных мышц.
Посмертные исследования животных.
1) Гистологические исследования.
У экспериментальных животных находящихся в последней фазе терминальной стадии заболевания под глубоким эфирным наркозом стерильно забирали головной мозг и селезенку и помещали либо в 4% раствор нейтрального формалина (для гистологических исследований), либо в морозильник на -20°С.
Гистологические препараты готовили по общепринятой методике. Из головного мозга вычленяли кусочки ткани из различных его отделов: коры полушарий большого мозга, подкорковых ядерных групп, мозжечка, продолговатого и спинного мозга. Готовили парафиновые препараты, стандартным способом получали срезы и окрашивали их гематоксилином и эозином и Конго красным.
Результаты анализировали в световом микроскопе «Biostar» (США) при увеличении в 200-600 раз.
2) Иммуноблоттинг (ИБ). Иммунологическое обнаружение возбудителя скрейпи в ЦНС экспериментальных животных осуществляли с использованием тест-системы «Prionics-Check Western» (Phonics AG, Швейцария). Положительным контролем служил положительный антиген тест-системы. В качестве первичных моноклональных антител использовали моноклональные антитела к белку PrP: прилагаемые к тест-системе мышиные анти-PrP IgG1 (рабочее разведение 1:5000), Am 308 (аналог коммерческих антител Am 3F4, титр 1:5000) и Am 6H4 (титр 1:5000). Работу с тест-системой осуществляли согласно инструкции исполнителя.
Статистическая обработка результатов.
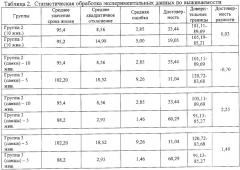
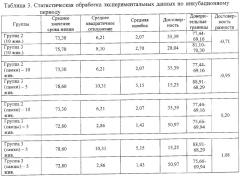
При статистической обработке экспериментальных данных вычисляли среднеарифметические величины, их доверительные интервалы и проводили оценку достоверности различий числовых результатов по критерию Стьюдента. Разницу считали статистически достоверной при р<0,05.
Прижизненные исследования животных
Клиническая картина заболевания у опытных (2 и 3-я группы) и контрольных (1-я группа) животных с экспериментальным скрейпи.
Развитие экспериментального скрейпи изучали у 20 сирийских хомячков (группа 2 и 3).
Ежедневное наблюдение за опытными животными не выявило изменений со стороны шерстяного покрова у опытных и контрольных животных в течение 2-2,5 месячного срока. На 10-12 неделях наблюдения у опытных животных была отмечена некоторая вялость, взъерошенность шерстяного покрова и снижение двигательной активности, сопровождающееся потерей аппетита. На 16-й неделе у экспериментально зараженных хомячков наблюдали выпадение шерсти и сильный тремор головы. В этот период опытные животные значительно отличались в развитии от контрольных: вес тела снижался на 20-40%, постепенно прогрессировала слабость задних конечностей, парезы. Животные при движении опрокидывались на спину и с трудом принимали прежнее положение тела. Отмечали замедленную реакцию на раздражители. Продолжительность инкубационного периода составила 3-3,5 месяца, продолжительность заболевания составляла 0,5-1,5 месяца. Основными симптомами развития экспериментального скрейпи являлись: выпадение шерсти, атрофия мышц, тремор, развитие парезов конечностей и туловища. При этом летальность среди инфицированных хомячков к концу срока наблюдения составила 95% (пало 19 животных из 20 под наблюдением). Как правило, развитию неврологической симптоматики предшествовало: снижение веса (до 40% от максимального). Среди контрольных животных (группа 1) гибели не отмечено.
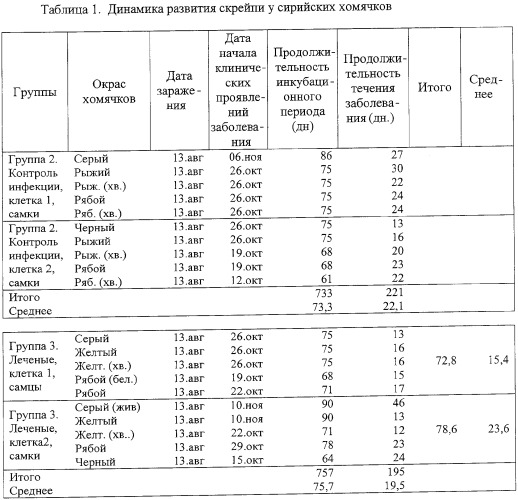
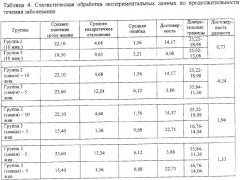
Обобщенные данные по развитию скрейпи в группах 2 и 3 представлены в таблице 1.
Как видно из таблицы 1, введение препарата не влияет на показатели инкубационного периода и на продолжительность развития специфической симптоматики скрейпи у сирийских хомячков (р>0,05). Отмечена разница у самцов и самок по чувствительности к скрейпи. Самцы гибли быстрее, поэтому в качестве основного критерия при сравнении показателей контрольных и опытной групп животных были взяты однополые животные - самки.
Расчеты достоверности полученных результатов представлены в таблицах 2-5.
Изучение динамики массы тела сирийских хомячков с экспериментальным скрейпи.
Первичные данные по динамике массы тела сирийских хомячков групп 1, 2 и 3 представлены в Таблице 6.
Графические изменения массы тела (средний показатель группы) у хомячков, не получавших (группа 2) и получавших испытуемый препарат (группа 3), в сравнении с массой тела контрольных хомячков показаны на фиг.1. Сравнение кривых динамики потери массы тела самок и самцов групп 2 и 3 представлено на фиг.2, 3 и 4.
Видно, что применение испытуемого препарата по лечебно-профилактической схеме у хомячков группы 3 приводило к задержке потери массы тела более чем на 2 недели, по сравнению с хомячками группы 2 (22 октября и 8 октября соответственно).
Введение препарата третий раз 5 хомячкам группы 3, находящимся в последней фазе терминальной стадии развития заболевания, привело к замедлению падения массы тела и сроков гибели 3-х самок опытных животных, по сравнению с аналогами группы 2.
Выживаемость сирийских хомячков с экспериментальным скрейпи. Обобщенные данные по срокам жизни сирийских хомячков с экспериментальным скрейпи представлены в таблице 7.
Как видно из таблицы 7, сроки жизни хомячков групп 2 и 3 варьируют в широких пределах, средние показатели практически идентичны (р>0,05), если не принимать во внимание пол животных.
Однако отмечена разница по срокам жизни у самок сирийских хомячков 2-й и 3-й групп. Самки группы 2 погибали в среднем на неделю раньше, чем самки группы 3, получавшие испытуемый препарат. Следует подчеркнуть, что одно животное (самка, серый окрас), получавшее препарат, продолжало жить еще 3 недели после завершения эксперимента.
Самцы сирийских хомячков более чувствительны к скрейпи, чем самки. Они погибали в среднем на неделю раньше, чем зараженные самки.
Посмертные исследования животных
Гистологические исследования мозга сирийских хомячков с экспериментальным скрейпи.
Для исследования брали мозг животных, находящихся в последней фазе терминальной стадии заболевания. Исследовали по одному животному каждой группы.
У животных, находящихся в терминальной стадии заболевания, отмечены специфические изменения, характерные для инфекции скрейпи: спонгиоформные изменения в корковом слое и гиппокампе, гибель нейронов, диффузная пролиферация астроглии, субэпендимарный глиоз, амилоидоз стенок сосудов и другие. Отмечено образование амилоидных бляшек непосредственно в ткани ЦНС.
Обнаружение PrPSc в ЦНС сирийских хомячков с экспериментальным скрейпи методом иммунного блоттинга.
РгРSc отличается от нормального PrPc по устойчивости к протеазе К: после обработки протеазой нормальная форма PrP разрушается, в то время как молекулярный вес PrPSc уменьшается от его первоначального размера 32-35 kD к меньшему размеру 27-30 kD. Остающийся протеазо-устойчивый фрагмент PrPSc выявляется иммуноблотингом как PrP27-30 (фиг.5).
Иммунологическое обнаружение возбудителя скрейпи в образцах мозга экспериментальных животных осуществляли, как описано выше.
В качестве первичных антител использовали моноканальные антитела 308 (аналог 3F4), титр 1:5000.
Изложенные результаты исследований позволяют заключить, что испытуемый препарат (экстракт бересты) является безвредным и не оказывает патологического воздействия на организм хомячков. Все животные 1-й контрольной группы были клинически здоровыми в течение всего периода наблюдения.
При интрацеребральном заражении сирийских хомячков заболевание скрейпи развивается специфически. Инкубационный период в среднем составил у животных в группе 2 - 73,3±6,21 дней, в группе 3 - 75,7±8,10 дней (самцы - 72,8±2,86 дней, самки - 78,6±10,31 дней). Продолжительность развития болезни до гибели животных в группах 2 и 3 составила 22,1±4,68 и 19,5±9,63 (самцы - 15,4±1,36 и самки - 23,6±12,24) дней соответственно.
Основными симптомами развития экспериментального скрейпи являлись: снижение массы тела, выпадение шерсти, атрофия мышц, тремор, развитие парезов конечностей. Потеря веса у животных наблюдалась за 1-3 недели до развития клинических проявлений заболевания. Летальность среди инфицированных хомячков к концу срока наблюдения составила 95% (пало 19 животных из 20 инфицированных).
Посмертные исследования животных гистологическим методом и идентификация возбудителя в иммуноблоттинге подтвердили эффективность экспериментального заражения животных 2-й и 3-й групп. Гистологическими исследованиями подтверждено наличие специфических морфологических маркеров развития скрейпи в ЦНС сирийских хомячков. В корковом слое головного мозга отмечена гибель нейронов, спонгиоз, пролиферация астроглии и астроглиоз, амилоидоз. Прионный белок PrPSc был обнаружен в ЦНС сирийских хомячков с экспериментальным скрейпи в группах 2 и 3.
Использование испытуемого препарата с лечебно-профилактической целью показало следующее (сравнение самок 2-й группы с самками 3-й).
Отмечена 2-недельная задержка снижения массы тела у животных, получавших испытуемый препарат, по сравнению с хомячками, не получавшими препарат. Причем самки теряли вес на 3 недели позже, чем контрольные аналоги, а самцы - на 1 неделю.
Установлено, что продолжительность жизни самок группы 3, получавших испытуемый препарат, была в среднем на 1 неделю больше, чем у аналогов группы 2. При этом после третьего введения испытуемого препарата в терминальной стадии болезни одна самка продолжала жить еще 21 день.
Посмертные изменения были аналогичны у животных обеих групп.
На основании результатов проведенных экспериментов можно сделать общее заключение о том, что в остром опыте было отмечено воздействие испытуемого препарата на организм экспериментально зараженных хомячков. Эффект воздействия заключался в задержке времени начала снижения массы тела у опытных животных и увеличении продолжительности их жизни.
Способ продления жизни животного, инфицированного скрейпи, путем введения ему экстракта бересты.