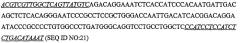Способы лечения неврологических состояний с применением гематопоэтических факторов роста
Иллюстрации
Показать всеИзобретение относится к области медицины и касается способов лечения неврологических состояний с применением введения гематопоэтических факторов роста. Сущность изобретения включает G-CSF или его функционально активный вариант, который на 90% идентичен последовательности G-CSF человека, представленной в SEQ ID NO: 28 для применения в способе лечения амиотрофического бокового склероза. Преимущество изобретения заключается в создании нейропротекции вовлеченных в заболевание нейронных клеток. 1 з.п. ф-лы, 1 табл. 41 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу лечения неврологических состояний у млекопитающего путем введения гематопоэтического фактора роста, такого как гранулоцитарный колониестимулирующий фактор (GCSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GMCSF), и/или других гематопоэтических факторов, например MCSF, за исключением эритропоэтина (EPO). Настоящее изобретение также относится к способам скрининга соединений, связывающихся с рецептором GCSF или MCSF, обнаруженным на поверхности нервной клетки; и которые обеспечивают нейропротективную, нейропролиферативную активность и/или активность по активации STAT гена.
Уровень техники
Факторы роста представляют собой белки, которые по существу участвуют в регуляции жизнеспособности, пролиферации, созревания и роста развивающихся нейрональных клеток. Например, экспрессия большого числа факторов роста повышается в ответ на различные типы мозговых инсультов. Многие факторы обладают эндогенными нейропротективными и нейротропными эффектами (см. Arvidsson A et al., Neurosciense 2001; 106:27-41; Larsson E. et al., J .Cereb. Blood Flow Metab 1999;19:1220-8; Mattison MP. et al., J Neurotrauma 1994; 11:3-33; Semkova I, et al., Brain Res Rev 1999; 30:176-88). О таких эффектах также сообщали после экзогенного введения in vitro и in vivo после травмы головного мозга и инсульта (см. Semkova I., et al., Brain Res Rev 1999; 30:176-88; Fisher M., et al., J.Cereb. Blood Flow Metab 1995;15:953-9; Schabitz WR, et al., Stroke 2001; 32:1226-33; Schabitz WR, et al., Stroke 2000; 31:2212-7). После связывания с высокоаффинными мембранными рецепторами воздействие факторов роста опосредуется каскадом событий внутриклеточной передачи сигналов (Kernie SG, et. al., Arch Neurol. 2000; 57:654-7), стимулирующим рост и дифференцировку клеток или обеспечивающим питание для жизнеобеспечения клеток.
Гранулоцитарный колониестимулирующий фактор (GCSF) представляет собой белок размером 20 кДа, который вместе с фактором некроза опухоли-α (TNF-α) и интерлейкинами является представителем цитокинового семейства факторов роста. GCSF представляет собой основной фактор роста, участвующий в продукции нейтрофильных гранулоцитов.
GCSF проявляет свою функцию посредством активации мембранного рецептора (рецептора GCSF), принадлежащего к суперсемейству рецепторов гематопоэтинов, обозначаемых также как рецепторы цитокинов I класса (de Koning and Touw, Curr. Opin. Hematol., 1996, 3, 180-4).
Обнаружено, что ряд рецепторов лимфокинов, гематопоэтических факторов роста и молекул, родственных гормону роста, обладают общим связывающим доменом. Данные рецепторы называют рецепторами гематопоэтинов, а соответствующие лиганды - гематопоэтинами. Кроме того, гематопоэтины подразделяются на две основных структурных группы: большие/длинные и малые/короткие гематопоэтины. Одна подгруппа отдельных рецепторных цепей, которые являются частью рецепторных комплексов крупных гематопоэтинов, содержит в своих внеклеточных частях общие структурные элементы: иммуноглобулин-подобный домен, домен рецептора гематопоэтина и три домена фибронектина типа III (2 в лептиновом рецепторе). Данную подгруппу обозначили как "семейство рецепторов gp130" (Mosley, et.al., J.Biol. Chem. 1996, 271, 32635-43), и она включает в себя лептиновый рецептор (LPTR), рецептор гранулоцитарного колониестимулирующего фактора (GCSFR), общую бета-цепь интерлейкина-6/-11/LIF/OSM/CNTF (GP130), рецептор ингибирующего лейкоз фактора (LIFR), бета-цепь рецептора онкостатина-М (OSMR), бета-1-цепь рецептора интерлейкина-12 (IL12RB1), бета-2-цепь рецептора интерлейкина-12 (IL12RB2). Данные рецепторные цепи при связывании с узнаваемым цитокином образуют гомодимеры (GCSFR, GP130, LPTR) или гетеродимеры (GP130 с LIFR или OSMR, IL12RB1 с IL12RB2). Кроме того, характеристикой данного семейства рецепторов является консенсусная структура prosite:
N-x(4)-S-x(28,35)-[LVIM]-x-W-x(0,3)-P-x(5,9)-[YF]-x(1,2)-[VILM]-x-W (SEQ ID № 1)
GCSF стимулирует пролиферацию, жизнеспособность и созревание клеток, коммитированных в направлении линии нейтрофильных гранулоцитов посредством связывания со специфическим рецептором GCSF (GCSFR) (см. Hartung T., et al., Curr. Opin. Hematol. 1998; 5:221-5). Опосредованный GCSFR сигнальный путь активирует семейство белков переносчиков сигнала и активаторов транскрипции (STAT), перемещающихся в ядро и регулирующих транскрипцию (Darnell JE Jr., Science 1997; 277:1630-5). GCSF, как правило, применяют для лечения различных видов нейтропении у людей. Он представляет собой один из немногих факторов роста, одобренных для клинического применения. В частности, его применяют для снижения вызванной химиотерапией (ХТ) цитопении (Viens et al., J. of Clin. Oncology, Vol. 20, No. 1, 2002:24-36). GCSF также применяют для лечения инфекционных заболеваний как потенциальное дополнительное средство (Hubel et al., J. of Infectious Diseases, Vol. 185:1490-501, 2002). Сообщалось, что GCSF кристаллизован до некоторой степени (EP 344 796) и что предположена общая структура GCSF, но только и в грубом приближении (Bazan, Immunology Today 11:350-354 (1990); Parry et al., J. Molecular recognition 8: 107-110 (1988)).
В последние годы ряд факторов роста, таких как bFGF, и перспективные в фармацевтическом плане вещества, такие как блокаторы адгезии тромбоцитов типа анти-GP IIb/IIa и Abcizimab, протестированы в клинических испытаниях на наличие у них нейропротективного эффекта. К сожалению, ни одно из указанных средств не обладало достаточной нейропротективной эффективностью. В частности, антагонисты NMDA, уловители свободных радикалов и антагонисты глутамата либо являлись неэффективными, либо оказывали серьезные побочные эффекты. Перечень веществ, таких как анти-ICAM или ингибиторы опосредованной глутаматом NO-синтетазы, не способствующие росту, представлен в (De Keyser, et al., (1999), Trends Neurosci, 22, 535-40).
Большинство исследований ишемии головного мозга и тестирования фармакологических веществ in vivo сосредоточены только на непосредственных эффектах лекарственного средства на исследуемую модель (например, размер инфаркта через 24 часа после индукции инсульта). Однако более надежным параметром истинной эффективности конкретного вещества является длительное действие на восстановление функциональной активности, что также отражено в исследованиях инсульта у человека, где шкалы клинической оценки (например, скандинавская шкала оценки, шкала оценки национального института здравоохранения США (NIH), индекс Бартеля) также отражают способность осуществлять ежедневную жизнедеятельность. Восстановление в первые несколько суток после очаговых поражений может происходить вследствие разрешения отека или реперфузии области "ишемической полутени". Большая часть восстановления функции, достигаемая после острой фазы, вероятно, происходит вследствие пластичности головного мозга, где смежные зоны коры головного мозга берут на себя выполнение тех функций, которые ранее выполняли поврежденные участки (Chen R, Cohen LG, Hallett M, Neuroscience 2002; 111(4): 761-73). Два основных механизма, предложенных для объяснения такой перестройки, представляют собой демаскирование ранее существовавших, но функционально неактивных связей и рост новых связей, таких как коллатеральные пучки (Chen R, Cohen LG, Hallett M, Neuroscience 2002; 111(4): 761-73). Краткосрочные пластические изменения опосредованы снятием ингибирования возбуждающих синапсов, что, вероятно, происходит вследствие сниженного ГАМК-эргического ингибирования (Kaas JH. Annu Rev Neurosci. 1991; 14:137-67; Jones EG. Cereb Cortex. 1993 Sep-Oct; 3(5):361-72). Происходящие в течение более длительного периода времени пластические изменения в дополнение к демаскировке латентных синапсов включают в себя такие механизмы, как долговременная потенциация (LTP), требующая активации рецептора NMDA и повышенной внутриклеточной концентрации кальция (Hess and Donoghue, J. Neurophysiol. 1994, 71(6): 2543-7). Долговременные изменения также включают в себя регенерацию аксонов и ростки с изменениями в форме, количестве, размере и типе синапсов (Kaas JH, Annu Rev Neurosci. 1991; 14: 137-67, 3:).
Инсульт представляет собой третью ведущую причину смертности и основную причину инвалидизации на Западе. Он представляет собой большую социально-экономическую проблему. Этиология может являться или ишемической (в большинстве случаев), или геморрагической. Причиной ишемического инсульта, как правило, является эмболия или тромб. До настоящего времени эффективного лечения для большинства пациентов с инсультом не существует. Единственным клинически подтвержденным лекарственным средством до настоящего времени является тканевой активатор плазминогена (ТАП) и аспирин. После массовой гибели клеток непосредственно в очаге инфаркта в связи с недостатком глюкозы и кислорода зона инфаркта со временем расширяется под действием вторичных механизмов, таких как опосредованная глутаматом эксайтотоксичность, механизмы апоптоза и образование свободных радикалов.
Боковой амиотрофический склероз (ALS; болезнь Лу-Герига; болезнь Шарко) представляет собой нейродегенеративное заболевание с частотой заболеваемости от 0,4 до 1,76 на 100000 человек в год (Adams et al., Principles of Neurology, 6th ed., New York, pp. 1090-1095). Он представляет собой наиболее общую форму заболевания моторных нейронов с типичными проявлениями генерализованных фасцикуляций, прогрессирующей атрофии и слабости скелетных мышц, спастичности и пирамидных симптомов, дизартрии, дисфагии и диспноэ. По существу патология заключается в потере нервных клеток в переднем роге спинного мозга и в двигательных ядрах нижней части ствола головного мозга, а также может включать в себя моторные нейроны первого порядка в коре головного мозга. Патогенез данного изнуряющего заболевания до сих пор почти совершенно неизвестен, хотя хорошо изучена роль мутантов по супероксиддисмутазе (SOD1) в семейных случаях, что соответствует гипотезе окислительного стресса. До настоящего времени в белке SOD1 описаны более 90 мутаций, способных служить причиной ALS (Cleveland and Rothstein (2001), Nat Rev Neurosci, 2, 806-19). Кроме того, при данном заболевании показана роль нервных волокон. Эксайтотоксичность, механизм, индуцируемый избыточной стимуляцией глутаматом, также является важным фактором, иллюстрируемым эффективным действием рилузола у человеческих пациентов. Как наиболее убедительно показано у мутантов SOD1, активация каспаз и апоптоза, по-видимому, представляет собой общий заключительный этап патогенеза ALS (Ishigaki et al., (2002), J. Neurochem, 82, 576-84., Li, et al., (2002), Science, 288, 335-9). Следовательно, по-видимому, ALS также удовлетворяет той же общей патогенетической модели, которая также работает при других нейродегенеративных заболеваниях и при инсульте, например участие глутамата, окислительный стресс и программируемая гибель клеток.
Болезнь Паркинсона представляет собой наиболее частое двигательное расстройство, которым страдают приблизительно 1 миллион пациентов в Северной Америке; приблизительно 1 процент населения в возрасте старше 65 лет. Основными симптомами заболевания являются мышечная ригидность, тремор и акинезия (Adams et al., Principles of Neurology, 6th ed., New York, pp. 1090-1095). Этиология болезни Паркинсона неизвестна. Тем не менее, значительная часть биохимических данных, полученных на основании исследований образцов аутопсии головного мозга человека и на животных моделях, указывают на происходящий процесс окислительного стресса в черном веществе, который может инициировать дофаминэргическую нейродегенерацию. Окислительный стресс, как индуцируемый нейротоксинами 6-гидроксидофамином и MPTP (N-метил-4-фенил-1,2,3,6-тетрагидропиридином), применяли на животных моделях для изучения процесса нейродегенерации. Несмотря на существование симптоматической терапии (например, L-ДОФА совместно с ингибитором декарбоксилазы; агонисты дофамина, такие как бромокриптин, перголид; и антихолинергические средства, такие как тригексилфенидил (артан)), существует очевидная потребность в каузативном лечении, например в нейропротективной терапии, которая действительно останавливает прогрессирование заболевания. Данные животные модели применяли для исследования эффективности акцепторов радикалов, хелаторов железа, агонистов дофамина, ингибиторов синтазы оксида азота и определенных антагонистов кальциевых каналов. Отчетливо видно, что в животных моделях, а также у пациентов действуют механизмы апоптоза (Mochizuki et al. (2001), Proc. Natl. Acad. Sci. USA, 98, 10918-23, Xu et al. (2002), Nat. Med. 8, 600-6, Vismanath, et al. (2001), J. Neurosci. 21, 9519-28, Hartmann, et al. (2002), Neurology, 58, 308-10). Данная патофизиология с участием окислительного стресса и апоптоза также включает болезнь Паркинсона в число других нейродегенеративных расстройств и инсульта.
Ишемия головного мозга может возникать в результате множества причин, нарушающих мозговой кровоток (CBF) и ведущих к недостаточности кислорода и глюкозы. С другой стороны, травматическое повреждение головного мозга (TBI) включает в себя участие первичного механического воздействия, которое обычно вызывает перелом черепа и грубо разрушает паренхиму головного мозга с деформацией и разрывом кровеносных сосудов и ткани головного мозга. Это, в свою очередь, запускает каскад событий, характеризующихся активацией молекулярных и клеточных реакций, что ведет ко вторичному повреждению. Развитие такого вторичного повреждения представляет собой активный процесс, в который вовлечено множество биохимических путей (Leker and Shohami (2002), Brain Res. Rev., 39, 55-73). Выявлены многочисленные совпадения между патологическими механизмами, ведущими ко вторичной гибели клеток в зоне частичной ишемии, и патологическими механизмами в области, подвергавшейся вторичному посттравматическому повреждению (например, эксайтотоксичность, при избыточном высвобождении глутамата, оксида азота, реакционно-способных форм кислорода, воспаление и апоптоз (Leker and Shohami (2002), Brain Res. Rev., 39, 55-73)). Кроме того, сообщалось, что после травматического повреждения мозга возникают ранние эпизоды ишемии, добавляя компонент ишемии в первичное механическое повреждение.
Сердечно-сосудистые заболевания представляют собой основную причину смерти в западных развитых странах. В Соединенных Штатах Америки случается примерно один миллион смертельных случаев каждый год, из них примерно 50% связано с внезапной смертью и происходит вне больницы (Zheng, et al. (2001), Circulation, 104, 2158-63). Ежегодно проводят 40-90 сердечно-легочных реанимаций (CPR) на 100000 человек, а восстановление самостоятельного кровообращения (ROSC) достигают у 25-50% указанных пациентов. Однако количество выписавшихся из больницы после удачной ROSC пациентов составляет лишь 2-10% (Bottiger, et al. (1999), Heart, 82, 674-9). Таким образом, в подавляющем большинстве случаев остановок сердца, наблюдаемых ежегодно в Соединенных Штатах, не проводится успешного лечения. Основной причиной низкого уровня выживания после удачной CPR, например уровня внутрибольничной смертности после остановки сердца, является стойкое повреждение головного мозга. Повреждение мозга после остановки кровообращения связано с небольшим периодом толерантности к гипоксическому стрессу и со специфическими расстройствами после реперфузии (Safar (1986), Circulation, 74, IV138-53, Hossmann (1993), Resuscitation, 26, 225-35). На начальной стадии после остановки сердца большее число пациентов можно стабилизировать гемодинамически, однако многие из них умирают в результате поражения центральной нервной системы. Личностные, социальные и экономические последствия повреждения головного мозга, наступающие после остановки сердца, разрушительны. Следовательно, одной из наиболее важных проблем в исследовании остановки сердца и реанимации ("полная ишемия организма и реперфузия") является реанимация головного мозга и повреждение головного мозга после остановки сердца (Safar (1986), Circulation, 74, IV138-53, Safar, et al. (2002), Crit Care Med, 30, p. 140-4). В настоящее время никакими терапевтическими мерами после остановки сердца невозможно снизить первичное повреждение нейронов, вызываемое гипоксией, возникающей при остановке сердца. Основные патофизиологические исходы включают в себя гипоксию и последующий некроз, реперфузионное повреждение с образованием свободных радикалов, приток кальция в клетки, высвобождение аминокислот, вызывающих возбуждение, реперфузионные расстройства церебральной микроциркуляции и программированную гибель нейронов или апоптоз (Safar (1986), Circulation, 74, IV138-53, Safar, et al. (2002), Crit Care Med, 30, p. 140-4).
Предприняты несколько безуспешных клинических испытаний с целью улучшения неврологического исхода после остановки сердца. Тестировали терапевтическое применение барбитуратов (для усиления нейропротекции) или применение блокаторов кальциевых каналов (для снижения реперфузионного повреждения при ишемии) (Group (1986), Am. J. Emerg. Med., 4, 72-86, Group (1986), N. Engl. J. Med. 314, 397-403, Group (1991), Control.Clin. Trials 12, 525-45, Group (1991), N. Engl. J. Med. 324, 1225-31). В настоящее время не доступно каких-либо терапевтических средств после остановки сердца для улучшения неврологических исходов после остановки деятельности сердца в клинических условиях (с возможным исключением слабой гипотермии и тромболиза, для исследования которых в настоящее время проводятся крупномасштабные рандомизированные и контролируемые клинические испытания, результаты которых ожидают с большим вниманием) (Safar, et al. (2002), Crit Care Med., 30, p. 140-4). Следовательно, новые подходы к лечению для улучшения неврологического исхода после остановки сердца являются очень важными.
Рассеянный склероз представляет собой модельное воспалительное аутоиммунное заболевание центральной нервной системы, риск развития которого составляет один к 400, и потенциально он является наиболее частой причиной неврологической инвалидности у совершеннолетних молодых людей. Во всем мире насчитывается примерно 2-5 миллионов пациентов, страдающих от данного заболевания (Compston and Coles (2002), Lancet, 359, 1221-31). Как и при всех комплексных синдромах, данное заболевание является результатом взаимодействия еще не выявленных факторов внешней среды и генов предрасположенности. Вместе данные факторы запускают каскад событий, включающих в себя вовлечение иммунной системы, острое воспалительное повреждение аксонов и глии, восстановление функции и структурную репарацию, глиоз после воспаления и нейродегенерацию. Последовательное вовлечение указанных процессов лежит в основе клинического течения, характеризующегося случаями с восстановлением, случаями со стойкой недостаточностью и с вторичной прогрессией. Целью лечения является снижение частоты и уменьшение длительного воздействия рецидивов, ослабление симптомов, профилактика инвалидности, возникающей при развитии заболевания, и содействие восстановлению ткани.
Депрессия является распространенным психическим расстройством, характеризующимся унынием, потерей интереса к активной жизни и уменьшением активной деятельности. Депрессия отличается от нормальных изменений настроения степенью тяжести, симптомами и длительностью расстройства. Суицид остается одним из самых распространенных и часто неизбежных последствий депрессии. Если заболевание включает чередование депрессивных эпизодов с эйфорией или раздражительностью, его относят к биполярному расстройству. Депрессивные расстройства и шизофрения являются причиной 60% всех суицидов. Депрессия может быть вызвана разными причинами. На начало и течение депрессивных эпизодов могут оказывать влияние психосоциальные факторы, такие как неблагоприятные жизненные условия. Генетические и биологические факторы также могут вносить определенный вклад.
По расчетам в настоящее время от депрессии страдает 121 миллион человек. Депрессия является ведущей причиной инвалидности по данным оценки параметра YLD (годы, прожитые с инвалидностью) и является 4-м по важности фактором, определяющим суммарный поражающий эффект (DALY = длительность жизни, скорректированная с учетом инвалидности; сумма лет потенциальной жизни, потерянных в связи с преждевременной смертью, и годы продуктивной жизни, потерянные из-за инвалидности) в 2000 году. По оценкам, ежегодно от приступов депрессии страдают 5,8% мужчин и 9,5% женщин. Прогнозируют, что к 2020 году депрессия достигнет второго места в шкале DALY, рассчитываемой для всех возрастов и обоих полов. В развитых странах депрессия займет одно из ведущих мест в ряду всех причин заболеваний.
В настоящее время первая линия лечения большинства людей с депрессией включает применение антидепрессантов, психотерапии или их сочетания. Антидепрессанты эффективны на всем диапазоне тяжести большинства приступов депрессии. В настоящее время эффективная антидепрессивная терапия тесно связана с модуляцией или регулировкой серотонинергической нейротрансмиссии. Лекарственные средства, повышающие уровень серотонина в головном мозге, являются самыми сильными из известных антидепрессантов (такие как флуоксетин, прозак (Prozac®) или флуктин (Fluctin®)). Способы лечения с антидепрессивными эффектами у пациентов также включают в себя, например, фармакологические антидепрессанты, такие как литий, электросудорожную терапию и физические упражнения. Другие способы воздействия включают в себя создание систем поддержки для уязвимых индивидуумов, семей и групп. Менее убедительны доказательства профилактического лечения депрессии, лишь в нескольких отдельных исследованиях показали эффективность предлагаемых для профилактики депрессии способов воздействия. Важно иметь в виду, что существующие лекарственные средства направлены на облегчение симптомов заболевания, но не воздействуют на основные патофизиологические механизмы, вызывающие данное заболевание. В этой связи имеется потребность в новом лечении, которое было бы специфически направлено на новые выявленные причины депрессии.
Шизофрения является самым распространенным психическим заболеванием. Шизофрения поражает приблизительно 1 из 100 человек (1% населения). Это расстройство распространено во всем мире, охватывая все расы и культуры. Шизофрения поражает и мужчин, и женщин в равной мере, хотя в среднем у мужчин шизофрения развивается в более раннем возрасте, чем у женщин. Как правило, первые признаки шизофрении у мужчин появляются в середине 20-летнего возраста, а у женщин первые признаки - в конце 20-летнего возраста. Шизофрения сопряжена с огромными экономическими потерями, так, например, в США связанные с нею убытки составляют 32,5 миллиарда долларов в год. Шизофрения характеризуется наличием ряда симптомов: бред, галлюцинации, спутанные мышление и речь, негативные симптомы (отсутствие социальной адаптации, отсутствие эмоций и их выражения, снижение энергии, мотивации и активности), кататония. Главным способом лечения шизофрении является применение нейролептиков, таких как хлорпромазин, галоперидол, оланзапин, клозапин, тиоридазин и другие. Однако при лечении нейролептиками часто не удается ослабить все симптомы шизофрении. Кроме того, антипсихотическое лечение оказывает серьезные побочные эффекты, такие как поздняя дискинезия. Этиология шизофрении не ясна, хотя предполагают, что на нее сильное воздействие оказывают генетические факторы. В последнее время стало ясно, что у шизофрении существуют, по меньшей мере, несколько аспектов нейродегенеративного заболевания. В частности, в исследованиях с применением MR у больных шизофренией выявлена быстрая потеря серого вещества в коре головного мозга (Thompson, et al. (2001), Proc Natl Acad Sci USA 98, 11650-5; Cannon, et al. (2002), Proc Natl Acad Sci USA, 99, 3228-33). Следовательно, обосновано лечение больных шизофренией нейропротективным лекарственным средством, таким как GCSF, или GMCSF, или другие гематопоэтические факторы.
У людей существует потребность в способах повышения познавательной способности и усиления интеллекта. "Интеллект" в современном понимании не ограничивается просто логическими или семантическими способностями. Так, например, теория множественного интеллекта Говарда Гарднера оценивает интеллект с точки зрения эволюционной и антропологической перспективы и выдвигает более широкую концепцию, которая включает в себя атлетические, музыкальные, артистические и эмпатические способности, а также лингвистические/логические способности, которые чаше всего связывают с интеллектом и определяют с помощью тестов IQ. Такое расширенное понимание интеллекта распространяется и на область творчества. Кроме того, существует непатологическое состояние, известное как возрастное снижение памяти у людей (ARML), или легкое когнитивное нарушение (MCI), или возрастное снижение познавательной способности (ARCD), которое, как правило, начинается приблизительно в возрасте 40 лет и отличается от ранних симптомов болезни Альцгеймера.
В течение всего периода жизни взрослого человека происходит физиологическое снижение количества нервных клеток, составляющее, по подсчетам, 100000 нейронов в сутки. В течение указанного периода отмечается постепенное снижение веса и объема мозга. Оно составляет примерно 2% в 10 лет. В отличие от более ранних представлений указанное снижение не усиливается после 50 лет, но продолжается примерно с одной и той же скоростью, начиная с раннего периода совершеннолетия. Аккумулятивные эффекты указанного процесса, как правило, не заметны до старости.
Хотя головной мозг уменьшается в размерах, этого не происходит равномерно. Определенные структуры больше подвержены такому уменьшению. Например, часто становятся меньше гиппокамп и лобные доли, две структуры, вовлеченные в механизмы памяти. Частично это происходит вследствие потери нейронов и частично - вследствие атрофии некоторых нейронов. Размер многих других структур головного мозга не уменьшается. Снижение интеллектуальной деятельности может происходить вследствие повреждения нейронов, когда они разрушаются, уменьшаются или утрачивают связи. Такое снижение числа полностью функционирующих нейронов делает необходимым привлечение дополнительных сетей нейронов для управления видами умственной деятельности, которые в ином случае выполнялись бы проще или автоматически. Таким образом, процесс замедляется. Часть лобной доли, называемая префронтальная кора, участвует в управлении и контроле мыслей и действий. Атрофия, происходящая в этом участке головного мозга, может являться причиной испытываемой пожилыми людьми трудности в подборе слова. Она также может являться причиной забывания места нахождения ключей от машины или общей рассеянности. Полагают, что за затруднения с памятью ответственно уменьшение лобной доли и гиппокампа. Таким образом, также сохраняется необходимость в улучшении или усилении познавательной способности индивидуума.
В связи с указанным выше существует необходимость лечения неврологических и/или психиатрических состояний, таких как неврологические заболевания, связанные с усилением пластичности и восстановлением функций или клеточной гибелью в нервной системе. В частности, имеется потребность в лечении неврологических заболеваний путем создания нейропротекции для вовлеченных нервных клеток.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Таким образом, одной из целей настоящего изобретения является предоставление способа лечения неврологического или психиатрического состояния у млекопитающего посредством введения данному млекопитающему гематопоэтического фактора, такого как GMCSF, производное GMCSF, GCSF, производное GCSF и их сочетания, или клеток, секретирующих GCSF, или GMCSF, или их производные, для лечения указанного состояния.
Другой целью настоящего изобретения является предоставление способа лечения неврологического состояния у млекопитающих посредством кондиционирования композиции нейрональных стволовых клеток с гематопоэтическим фактором, таким как GMCSF, производное GMCSF, GCSF, производное GCSF и их сочетаний, с последующим введением нейрональных стволовых клеток млекопитающему для лечения указанного состояния.
Другой целью настоящего изобретения является предоставление способа идентификации соединения, которое связывается с рецептором гранулоцитарного колониестимулирующего фактора (GCSFR) на нервных клетках и которое активирует экспрессию гена STAT в нервной клетке, посредством взаимодействия нервной клетки с данным соединением и измерения степени повышения активации STAT относительно активации STAT в нервной клетке, которая не контактировала с данным соединением, и определения степени активации относительно, например, опосредованной GCSF активации STAT. Кроме того, соединения, получаемые этим способом, а также способы применения данных соединений для лечения неврологических состояний представляют собой дополнительные объекты настоящего изобретения.
Другой целью настоящего изобретения является предоставление способа идентификации соединения, которое связывается с рецептором гранулоцитарно-макрофагального колониестимулирующего фактора (GMCSFR) на нервных клетках и/или которое активирует экспрессию гена STAT в нервной клетке, путем взаимодействия нервной клетки с данным соединением и измерения степени повышения уровня активации STAT относительно активации гена STAT в нервной клетке, которая не контактировала с данным соединением. Кроме того, соединение, получаемое этим способом, а также способы применения данных соединений для лечения неврологических состояний представляют собой дополнительные объекты настоящего изобретения.
Другой целью настоящего изобретения является предоставление способа идентификации агониста рецептора GCSF с повышенной нейропротективной активностью посредством взаимодействия соединения с нервной клеткой, несущей рецептор GCSF, измерения нейропротективного эффекта соединения на нервную клетку и сравнения эффекта соединения с эффектом GCSF. Кроме того, соединения, получаемые этим способом, а также способы применения данных соединений для лечения неврологических состояний представляют собой дополнительные объекты настоящего изобретения.
Другой целью настоящего изобретения является предоставление способа идентификации агониста рецептора GMCSF с улучшенной нейропротективной активностью путем осуществления взаимодействия соединения с нервной клеткой, несущей рецептор GMCSF, измерения нейропротективного эффекта соединения на нервную клетку и сравнения эффекта соединения с эффектом GMCSF. Кроме того, соединения, получаемые этим способом, а также способы применения данных соединений для лечения неврологических состояний представляют собой дополнительные объекты настоящего изобретения.
Другой целью настоящего изобретения является предоставление способа идентификации соединения с повышенной активностью в качестве агониста в отношении рецептора GCSF посредством взаимодействия соединения с нервной клеткой, несущей рецептор GCSF, сравнения уровня экспрессии гена STAT в нервной клетке со второй нервной клеткой, контактировавшей с GCSF. Кроме того, соединения, получаемые этим способом, а также способы применения данных соединений для лечения неврологических состояний представляют собой дополнительные объекты настоящего изобретения.
Другой целью настоящего изобретения является предоставление способа идентификации соединения с улучшенной активностью в качестве агониста в отношении рецептора GMCSF посредством взаимодействия соединения с нервной клеткой, несущей рецептор GMCSF, сравнения уровня экспрессии гена STAT в нервной клетке со второй нервной клеткой, контактировавшей с GMCSF. Кроме того, соединения, получаемые этим способом, а также способы применения данных соединений для лечения неврологических состояний представляют собой дополнительные объекты настоящего изобретения.
Другой целью настоящего изобретения является предоставление способа стимуляции экспрессии GCSF или GMCSF и/или их высвобождения в эндогенных нервных клетках посредством применения агонистов рецептора GCSF или GMCSF, расположенного на клетке. В другом варианте осуществления клетки приводят в контакт с веществом, которое повышает экспрессию и/или высвобождение GCSF или GMCSF. Такие способы можно применять в тестах, выявляющих высвобождение или повышение экспрессии GCSF или GMCSF в нервных клетках, например в культурах нервных клеток (например, анализы ПЦР и/или ELISA).
Другой целью настоящего изобретения является предоставление способа лечения неврологического состояния у млекопитающего путем применения агонистов рецептора GMCSF, рецептора GCSF или обоих рецепторов для лечения неврологического состояния.
Другой целью настоящего изобретения является предоставление способа повышения жизнеспособности клеток, трансплантированных в организм млекопитающего посредством введения в клетку одного или нескольких полинуклеотидов, которые кодируют GMCSF, производное GMCSF, GCSF, производное GCSF и/или их сочетания, перед трансплантацией клетки в организм млекопитающего, посредством чего достигается экспрессия в клетке гематопоэтического фактора в количестве, достаточном для повышения жизнеспособности клетки в сравнении с показателем жизнеспособности клетки до введения полинуклеотидов.
Другой целью настоящего изобретения является предоставление способа повышения жизнеспособности культуры нервных клеток посредством введения GMCSF, производного GMCSF, GCSF, производного GCSF и/или их сочетаний для повышения жизнеспособности культуры нервных клеток в сравнении с жизнеспособностью культуры до введения гематопоэтического фактора. В таком способе гематопоэтические факторы можно применять для взаимодействия с клетками культуры или их можно предоставлять с применением полинуклеотидов, которые кодируют и экспрессируют гематопоэтические факторы.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
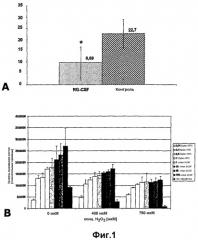
На фиг.1 показана эффективная нейропротекция in vivo и in vitro при применении GCSF. А - уровень нейропротективного воздействия GCSF после очаговой ишемии головного мозга (с применением модели нитевидной структуры; окклюзии средней мозговой артерии, MCAO), как измерено посредством окрашивания ТТС. Значения по оси Y означают процент инфаркта от всего полушария (данные приведены как среднее значение ± SD; T-тест; p<0,05). В - тест жизнеспособности клеток, проведенный на клетках РС12, обработанных NGF в условиях повышающегося окислительного стресса под действием H2O2 (0 мкМ, 400 мкМ, 750 мкМ). Добавление GCSF приводит к резкому повышению жизнеспособности клеток. Для сравнения представлена жизнеспособность клеток после обработки клеток эритропоэтином (EPO), известным нейропротективным веществом. Ось Y: относительная (отн.) жизнеспособность клеток (световые единицы люциферазной активности).
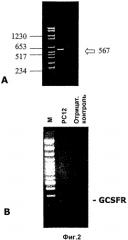
На фиг.2А показана ОТ-ПЦР, специфичная для мышиного GCSFR. РНК GCSF-R обнаружена в ткани головного мозга и имела ожидаемый размер 567 п.н. Идентичность подтверждена определением последовательности продукта ПЦР.
На фиг.4 приведены результаты иммуногистохимического анализа, показывающие распределение рецептора GCSF-R по различным участкам головного мозга мыши (парафиновые срезы, 2 мкм). a-d: локализация GCSF-R в гиппокампе. Следует отметить, что антитело преимущественно окрашивает нейроны в зоне СА3 (a,b), с наличием четкой границы между участками СА3 и СА2 (с, стрелка). GCSF-R распределен по всем клеткам, а также отросткам нейронов (b, стрелка). Следует отметить наличие рецептора в районе ворот и слоях базальных клеток зубчатой извилины (d, стрелка). Рецептор GCSF также выявляется в областях коры головного мозга: в пириформной коре головного мозга (е) и в периринальной коре головного мозга (f) в качестве примеров. В мозжечке метятся клетки Пуркинье (g, стрелка). Кроме того, положительными по GCSF-R являются некоторые из крупных митральных клеток обонятельной луковицы (h, стрелка). Сильное окрашивание проявляют передние рога спинного мозга (i, j), а при большом увеличении как позитивные по GCSF-R выявляются крупные двигательные нейроны (k, l). Следует отметить, что отростки нейронов также сильно метятся. В среднем мозге нейроны черного вещества демонстрируют положительное окрашивание по GCSF-R (m). Особенно сильно метятся все нейроны в компактной части (SNC) (стрелки в m и n). Кроме того, несколько нейронов в сетчатой части экспрессируют GCSF-R (o). Кроме нейронов, также окрашены олигодендроциты в пучках белого вещества, например, в передней спайке (р, стрелка). Неожиданным являетс