Аллогенное противоопухолевое терапевтическое средство
Иллюстрации
Показать всеИзобретение относится к иммунологии и генетической инженерии. Предложена опухолевая клетка человека и вакцина на ее основе. Изобретение может быть использовано для терапевтического лечения опухолевых заболеваний. 6 н. и 20 з.п. ф-лы, 3 ил., 3 табл.
Реферат
Изобретение относится к вакцине на основе аллогенных опухолевых клеток для терапевтического лечения опухолевых заболеваний, а также к способу получения такой вакцины; а также к трансфицированным опухолевым клеткам человека для применения в качестве вакцины.
Наряду с общепринятыми способами лечения раковых заболеваний, такими как лучевая терапия и химиотерапия, которые с 1950-х годов являются единственной возможностью лечения для прогрессирующих и широко распространенных опухолевых заболеваний, иммунотерапия при метастазирующих опухолях является, по-видимому, новым обещающим успех подходом.
Иммунотерапия направлена на то, чтобы усилить природную иммунную реакцию против опухолевого заболевания посредством генно-инженерных модификаций, следовательно, повлиять на “внимание” иммунной системы против раковых клеток и, тем самым, на защитную реакцию таким образом, чтобы организм сам мог победить опухоль.
Поскольку некоторые злокачественные заболевания, такие как, например, почечно-клеточный рак на поздней стадии, являются, по-видимому, относительно чувствительными для иммунотерапевтических подходов, но системная терапия цитокинами, такими как IL-2 и IFN-альфа, сопровождается отчасти значительными побочными действиями, развивались другие иммунотерапевтические протоколы.
Большинство клинических исследований делают ставку на удаление опухоли, последующую трансфекцию ex vivo опухолевых клеток терапевтическим геном, облучение популяции опухолевых клеток и последующую повторную имплантацию модифицированных теперь опухолевых клеток. Посредством этого вакцинирования опухолевыми клетками противоопухолевая реакция может быть повышена в зависимости от трансфицированного терапевтического гена в различной степени.
На основе этого подхода, а также на основе результатов экспериментов с животными был разрешен ряд клинических исследований фазы I и II (Finke et al., 1997; Wittig et al., 2001).
Однако первые результаты с трансфицированными единственными генами показали, наряду с хорошей переносимостью терапии, лишь в немногих случаях частичные или полные ремиссии.
В одной мышиной модели рака ободочной кишки перенос гена CD40L/CD154 смог произвести индукцию цитокинов, ликвидацию опухоли и создание иммунитета (Sun et al., 2000).
Авторы настоящей заявки смогли показать, что перенос экспрессионных плазмид для интерлейкина 7 (IL-7) человека в опухолевые клетки приводит к повышенной чувствительности к эффекторным клеткам иммунной системы, особенно при аутологичном переносе (Finke et al., 1997, Cancer Gene Ther. 4: 260-268). Авторы смогли также показать, что после трансфекции двух терапевтических генов (IL-7, GM-CSF) в аутологичные опухолевые клетки удалось у половины пациентов избежать клинически значимой реакции (WO 02/060476).
Из патента США 5681562 известно, что можно инъецировать пациентам с определенными раковыми заболеваниями клетки, которые трансфицированы кодирующей цитокины ДНК или РНК. Иммунная система пациента должна стимулироваться, таким образом, против антигенов опухолей. В этом патентном описании описаны опыты, в которых фибробласты мышей трансфицировали ретровирусными векторами, кодирующими IL-2. Описан также опыт in vivo, в котором испытывали эффективность этой обработки в мышиной модели рака толстой кишки. Мыши, которым инъецировали подкожно (s.c.) трансфицированные фибробласты, развивали явно замедленный рост опухоли в сравнении с контрольными группами. В опытах in vitro с трансфицированными фибробластами человека мог быть также определен явно повышенный уровень экспрессии IL-2. Наряду с отсутствующими клиническими результатами, которые выходят за пределы мышиной модели, используемые в качестве экспрессирующего вектора вирусные векторы считаются мало предпочтительными. Вследствие нестабильности аттенуированного вакцинного штамма нельзя исключить обратное превращение в вирулентный штамм, кроме того, сами вирусные компоненты могут действовать иммуногенно, что ведет к снижению их эффективности иммунной системой пациента. Эти выборочные риски в значительной степени препятствуют их широкому применению в качестве генотерапевтического вектора.
Многочисленные публикации показывают, что наилучшие терапевтические результаты достигаются комбинацией генов цитокинов с фактором роста GM-CSF (Paillard, 1998, Hum. Gene Ther. 9: 2457-2458; Schadendorf et al., 1995, J. Mol. Med. 73: 473-477). Значение GM-CSF при вакцинировании опухолевым антигеном обнаруживалось также в повышении клинической и иммунологической противоопухолевой реакции при вакцинировании пептидами (Jäger et al., 1996). Очевидно, при этом существенную роль играет активирование антигенпредставляющих клеток, а также стимуляция популяции эффекторных клеток.
Однако до сих пор неясно, какие гены цитокинов в комбинации с иммуногенной композицией с GM-CSF вызывают самую эффективную противоопухолевую иммунную реакцию.
В экспериментах на мышах оказалось, что вакцинация экспрессионными конструкциями, кодирующими IL-7, вызывает противоопухолевое действие (Miller et al., 1993, Blood 18: 3686-3694; Murphy et al., 1993, J. Clin. Invest. 92: 1918-1924). Известно также, что инкубирование CTL с IL-7 или IL-7-трансфицированными клетками приводит к регрессу опухоли у мышей (Jicha et al., 1991; Hock et al., 1993), а трансфекция IL-7 и В7.1/CD80 индуцирует CD28+CD25+ Т-клеточный инфильтрат и иммунитет (Cayeux et al., 1995).
До сих пор не получены терапевтические эффекты, даже в мышиной модели.
Кроме того, при попытках стимуляции иммунных реакций посредством генотерапии последовательностями плазмидной ДНК или олигонуклеотидными последовательностями наблюдали, что определенные последовательности нуклеиновых кислот, которые обнаруживают Cog-мотив (Cog = неметилированный динуклеотид цитозин-гуанозин), могут иметь огромное иммуностимуляторное действие (Schmidt-Wolf et al., 1989, J. Immunol. Methods 125: 185-189). Иммуностимуляторные последовательности нуклеиновых кислот (ISS) применяли по этой причине уже давно в качестве адъювантов в протоколах иммунизации на основе ДНК против инфекционных возбудителей (Sato et al., 1996, Science 273: 352-354). В экспериментах с мышами оказалось, что обогащение CpG-богатыми ДНК-последовательностями приводит к сильной активации В-клеток и индуцирует экспрессию определенных цитокинов, например, IL-6 и GM-CSF. В мышиной модели удалось также показать, что иммунизация CpG-олигодезоксирибонуклеотидами (ODN) вместе со слитым белком за три дня перед инокуляцией опухоли может подавлять рост опухоли у мыши (Liu et al., 1998). Учение о применении и получении иммуностимуляторных, CpG-содержащих ISS всеобъемлющим образом обсуждается в WO 98/18810.
Из WO 00/04918 известна трансфекция опухолевых клеток генами, кодирующими, например, интерферон-гамма и GM-CSF. В качестве экспрессирующих векторов использовали плазмиды. Этот документ излагает концепцию лечения опухолевых заболеваний с использованием иммунотерапии. Убедительные in vivo или in vitro данные или клинические результаты, которые подтверждают эффективность рассматриваемой вакцины, не представлены. Следует отметить, что эти векторы на основе плазмид не являются безоговорочно пригодными для использования в генотерапии человека, так как они, наряду с терапевтическими последовательностями, несут генетические функциональные единицы, которые необходимы для их репликации. Наряду с этим, они обнаруживают гены устойчивости к антибиотикам, которые являются необходимыми для их отбора. Следовательно, происходит длительная экспрессия терапевтически нежелательных белков млекопитающих или бактерий.
Несмотря на многолетние исследования и многообещающие подходы, до сих пор не удалось разработать эффективную иммунотерапию против опухолевых заболеваний посредством применения иммуногенных веществ.
Задачей настоящего изобретения является обеспечение вакцины в качестве лекарственного средства для лечения связанных с цитокинами заболеваний, таких как, например, раковые заболевания, которая является специфически и эффективно применимой и, в частности, приводит к индукции опухолеспецифических иммунных ответов. Далее, должен быть разработан соответствующий способ получения подобной вакцины.
Эта задача решается признаками самостоятельных пунктов формулы изобретения.
В контексте изобретения следующие выражения и аббревиатуры обозначают:
| аллогенные | из генетически отличающегося индивидуума того же самого вида (species) в противоположность "аутологичным" (собственным (гомологичным) клеткам) |
| АРС | антигенпредставляющие клетки |
| В7.1/CD80 | кластер дифференцировки 80 |
| CD40L/CD154 | лиганд кластера дифференцировки 40 |
| DC | дендритные клетки |
| dSLIM | иммуномодулирующие олигодезоксирибонуклеотиды с двойной структурой стебель-петля |
| GM-CSF | гранулоцитарный-макрофагальный колониестимулирующий фактор |
| IL-7 | интерлейкин-7 |
| ISS | иммуностимуляторные последовательности нуклеиновых кислот |
| MIDGE | минимизированный иммунологически определенный экспрессирующий вектор гена (MIDGE® является зарегистрированным товарным знаком Mologen AG) |
| ODN | олигодезоксирибонуклеотид |
| ТАА | ассоциированный с опухолью антиген (опухолеспецифический антиген) |
Далее, ряд общих понятий должны пониматься следующим образом.
Трансфицированные клетки, в контексте изобретения, являются аллогенными опухолевыми клетками человека, которые были обработаны ex vivo в соответствии с изобретением кодирующими экспрессирующими векторами и вследствие этой обработки экспрессируют кодирующие цитокин и костимуляторный фактор последовательности и применяются в качестве иммунотерапевтического средства при опухолевых заболеваниях.
В контексте изобретения термин костимуляторный фактор и/или цитокин относится как к природно встречающимся костимуляторным факторам и/или цитокинам, так и ко всем модификациям, мутантам или производным костимуляторных факторов и/или цитокинов, полученным способами рекомбинации костимуляторным факторам и/или цитокинам, которые содержат модификации аминокислот, такие как инверсии, делеции, вставки, присоединения и т.д., пока имеется в наличии по меньшей мере часть существенных функций костимуляторных факторов и/или цитокинов дикого типа. Такие костимуляторные факторы и/или цитокины могут также включать в себя необычные аминокислоты и/или модификации, такие как алкилирование, окисление, модификацию тиолом, денатурацию и олигомеризацию и т.п. В связи с изобретением костимуляторные факторы и/или цитокины могут быть, в частности, белками, пептидами и/или слитыми пептидами, которые, наряду с другими белками, пептидами или их частями, содержат костимуляторные факторы и/или цитокины в целом виде или в частичном виде. В следующем варианте осуществления изобретения костимуляторные факторы и/или цитокины являются укороченными формами природно встречающихся костимуляторных факторов и/или цитокинов.
Все вышеуказанные костимуляторные факторы, которые пригодны для модуляции реакции иммунной системы, являются в контексте изобретения иммуногенными веществами. Таким образом, вакцина по изобретению представляет собой, в контексте изобретения, иммуногенную композицию, так как она содержит комбинацию иммуногенных веществ. Опухолевые клетки отличаются от нормальных клеток, среди прочего, измененной экспрессией белков клеточной поверхности. Прежде всего, экспрессия опухолеспецифических антигенов (ТАА) делает теоретически возможными узнавание и уничтожение этих клеток иммунной системой. Однако часто иммунная система пациентов является супрессированной, так что ей не удается узнать измененные клетки.
Эта проблема решается обеспечением вакцины для лечения пациентов с определенными опухолевыми заболеваниями, причем эта вакцина состоит из опухолевых клеток другого пациента (аллогенных клеток), и эти опухолевые клетки были предварительно трансфицированы ex vivo экспрессионными конструкциями, кодирующими интерлейкин-7 (IL-7), гранулоцитарно-макрофагальный колониестимулирующий фактор GM-CSF и костимуляторные факторы CD40L/CD154 и В7.1/CD80. В следующем варианте осуществления изобретение относится к соответствующей вакцине, причем эти опухолевые клетки предварительно были трансфицированы ex vivo экспрессионными конструкциями, кодирующими интерлейкин-7 (IL-7), гранулоцитарно-макрофагальный колониестимулирующий фактор GM-CSF и костимуляторный фактор CD40L/CD154.
В случае используемых опухолевых клеток речь может идти о таких клетках, которые происходят от пациентов с картиной заболевания, подобной картине заболевания подлежащего лечению пациента, или о таких клетках, которые происходят от пациентов с картиной заболевания иной, чем картина заболевания подлежащего лечению пациента.
Комбинация компонентов (иммуногенных веществ) вакцины должна гарантировать, что производятся все три стадии каскада сигнала, которые в принципе необходимы для индукции специфической иммунной реакции. Эти три стадии включают в себя презентирование антигена, костимуляцию и обеспечение подходящей локальной среды.
Экспрессия GM-CSF и CD40L/CD154 должна вызывать локальный рекрутинг и активацию антигенпредставляющих клеток (АРС), а также дендритных клеток (DC). Следствием является усиленная презентация ТАА (опухолеспецифического антигена).
Экспрессия В7.1/CD80 приводит к повышению костимуляторной активности. Благодаря этому антигенность ТАА усиливается и повышается количество активированных против ТАА Т-лимфоцитов.
Экспрессия IL-7 дополнительно индуцирует пролиферацию опухолеспецифических Т-лимфоцитов.
Вакцина по изобретению приводит посредством этого в месте применения к высокой концентрации растворимых, усиливающих пролиферацию цитокинов и костимуляторных молекул в сопряжении с ТАА на поверхности опухолевых клеток, которая приводит к активации и пролиферации опухолеспецифических Т-клеток. АРС и DC также "привлекаются" к месту применения.
Экспрессионные конструкции существуют в виде плазмиды, но предпочтительно являются также минимизированными иммунологически определенными конструкциями экспрессии генов. При этом речь идет о линейной двухцепочечной, ковалентно замкнутой экспрессионной кассете, которая состоит только из промотора CMV, интрона, кодирующей ген последовательности и последовательности полиаденилирования. Эта экспрессионная кассета на обоих концах двойной цепи ковалентно замкнута короткой петлей одноцепочечных нуклеозидных остатков. Эти ковалентно замкнутые минимизированные ДНК-конструкции в дальнейшем описании обозначаются как MIDGE-векторы (MIDGE: минимизированный иммунологически определенный экспрессирующий вектор гена); см. ЕР 0941318 В1. MIDGE-конструкции имеют преимущество, заключающееся в том, что с ними можно избежать структур, которые не являются существенными для терапевтического действия, что, наконец, устраняет недостатки традиционных переносчиков генов.
Обеспечение локальной среды, которая является пермиссивной для индукции специфической иммунной реакции, гарантируется использованием адъюванта в форме иммуностимуляторных последовательностей нуклеиновых кислот (ISS). Для этой цели в соответствии с изобретением предусматривается, что вакцина дополнительно включает в себя иммуномодулирующие олигодезоксирибонуклеотиды в качестве адъюванта. Предпочтительным при этом является иммуномодулирующий олигодезоксирибонуклеотид, который
а) включает в себя последовательность с очередностью оснований N1N2CGN3N4, причем N1N2 является элементом, выбранным из группы, состоящей из GT, GG, GA, AT или AA, N3N4 является элементом, выбранным из группы, состоящей из СТ или ТТ, а также С обозначает дезоксицитозин, G обозначает дезоксигуанозин, А обозначает дезоксиаденозин и Т обозначает дезокситимидин,
b) и включает в себя дезоксирибонуклеиновую кислоту с кольцевой цепью с по меньшей мере частично комплементарной, антипараллельной последовательностью оснований и образован в форме гантели.
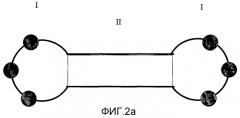
CpG-мотивы ISS (см. фиг.2а) обусловливают повышение активности NK-клеток и макрофагов, а также сильную стимуляцию клеточной Th1-реакции. Они действуют посредством этого в качестве иммуномодуляторов и делают возможной и усиливают опухолеспецифическую иммунную реакцию. Предпочтительно используют ковалентно замкнутые ISS с длиной 30 п.н., которые описаны в WO 01/07055. Эти конструкции в дальнейшем будут называться dSLIM (иммуномодулирующие олигодезоксирибонуклеотиды с двойной структурой стебель-петля).
Последовательность с очередностью оснований N1N2CGN3N4 расположена в одноцепочечной области этого олигодезоксирибонуклеотида и включает в себя 40-200 нуклеотидов (см. фиг.2b).
Объектом изобретения является также способ получения вышеописанной вакцины для лечения пациентов с опухолевыми заболеваниями, в котором опухолевые клетки генетически неидентичного (гетерологичного) донора того же самого вида (аллогенного) трансфицируют ex vivo молекулами нуклеиновых кислот, кодирующими
а) интерлейкин-7 (IL-7), гранулоцитарный-макрофагальный колониестимулирующий фактор (GM-CSF), CD40L/CD154 и В7.1/CD80, или
b) интерлейкин-7, гранулоцитарный-макрофагальный колониестимулирующий фактор (GM-CSF) и CD40L/CD154,
и затем переводят в пригодную для применения фармацевтическую композицию. Уже описанные выше иммуномодулирующие олигодезоксирибонуклеотиды включают в себя кольцевую цепь дезоксирибонуклеиновой кислоты с частично комплементарной, антипараллельной последовательностью оснований и образованы в форме гантели. Они являются также компонентом для использования в качестве адъюванта в указанном способе.
Таким образом, в соответствии с изобретением предусматривается, что одна аллогенная опухолевая клетка включает в себя по меньшей мере три, предпочтительно четыре молекулы нуклеиновой кислоты, которые вместе кодируют костимуляторные факторы В7.1/CD80 и CD40L/CD154 и цитокины интерлейкин-7 и GM-CSF.
Поэтому предметом изобретения являются также соответственно трансфицированные, аллогенные опухолевые клетки человека, которые были ex vivo трансфицированы молекулами нуклеиновых кислот, кодирующими
а) интерлейкин-7 (IL-7), гранулоцитарный-макрофагальный колониестимулирующий фактор (GM-CSF), CD40L/CD154 и В7.1/CD80, или
b) интерлейкин-7, гранулоцитарный-макрофагальный колониестимулирующий фактор (GM-CSF) и CD40L/CD154,
и обнаруживают соответствующие экспрессионные конструкции. Эти опухолевые клетки обнаруживают экспрессионные конструкции в форме плазмиды или также в виде линейной двухцепочечной, ковалентно замкнутой экспрессионной кассеты, которая состоит только из промотора CMV, интрона, кодирующей последовательности гена и последовательности полиаденилирования, которая на обоих концах двойной цепи ковалентно замкнута короткой петлей одноцепочечных нуклеозидных остатков. Предпочтительно речь идет при этом об аллогенной опухолевой клетке клеточной линии почечно-клеточного рака.
Как в случае самой вакцины, так и в случае способа по изобретению предусматривается, что молекулы нуклеиновых кислот находятся в одной или нескольких экспрессионных конструкциях. Таким образом, речь может идти об экспрессионной конструкции ДНК для экспрессии множественных генов,
- состоящей из двухцепочечных областей, которые содержат линейную экспрессионную кассету, которая обнаруживает по меньшей мере одну промоторную последовательность и одну кодирующую последовательность,
- причем эти двухцепочечные области связаны друг с другом одноцепочечными ДНК или некодирующими двухцепочечными ДНК,
- и эти экспрессионные кассеты на концах, на которых они не связаны с другими экспрессионными кассетами через одноцепочечные ДНК или некодирующие двухцепочечные ДНК, защищены против расщепления экзонуклеазами.
Подобная экспрессионная конструкция ДНК для экспрессии множественных генов уже описана в РСТ/DE03/02478. Таким образом, несколько нуклеиновых кислот, которые являются предметом вакцины по изобретению, могут быть связаны в единой экспрессионной конструкции.
В одном особенно предпочтительном варианте осуществления изобретения молекулой нуклеиновой кислоты является ДНК, в частности, кДНК или геномная ДНК. Само собой разумеется, может быть также предпочтительным, чтобы этой молекулой нуклеиновой кислоты была РНК.
Аллогенные опухолевые клетки происходят от пациентов с колоректальным раком, мелкоклеточным и немелкоклеточным раком легкого, раком предстательной железы, раком молочной железы, раком яичника, а также злокачественной меланомой.
В рамках изобретения используется, в частности, клеточная линия почечно-клеточного рака, которая является особенно подходящей для получения вакцины по изобретению. Предпочтительная клеточная линия почечно-клеточного рака была депонирована в DSMZ (Немецкой Коллекции Микроорганизмов и Клеточных Культур GmbH) в виде жизнеспособной культуры под номером DSM ACC 2635. В клетки этой клеточной линии почечно-клеточного рака с использованием по существу известных способов трансфекции биологического, химического и/или физического типа вводят экспрессионные ДНК-конструкции, которые приводят в этих клетках к экспрессии желаемых генов. К трансфицированным таким образом аллогенным клеткам добавляют адъювант, предпочтительно ISS, особенно предпочтительно dSLIM (см. выше). После радиоактивного облучения трансфицированных аллогенных опухолевых клеток гамма-излучением вакцину изобретения применяют для пациентов с опухолевым заболеванием.
Организм для взятия клеток, в отличие от терапии аутологичными клетками, не является организмом, который сам должен лечиться лекарственным средством. Применение аллогенных клеток имеет, с одной стороны, преимущество однократной характеристики и надежного размножения клеток, с другой стороны, аллогенный стимул рассматривается как дополнительное благоприятное адъювантное воздействие.
Подлежащие обработке клетки могут происходить из единственного (гетерологичного) организма или могут объединяться (в пул) из нескольких организмов с той же самой картиной заболевания.
Таким образом, изобретение относится к комбинации из трех или четырех нуклеиновых кислот, которые кодируют два цитокина и один или два костимуляторных фактора.
В качестве дополнительных иммуномодуляторов могут быть использованы ISS, предпочтительно dSLIM.
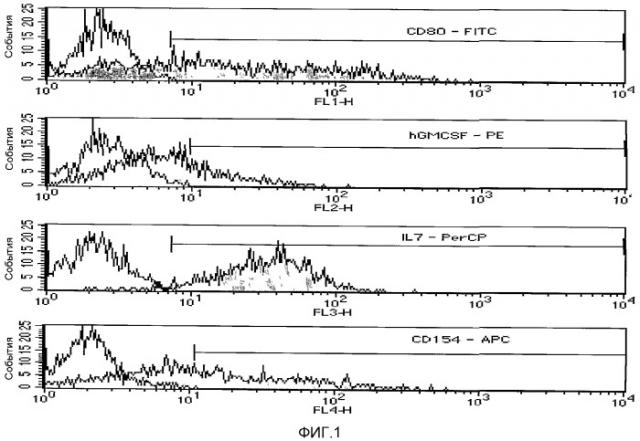
В экспериментах на культурах клеток в первичных клеточных линиях после трансфекции удалось обнаружить трижды или четырежды положительные клетки (см. фиг.1). Термины "трижды" или "четырежды" положительные обозначают в этой связи, что высокий процент клеток со всеми тремя или четырьмя генами, кодирующими GM-CSF, IL-7, CD40L/CD154 и В7.1/CD80, одновременно успешно трансфицировался, и эти три или четыре гена затем экспрессировались этими клетками. В используемой клеточной линии рака ободочной кишки можно было определить 14,4% всех клеток в качестве четырежды положительных клеток с использованием FACS-анализа (клеточного сортера с возбуждением флуоресценции). Далее удалось установить, что независимо от гена 20,3% клеток были трансфицированы одним геном после электропорации; с тремя различными генами были успешно трансфицированы еще 19,9% клеток. Было установлено, что процентная доля успешно трансфицированных клеток рака ободочной кишки после четырехкратной трансфекции экспрессионными конструкциями, кодирующими CD40L/CD154, GM-CSF, В7.1/CD80 и IL-7, составляет 14,4% этих клеток. Согласно этому, 14,4% клеток были трансфицированы четырьмя различными генами и были способны успешно экспрессировать их. В целом, 69,4% всех клеток были трансфицированы одним или несколькими из этих генов.
Трансфекция несколькими генами является преимуществом, так как экспрессируемые таким образом цитокины и костимуляторные факторы экспрессируются в тесной пространственной близости друг к другу в эффекторных органах иммунной системы. Эта пространственная близость является важной, так как костимуляторные сигналы дают эффективное усиление только в связи с антигенами.
Для трансфекции могут использоваться по существу известные биологические, химические и/или физические способы, например, трансфекция при помощи баллистического переноса (ЕР 0686697), трансфекция с использованием поликатионов, трансфекция с использованием осаждения фосфатом кальция, микроинъекция, слияние протопластов, слияние липосом, вирусные системы трансфекции, липофекция и/или электропорация in vivo и/или in vitro. В одном предпочтительном варианте осуществления изобретения трансфекция происходит посредством электропорации.
Дополнительными предпочтительными способами являются такие способы трансфекции, как опосредованный рецептором перенос генов. При этом, например, экспрессионные ДНК-конструкции, которые кодируют по меньшей мере один, предпочтительно два, костимуляторных фактора и два цитокина, ковалентно связаны с олигопептидом, который является предпочтительно последовательностью ядерной локализации (сигналом ядерной локализации = NLS) из вакуолизирующего обезьяньего вируса SV-40.
С использованием другого, частично синтетически полученного пептида можно дополнительно повысить эффективность трансфекции. Эти способы пригодны особенно для клеткоспецифического переноса генов in vivo с использованием внутривенного введения.
Полученная в соответствии со способом по изобретению вакцина из модифицированных аллогенных опухолевых клеток обнаруживает поразительные действия. Предпочтительно могут быть устранены недостаточности в иммунной системе имеющих опухоль пациентов и одновременно усилена имеющаяся внутренняя иммунная реакция на опухолеспецифические антигены.
Кроме того, эта вакцина может быть использована для пациентов, опухоль которых была удалена, в качестве адъювантной терапии для улучшения и восстановления их иммунной реакции против остаточных опухолевых клеток или для уменьшения оставшейся опухолевой массы. Открывается перспектива для пациентов с хирургически удаленной первичной опухолью без видимых метастазов, которые могли бы пролиферировать вследствие дополнительной опухолеспецифической терапии, уменьшающей скорость рецидивов.
Дополнительные предпочтительные варианты осуществления изобретения составляют зависимые пункты формулы изобретения и описание. Изобретение, в том числе неожиданное действие лекарственного средства по изобретению (в качестве вакцины для терапии рака), а также способ по изобретению будут описаны далее более подробно с использованием фигур и примеров осуществления.
Фиг.1 показывает интенсивности FACS четырежды трансфицированных клеток рака ободочной кишки человека. Трансфекцию выполняли электропорацией экспрессирующими векторами, кодирующими CD40L/CD154, GM-CSF, В7.1/CD80 и IL-7.
Фиг.2а и b показывают схемы иммуномодуляторов (dSLIM): гантелеобразную структуру в каждом случае с тремя схематически изображенными CG-мотивами в шпилечных структурах петель; в них I обозначает петлю и II обозначает стебель.
Для обнаружения продуктов генов использовали антитела, с которыми связаны четыре различных флуоресцентных красителя, обозначенных на фиг.1 как CD80-FITC, hGMCSF-PE, IL7-PerCP и CD154-APC.
Клеточный сортер с возбуждением флуоресценции (FACS) узнает эти окрашивания в четырех различных каналах. На абсциссе они обозначены как FL1-H, FL2-H, FL3-H и FL4-H. Экспоненты на абсциссе показывают относительную интенсивность флуоресценции. На ординате даны числа, которые соответствуют приблизительно количеству измеренных клеток. Оценка осуществляется посредством так называемой установки дискриминирующих окон в клеточном сортере, что означает, что считаются только клетки, которые проходят через определенный энергетический порт.
В таблице 1 представлена процентная доля успешно трансфицированных аллогенных клеток рака почки после трехкратной трансфекции экспрессионными конструкциями, кодирующими CD40L/CD154, GM-CSF и IL-7, или четырехкратной трансфекции экспрессирующими конструкциями, кодирующими CD40L/CD154, GM-CSF, В7.1/CD80 и IL-7.
| Таблица 1 | ||
| Кодирующий ген | Трехкратная трансфекция экспрессирующими конструкциями, кодирующими CD40L/CD154, GM-CSF и IL-7 | Четырехкратная трансфекция экспрессирующими конструкциями, кодирующими CD40L/CD154, GM-CSF,В7.1/CD80 и IL-7 |
| Доля трансфицированных клеток (1 измерение) | Доля трансфицированных клеток (2 измерения) | |
| В7.1/CD80 | --- | 66,3-87,6% |
| CD40L/CD154 | 60,8% | 21,6-29,5% |
| IL-7 | 21,7 нг в 1×106 клетках | 14,9-38,2 нг в 1×106 клетках |
| GM-CSF | 698,9 нг в 1×106 клетках | 370,6-1567,2 нг в 1×106 клетках |
Трансфекцию костимуляторных факторов В7.1/CD80 или CD40L/CD154 обнаруживали по окрашиванию клеток флуоресцентно меченными антителами; степень трансфекции цитокинами IL-7 или GM-CSF обнаруживали по концентрации цитокинов в среде культуры клеток.
Вакцину по изобретению, состоящую из аллогенных, трансфицированных ex vivo клеток, вводили пациентам с метастазирующими солидными опухолями с интервалом 7-10 дней в форме 4 циклов инъекций, состоящих в каждом отдельном случае из 2 инъекций. Эти клетки были предварительно трансфицированы вектором экспрессии, кодирующим IL-7, GM-CSF, CD40L/CD154 и/или B7.1/CD80, и сразу же после этого смешаны с иммуностимуляторными последовательностями (ISS). Две первые инъекции выполняли в день 1 в типичные места вакцинации в коже (интрадермально) сбоку на левом и правом плече, в день 7 (до 10) в типичные места вакцинации интрадермально на передней стороне левого и правого бедра, в день 14 (до 20) подкожно на приблизительно 30 мм слева и справа от пупка и в день 21 (до 30) опять в плечи, но подкожно.
Все пациенты находились к началу лечения в поздней фазе заболевания. Для оценки клинического успеха имели силу следующие формулировки в соответствии с Всемирной организацией здравоохранения (1979): частичной реакцией (частичным ответом, PR) называют уменьшение поддающегося учету опухолевого очага на более чем 50%, в последние четыре недели, а также подавление новых опухолевых очагов. Под стабильным ходом заболевания (стабильное заболевание, SD) понимают сохранение прежнего состояния. Смешанная реакция (MR) обозначает смешанную реакцию, например, прогрессирование метастазирования и уменьшение метастазов в другом месте. Полная реакция (CR) обозначает полный регресс опухолевых очагов.
Далее изобретение должно объясняться более подробно при помощи примеров, но без ограничения изобретения этими примерами.
Вакцинация
Пациент мужского пола, имеющий мелкоклеточный рак легкого, получал с интервалом 7 дней четыре следующие одна за другой вакцинации вакциной изобретения. Аллогенную линию клеток рака почки обрабатывали предварительно, как описано выше. Контроль экспрессии выполняли спустя 24 часа после трансфекции. Контроль экспрессии костимуляторных факторов В7.1/CD80 или CD40L/CD154 выполняли окрашиванием клеток флуоресцентно меченными антителами и последующим измерением с использованием проточной цитометрии. Определение экспрессии цитокинов IL-7 и GM-CSF выполняли измерением концентрации в среде культуры клеток с использованием ELISA.
"Успешно трансфицированные" обозначает: живые положительные клетки. Результаты трансфекции представлены в таблице 1. Процентная доля успешно трансфицированных В7.1/CD80 клеток составляла 66,3-87,6%. Доля трансфицированных CD40L/CD154 клеток составляла 21,6-29,5%. Концентрация цитокина IL-7 составляла в 1×106 клетках 14,9-38,2 нг. Концентрация GM-CSF составляла в 1×106 клетках 370,6-1567,2 нг.
В случае трансфекции для трехкратной вакцинации экспрессирующими конструкциями, кодирующими CD40L/CD154, GM-CSF и IL-7, процентная доля успешно трансфицированных CD40L/CD154 клеток составляла 60,8%. Концентрация цитокина IL-7 составляла в 1×106 клетках 21,7 нг. Концентрация GM-CSF составляла в 1×106 клетках 698,9 нг.
Лечение метастазирующих опухолевых заболеваний
Выбор пациентов: были выбраны пациенты с колоректальным раком, мелкоклеточным и немелкоклеточным раком легкого, раком предстательной железы, раком молочной железы, раком яичника и почечно-клеточным раком, а также злокачественной меланомой, в возрасте 18-70 лет и с индексом Karnofsky 70-100. Критериями исключения были: предыдущее лечение цитокинами или предыдущая химиотерапия, которые проводились за менее чем 28 дней перед этим, показатели креатина более 265 микромоль/л, показатели билирубина более 51 микромоль/л, некомпенсированная сердечная недостаточность, вентрикулярные аритмии, тяжелые психиатрические заболевания, активный гепатит А, В или С, ВИЧ-инфекция.
Лечение: наряду с анамнезом, определяли следующие параметры перед началом лечения: физическое обследование, гематологию (гемоглобин, гематокрит, лейкоциты и тромбоциты), химические показатели крови и анализ мочи. Брали кровь для определения иммунного статуса. Кожные тесты DHT (аллергии задержанного типа) проводили с использованием мультитеста Merieux (Leimen, Germany). Получали рентгеновские снимки верхней части туловища, а также компьютерные томографии верхней части туловища и живота. Пациенты получали четыре подкожные инъекции по меньшей мере 8×106-1,4×107 клеток с использованием предварительно обработанных ex vivo опухолевых клеток. Всеобъемлющие иммунологические исследования, гематологические исследования и черновые клинические исследования (физическое обследование, ультразвуковое исследование и исследование подчревной области, при необходимости) повторяли в дни 14, 28 и 56. Полное клиническое и иммунологическое исследование, сравнимое с проведенным в начале исследованием при отборе, имело место в день 84.
| Таблица 2 | ||
| Характеристика пациентов | ||
| Пациенты | 54 | |
| Пол | Мужской | 29 |
| Женский | 25 | |
| Диагноз | рак толстой кишки | 24 |
| рак молочной железы | 9 | |
| почечно-клеточный рак | 18 | |
| немелкоклеточный рак легкого | 3 | |
| Введенное количество клеток | средняя величина | 8×106-1,4×107 |
| Таблица 3Результаты лечения | |||
| Диагноз | Число пациентов | CR/PR/MR/SD vs PD | Результат |
| Рак толстой кишки | 24 | 6/2/2/5 vs.2 | 15/25 |
| Рак молочной железы | 9 | 3/1/1/2 vs.2 | 7/9 |
| Немелкоклеточный | 3 | 1/-/1/1 vs. - | 3/3 |
| Рак легкого | |||
| Почечно-клеточный рак | 18 | 7/1/1/5 vs.4 | 14/18 |
| CR полное обращение (полное реагирование, CR) | |||
| PR частичная реакция (частичное реагирование, PR) | |||
| MR смешанная реакция (смешанное реагирование, MR) | |||
| SD стабильное течение (стабильное заболевание, SD) | |||
| PD прогрессирующее течение (прогрессирующее заболевание, PD) |
Коэффициенты реакции опухолей подразделяли на категории с использованием системы RECIST (Критерии Оценки Реагирования в Солидных Опухолях). Возможными результатами являются полная реакция (полная реакция, CR, полное обращение всех опухолей), частичное реагирование (частичное реагирование, CR) и смешанное реагирование, MR, обращение поддающихся учету опухолевых очагов на более чем 50% в последних четырех неделях, а также подавление новых опухолевых очагов), стабильное заболевание (стабильное заболевание, SD, между 30%-ным уменьшением и 20%-ным увеличением суммы измерений повреждений) и прогрессирующее заболевание (прогрессирующее заболевание, PD, повышение суммы величин повреждений на более чем 20%, или появление новых повреждений).
Все 54 пациента находились к началу лечения в далеко зашедшей фазе заболевания. 24 пациента имели рак толстой кишки, девять пациентов имели рак молочной железы, 18 пациентов имели почечно-клеточный рак и три пациента имели немелкоклеточный рак легкого (в отношении характеристики пациентов см. Таблицу 2).
Все пациенты хорошо переносили лечение, и не было никаких нежелательных побочных действий.
В целом из 54 пациентов 39 пациентов обнаружили клинически значимую реакцию (72%). В группе пациентов, которые имели немелкоклеточный рак легкого, коэффициент реакции на объект изобретения составлял даже 100%. Это означает, что у одного пациента было зарегистрировано стабильное течение (SD) после лечения, од