Способ флуорометрического определения параметров фотосинтеза фотоавтотрофных организмов, устройство для его осуществления и измерительная камера
Иллюстрации
Показать всеИзобретение относится к измерительной технике. В способе, включающем световое воздействие на образец пробы анализируемой среды, импульсы возбуждающего света имеют одинаковую амплитуду и изменяемую длительность, при этом характеристики флуоресценции хлорофилла измеряют при постоянной фоновой подсветке, имитирующей интенсивность облучения объекта в момент проведения исследований в естественных условиях, и после адаптации его в темноте. Устройство включает измерительную камеру, четное количество источников измерительного света, оптически сопряженных с измерительной камерой, модуль измерения флуоресценции образца, блок управления, стабилизатор токов источников света и датчик естественной облученности. Измерительная камера содержит корпус, регистратор флуоресценции и четное число источников света, которые расположены попарно диаметрально противоположно друг другу в одной плоскости, перпендикулярной оси корпуса. Технический результат - повышение точности определения. 3 н. и 20 з.п. ф-лы, 1 табл., 5 ил.
Реферат
Изобретение относится к области биологии и может быть использовано в технологиях исследования окружающей среды, в частности в лимнологии и океанологии при изучении и оценке состояния водной среды для измерения концентрации водорослей и их фотосинтеза, а также в любой другой области науки, технике и охраны окружающей среды, где необходимо проводить непрерывный анализ водной среды с использованием флуориметров.
Известно, что при действии различных экологических факторов и антропогенных загрязнений на наземные и водные экосистемы в первую очередь изменяются концентрация и фотосинтетическая активность клеток фотосинтезирующих организмов. Их изменения приводят к изменениям во всех остальных звеньях экосистемы. В связи с этим функционирование фотосинтетического аппарата (ФСА) оказывается наиболее значимым для определения состояния растения. Так, регистрация фотосинтетических характеристик фитопланктона является способом оценки состояния водной среды в целом.
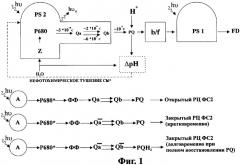
Принятая в настоящее время модель первичных реакций фотосинтеза включает две фотосистемы ФС1 и ФС2. ФС2 окисляет воду с выделением кислорода и протонов и восстанавливает первичный и вторичный хинонные акцепторы Qa и Qb. ФС1 переносит электрон от пула пластохинона (PQ) к конечному акцептору электрона CO2.
Реакционный центр ФС2 (РЦ) состоит из специальной молекулы хлорофилла Р680, которая в возбужденном состоянии является первичным донором электрона для хинонного акцептора Qa. Энергия кванта света, поглощенного в ФС2, может быть превращена в энергию разделенных зарядов Р680+Qa-, которая используется в дальнейших реакциях фотосинтеза, либо потеряна путем излучения кванта флуоресценции или рассеяния в тепло. Эти три процесса характеризуются константами скорости Kph, Kf и Kd соответственно.
Исходное состояние, в котором Р680 восстановлен, а Qa окислен, называется открытым. Состояние, образующееся сразу после разделения зарядов в первичной паре Р680+Qa-, называется закрытым состоянием РЦ. В этом состоянии новая порция возбуждения не может быть использована таким центром до тех пор, пока он не вернется в исходное открытое состояние в результате восстановления Р680+ от вторичных доноров и окисления первичного акцептора вторичными акцепторами электрона.
При открытом состоянии РЦ эффективность использования энергии возбуждения в фотосинтезе высока, вероятность потери энергии минимальна, квантовый выход флуоресценции, равный отношению Kf/(Kph+Kf+Kd), минимален и составляет около 2%. В случае постоянной интенсивности возбуждающего света, не вызывающей закрытия РЦ, интенсивность флуоресценции соответствует величине F0. Низкий выход флуоресценции хлорофилла за счет использования энергии света в первичных реакциях фотосинтеза обусловлен фотохимическим тушением флуоресценции хлорофилла. При закрытых РЦ фотохимическое разделение зарядов становится невозможным, квантовый выход флуоресценции возрастает до Kf/(Kf+Kd), что соответствует значению интенсивности Fm и составляет около 5%. Разность между максимальным и минимальным значениями интенсивности флуоресценции (Fv=Fm-F0 - переменная флуоресценция) пропорциональна той части энергии света, которая используется в фотохимических реакциях фотосинтеза при открытых реакционных центрах ФС2. Отношение интенсивностей переменной и максимальной флуоресценции Fv/Fm (относительная переменная флуоресценция) равно эффективности использования энергии света РЦ, т.е. позволяет определить эффективность утилизации света в ходе фотосинтеза. Эта безразмерная энергетическая характеристика фотосинтеза, аналогичная коэффициенту полезного действия, является универсальной и не зависит от видовой специфики организма.
При воздействии возбуждающего света на растение, адаптированное к темноте, наблюдается изменение интенсивности флуоресценции хлорофилла во времени (характерная индукционная кривая флуоресценции), имеющее насколько фаз. Сначала интенсивность флуоресценции быстро возрастает до уровня, который соответствует квантовому выходу флуоресценции при открытых РЦ (F0). Затем, при достаточно высокой интенсивности действующего света, выход флуоресценции может достигать Fm. Дальнейшие фазы индукции флуоресценции хлорофилла в конечном счете приводят к снижению выхода флуоресценции. Это явление обусловлено возрастанием фотохимического тушения при ускорении транспорта электронов и соответствующим уменьшением степени восстановленности хинонных акцепторов ФС2, а также развитием процессов нефотохимического тушения, которые обусловлены рядом процессов, связанных с образованием градиента протонов на фотосинтетической мембране.
Таким образом, измерение разных параметров флуоресценции хлорофилла дает возможность получать информацию о состоянии фотосинтетического аппарата объекта.
Так, измерение следующих параметров флуоресценции:
- F0 - значение интенсивности флуоресценции хлорофилла в отсутствие постоянной подсветки после длительной адаптации пробы в темноте при возбуждении тестирующим светом, не приводящим к закрытию РЦ и не приводящим к изменению состояния фотосинтетического аппарата,
- Fm - значение интенсивности флуоресценции хлорофилла в отсутствие постоянной подсветки после длительной адаптации пробы в темноте при возбуждении светом, приводящим к полному закрытию РЦ, и достижении стационарного уровня,
- Ft - значение интенсивности флуоресценции хлорофилла при длительной постоянной подсветке,
- F'm - значение интенсивности флуоресценции хлорофилла при длительной постоянной подсветке объекта и его возбуждении светом, приводящим к полному закрытию РЦ фотосинтетического аппарата
позволяет вычислить такие показатели состояния фотосинтезирующих организмов как:
1) максимальный квантовый выход разделения зарядов в ФС2 как отношение Fv/Fm=(Fm-F0)/Fm. Этот параметр пропорционален доле активных РЦ ФС2 в темноте и соответствует потенциальной эффективности процессов фотосинтеза,
2) фотохимическое тушение на фоновом свету - qP=(F'm-Ft)/(F'm-F0'),
3) нефотохимическое тушение на фоновом свету - NPQ=(Fm/F'm)-1,
4) квантовый выход фотохимического превращения поглощенной световой энергии в ФС2 как отношение Y=(Fm'-Ft)/Fm', отражающей параметры нециклического транспорта электронов при фотосинтезе,
5) абсолютное значение F0 как показатель обилия фитопланктона в воде,
6) скорость переноса электронов от Qa к Qb, а также размер световой антенны и пула хинонов, которые можно вычислить по кинетике роста интенсивности флуоресценции хлорофилла от F0 к Fm и другие.
Флуоресцентные методы оценки физиологического состояния растительных организмов являются наиболее объективными, неразрушающими и позволяют в течение короткого времени получать данные о состоянии ФСА объектов в естественной среде обитания в реальном времени.
Известен однолучевой метод регистрации флуоресценции (Маторин Д.Н., Венедиктов П.С. Люминесценция хлорофилла в культурах микроводорослей и природных популяциях фитопланктона // М.: Итоги науки и техники, ВИНИТИ. Сер. Биофизика. 1990. Т.40. С.49-100) путем освещения объекта постоянным светом через коротковолновый (обычно синий) фильтр с последующей регистрацией индукционных изменений интенсивности флуоресценции через скрещенный красный фильтр, защищающий детектор флуоресценции от возбуждающего света. Поскольку выход флуоресценции невелик, то в качестве детектора используют, как правило, фотоумножитель. Использование одного и того же луча света для возбуждения флуоресценции и запуска процессов фотосинтеза, в ходе которого изменяется состояние фотосинтетического аппарата и квантовый выход флуоресценции, не позволяет однозначно интерпретировать результаты таких измерений.
Известен двулучевой способ регистрации флуоресценции (Лядский В.В., Горбунов М.А., Венедиктов П.С. Импульсный флуорометр для исследования первичных фотохимических процессов зеленых растений // Науч. докл. высшей школы. Биол. науки. 1987. Т.11. С.31-36), в котором изменение состояния ФСА осуществляют постоянным световым потоком, а возбуждение флуоресценции с целью зондирования изменений ФСА производят слабым модулированным светом и по изменениям квантового выхода флуоресценции оценивают состояние ФСА.
Для регистрации модулированного сигнала флуоресценции в этом методе используют резонансный усилитель, который не пропускает постоянный сигнал флуоресценции, возбуждаемый действующим светом.
Такой метод имеет довольно узкий динамический диапазон интенсивностей измеряющего и действующего света. Так, повышение насыщающих интенсивностей действующего света требует достаточно интенсивный зондирующий свет, чтобы переменный сигнал флуоресценции, был выше шумов постоянного сигнала флуоресценции, индуцированного постоянным действующим светом. Однако в этом случае зондирующий свет может индуцировать ощутимый поток электронов, что приведет к ошибке в определении величины F0. Кроме того, известный способ предполагает использование ингибиторов (диурона), что значительно усложняет измерения, и практически не реализуем в погружном или проточном варианте.
Известен также способ регистрации флуоресценции путем модуляции зондирующего света (флуорометр с импульсной амплитудной модуляцией) (Ounis A., Evain S., Flexas J., Tosti S., Moya I. Adaptation of a PAM-fluorometers for remote sensing of chlorophyll fluorescence // Photosynth. Res. 2001. V.68. №2. P.113-120), в котором в качестве источника измеряющего света используют светодиод, генерирующий очень короткие (1 мкс) импульсы красного (650 нм) света с высокой скважностью (интервал между импульсами составляет около 1000 мкс). Импульсный сигнал флуоресценции детектируется фотодиодом и усиливается импульсным усилителем с синхронным детектором. Этот метод позволяет увеличить отношение интенсивностей действующего и зондирующего света до 106 и надежно регистрировать уровень флуоресценции F0 в широком диапазоне интенсивности действующего света. В то же время известный способ предполагает в качестве действующего использовать постоянный свет, который вызывает многократное срабатывание фотосинтетических реакционных центров (multiple turnover). Это затрудняет интерпретацию данных, поскольку в стационарном состоянии на выход флуоресценции влияет большое число факторов, вклад каждого из которых трудно определить, что в конечном счете приводит к возможности неоднозначной оценки результатов.
Известен также способ флуорометрического определения параметров фотосинтеза фотоатвотрофных организмов измерения параметров флуоресценции хлорофилла (Патент США №4942303, МПК G01N 21/64, опубл. 1990 г.), основанный на методе «накачки и зондирования» (pump-and-probe method), при котором образец освещают последовательно тремя вспышками света: «слабая зондирующая - мощная насыщающая - слабая зондирующая». Мощная вспышка накачки вызывает однократное срабатывание (single turnover) фотосинтетических РЦ, а слабая зондирующая вспышка, подаваемая через разное время после накачки, служит для определения кинетики изменения квантового выхода флуоресценции хлорофилла в процессе перехода РЦ из закрытого в открытое состояние.
Измерение выхода флуоресценции до и после насыщающей вспышки в присутствии постоянного действующего света известной интенсивности дает возможность измерить скорость фотосинтеза. Метод накачки и зондирования позволяет несколько расширить круг определяемых параметров ФСА. В то же время для измерения поперечного сечения поглощения и скорости потока электронов от ФС2 к ФС1 последовательность вспышек «зондирования - накачки - зондирования» требуется повторять 30 раз, при этом интенсивность вспышки накачки изменяют от нуля до насыщающего уровня или время задержки между накачкой и второй зондирующей вспышкой изменяют от 80 мкс до 300 мс. Осуществление таких двух экспериментальных протоколов требует от 5 минут до 10 минут работы флуорометра для проведения соответствующих измерений. Это ограничивает область применения известного способа, например, при получении вертикального профиля флуоресценции фитопланктона в океане, где эти протоколы часто необходимо проводить через каждый метр водного столба, указанное время становится недопустимо большим. Необходимость поддерживать интенсивность зондирующей вспышки ниже 1% от уровня насыщения ФС2 приводит к низкому отношению сигнал/шум, особенно при низкой концентрации хлорофилла, что не позволяет получить необходимую чувствительность измерений.
Известный флуорометр накачки и зондирования предусматривает применение двух отдельных каналов возбуждения (две вспышки), что усложняет конструкцию и увеличивает стоимость флуорометра. При этом полное выполнение экспериментального протокола по известному способу, в особенности при изучении фитопланктона в океане, требует значительного количества электрической энергии. Эти требования ограничивают возможность длительного автономного (на плавающем буе) измерения, при котором для питания флуорометра используют электрические батареи.
В зависимости от поставленной задачи определяют комплекс измеряемых параметров фотосинтетического аппарата и используют тот или иной метод возбуждения и регистрации флуоресценции.
Наиболее близким из известных технических решений к описываемому изобретению является способ флуорометрического определения параметров фотосинтеза фотоавтотрофных организмов (Патент США №5426306, МКП G01N 21/64, опубл. 1995 г.), включающий световое воздействие на образец пробы анализируемой среды возбуждающими импульсами света с энергией, достаточной для возбуждения флуоресценции хлорофилла в образце, и последующее измерение интенсивности флуоресценции, по которой определяют фотосинтетические параметры исследуемого объекта.
В известном способе в качестве возбуждающих импульсов света используют быстро повторяющиеся вспышки (fast repetition rate, FRR) с регулируемой энергией и высокой частотой для постепенного и увеличивающегося насыщения ФС2 у фитопланктона. Известный способ позволяет быстро получать данные о функциональной величине поперечного сечения поглощения РЦ, переносе энергии между фотосинтетическими единицами ФС2, фотохимическом и нефотохимическом тушении флуоресценции и о кинетике переноса электронов на акцепторной стороне ФС2. Однако возможности известного способа флуорометрического определения состояния и активности ФСА фотосинтезирующих организмов не предполагают многократного измерения интенсивности флуоресценции F0 на одном образце, что приводит к большим погрешностям измерения этого ключевого показателя. Для определения каждого показателя состояния ФСА в известном способе используют отдельную пробу, что также может вносить значительные ошибки. Известный способ не позволяет определять различные типы тушения, а следовательно, рассчитывать световую кривую электронного транспорта и определение зон оптимального фотосинтеза. Также известным способом невозможно определять устойчивость антиокислительной системы.
При этом известный способ измерения не позволяет определять вклад отдельных видов организмов в продукционные характеристики фитопланктонного сообщества. Кроме того, к известному методу измерения практически невозможно применить методы математического моделирования, т.к. моделировать приходиться каждый импульс отдельно и при серии 100-200 импульсов это крайне затруднено. Поэтому использование математической модели в известном способе для определения (вычисления) констант скоростей реакций переноса электрона в процессе фотосинтеза дает лишь отдаленно приближенные значения или невозможно совсем.
Наиболее близким из известных устройств для определения состояния фотосинтезирующих организмов к описываемому изобретению является устройство, реализующее способ по указанному выше патенту, включающее измерительную камеру, источник измерительного света, выполненный с возможностью возбуждать флуоресценцию образца, устройство измерения флуоресценции образца и блок управления, подключенный к ЭВМ, источнику измерительного света и устройству измерения флуоресценции образца.
Конструкция известного флуорометра позволяет проводить непрерывное измерение фотосинтетических параметров и скорости фотосинтеза как в темноте, так и при естественном освещении. Однако функциональные возможности известного устройства ограничены и не позволяют одновременно измерить необходимое количество параметров, характеризующих ФСА организма, требуемое для расчета и построения световой кривой электронного транспорта или для построения математических моделей ФСА, по которым можно определять признаки и параметры ФСА, не поддающиеся непосредственному измерению. При этом, поскольку малый сигнал флуоресценции в известном устройстве измеряют на фоне интенсивной инсоляции, проведение измерений в открытой камере в поверхностных слоях воды при интенсивном солнечном освещении не представляется возможным.
Кроме того, измерительные камеры во всех известных устройствах для измерения флуоресценции не обеспечивают подавление паразитного сигнала с фотоприемника, обусловленного тем, что значительная доля рассеянного света приходится на возбуждающий свет, попадающий на стенки и другие конструктивные элементы измерительной камеры. В то же время при измерении параметров флуоресценции фитопланктона в природных условиях, характеризующихся предельно низким содержанием клеток фитопланктона, необходима высокая чувствительность устройства.
Все приведенные выше факторы ограничивают возможность применения известных способа и устройства.
Таким образом, технический результат, достигаемый от реализации описываемого изобретения, состоит в повышении объективности и точности флуорометрической оценки активности фотосинтетического аппарата фотоавтотрофных организмов за счет проведения многократных измерений с высоким временным разрешением на одной пробе с одновременным определением вклада индивидуальных видов организмов в продукционные характеристики экосистемы и исследованием обилия фитопланктона и его функционального состояния in situ, а также за счет возможности определения его продукционных характеристик в естественных условиях в режиме реального времени.
Технический результат состоит также в расширении области применения за счет осуществления возможности рассчитывать световые кривые электронного транспорта и применять методы математического моделирования и тем самым определять дополнительные параметры, характеризующие фотосинтетические процессы.
Технический результат, достигаемый от реализации описываемого изобретения, состоит также в расширении функциональных и эксплуатационных возможностей устройства для определения состояния фотосинтезирующих организмов.
Указанный технический результат достигается тем, что в способе флуорометрического определения параметров фотосинтеза фотоавтотрофных организмов, включающем световое воздействие на образец пробы анализируемой среды импульсами возбуждающего света с энергией, достаточной для возбуждения флуоресценции хлорофилла, и последующее измерение интенсивности флуоресценции, по которой определяют фотосинтетические параметры исследуемого объекта, измерения флуоресценции осуществляют на одной пробе анализируемой среды, импульсы возбуждающего света имеют одинаковую амплитуду, а их длительность последовательно изменяют в соответствии с временем переноса электронов на отдельных звеньях электронно-транспортной цепи фотосинтеза, при этом характеристики флуоресценции хлорофилла измеряют как при постоянной фоновой подсветке, имитирующей интенсивность облучения объекта в момент проведения исследований в естественных условиях, так и после адаптации образца в темноте и по совокупности значений интенсивности флуоресценции определяют параметры состояния фотосинтетического аппарата.
При этом для определения интенсивности флуоресценции хлорофилла, при котором импульсы возбуждающего света не влияют на состояние фотосинтетического аппарата, длительность импульсов выбирают 1-5 мкс с интервалом между импульсами 50-100 мс.
Целесообразно оценку относительного размера светособирающего комплекса пигментов фотосинтетических реакционных центров производить посредством подачи на образец импульса света с длительностью 100-200 мкс и измерения интенсивности флуоресценции хлорофилла не реже, чем через каждые 10 мкс от начала импульса света с последующим вычислением прироста интенсивности флуоресценции хлорофилла за время действия импульса.
Для оценки скорости восстановления компонентов в акцепторной части ФС2 целесообразно производить воздействие на объект последовательностью из трех групп импульсов света одинаковой амплитуды и длительностью в каждой группе соответственно 1-5 мкс, 100-200 мкс и 200-1000 мс при средней плотности мощности не менее 3000 Дж·м-2·с-1 и измерять кинетику изменения интенсивности флуоресценции под действием каждого из этих импульсов в отдельности, при этом интенсивность флуоресценции в ответ на длительность импульса 1-5 мкс соответствует величине интенсивности флуоресценции хлорофилла, при котором импульсы возбуждающего света не влияют на состояние фотосинтетического аппарата, по углу наклона начального участка индукционной кривой изменения интенсивности флуоресценции в ответ на импульс возбуждающего света длительностью 100-200 мкс определяют относительный размер светособирающего комплекса, а по углу наклона кривой изменения интенсивности флуоресценции в ответ на действие импульса света длительностью 200-1000 мс определяют относительный размер пула хинонов.
Максимальный уровень флуоресценции хлорофилла можно определить путем подачи на образец импульса света длительностью 200-500 мс при плотности мощности облучения 3000 Вт/м2.
Целесообразно измерять кинетики изменения флуоресценции (индукционные кривые) посредством воздействия на образец пробы импульсом света 300-1000 мс и в течение его действия не реже, чем через 1 мс производить измерение интенсивности флуоресценции хлорофилла.
По результатам измерения кинетик флуоресценции может быть построена математическая модель фотосинтетического аппарата, по которой определяют количественные признаки и константы реакций переноса электронов, не определяемые экспериментально.
Предпочтительно измерения параметров флуоресценции производить на одном образце пробы исследуемой среды путем последовательного переключения режимов возбуждающих импульсов после проведения измерения каждого параметра, при этом длительность облучения в каждом последующем режиме выбирают больше, чем при предыдущем облучении.
Целесообразно описываемый способ использовать для определения фотосинтетических характеристик фитопланктона.
Предпочтительно отобранную пробу одновременно использовать для определения вклада индивидуальных видов водорослей в продукционные характеристики фитопланктона, а также гетерогенности популяций индивидуальных клеток.
Для определения вклада индивидуальных видов водорослей в продукционные характеристики фитопланктона и гетерогенности популяций из первоначально отобранной пробы выделяют второй образец анализируемой среды, концентрируют его, например, посредством фильтрации воды через ядерные фильтры, полученный концентрат распределяют в один слой клеток, например, в камере Нажотта, после чего путем визуальной оценки определяют видовой состав клеток фитопланктонных организмов.
Предпочтительно одновременно с оценкой видовой принадлежности популяций измерять на каждой клетке параметры флуоресценции по описанному выше способу и определять ее гетерогенность, при этом распределение клеток в популяции определять по эффективности процессов фотосинтеза, а относительное содержание пигментов в клетках по величине интенсивности флуоресценции хлорофилла, при котором импульсы возбуждающего света не влияют на состояние фотосинтетического аппарата, в отсутствие постоянной подсветки после длительной адаптации пробы в темноте.
Указанный технический результат достигается также тем, что устройство для флуорометрического определения параметров фотосинтеза фотоавтотрофных организмов, включающее измерительную камеру, источник света, оптически сопряженный с измерительной камерой и выполненный с возможностью возбуждать флуоресценцию образца, модуль измерения флуоресценции образца и соединенный с ним блок управления, подключенный к ЭВМ, содержит, по крайней мере, один дополнительный источник света, таким образом, чтобы число оптически сопряженных с измерительной камерой источников света было четным, стабилизатор токов источников света, выходы которого подключены к электрическим входам источников света, а вход - к блоку управления, и датчик естественной облученности, связанный через блок управления со стабилизатором токов источников света.
При этом источники света выполнены одинаковыми и каждый из них используют в качестве источника измерительного и/или насыщающего, и/или действующего света.
Модуль измерения флуоресценции образца может быть выполнен в виде подключенного к автономному высоковольтному источнику питания детектора флуоресценции, например фотоумножителя, соединенного через блок обработки сигнала и блок управления со средством регистрации, например с персональным компьютером.
При этом блок обработки сигнала может содержать, по крайней мере, один усилитель, связанный через синхронный детектор с аналого-цифровым преобразователем, выход которого подключен к блоку управления.
Целесообразно блок обработки сигнала выполнить в виде четырех последовательно соединенных операционных усилителей, выход каждого из которых через соответствующий синхронный детектор подключен к аналого-цифровому преобразователю, связанному с блоком управления.
В предпочтительном варианте устройство для флуорометрического определения параметров фотосинтеза фотоавтотрофных организмов может содержать насос, коллектор, первый выход которого подсоединен к измерительной камере, а второй - к системе концентрирования второго образца пробы среды, дополнительную измерительную камеру для измерения параметров флуоресценции индивидуальных клеток, в качестве которой целесообразно использовать камеру Нажотта, микрофлуорометрическую приставку, состоящую из люминесцентного микроскопа с флуорометрической насадкой, и светодиодный источник света, подключенный через стабилизатор тока источника света к блоку управления.
При этом флуорометрическая насадка может быть выполнена в виде модуля измерения флуоресценции образца.
Указанный технический результат достигается также тем, что измерительная камера для измерения флуоресценции, включающая корпус, источник света и детектор флуоресценции, размещенные в окнах корпуса, а также входной и выходной патрубки, выполненные с возможностью соответственно подачи в камеру и вывода из нее образца пробы исследуемой среды, содержит, по крайней мере, один дополнительный источник света, расположенный диаметрально противоположно первому с возможностью поглощать свет от противоположно расположенного источника.
Предпочтительно, чтобы измерительная камера содержала четное число источников света больше двух, которые расположены попарно диаметрально противоположно друг другу в одной плоскости, перпендикулярной оси корпуса, при этом каждый источник света выполнен с возможностью поглощать свет от противоположно расположенного источника.
При этом детектор флуоресценции может быть выполнен в виде фотоумножителя, ось оптической системы которого совпадает с осью корпуса.
Изобретение поясняется чертежами, где представлены:
на фиг.1 - схема модели первичных реакций фотосинтеза;
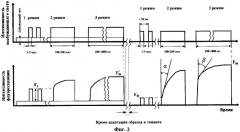
на фиг.2 - временная диаграмма измерения флуоресценции;
на фиг.3 - блок-схема устройства для измерения параметров флуоресценции фитопланктона;
на фиг.4 - схема измерительной камеры;
на фиг.5 - внешний вид бортового флуометра как вариант реализации описываемого изобретения.
Установлено, что при воздействии на образец длительным импульсом света происходит последовательный запуск реакций фотосинтеза с разными скоростями протекания и различными продуктами этих реакций (фиг.1). При этом происходит изменение выхода флуоресценции хлорофилла, обусловленное протеканием этих реакций.
Таким образом, путем воздействия на исследуемый образец импульсами различной длительности, каждый из которых соответствует времени переноса электронов на определенной стадии в электронно-транспортной цепи фотосинтеза, можно получать ответную флуоресценцию с параметрами, характеризующими реакции, протекающие именно на этой стадии фотосинтеза. Так, характерное время одной из первых реакций - восстановление Qa составляет около 100 мкс, таким образом, при длительности импульса значительно менее 100 мкс практически не происходит запуска реакций фотосинтеза, а потому при подаче импульса света в 1-5 мкс уровень флуоресценции соответствует исходному уровню флуоресценции хлорофилла, когда все РЦ находятся в «открытом» состоянии. При длительности импульса света 100-200 мкс происходит процесс восстановления Qa. При этом Qa практически не окисляется, т.к. последующие процессы переноса электрона по электронно-транспортной цепи происходят со значительно меньшими скоростями. Это позволяет измерить относительный размер светособирающего комплекса по углу наклона начального участка изменений интенсивности флуоресценции. Чем больше угол наклона, тем больше относительный размер светособирающей антенны.
В ответ на действие возбуждающего света длительеностью 200-1000 мс происходит полное восстановление Qa и Qb и следующего за ними пула хинонов. При этом окисление пула хинонов в дальнейших реакциях имеет значительно меньшую скорость. В этих условиях можно измерить относительную величину пула хинонов по углу наклона кривой изменения интенсивности флуоресценции.
Таким образом, при воздействии на образец импульсами света, возбуждающего флуоресценцию хлорофилла, одинаковой амплитуды, но разной длительности достигается возможность измерить на одном образце ряд показателей функционального состояния фотосинтетического аппарата объектов.
При этом измерения параметров флуоресценции хлорофилла объекта проводят как на фоне действующего света, равного по величине естественному свету в месте отбора пробы (или на фоне выбранного значения интенсивности облучения), когда реакции фотосинтеза запущены и имеют равновесный характер, так и после адаптации образца в темноте.
Создание в зоне измерений освещения, воспроизводящего интенсивность естественного освещения в месте забора пробы, позволяет определять различные типы тушения, а следовательно, рассчитывать световую кривую электронного транспорта и определять зоны оптимального фотосинтеза.
При увеличении длительности импульса свыше 1000 мс происходит запуск множества реакций фотосинтеза, что затрудняет интерпретацию полученных данных и прямое однозначное измерение параметров без адаптации образца в темноте в течение порядка 10 минут становится невозможным. Чем длительнее импульс, тем больше должно быть время темновой адаптации после него.
После адаптации в темноте электронно-транспортная цепь фотосинтеза полностью разгружена от электронов и отключены механизмы, регулирующие первичные процессы фотосинтеза. При включении света запускают как световые, так и темновые реакции, регулирующие фотосинтетические процессы. Чем короче импульс света, тем меньше время, через которое можно подавать следующий импульс без изменения фотосинтетического аппарата. Поэтому сначала подают короткие импульсы и измеряют F0, а затем более длительные импульсы для измерения остальных параметров, что экономит время каждого цикла измерений. Для достоверного статистического анализа полученных данных осуществляют подачу нескольких импульсов (группы) одинаковой длительности.
Данные, полученные при измерениях одиночными импульсами на одной пробе фитопланктона, дают возможность построения достаточно точной математической модели процессов фотосинтеза, по которой производят расчет соотношения констант скоростей реакций, протекающих в фотосинтетическом аппарате планктонных водорослей, но не измеряемых прямыми методами.
Описываемый способ определения состояния фотосинтезирующих организмов показан на конкретном примере исследования характеристик флуоресценции хлорофилла клеток фитопланктона. Такой выбор обоснован тем, что на долю фитопланктона приходится почти половина фотосинтетической биологической продукции Земли.
Забор пробы воды, содержащей клетки фитопланктона, осуществляют любым известным способом, в зависимости от задач и условий проведения исследований.
Пробу воды разделяют на два образца, один из которых помещают в измерительную камеру, где создана освещенность, имитирующая интенсивность облучения объекта в данный момент в естественных условиях, а другой образец концентрируют и помещают в отдельный блок для исследования отдельных клеток среды и определения вклада индивидуальных видов водорослей в продукционные характеристики фитопланктона.
Предварительно выбирают наиболее информативные для предполагаемых исследований флуоресцентные показатели, после чего разрабатывают протокол измерения и его аппаратурную реализацию, настроенную на условия возбуждения флуоресценции для корректного измерения флуоресцентных показателей функционального состояния ФСА объекта.
На образец воздействуют импульсами возбуждающего света с изменяемой по выбранному алгоритму длительностью и производят измерения флуоресценции хлорофилла клеток фитопланктона, возникающей в ответ на воздействие света. При всех режимах воздействия светом на образец импульсы возбуждающего света имеют одинаковую амплитуду.
Ниже приведен пример алгоритма измерений одновременно на одной пробе для определения рассмотренной выше совокупности параметров флуоресценции при использовании импульсов трех длительностей.
Предварительно в измерительной камере создают постоянную подсветку, эквивалентную по количеству квантов естественному фоновому облучению в точке отбора пробы, или интенсивность облучения задается оператором, исходя из средних типичных значений естественной облученности в месте забора пробы, на все время проведения первой стадии измерений в трех нижеследующих режимах (фиг.2).
1. Режим определения интенсивности флуоресценции хлорофилла, при котором импульсы возбуждающего света не влияют на состояние фотосинтетического аппарата.
Длительность импульсов света составляет от 1-5 мкс, интервал между импульсами - 50-100 мс при средней плотности мощности облучения не более 0,4 Вт·м-2. В данном режиме определяют среднее значение интенсивности флуоресценции хлорофилла Ft.
Количество измерений выбирают исходя из необходимости достижения заданного значения ошибки среднего либо автоматически, либо по расчетам оператора.
При средней плотности мощности облучения не более 0,4 Дж·м-2·с-1 закрываются не более 1% РЦ на импульс и следующий импульс возможно подавать уже через 10-100 мс, т.к. за это время все закрытые коротким импульсом РЦ вернутся в открытое состояние.
После завершения режима 1 включают режим 2.
2. Режим определения прироста интенсивности флуоресценции хлорофилла за время действия импульса для оценки относительного размера светособирающего комплекса пигментов фотосинтетических реакционных центров.
Для проведения этих измерений на образец подают импульс света с длительностью 100-200 мкс, производят измерения интенсивности флуоресценции хлорофилла через каждые 10 мкс и вычисляют средний прирост интенсивности флуоресценции хлорофилла за время дейс