Способ лечения инфаркта миокарда
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к кардиологии. Устанавливают в коронарный синус сердца и коронарную артерию зонды. Погружают больного в состояние общей умеренной гипотермии. При этом регенераторную реакцию миокарда осуществляют изолированной перфузией коронарного русла охлажденной кровью, при этом венозный зонд, по которому оттекает кровь от миокарда, соединяют с входом в оксигенатор. В оксигенаторе кровь из коронарного синуса насыщают кислородом, из оксигенатора кровь, забираемую из коронарного синуса, направляют в теплообменник и охлаждают до температуры 31°С. Из теплообменника оксигенированную и охлажденную кровь роликовым насосом направляют по артериальному зонду в коронарную артерию или в обе коронарные артерии. Во время перфузии миокарда измеряют разность объема между поступившей кровью в коронарное русло и забранной в коронарном синусе, для компенсации части крови, уходящей по Тебезиевым сосудам в большой круг кровообращения, дополнительно вставляют третий зонд в подходящую периферическую вену, по которому порциями добавляют периферическую венозную кровь в оксигенатор. Смесь крови из коронарного русла и венозной периферической крови многократно циркулирует по охлажденному миокарду. Способ предупреждает формирование соединительнотканного рубца на месте пораженного миокарда. 2 з.п. ф-лы, 2 ил.
Реферат
Способ относится к медицине, а именно к способам лечения ишемической болезни сердца и инфаркта миокарда.
Известны способы лечения инфаркта миокарда, которые сводятся к провокации новообразования сосудистого русла либо к регенерации кардиомиоцитов в пораженной зоне. Это лечение начинается после того как возникает адаптация организма больного к постинфарктному состоянию, а зона инфаркта организуется. Суть этих способов сводится к тому, что мононуклеарные аутологичные клетки костного мозга инъецируют в инфарктную зону во время создания обходного шунта на коронарной артерии [Hamano К., Nishida M., Hirata К. et al., 2001].
Другие авторы вводили в коронарное русло аутологичные родоначальнае клетки костного мозга через баллонный катетер для ангиопластики по поводу острого инфаркта миокарда [Assmus В., Schachinger V., Teupe С. Et al., 2002].
Для этих же целей использовались миобласты, выращенные из биопсии бедренной мышцы, которые путем слияния с кардиомиоцитами образовывали гибридные клетки, являвшиеся источниками опасных аритмий [Menasche P., Hagege A.A., Vilquin J.T. et al., 2003; см. также на сайте CELL TRANSPL.ru (http://celltranspl.ru/news/march/13-03-04.html)].
Однако все эти способы обладают существенным недостатком - большинство имплантированных клеток в миокард погибает, а оставшиеся в живых скапливаются в краевой зоне инфаркта, не вступают в контакт с соседними здоровыми клетками и не проводят электрических сигналов, обеспечивающих синхронные сердечные сокращения [Коэн С., Лиор Дж., 2005].
В клинических условиях был продемонстрирован эффект влияния умеренного охлаждения, которое способствовало уменьшению зоны инфаркта, если охлаждение применяли в ближайшие часы после возникновения инфаркта [Dixon, Whitbourn, Dae et al., 2002; Dixon, 2004; Futterman, Lemberg, 2004; Ly, Denault, Dupuis et al., 2005]. Этому предшествовала экспериментальная проверка на животных (свиньях), которая дала положительный результат [Dae et al., 2002; Maeng et al., 2003].
Известен способ лечения ишемии миокарда путем введения лекарственного средства в инфарктзависимую коронарную артерию и забора всей крови, оттекающей в коронарный синус с помощью ретроперфузионного катетара [Осиев А.Г. Патент №2093065 на изобретение «Инвазивный способ лечения ишемии миокарда»].
Так же известно, что в постинфарктный период состояние миокарда проходит четко выраженные стадии, отличающиеся как по направленности, так и по достигаемым функциональным эффектам. [Власов, Бобошко, Окунева и др., 2004].
Известно, что артериальная гипоксемия является стимулятором кроветворения - чем длительнее воздействие, тем больше костный мозг продуцирует клеточных элементов [Мешалкин, Власов, Окунева, 1982 (Глава 5, табл. 48-51)]. Поэтому умеренная гипоксемия, наблюдаемая в остром периоде инфаркта миокарда, является естественым механизмом, стимулирующим костномозговое кроветворение.
Установлено, что максимальная величина трансплантации стволовых клеток из костного мозга в миокардиальную ткань, активированную ишемией, инфарктом или другим патологическим процессом или в гомотрансплантат (донорское сердце), происходит в интервал времени - от 4 до 28 дней. В более поздние сроки - от 7 месяцев до 1,5 лет величина трансплантации стволовых клеток в пораженной зоне незначительна [Quaini, Urbanek, Beltrami, 2002]. Следовательно, максимальный эффект при стимуляции выброса стволовых клеток костным мозгом и провокации регенераторной реакции миокарда может быть достигнут в первые дни или первую неделю после возникновения инфаркта миокарда, так как именно в этот первый постинфарктный период отмечается естественная быстрая гипертрофия миокарда примерно на 5% к концу второго месяца после инфаркта.
Известно, что инфильтрация зоны поражения нейтрофилами и фибробластами провоцирует конкурирующий процесс формирования соединительнотканного рубца на месте пораженного миокарда [Серов, Шехтер, 1981 (стр.120-121)], который прерывает процесс спонтанно возникающей регенерации миокарда, не позволяя возникнуть на месте погибших клеток новым клеткам, которые бы восстановили непрерывную цепь клеток, то есть органоспецифичную регенерацию.
Установлено, что пролонгированная умеренная гипотермия у животных (31°С) блокирует инфильтрацию раневой зоны нейтрофилами и фибробластами, и заживление асептической раны происходит без образования соединительнотканного рубца при органоспецифичной регенарации всех компонентов (например, кожи) в раневой зоне [Мяделец, Пчельникова, Суханов, 1993; Мяделец, 1994].
Известно, что при общей бесперфузионной гипотермии при достижении температуры тела 30-31°С выброс сердца (минутный объем кровообращения) уменьшается до 60% исходной величины [Литасова, Власов, Окунева и др., 1997]. Другие авторы показали, что изолированное охлаждение сердца до этого уровня не влияет на величину его выброса [Futterman, Lemberg, 2004; Dae et al, 2002; Maeng et al., 2003].
Установлено, что лечение препаратами глюкокортикоидов (например - methylprednisolone) нарушений микроциркуляции в миокарде блокирует проникновение лейкоцитов в пораженные зоны и тем самым прогрессивно сокращает дисфункцию пораженных участков [Skyschally, Haude, Dörge et al., 2004].
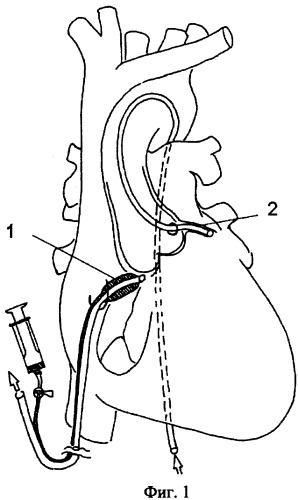
Способ реализуется следующим образом. У экстренно поступившего больного определяют величину и локализацию инфаркта миокарда, осуществляют общую анестезию. Под общей анестезией производят установку зондов - ретроперфузионного (Фиг.1(1)) в коронарный синус сердца, фиксируемого специальным баллоном, артериального (Фиг.1(2)), вставляемого в инфарктзависимую коронарную артерию, и больного погружают в состояние умеренной гипотермии.
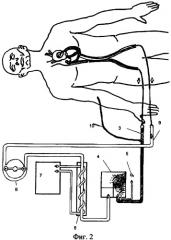
Для того чтобы вызвать регенераторную реакцию миокарда, осуществляют изолированную перфузию коронарного русла охлажденной кровью (Фиг.2), которую забирают из коронарного синуса. Венозный ретроперфузионный зонд, по которому оттекает кровь от миокарда, соединяется с венозной магистралью (Фиг.2(3)), которую соединяют с входом в оксигенатор (Фиг.2(4)), в котором кровь из коронарного синуса насыщают кислородом по газовой магистрали (Фиг.2(5)), из оксигенатора насыщенную кислородом кровь, забираемую из коронарного синуса, направляют в теплообменник (Фиг.2(6)) и охлаждают до заданной температуры, а величина охлаждения задается термостатом (Фиг.2(7)).
Из теплообменника оксигенированную и охлажденную кровь роликовым насосом (Фиг.2(8)) направляют по артериальной магистрали (Фиг.2(9)) и соединенному с ней артериальному зонду в коронарную артерию или в обе коронарные артерии.
Во время перфузии миокарда измеряют разность между поступившей кровью в коронарное русло по артериальному зонду и забранной из коронарного синуса.
Для компенсации части крови, уходящей по Тебезиевым сосудам в большой круг кровообращения, дополнительно вставляют третий зонд (Фиг.10)) в подходящую периферическую вену. По нему добавляют периферическую венозную кровь в оксигенатор.
Смесь крови из коронарного русла и венозной периферической крови, содержащей стволовые клетки из красного костного мозга, многократно циркулирует по охлажденному миокарду и тем самым увеличивают вероятность попадания стволовых клеток в пораженные участки миокарда.
Стволовые клетки, попадая в пораженные участки миокарда, стимулируют регенерацию кардиомиоцитов, эндотелиальных клеток и гладкомышечных клеток, а низкая температура блокирует проникновение фибробластов в раневую зону и тем самым обеспечивает безрубцовое заживление.
Для провокации продукции эритропоэтинов и тем самым стимуляции функции костного мозга создают искусственную гипоксемию путем соответствующего подбора дыхательных газовых смесей со снижением парциального давления кислорода, которыми дышит пациент.
Дополнительно для облегчения трансплантации стволовых клеток на границе жизнеспособной и нежизнеспособной ткани в пораженной зоне миокарда и дополнительного предупреждения формирования соединительнотканного рубца в коронарную кровь добавляют терапевтические дозы препаратов из группы глюкокортикоидов.
Литература
1. Hamano К., Nishida M., Hirata К., et al., Local implantation of autologous bone marr0w cells for therapeutic angiogenesis in patients with ischemic heart disease: clinical trial and preliminary resylts. // Jap. Circ. J. - 2001. - V.65. - P.845-847.
2. Assmus В., Schachinger V., Teupe C. Et al. Transplantation of progenitor cells and regeneration enhancement in acute myocardial infarction (TOP-CARE-AMI). // Circulation. - 2002. - V.106. - P.3009-3017.
3. Menasche P., Hagege A.A., Vilquin J.T. et al. Autologous skeletal mioblast transplantation for severe postinfarction left ventricular dysfunction. // J. Am. Coll. Cardiol. - 2003. - V.41. - N7. - P.1078-1083.
4. Клеточные технологии в медицине, http://celltranspl.ru/news/march/13-03-04.html.
5. Коэн С., Лиор Дж. Как восстановить разбившееся сердце? // В мире науки - 2005. - №2. - с.24-31.
6. Dixon S.R., Whitbourn R.J., Dae M.W. et al. Induction of mild systemic hypotermia with endovascular cooling during primary percutaneous coronary intervention for acute myocardial infartion // J. Am. Coll. Cardiol. - 2002. - V.40. - №11. - P.1928-1934.
7. Dixon S.R. Hypothermia during acute myocardial infarction / ACC 53rd Annual Scientific Session. Rapid News Summaries. March 7-10, 2004.
8. Futterman L.G., Lemberg L. The significance of hypothermia in the preserving ischemic myocardium - Cardiology Casebook // Amer. J. Critical Care. - 2004 Jan.
9. Ly H.Q., Denault A., Dupuis J. et al. A pilot study: the noninvasive sur face cooling thermoregulatory system for mild hypothermia induction in acute myocardial infarction (the NICAMI Study) // Am. Heart J. - 2005. - V.150. - №5. - P.933.e9 - 933.e13.
10. Dae M.W., Dong Wei Gao, Sessler D.I. et al. Effect of endovascu-Lar cooling on myocardial temperature, infarct size and cardiac output in human-sized pigs // Am. J. Physiol. Heart Circ. Physiol. - 2002. - V.282. - №5. - H1584 - H1591.
11. Maeng M., Kristiansen S.B., Mortensen U.M. et al. Myocardial cooling for reperfusion injury protection achieved by organ specific hypothermic autologous perfusion // Scand. Cardiovasc. J. - 2003. - V.37. - №5, - P.297-303.
12. Осиев А.Г. Патент №2093065 на изобретение «Инвазивный способ лечения ишемии миокарда»].
13. Власов Ю.А., Бобошко А.В., Окунева Г.Н., Чернявский A.M., Пак И.А. Эволюция гемодинамики и коронарного кровообращения в течение длительного постинфарктного периода (более 10 лет) у больных ишемической болезнью сердца // Патология кровообращения и кардиохирургия. - 2004. - №3. - С.20-28.
14. Мешалкин Е.Н., Власов Ю.А., Окунева Г.Н. Хроническая артериальная гипоксемия человека. - Новосибирск: Наука, 1982. - 278 с.
15. Quaini F., Urbanek К., Beltrami A.P. et al. Chimerism of the trans planted heart // N. Engl. J. Med. - 2002. - V.346. - №1. - P.5-15.
16. Серов В.В., Шехтер А.Б. Соединительная ткань. - M.: Медицина, 1981 г., с.312.
17. Мяделец О.Д., Пчельникова Е.Ф., Суханов А.Ф. Особенности заживления кожной раны, нанесенной в условиях нормо- и гипотермии // Патологическая физиология и экспериментальная терапия. 1993 - №3. - С.47-50.
18. Мяделец О.Д. Исследование условий органотипической регенерации кожи при нанесении раны на фоне общей глубокой гипотермии организма // Патологическая физиология и экспериментальная терапия. 1994 - №2. - С.33-35.
19. Литасова Е.Е., Власов Ю.А., Окунева Г.Н. и др. Клиническая физиология искусственной гипотермии. - Новосибирск: Наука. Сиб. Предприятие РАН, 1997. - с.565.
20. Skyschally A., Haude M., Dörge H. et al. Glucocorticoid treatment prevents progressive myocardial disfunction resulting from experimental coronary microembolisation // Circulation. - 2004. - V.109. - №19. - P.2337-2342.
1. Способ лечения инфаркта миокарда, включающий общую анестезию пациента, установку зондов в коронарный синус сердца и коронарную артерию, погружение больного в состояние общей умеренной гипотермии, отличающийся тем, что регенераторную реакцию миокарда осуществляют изолированной перфузией коронарного русла охлажденной кровью, при этом венозный зонд, по которому оттекает кровь от миокарда, соединяют с входом в оксигенатор, в оксигенаторе кровь из коронарного синуса насыщают кислородом, из оксигенатора кровь, забираемую из коронарного синуса, направляют в теплообменник и охлаждают до температуры 31°С, из теплообменника оксигенированную и охлажденную кровь роликовым насосом направляют по артериальному зонду в коронарную артерию или в обе коронарные артерии, во время перфузии миокарда измеряют разность объема между поступившей кровью в коронарное русло и забранной в коронарном синусе, для компенсации части крови, уходящей по Тебезиевым сосудам в большой круг кровообращения, дополнительно вставляют третий зонд в подходящую периферическую вену, по которому порциями добавляют периферическую венозную кровь в оксигенатор, смесь крови из коронарного русла и венозной периферической крови многократно циркулирует по охлажденному миокарду.
2. Способ по п.1, отличающийся тем, что для провокации продукции эритропоэтинов и стимуляции функции костного мозга создают искусственную гипоксемию путем соответствующего подбора дыхательных газовых смесей со снижением парциального давления кислорода, которыми дышит пациент.
3. Способ по п.1, отличающийся тем, что для облегчения трансплантации стволовых клеток на границе жизнеспособной и нежизнеспособной ткани в пораженной зоне миокарда и дополнительного предупреждения формирования соединительно-тканного рубца в коронарную кровь добавляют терапевтические дозы препаратов из группы глюкокортикоидов.