Способ для лечения перитонита
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к абдоминальной хирургии, и может найти применение в хирургическом лечении острого перитонита. Сущность способа заключается в лапаротомии, удалении очага воспаления в брюшной полости, санации брюшной полости, создании лапаростомы с помощью спицевого адаптационно-репозиционного аппарата. При этом края раны сводят под одновременным контролем уровня повышения внутрибрюшного давления и силы натяжения паравульнарных тканей. Причем, если внутрибрюшное давление достигает 15 мм рт.ст. или сила натяжения паравульнарных тканей достигает 30 Н, то края раны дальше не сводят и фиксируют. Использование данного изобретения позволяет контролировать и корригировать внутрибрюшное давление, степень натяжения паравульнарных тканей лапаростомы при плановых санациях, а также избежать развития синдрома абдоминальной компрессии, микроциркуляторных нарушений в тканях передней брюшной стенки при перитоните. 4 ил.
Реферат
Изобретение относится к медицине, а именно к способам и устройствам для хирургического лечения перитонита.
Несмотря на достигнутые в последние годы определенные успехи в лечении перитонита, он продолжает оставаться одной из важнейших хирургических проблем. Около 15% заболеваний органов живота сопровождается развитием перитонита, наиболее тяжелым клиническим проявлением которого является распространенная форма. Статистические данные свидетельствуют о крайне неудовлетворительных исходах при лечении разлитых гнойных перитонитов [3, 6]. Многочисленные оперативные приемы, широкое применение антибактериальных средств с различными путями их введения, активных детоксикационных методов (гемо- и лимфосорбция, плазмоферез и др.), способов гипероксигенации тканей (баротерапия и др.), использование компонентов и заменителей крови не привело к значимому снижению летальности, которая при распространенном перитоните достигает 60%, а при госпитальном перитоните 80% [4].
Основная причина смерти при остром перитоните - развитие на фоне тяжелого эндотоксикоза каскада прогрессирующих микроциркуляторных нарушений и полиорганной недостаточности в ближайшем послеоперационном периоде [5]. В современной хирургии перитонита все большее значение в патогенезе микрососудистой и полиорганной дисфункции придается синдрому абдоминальной компрессии (САК) [9, 11, 12].
В настоящее время применяются несколько основных способов лечения распространенного перитонита: закрытый применяется при низкой степени бактериальной контаминации брюшной полости и при сроках развития заболевания, не превышающих 6 часов; лапароскопический (лапароскопический ассистированный) способ применяется как альтернатива релапаротомии и аналогично предыдущему методу; полузакрытый способ, заключающийся в лапаротомии, устранении источника перитонита, санации и дренировании брюшной полости; полуоткрытый способ - программированные релапаротомии (ПР), используемые при высокой бактериальной контаминации брюшной полости, невозможности в ходе одной операции ликвидировать полностью источник перитонита или факторы его прогрессирования, при наличии синдрома полиорганной дисфункции; открытый способ - лапаростомия, применяется при обширных неудалимых в ходе одной операции деструктивных изменениях в брюшной полости, кишечных свищах, при инфицированных панкреонекрозах [7].
Однако полузакрытый способ лечения перитонита, заключающийся в том, что после санации брюшной полости края лапаротомной раны ушиваются, а в послеоперационном периоде через дренажи, установленные в брюшной полости, производится проточный или фракционный перитонеальный диализ, имеет следующие недостатки: даже тщательный однократный интраоперационный лаваж брюшной полости растворами антисептиков при гнойном перитоните не приводит к стерильности брюшины; роль послеоперационного лаважа через оставленные в брюшной полости дренажи подвергается большому сомнению, так как дренажные трубки уже в первые сутки послеоперационного периода отграничиваются сращениями и прилежащими тканями, и санирующие растворы омывают лишь узкие ходы в брюшной полости [7]; к существенным недостаткам перитонеального диализа относят вымывание большого количества белков и фагоцитов, создание благоприятных условий для развития неклостридиальной микрофлоры и невозможность осуществления контроля за динамикой патологического процесса.
Полуоткрытый способ лечения перитонита, заключающийся в том, что после санации брюшной полости создается лапаростома путем вшивания в края раны молнии-застежки (1, 13), позволяет производить плановые санации брюшной полости после первичной операции по поводу перитонита. Однако он имеет следующие недостатки: для фиксации молнии-застежки требуется наложение большого количества швов. Стерилизация такой застежки затруднена. Из-за сложности конструкции создаются условия для накопления в застежке грязи, крови, что может вызвать не только заедание ее замка, но и повлечь серьезные осложнения при лечении раны. Причем устройство фиксирует лишь сопоставленные края раны, не способствуя равномерному, атравматичному, одномоментному или дискретному их сближению (самый трудный этап хирургического пособия). При этом невозможно достичь как декомпрессии в брюшной полости при развитии абдоминальной гипертензии, так и необходимой компрессии тканей сопоставленных краев раны, то есть создать оптимальные условия для заживления и предупредить вторичную контаминацию и присоединение госпитальной инфекции.
Открытый способ лечения острого распространенного перитонита, позволяющий поддерживать внутрибрюшное давление на уровне атмосферного и не создающий усилия натяжения на паравульнарные ткани лапаростомы, также имеет существенные недостатки. Неконтролируемая полная декомпрессия брюшной полости является патофизиологической основой осложнений - артериальной гипотензии, нарушений сердечного ритма и асистолии, а также тромбоэмболии легочной артерии, что усугубляет гемодинамические нарушения, развивающиеся у больных с перитонитом на фоне эндотоксикоза (8); состояние, при котором края лапаротомной раны максимально разведены в течение длительного времени, приводит к нарушению биомеханической функции мышц брюшного пресса, ригидности передней брюшной стенки, что усугубляет мышечную контрактуру, развивающуюся при перитоните; после разрешения перитонита ушивание атрофированного, ригидного мышечно-апоневротического слоя брюшной стенки увеличивает риск резкого одномоментного повышения внутрибрюшного давления, макро- и микроциркуляторных нарушений в органах брюшной полости и грудной клетки, часто неудавшиеся попытки сопоставления легко рвущихся перивульнарных тканей приводят к образованию дефектов тканей, требующих затем проведения восстановительных операций [2].
В настоящее время для лечения перитонита предложены и применяются техническое устройство и способ, наиболее близкие по технической сущности к предлагаемому нами изобретению и взятые нами за прототип. Устройство для сведения краев лапаротомной раны представляет собой раноадаптерный аппарат (А.с. СССР N1165376, А61В 17/10, 1985) и содержит зубчатую рейку с прижимными пластинами и храповый механизм с ручкой. Прижимные пластины, выполненные сборными из отдельных секций, имеющие шипы и отверстия, фиксируются на краях лапаротомной раны, храповый механизм необходим для их дозированного сведения и разведения. Применение данного устройства позволяет дозированно сопоставлять края лапаростомы, надежно, малотравматично фиксировать их; обеспечивает техническую возможность применения способа лечения перитонита, заключающегося в многократных (по показаниям) и малотравматичных плановых санациях брюшной полости.
Однако данные устройство и способ имеют существенные недостатки:
1) не позволяют контролировать изменения уровня абдоминальной компрессии на всех этапах операции и в раннем послеоперационном периоде;
2) не позволяют контролировать степень натяжения паравульнарных тканей и состояние микроциркуляторного русла тканей передней брюшной стенки, что повышает риск распространения инфекционно-воспалительного процесса на переднюю брюшную стенку, раневых осложнений.
Цель изобретения - улучшение результатов лечения больных с острым перитонитом путем предупреждения развития синдрома абдоминальной компрессии, микроциркуляторных нарушений и раневых осложнений.
Поставленная цель достигается тем, что сведение краев лапаростомы проводят под одновременным контролем внутрибрюшного давления и натяжения паравульнарных тканей, причем если в процессе сведения краев раны внутрибрюшное давление достигает 15 мм рт.ст. или сила натяжения паравульнарных тканей достигает 30 Н, края раны дальше не сводятся и фиксируются браншами аппарата. При этом для дозированного сведения краев лапаротомной раны применяется новое устройство: спицевой адаптационно-репозиционный аппарат с приклеенным на его браншу резистивным тензометрическим датчиком натяжения паравульнарных тканей, для измерения внутрибрюшного давления используется помещенный в брюшную полость эластичный баллон из медицинской резины объемом 30 мл, заполненный воздухом и герметично соединенный с электронным датчиком давления, а для синхронной фиксации изменений уровня внутрибрюшного давления и натяжения паравульнарных тканей используется электронная система регистрации. Критические уровни измеряемых параметров, при достижении которых прекращается сведение краев лапаростомы, обусловлены тем, что при повышении внутрибрюшного давления до 15 мм рт.ст. и росте усилия натяжения паравульнарных тканей до 30 Н начинают развиваться необратимые микроциркуляторные нарушения в органах брюшной полости, грудной клетки (10) и тканях брюшной стенки (14).
Конструкция и принцип действия устройства приведены на чертежах:
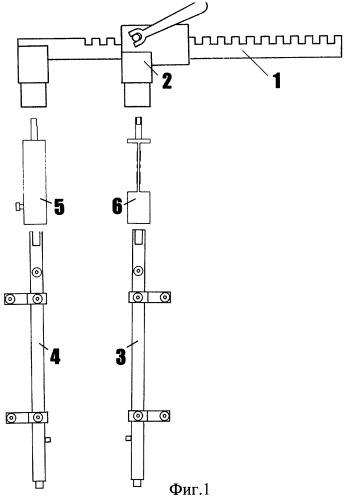
Фиг.1 - общий вид устройства (СпАРА, система регистрации давления и усилия) в разобранном виде.
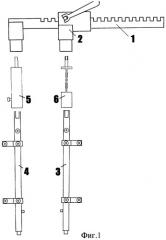
Фиг.2 - резистивный датчик усилия на насадке бранши СпАРА.
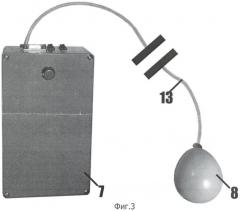
Фиг.3 - система для измерения внутрибрюшного давления.
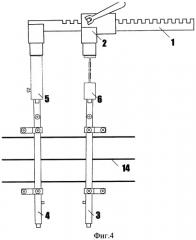
Фиг.4 - общий вид устройства (СпАРА, система регистрации усилия) в собранном виде.
Устройство (фиг.1) состоит из зубчатой рейки 1 и реечно-винтового механизма 2, на которых расположены подвижная 3 и неподвижная 4 бранши аппарата. На браншах аппарата закреплены две насадки 5, 6, одна из которых (6), установленная на подвижной бранше, функционально служит для крепления тензометрических датчиков, преобразующих механические деформации в электрические сигналы, и представляет собой (фиг.2) прямоугольную пластину, имеющую на концах присоединительные втулки 9, 10 и центральную часть прямоугольного сечения 11 с приклеенным резистивным датчиком усилия 12. Информация с датчика усилия в виде электрических сигналов передается в контроллер 7 (фиг.1).
Часть устройства, предназначенная для измерения внутрибрюшного давления, (фиг.3) состоит из терминального отдела датчика давления 8, представляющего собой эластичный резиновый баллон объемом 30 мл, заполненный воздухом, сообщающегося и герметично закрепленного на полихлорвиниловой трубке 13. Противоположный конец трубки подсоединяется к контроллеру 7 системы синхронной регистрации внутриполостного давления и усилия.
Электрическая часть регистрационной системы состоит из следующих частей:
1. Датчики:
а) усилия на браншах
б) внутриполостного (внутрибрюшного) давления
2. Модуль контроллера, состоящий из контроллера и устройств оцифровки данных.
3. ЭВМ, составляющая, необходимая для вывода данных контроллера на монитор, а также анализа и обработки измеренных данных.
Модуль контроллера состоит собственно из самого контроллера, трех модулей АЦП для регистрации сигналов нагрузки, давления и температуры, усилителей сигналов, блока питания датчиков и интерфейсного модуля RS-232. Блок питания датчиков обеспечивает подачу питания на тензометрические мосты датчика силы натяжения и датчика давления. Усилители предназначены для усиления и согласования сигналов с датчиков и измерительных цепей. Три модуля АЦП производят оцифровку сигналов с частотой дискретизации до 10 Гц. Контроллер обеспечивает синхронизацию запуска отдельных устройств, прием команд от ЭВМ и выдачу измеренных данных на ЭВМ через порт RS-232.
Предложенный способ лечения перитонита осуществляют следующим образом. После устранения источника перитонита и санации брюшной полости, при наличии показаний к дальнейшим плановым санациям, в брюшную полость между петлями кишечника помещают терминальный отдел датчика давления. Противоположный конец трубки выводят через контраппертуру на переднюю брюшную стенку и герметично подсоединяют к контроллеру, после чего фиксируют уровень внутрибрюшного давления при полностью разведенных краях лапаротомной раны. Далее проводят поэтапное дозированное сведение краев лапаротомной раны. Для этого используют спицевой адаптационно-репозиционный аппарат (СпАРА) (фиг.4) с перпендикулярным проведением спиц 14 через края раны. В процессе сведения краев лапаростомы производят одновременное измерение динамики внутрибрюшного давления и усилия стягивания перивульнарных тканей. Полученные данные фиксируются регистрационной системой и отображаются на мониторе компьютера.
Система позволяет одновременно производить регистрацию параметров усилия натяжения мягких тканей в процессе сближения краев раны, внутрибрюшного давления. При этом когда любой из контролируемых параметров достигает критического значения, т.е. когда внутрибрюшное давление повышается до 15 мм рт.ст. выше атмосферного, или натяжение паравульнарных тканей достигает уровня З0Н, процесс сведения краев раны прекращается, бранши СпАРА фиксируются.
Уровень измеряемых параметров фиксируют также в раннем послеоперационном периоде - после прекращения действия миорелаксантов, выведения больного из наркоза, при необходимости степень сведения краев лапаростомы изменяют с помощью СпАРА. После этого систему регистрации отсоединяют от аппарата.
Предложенный способ лечения перитонита позволяет контролировать динамику роста внутрибрюшного давления и усилия натяжения паравульнарных тканей при сведении краев лапаротомной раны и не допускать развития микроциркуляторных нарушений и синдрома абдоминальной компрессии в послеоперационном периоде; предложенное устройство обеспечивает техническую возможность одновременного измерения двух параметров и надежную фиксацию краев лапаротомной раны при достижении критических величин давления и силы натяжения; электронная система регистрации позволяет одновременно измерять, фиксировать и визуализировать данные о внутрибрюшном давлении и усилии натяжения паравульнарных тканей на мониторе компьютера.
Клиническое применение способа и устройства было проведено в хирургическом отделении ГКБ №12 г.Н.Новгорода. В 2005 г. способ применен при лечении 12 пациентов в возрасте от 19 до 76 лет с диагнозом «разлитой перитонит». Перитонит у всех пациентов был вторичным и развился на фоне воспалительных, онкологических заболеваний либо в результате травмы органов брюшной полости, степень тяжести перитонита в соответствие с мангеймским индексом в большинстве случаев - у 7 пациентов из 12 - была III, у 5 пациентов - II.
В результате проведенного исследования было установлено, что в 10 из 12 случаев при закрытии лапаротомной раны после первичной операции по поводу острого перитонита внутрибрюшное давление возрастает до уровня 15 мм рт.ст. и выше, причем при полном сопоставлении краев раны в 3-х случаях полостное давление превышало 25 мм рт.ст. В 4-х случаях процесс сведения краев лапаротомной раны сопровождался критическим уровнем усилия на паравульнарных тканях - выше 30 Н. Во всех этих случаях сведение краев раны прекращалось, бранши СпАРА фиксировались.
После первичной операции больным было проведено от 1 до 5 плановых санаций брюшной полости. Средние сроки нахождения СпАРА на ране с момента его установки составили 12,4 суток, а после ушивания раны 7,1 суток. Показанием к удалению аппарата являлись регресс воспаления в брюшной полости и в области раны.
При этом во всех случаях удалось избежать развития синдрома абдоминальной компрессии, сократился срок перехода больного на спонтанное дыхание в раннем послеоперационном периоде, не отмечалось острых дыхательных и гемодинамических нарушений. Послеоперационная рана у 9 пациентов зажила первичным натяжением, у 1-го пациента - инфицированная серома ограниченного участка раны. Не наблюдалось образования пролежней, лигатурных свищей, эвентраций. Летальный исход - в 2-х случаях, причиной смерти были: сепсис, гнойный перикардит; раковая интоксикация, полиорганная недостаточность.
Клинические примеры:
Больной К., 52 года, поступил в х/о 16.02.2004 г. на 6 сутки от начала заболевания с клинической картиной разлитого перитонита. Состояние при поступлении тяжелое, АД 90/60 мм рт.ст., пульс 120 в мин. Живот во всех отделах резко болезненный, напряжен при пальпации. Кишечные шумы не выслушивались. Анализ крови: Нв 124 г/л; эр. 3,60×1012 /л; л. 14,2×109 /л; п 6%, с 55%, э 1%, лимф. 30%, мон. 7%; СОЭ 22 мм/ч. После предоперационной подготовки больной прооперирован. Интраоперационно в брюшной полости большое количество гнойного экссудата с примесью желчи, наложения фибрина, желчный пузырь гангренозно изменен, перфорирован. Диагноз: острый гангренозный перфоративный калькулезный холецистит. Произведена холецистэктомия, санация, дренирование брюшной полости. Ввиду наличия в брюшной полости неудалимых фибриновых наложений, тяжести состояния больного принято решение о проведении плановой санации через 24-48 часов. На края раны наложен СпАРА с параллельным проведением спиц, края раны сведены полностью. Внутрибрюшное давление не измеряли. В послеоперационном периоде в течение 10 часов больной нуждался в продленной искусственной вентиляции легких, сохранялась гипотония, тахикардия до 130 уд. в мин.
В связи с нарастающим эндотрахеальным давлением, тяжестью состояния больного измерено внутрибрюшное давление методом открытого уретрального катетера, оно составило 22 мм рт.ст. Края раны разведены, внутрибрюшное давление снизилось до 13 мм рт.ст., через 40 минут после этого у больного восстановилось спонтанное дыхание. 18.02.04 развилась правосторонняя нижнедолевая пневмония. В дальнейшем больному было поведено 4 плановые санации, состояние медленно улучшалось, через 22 дня больной выписан.
Больная Г., 48 лет, поступила в хирургическое отделение 13.06.2005 г. на 3-е сут от начала заболевания. Общее состояние тяжелое, заторможена. АД 100/65 мм рт.ст., пульс 130 в мин. Язык сухой, обложен грязным налетом. Живот во всех отделах резко болезненный, напряжен при пальпации. Кишечные шумы не выслушивались. Анализ крови: Нв 94 г/л; эр. 3,02×1012 /л; л. 11,1×109 /л; п 8%, с 54%, э 3%, лимф. 32%, мон. 3%; СОЭ 25 мм/ч. На обзорной рентгенографии органов брюшной полости: единичные уровни в тонких и толстых отделах кишечника. После интенсивной дезинтоксикационной инфузионной терапии с диагнозом распространенный перитонит больная экстренно оперирована. При ревизии во всех отделах брюшной полости гнойный выпот (500 мл), париетальная, висцеральная брюшина гиперемирована, массивные налеты фибрина. В правой подвздошной ямке - массивные налеты фибрина, червеобразный отросток 9×1,5 см, гангренозно изменен, с перфоративным отверстием. Диагноз: острый гангренозный перфоративный аппендицит, разлитой фибринозно-гнойный перитонит.
Ввиду наличия тяжелой формы распространенного гнойно-фибринозного перитонита был использован предлагаемый способ. Во время первичной операции после аппендектомии, санации, дренирования брюшной полости при сведении краев лапаротомной раны внутрибрюшное давление повысилось на 15 мм рт.ст, после чего края лапаротомной раны были зафиксированы с помощью СпАРА с диастазом 4 см. В раннем послеоперационном периоде после прекращения действия миорелаксантов выявлена тенденция к повышению внутрибрюшного давления, с помощью СпАРА края лапаротомной раны вновь разведены, после чего внутрибрюшное давление 12 мм рт.ст., диастаз 7 см. При этом усилии натяжения на паравульнарных тканях не превышало 15Н. Впоследствии под наркозом провели 5 этапных санаций брюшной полости. Состояние постепенно улучшалось. На 3-и сутки больная начала сидеть, а на 5-е ходить. Заживление раны осуществлялось аппаратным методом, что позволило предотвратить развитие синдрома абдоминальной компрессии, добиться заживления раны по типу первичного натяжения. На 13-е сутки после поступления в клинику в удовлетворительном состоянии выписана.
Таким образом, предложенные способ и устройство для лечения перитонита являются эффективными, позволяют непосредственно во время операции и в раннем послеоперационном периоде одновременно контролировать динамику изменения внутрибрюшного давления и усилия на паравульнарных тканях и тем самым избегать развития синдрома абдоминальной компрессии и микроциркуляторных нарушений в тканях передней брюшной стенки.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. Бут В.И. Застежка молния. // Открытия изобретения. - 1989. - №37. - С.15.
2. Бытка П.Ф. и соавт. Открытое лечение послеоперационного перитонита. - Вест. хир. - 1988. - №10. - С.109-111.
3. Гостищев В.К. Оперативная гнойная хирургия. М.: Медицина, 1996. 220 с.
4. Гостищев В.К., Сажин В.П., Авдовенко А.Л. Перитонит. М. Медицина. 1992. 224 с.
5. Кузин М.И. Синдром системного ответа на воспаление. // Хирургия. 2000. №2. с.54-59.
6. Стручков В.И. и соавт. Гнойная хирургия. М.: Медицина, 1962.
7. Шайн М. Здравый смысл в неотложной абдоминальной хирургии. / Пер. с англ. и ред. Б.Д.Савчука. - М.: ГЭОТАР-МЕД, 2003. - 272 с.
8. Abdominal compartment syndrome. / S.T.Reeves, M.L.Pinosky, Т.К.Byrne, E.D.Norcross // Can. J. Anaesth. - 1997. - Vol.44, №3. - P.308-312.
9. Diebel L.N., Dulchavsky S.A., Brown W.J. Splanchnic ischemia and bacterial translocation in the abdominal compartment syndrome. J Trauma 1997; N 43. - P.852-855.
10. Diebel L.N., Dulchavsky S.A., Wilson R.F. Effect of increased intra-abdominal pressure on mesenteric arterial and intestinal mucosal blood flow. / J. Trauma. - 1992. - №1. - Р.45-49.
11. Malbrain MLNG. Abdominal pressure in the critically ill. Curr Opin Crit Care, 2000. N6. - P.17-29
12. Schein М., Wittman D.H., Aprahamian C.C., Condon R.E. The abdominal compartment syndrome: the physiological and clinical consequences of elevated intra-abdominal pressure. J Am Col Surg 1995; N180. - P.745-53.
13. Teichmann W. et al. Der Reibverschluβ als neue Method des temporalen Banchdeckenverschlusses in der Abdominale chirurgie. // Chirurg. - 1985. - N3. - S.173-174.
14. Hirshowitz В., Lindenbaum E., Har-shai Y. A scin-stretching devise for the harnessing of viscoelastic properties of scin. // Plast Reconstr Surg. - 1993. - N 92. - P. 260-270.
Способ для лечения перитонита, заключающийся в лапаротомии, удалении очага воспаления в брюшной полости, санации брюшной полости, создании лапаростомы с помощью спицевого адаптационно-репозиционного аппарата, отличающийся тем, что края раны сводят под одновременным контролем уровня повышения внутрибрюшного давления и силы натяжения паравульнарных тканей, причем если внутрибрюшное давление достигает 15 мм рт.ст. или сила натяжения паравульнарных тканей достигает 30 Н, края раны дальше не сводят и фиксируют.