Композиции пролонгированного действия с контролируемым высвобождением
Иллюстрации
Показать всеОписаны способы и композиции для системного или локального введения лечебного средства пациенту, причем они включают, например, гелевые композиции пролонгированного действия, которые могут быть инъецированы в желаемое местоположение и которые могут обеспечить контролируемое высвобождение лечебного средства на протяжении продолжительного периода времени. Композиции включают биосовместимый полимер, биосовместимый растворитель, имеющий низкую растворимость в воде, который образует вязкий гель с полимером и ограничивает поглощение воды имплантатом, а также лечебное средство. 6 н. и 36 з.п. ф-лы, 17 табл., 21 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к гелевым композициям пролонгированного действия (гелевым депо-композициям), которые могут быть инъецированы в желаемую область и которые могут обеспечить контролируемое высвобождение лечебного средства в течение определенного/желаемого периода времени. Данное изобретение также относится к способам получения и введения упомянутых композиций.
УРОВЕНЬ ТЕХНИКИ
Биоразрушаемые (биодеградируемые) полимеры используются в медицинских приложениях в течение многих лет. Устройства, иллюстрирующие применение биоразрушаемых полимеров и созданные на их основе, включают в себя шовный материал, хирургические скобы, скрепки, имплантаты и системы доставки лекарственных средств. Большинство данных биоразрушаемых полимеров было основано на гликолиде, лактиде, капролактоне и сополимерах перечисленных соединений.
Биоразрушаемые полимеры могут представлять собой термопластичные материалы, это значит, что они могут быть нагреты и им может быть придана форма различных изделий, таких как волокна, скобы, скрепки, штифты, пленки и т.п. С другой стороны, они могут являться термоотверждающимися материалами, образуемыми реакциями сшивания, которые приводят к получению материалов с высокой молекулярной массой, не плавящимся и не образующим текучих жидкостей при высоких температурах. Хотя термопластические и термоотверждаемые биоразрушаемые полимеры находят много полезных медико-биологических применений, имеется несколько важных ограничений для их использования в организмах различных животных, включая людей, зверей, птиц, рыб и пресмыкающихся.
Системы доставки лекарственных средств на основе твердых имплантатов, содержащих лекарство, включенное в термопластические или термоотверждаемые биоразрушаемые полимеры, использовались широко и успешно. Такие имплантаты должны быть помещены в организм через разрез, который иногда оказывается больше, чем желательно с точки зрения медицинского работника и, порой, ведет к нежеланию пациента давать согласие на применение такого имплантата или системы доставки лекарственного средства. Следующие патенты Соединенных Штатов №№ 5456679, 5336057, 5308348, 5279608, 5234693, 5234692, 5209746, 5151093, 5137727, 5112614, 5085866, 5059423, 5057318, 4865845, 4008719, 3987790 и 3797492, как полагают, являются репрезентативными в отношении подобных систем доставки лекарств и включены в настоящее изобретение при помощи ссылок. Данные патенты описывают резервуарные устройства, устройства осмотической доставки, пульсирующие устройства для доставки лечебного средства.
Введение системы доставки лекарственного средства в виде маленьких частиц, микросфер или микрокапсул позволяет избежать разреза, необходимого для имплантации систем доставки лекарственного средства. Однако данные препараты не всегда удовлетворяют требованиям для биоразрушаемого имплантата. Данные препараты, по своей природе состоящие из мелких частичек, не образуют сплошную пленку или твердый имплантат со структурной целостностью, необходимой для постоянного протеза, причем частицы склонны к агрегации и, следовательно, их поведение трудно предсказать. При помещении в отдельные полости тела, в которых существуют значительные потоки жидкости, такие как рот, периодонтальный карман, глаз или влагалище, данные небольшие частицы, микросферы и микрокапсулы плохо удерживаются из-за их небольших размеров и дискретной природы. Далее, в случае возникновения осложнений, удаление из тела микрокапсул или систем с маленькими частицами без значительного хирургического вмешательства является значительно более трудным, чем в случае целостных имплантатов. Дополнительные проблемы представляют производство, хранение, а также пригодность для введения, в случае микросфер или микрокапсул, изготовленных из данных полимеров и содержащих лекарственные средства для высвобождения в организм.
В качестве ответа на вышеупомянутые проблемы в технике были разработаны различные системы доставки лекарственных средств. Следующие патенты Соединенных Штатов №№ 6432438, 5990194, 5780044, 5733950, 5620700, 5599552, 5556905, 5278201, 5242910 и 4938763, а также публикации PCT WO98/27962, WO 02/00137 и WO 02/058670, как полагают, являются репрезентативными и включены в данный патент при помощи ссылок. См. также Jain, R. et al., "Controlled drug delivery by biodegradable poly(ester) devices: different preparative approaches", Drug Dev. Ind. Pharm., 24(8): 703-727, 1998; Eliaz, R.E. and Kost, J., "Characterization of a polymenric PLGA-injectable implant deliver system for the controlled release of proteins", J. Biomed. Master Res., 50(3): 388-396, 2000; и Jain, R. A., "The manufacturing techniques of various drug loaded biodegradable poly(lactide-co-glycolide) (PLGA) devices", Biomaterials, 21(23): 2475-90, 2000. Данные патенты и публикации описывают полимерные композиции, пригодные для введения имплантатов, использующие растворители и/или пластификаторы.
В описанных ранее полимерных составах инъецируемых имплантатов использовались растворители/пластификаторы, которые хорошо или относительно хорошо растворимы в жидкостях организма, содержащих воду, для того чтобы ускорить быстрое затвердевание полимера в месте нахождения имплантата и ускорить диффузию лекарственного средства из имплантата. Быстрое проникновение воды в подобные полимерные имплантаты, использующие водорастворимые растворители полимеров, представляет собой серьезную проблему, когда имплантат попадает в организм и подвергается действию водосодержащих жидкостей организма. Быстрое поглощение воды часто приводит к тому, что имплантаты приобретают пористую структуру, которая является неоднородной в отношении размера и формы. Как правило, поверхностные поры принимают пальцевидную структуру, распространяющуюся от поверхности внутрь имплантата на одну треть миллиметра или более, причем эти пальцевидные поры открыты с поверхности имплантата в окружающую среду, в которой он используется. Внутренние поры имеют тенденцию быть меньше и менее доступными для жидкостей, представленных в окружающей среде. Свойство быстро поглощать воду часто приводит к неконтролируемому высвобождению лечебного средства, которое проявляется в форме быстрого первоначального высвобождения лечебного средства из полимерного состава, соответствующего взрывному высвобождению лечебного средства, выделившегося из имплантата. Такое взрывное высвобождение часто, если не всегда, приводит к тому, что значительная часть лечебного средства выделяется в течение очень короткого времени, например нескольких часов или 1-2 дней. Подобный результат может быть неприемлем, особенно в тех обстоятельствах, когда желательна контролируемая доставка, т.е. поступление лечебного средства контролируемым образом в течение периода, большего или равного одному месяцу или вплоть до одного года, или если существует узкое терапевтическое окно, причем высвобождение избытка лечебного средства может приводить к вредным последствиям для пациента, подвергаемого лечению, или, если необходимо имитировать естественный дневной график поступления лечебного средства в организм пациента, подвергающегося лечению, в случае таких веществ, как гормоны и т.п.
Соответственно, в случае имплантации подобных устройств пальцевидные поры позволяют очень быстро поглотить внутренние жидкости организма внутрь имплантата с последующим немедленным и быстрым растворением значительных количеств лечебного средства и беспрепятственной диффузией лечебного средства в окружающую среду, что производит эффект взрывного высвобождения, который обсуждался выше.
Более того, быстрое поглощение воды может приводить к преждевременному осаждению полимера, такому, что образуется затвердевший имплантат или имплантат с затвердевшим наружным слоем. Внутренние поры и большая часть внутреннего объема полимера, содержащие лекарственное средство, выводятся из контакта с внутренними жидкостями организма, и это может привести к значительному понижению высвобождения лечебного средства в течение существенного периода времени («время задержки»). Данное время задержки является нежелательным с точки зрения наличия контролируемого пролонгированного высвобождения лечебного средства в организм пациента, подвергаемого лечению. Таким образом, наблюдается взрывное высвобождение лечебного средства, выделенного в короткий промежуток времени немедленно после имплантации, время задержки, в течение которого лечебное средство отсутствует или выделяется в очень маленьких количествах и, затем, продолжительное поступление лекарственного средства (если предположить, что лекарственное средство осталось после взрывного высвобождения) до тех пор, пока его запасы не будут исчерпаны.
Были описаны разнообразные подходы для того, чтобы управлять взрывным высвобождением, а также регулировать и стабилизировать доставку лечебного средства. Следующие патенты Соединенных Штатов №№ 6130200, 5990194, 5780044, 5733950, 5656297, 5654010, 4985404 и 4853218, а также публикация PCT WO 98/27962, как полагают, являются репрезентативными и включены в данный патент при помощи ссылок. Несмотря на некоторые достижения, данные способы не являлись полностью удовлетворительными для большого числа лечебных средств, которые могут быть эффективно доставлены при помощи имплантатов.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение представляет собой способ и композицию (состав) инъецируемого геля пролонгированного действия для системной и локальной доставки лечебного средства в организм пациента в течение продолжительного периода времени. В частности, изобретение обеспечивает контролируемое высвобождение лечебного средства в организм пациента, подвергающегося лечению, причем высвобождение остается контролируемым в течение периода от, приблизительно, равного двум неделям или больше или до одного года после введения, т.е., приблизительно, от двух недель до, приблизительно, двенадцати месяцев после введения, предпочтительно, в течение периода, равного или большего, чем один месяц после введения, или, предпочтительно, в течение периода от, приблизительно, одного месяца до, приблизительно, двенадцати месяцев после введения; предпочтительно, в течение периода, равного или большего, чем 2 месяца после введения, предпочтительно в течение периода, равного или большего, чем 3 месяца после введения, предпочтительно в течение периода от, приблизительно, 3 месяцев до, приблизительно, 9 месяцев после введения, предпочтительно, в течение периода от, приблизительно, 3 месяцев до, приблизительно, 6 месяцев после введения, предпочтительно, в течение периода вплоть до, приблизительно, 3 месяцев, вплоть до, приблизительно, 4 месяцев, вплоть до, приблизительно, 5 месяцев и вплоть до, приблизительно, 6 месяцев после введения. Одноразовое введение инъецируемой гелевой композиции пролонгированного действия обеспечивает более длительное и устойчивое высвобождение активного средства в течение более продолжительного периода времени, снижая, таким образом, частоту введения и повышая готовность пациента проходить лечение. Дополнительно данное изобретение представляет собой способ получения инъецируемой гелевой композиции пролонгированного действия.
В одном аспекте данное изобретение относится к инъецируемой композиции пролонгированного действия для длительной доставки лечебного средства пациенту контролируемым образом в течение предварительно определенного (заданного) периода времени после введения, содержащей:
(a) состав вязкого геля, включающий:
(1) биоразрушаемый, биосовместимый полимер, причем полимер представляет собой полимер на основе молочной кислоты; и
(2) растворитель, обладающий растворимостью в воде, меньшей или равной 7 мас.% при 25°C, в количестве, достаточном для того, чтобы пластифицировать полимер и, вследствие этого, образовать гель; и
(b) лечебное средство, растворенное или диспергированное в геле; причем вышеупомянутое лечебное средство доставляется в течение периода, равного или большего, чем один месяц. Полимер, предпочтительно, представляет собой сополимер молочной и гликолевой кислот, имеющий соотношение сомономеров (соотношение L/G) от, приблизительно, 50:50 до, приблизительно, 100:0 и молекулярную массу, находящуюся в диапазоне от, приблизительно, 3000 до, приблизительно, 120000.
В другом аспекте данное изобретение относится к инъецируемой композиции пролонгированного действия для длительной доставки лечебного средства пациенту контролируемым образом в течение предварительно определенного периода времени после введения, содержащей:
(a) состав вязкого геля, включающий:
(1) биоразрушаемый, биосовместимый полимер, причем полимер представляет собой полимер на основе молочной кислоты; и
(2) растворитель, обладающий растворимостью в воде, меньшей или равной 7 мас.% при 25°C, в количестве, достаточном для того, чтобы пластифицировать полимер и, вследствие этого, образовать гель; и
(b) лечебное средство, растворенное или диспергированное в геле; причем вышеупомянутое лечебное средство доставляется в течение периода, равного или большего, чем один месяц. Полимер, предпочтительно, представляет собой сополимер молочной кислоты и полимера на основе капролактона, включающего капролактон (CL), имеющего соотношение сомономеров (соотношение L/CL) от, приблизительно 25:75 до, приблизительно, 75:25 и молекулярную массу в диапазоне от, приблизительно, 3000 до, приблизительно, 120000.
В другом аспекте данное изобретение относится к инъецируемой композиции пролонгированного действия для длительной доставки лечебного средства пациенту контролируемым образом в течение периода, равного или большего, чем один месяц после введения, содержащей: (a) состав вязкого геля, включающий: (1) биоразрушаемый, биосовместимый полимер, причем полимер представляет собой полимер на основе молочной кислоты; и (2) растворитель, обладающий растворимостью в воде, меньшей или равной 7 мас.% при 25°C, в количестве, достаточном для того, чтобы пластифицировать полимер и, вследствие этого, образовать гель; и (b) лечебное средство, растворенное или диспергированное в геле.
В дополнительном аспекте изобретение относится к инъецируемой композиции пролонгированного действия для длительной доставки лечебного средства пациенту контролируемым образом в течение предварительно определенного периода времени после введения, содержащей: (a) вязкую гелевую композицию, включающую: (1) биоразрушаемый, биосовместимый полимер, причем полимер представляет собой полимер на основе молочной кислоты; и (2) растворитель, обладающий растворимостью в воде, меньшей или равной 7 мас.% при 25°C, в количестве, достаточном для того, чтобы пластифицировать полимер и, вследствие этого, образовать гель; и (b) лечебное средство, растворенное или диспергированное в геле; причем вышеупомянутое лечебное средство доставляется системно контролируемым образом в течение периода, равного или большего, чем один месяц после введения.
В другом аспекте изобретение относится к инъецируемой композиции пролонгированного действия для длительной локальной доставки лечебного средства пациенту контролируемым образом в течение периода времени, равного или большего, чем один месяц после введения, содержащей: (a) состав вязкого геля, включающий: (1) биоразрушаемый, биосовместимый полимер, причем полимер представляет собой полимер на основе молочной кислоты; и (2) растворитель, обладающий растворимостью в воде, меньшей или равной 7 мас.% при 25°C, в количестве, достаточном для того, чтобы пластифицировать полимер и, вследствие этого, образовать гель; и (b) лечебное средство, растворенное или диспергированное в геле.
В дополнительном аспекте изобретение относится к инъецируемой композиции пролонгированного действия для длительной доставки лечебного средства пациенту контролируемым образом в течение предварительно определенного периода времени после введения, содержащей: (a) состав вязкого геля, включающий: (1) биоразрушаемый, биосовместимый полимер, причем полимер представляет собой полимер на основе молочной кислоты; и (2) растворитель, обладающий растворимостью в воде, меньшей или равной 7 мас.% при 25°C, в количестве, достаточном для того, чтобы пластифицировать полимер и, вследствие этого, образовать гель; и (b) лечебное средство, растворенное или диспергированное в геле; причем вышеупомянутое лечебное средство доставляется локально контролируемым образом в течение периода, равного или большего, чем один месяц после введения.
В другом аспекте данное изобретение относится к инъецируемой композиции пролонгированного действия, как описано выше, дополнительно включающей, как минимум, один из следующих компонентов: порообразующее вещество (средство для формирования пор), регулятор растворимости лечебного средства и осмотическое средство.
В другом аспекте данное изобретение относится к инъецируемой композиции пролонгированного действия, как описано выше, в которой вязкий гель дополнительно включает полимер, такой как биоразрушаемый полимер, выбранный из группы, состоящей из полилактидов, полигликолидов, полимеров на основе капролактона, поли(капролактона), полиангидридов, полиаминов, полиэфирамидов, полиортоэфиров, полидиоксанонов, полиацеталей, поликеталей, поликарбонатов, эфиров полифосфорных кислот, полиэфиров, полибутилентерефталата, полиортокарбонатов, полифосфазенов, сукцинатов, поли(яблочной кислоты), поли(аминокислот), поливинилпирролидона, полиэтиленгликоля, полигидроксицеллюлозы, полисахаридов, хитина, хитозана, гиалуроновой кислоты, а также сополимеров, трехкомпонентных сополимеров и смесей перечисленных соединений.
В другом аспекте изобретение относится к инъецируемой композиции пролонгированного действия, как описано выше, в которой растворитель выбран из числа ароматических спиртов, имеющих структурную формулу (I)
Ar-(L)n-OH (I),
в которой Ar представляет собой замещенную или незамещенную арильную или гетероарильную группу, n является нулем или 1 и L представляет собой связующий фрагмент; а также растворитель выбран из группы, состоящей из сложных эфиров ароматических кислот, ароматических кетонов и смесей этих соединений.
В предпочтительных воплощениях растворитель выбран из ароматического спирта, низших алкиловых и аралкиловых эфиров арилсодержащих кислот; кетонов, содержащих арил, аралкил и низший алкил; а также низших алкиловых эфиров лимонной кислоты. Предпочтительно, растворитель выбран из бензилового спирта, бензилбензоата и этилбензоата. В предпочтительных воплощениях состав не содержит растворителей, обладающих растворимостью в воде, большей, чем 7 мас.% при 25°C. Предпочтительно, растворитель имеет растворимость в воде менее 7 мас.%, более предпочтительно менее 5 мас.%, и, более предпочтительно, менее 3 мас.%.
В дополнительных аспектах изобретение относится к способам введения пациенту лечебного средства контролируемым образом в течение периода, равного или большего, чем один месяц после введения, включая введение инъецируемой композиции пролонгированного действия, как описано выше. В определенных воплощениях лечебное средство доставляется системно, контролируемым образом в течение периода, равного или большего, чем один месяц после введения. В дополнительных воплощениях лечебное средство поступает локально контролируемым образом в течение периода, равного или большего, чем один месяц после введения.
В дополнительных аспектах изобретение относится к набору для введения или для длительного поступления лечебного средства в организм пациента контролируемым образом в течение предварительно определенного периода времени после введения; комплекту, включающему:
(a) биоразрушаемый, биосовместимый полимер, причем полимер представляет собой полимер на основе молочной кислоты;
(b) растворитель, обладающий растворимостью в воде, меньшей или равной 7 мас.% при 25°C, в количестве, достаточном для того, чтобы пластифицировать полимер и, вследствие этого, образовать гель;
(c) лечебное средство, растворенное или диспергированное в геле; и, необязательно, один или несколько следующих компонентов:
(d) эмульгирующее средство;
(e) порообразующее средство;
(f) регулятор растворимости лечебного средства, необязательно связанный с лечебным средством; и
(g) осмотическое средство;
причем, по крайней мере, лечебное средство, необязательно связанное с регулятором растворимости, содержится отдельно от растворителя до момента введения лечебного средства пациенту. В дополнительных воплощениях набор включает мерное устройство, такое как шприц, катетер, насос, шприцевой насос, автоинъектор и т.п.
Эти и другие воплощения настоящего изобретения легко осуществимы средним специалистом в данной области техники, учитывая раскрытие изобретения в настоящем описании.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Задачи, изложенные выше, а также другие задачи, признаки и преимущества настоящего изобретения станут более понятными при чтении следующего подробного описания в сочетании с чертежами, как описано в дальнейшем в этом документе.
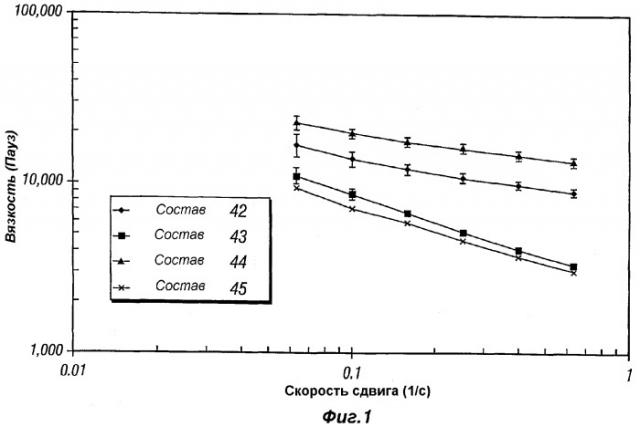
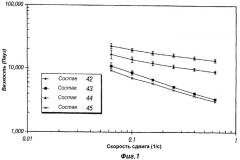
Фиг.1 представляет собой график, иллюстрирующий реологические свойства композиций пролонгированного действия (депо-композиций) по настоящему изобретению (композиции 42-45).
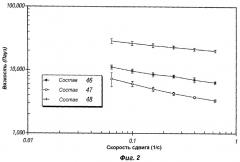
Фиг.2 представляет собой график, иллюстрирующий реологические свойства композиций пролонгированного действия по настоящему изобретению (композиции 46-48).
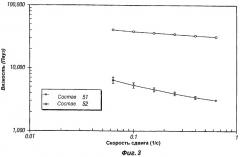
Фиг.3 представляет собой график, иллюстрирующий реологические свойства композиций пролонгированного действия по настоящему изобретению (композиции 51 и 52).
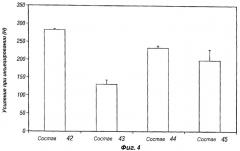
Фиг.4 представляет собой график, показывающий усилия при инъецировании композиций пролонгированного действия по настоящему изобретению (композиции 42-45).
Фиг.5 представляет собой график, показывающий усилия при инъецировании композиций пролонгированного действия по настоящему изобретению (композиции 48-50).
Фиг.6А представляет собой график, показывающий профиль высвобождения in vivo человеческого гормона роста (hGH), поступающего из композиций пролонгированного действия по настоящему изобретению (композиции 21 и 22).
Фиг.6B представляет собой график, показывающий профиль высвобождения in vivo человеческого гормона роста, поступающего из различных композиций пролонгированного действия, включая композиции по настоящему изобретению (композиции 29-31).
Фиг.6C представляет собой график, показывающий профиль высвобождения in vivo человеческого гормона роста, поступающего из различных композиций пролонгированного действия, включая композиции по настоящему изобретению (композиции 33,35,36,39 и 40).
Фиг.6D представляет собой график, показывающий профиль высвобождения in vivo человеческого гормона роста, поступающего из различных композиций пролонгированного действия, включая композиции по настоящему изобретению (композиции 34,35,37,38 и 40).
Фиг.7 представляет собой график, показывающий профиль высвобождения in vivo бупивакаина гидрохлорида, поступающего из композиций пролонгированного действия по настоящему изобретению (композиции 17-18).
Фиг.8 представляет собой график, показывающий профиль высвобождения in vivo бупивакаина основания, поступающего из композиций пролонгированного действия по настоящему изобретению (композиции 19-20).
Фиг.9 представляет собой график, показывающий профиль высвобождения in vivo бупивакаина основания, поступающего из композиций пролонгированного действия по настоящему изобретению (композиция 20).
Фиг.10 представляет собой график, показывающий профиль высвобождения in vivo бупивакаина гидрохлорида, поступающего из композиций пролонгированного действия по настоящему изобретению (композиции 62 и 63).
Фиг.11 представляет собой график, показывающий профиль высвобождения in vivo бупивакаина гидрохлорида, поступающего из составов пролонгированного действия по настоящему изобретению (композиции 64 и 65).
Фиг.12 представляет собой график, показывающий профиль высвобождения in vivo бупивакаина гидрохлорида, поступающего из составов пролонгированного действия по настоящему изобретению (композиции 11 и 12).
Фиг.13 представляет собой график, показывающий профиль высвобождения in vivo леупролида ацетата, поступающего из композиций пролонгированного действия по настоящему изобретению (композиции 42 и 47), в виде сравнения с 3-месячной Lupron depot® (композиция 53).
Фиг.14 представляет собой график, показывающий профиль высвобождения in vivo леупролида ацетата, поступающего из композиций пролонгированного действия по настоящему изобретению (композиции 42,43 и 45).
Фиг.15 представляет собой график, показывающий профиль высвобождения in vivo леупролида ацетата, поступающего из композиций пролонгированного действия по настоящему изобретению (композиции 42 и 49).
Фиг.16 представляет собой график, показывающий профиль высвобождения in vivo леупролида ацетата, поступающего из композиции пролонгированного действия по настоящему изобретению (композиция 46), в виде сравнения с 3-месячной Lupron depot® (композиция 53).
Фиг.17 представляет собой график, показывающий профиль высвобождения in vivo леупролида ацетата, поступающего из композиции пролонгированного действия по настоящему изобретению (композиции 42, 51 и 52), в виде сравнения с 3-месячной Lupron depot® (композиция 53).
Фиг.18 представляет собой график, показывающий профиль высвобождения in vivo леупролида ацетата, поступающего из 3-месячной композиции пролонгированного действия по настоящему изобретению (композиции 54 и 55).
Фиг.19 представляет собой график, показывающий супрессию in vivo крысиного тестостерона под действием 3-месячных композиций пролонгированного действия леупролида ацетата по настоящему изобретению (композиции 54 и 55), в виде сравнения с композициями плацебо без леупролида ацетата (композиции 56 и 57).
Фиг.20 представляет собой график, показывающий профиль высвобождения in vivo леупролида ацетата, поступающего из 6-месячной композиции пролонгированного действия по настоящему изобретению (композиции 58 и 59).
Фиг.21 представляет собой график, показывающий супрессию in vivo крысиного тестостерона под действием 6-месячных композиций пролонгированного действия леупролида ацетата по настоящему изобретению (композиции 58 и 59), в виде сравнения с композициями плацебо без леупролида ацетата (композиции 60 и 61).
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
ОБЩИЙ ОБЗОР И ОПРЕДЕЛЕНИЯ
Настоящее изобретение направлено на инъецируемые композиции пролонгированного действия для доставки лечебного средства пациенту в течение продолжительного периода времени, во множество участков, если это требуется, и для многократных или повторных инъекций, т.е., например, когда терапевтическое действие лечебного средства снижается или истекает период времени, в течение которого лечебное средство обладает терапевтическим действием, или, например, когда пациенту требуется дальнейшее введение лечебного средства по любой причине, причем инъецируемая композиция пролонгированного действия после введения в тело пациента служит в качестве имплантированной системы доставки и длительного высвобождения лечебного средства. В частности, изобретение обеспечивает контролируемое высвобождение лечебного средства в организм пациента, подвергаемого лечению, причем высвобождение является контролируемым в течение периода, приблизительно равного или превышающего две недели и вплоть до одного года после введения, т.е. периода от, приблизительно, двух недель до, приблизительно, 12 месяцев после введения, предпочтительно, на протяжении периода, равного или большего, чем один месяц после введения; предпочтительно, на протяжении периода, равного или большего, чем 2 месяца после введения, предпочтительно, на протяжении периода, равного или большего, чем 3 месяца после введения, предпочтительно, на протяжении периода от, приблизительно, 3 месяцев до, приблизительно, 9 месяцев после введения, предпочтительно, на протяжении периода от, приблизительно, 3 месяцев до, приблизительно, 6 месяцев после введения, предпочтительно, на протяжении периода вплоть до, приблизительно, 3 месяцев, вплоть до, приблизительно, 4 месяцев, вплоть до, приблизительно, 5 месяцев и вплоть до, приблизительно, 6 месяцев после введения. Настоящее изобретение также относится к способу применения инъецируемой композиции пролонгированного действия, для того чтобы ввести в организм пациента лечебное средство.
Инъецируемая композиция пролонгированного действия представляет собой гель, образованный из полимерной матрицы и содержащий биоразрушаемый, биосовместимый полимер; растворитель, имеющий растворимость в воде, равную или меньшую 7 мас.% при 25°C, в количестве, достаточном для того, чтобы пластифицировать полимер и, вследствие этого, образовать гель; и лечебное средство, растворенное или диспергированное в геле. Настоящее изобретение также направлено на способ системного или местного введения и доставки лечебного средства пациенту, включающий имплантированние инъецируемой композиции пролонгированного действия, как описано выше. Способ системной или локальной доставки по настоящему изобретению представляет собой способ доставки в множество участков, если это необходимо, кроме этого он направлен на многократное или повторное инъецирование, т.е., например, когда терапевтическое действие лечебного средства снижается или истекает период времени, в течение которого лечебное средство обладает терапевтическим действием, или, например, когда пациенту требуется дальнейшее введение лечебного средства по любой причине.
Путем подходящего выбора растворителя ограничивают миграцию воды из водной среды, окружающей имплантат, и лечебное средство высвобождается в организм пациента в течение определенного периода времени, обеспечивая, таким образом, доставку лечебного средства с контролируемым взрывным высвобождением и последующим устойчивым высвобождением лечебного средства.
Неожиданно было обнаружено, что скорость высвобождения лечебного средства из инъецируемых гелевых композиций пролонгированного действия по настоящему изобретению может изменяться при изменении свойств полимера, таких как тип полимера, молекулярная масса полимера (включая модальное распределение полимера) и соотношение сомономеров, из числа мономеров, образующих полимер, концевая группа полимеров; тип растворителя; и, путем изменения соотношений полимер/растворитель, чтобы обеспечить контролируемое устойчивое высвобождение лечебного средства на протяжении длительного периода времени, равного или большего, чем две недели и вплоть до одного года после введения, т.е. от, приблизительно, двух недель до, приблизительно, 12 месяцев после введения, или, предпочтительно, на протяжении периода от, приблизительно, одного месяца после введения до, приблизительно, двенадцати месяцев после введения, предпочтительно, на протяжении периода, равного или большего, чем один месяц после введения; предпочтительно, на протяжении периода, равного или большего, чем 2 месяца после введения, предпочтительно, на протяжении периода, равного или большего, чем 3 месяца после введения, предпочтительно, на протяжении периода от, приблизительно, 3 месяцев до, приблизительно, 9 месяцев после введения, предпочтительно, на протяжении периода от, приблизительно, 3 месяцев до, приблизительно, 6 месяцев после введения, предпочтительно, на протяжении периода вплоть до, приблизительно, 3 месяцев, вплоть до, приблизительно, 4 месяцев, вплоть до, приблизительно, 5 месяцев; и вплоть до, приблизительно, 6 месяцев после введения. График скорости высвобождения и его продолжительность могут регулироваться подходящим выбором полимера (включая соотношение мономеров, например соотношения L/G и CL/L), молекулярной массы полимера (LMW, MMW, HMW), концевой группы полимера (кислотная, сложноэфирная); нерастворимым в воде растворителем, соотношением полимер/растворитель, эмульгирующим средством, средством для образования пор, регулятором растворимости лечебного средства, осмотическим средством и т.п.
Дополнительно настоящее изобретение представляет собой способ контролирования высвобождения лечебного средства из инъецируемой композиции пролонгированного действия. Длительность и скорость высвобождения лечебного средства регулируются при помощи подходящего выбора биоразрушаемого полимера, молекулярной массы полимера, соотношения сомономеров из числа различных мономеров, образующих полимер (например, соотношения L/G и CL/L для данного полимера), соотношений полимер/растворитель и сочетаний данных факторов, как это описано ниже более детально (см. также таблицы A, B, C и D ниже).
В отдельных воплощениях к имплантированным системам могут быть добавлены порообразующие средства и регуляторы растворимости лечебного средства для обеспечения желаемых профилей высвобождения из имплантированных систем, а также могут быть добавлены обычные фармацевтические наполнители и другие добавки, которые не изменяют полезных аспектов настоящего изобретения.
Композиция обеспечивает контролируемое длительное высвобождение лечебного средства путем ограничения миграции воды из водной среды, окружающей имплантированную систему, доставляя, таким образом, лечебное средство на протяжении увеличенного периода, как описано ранее. Одноразовое введение инъецируемой гелевой композиции пролонгированного действия обеспечивает более устойчивое длительное высвобождение действующих средств на протяжении увеличенного периода времени, снижая, таким образом, частоту введения и повышая готовность пациента проходить лечение. Поскольку полимер, входящий в данную композицию, является биоразрушаемым, имплантированная система не должна удаляться хирургически после того, как лечебное средство в имплантате будет исчерпано. Более того, т.к. полимер, входящий в композицию по настоящему изобретению, является биоразрушаемым, композиция может вводиться как системно, так и локально, чтобы охватить доставку в множество участков, если это необходимо, а также композиция применима для многократных или повторных введений, в частности, например, когда терапевтическое действие лечебного средства снижается или истекает период времени, в течение которого лечебное средство обладает терапевтическим действием, или, например, когда пациенту требуется дальнейшее введение лечебного средства по любой причине.
В целом, композиция по настоящему изобретению является гелеобразной и образует, в основном, гомогенные не пористые структуры по всему объему имплантата при имплантации и в ходе высвобождения лекарственного средства, даже в случае затвердевания. Более того, пока полимерный гелевый имплантат будет медленно затвердевать, будучи подвергнут действию водной окружающей среды, твердеющий имплантат может сохранять эластичную (не жесткую) структуру, с температурой перехода в стеклообразное состояние Tg, лежащей ниже 37°C.
Предпочтительные композиции по настоящему изобретению дают возможность лечебному средству заполнить внутреннее пространство полимера с уровнем содержания, превосходящим уровень, требуемый для насыщения воды лечебным средством, облегчая, посредством этого, высвобождение лечебного средства нулевого порядка. Дополнительно предпочтительные композиции могут образовывать вязкие гели, которые имеют температуру перехода в стеклообразное состояние, меньшую, чем 37°C, так что такой гель остается не твердым в течение 24 часового периода времени после имплантации или более.
Было обнаружено, что в случае, когда в системе присутствует растворитель, имеющий растворимость в воде ниже 7 мас.%, достигается подходящее управление взрывным высвобождением и устойчивое высвобождение лечебного средства, независимо от того, присутствует ли в системе регулятор растворимости лечебного средства. Как правило, имплантированная система, применяемая в данном изобретении, будет выделять в первые два дня после имплантации 60% или менее от общего количества лечебного средства, которое должно поступить в организм пациента из имплантированной системы, предпочтительно, 50% или менее, более предпочтительно 40% или менее и, еще более предпочтительно, 30% или менее.
В случае, если состав предназначен для имплантации при помощи инъекции, вя