Агенты для визуализации
Иллюстрации
Показать всеДанное изобретение относится к соединениям формулы (Ia)
и их применению в радиофармацевтических композициях для связывания с рецепторами, ассоциированными с ангиогенезом. Таким образом, такие соединения могут быть использованы для диагностики или терапии, например, злокачественных заболеваний, сердечных заболеваний, эндометриоза, воспалительных заболеваний, ревматоидного артрита и саркомы Капоши.
Реферат
Настоящее изобретение относится к новым соединениям на основе пептидов и их применению в диагностических методах визуализации, таких как однофотонная эмиссионная компьютерная томография (SPECT) или позитронная эмиссионная томография (PET). Более конкретно изобретение относится к применению таких соединений на основе пептидов в качестве целевых векторов, которые связываются с рецепторами, ассоциированными с ангиогенезом, в частности рецепторами интегрина, например рецептором αмβ3-интегрина. Таким образом, такие соединения могут быть использованы для диагностики или терапии, например, злокачественных заболеваний, сердечных заболеваний, эндометриоза, воспалительных заболеваний, ревматоидного артрита и саркомы Капоши.
Новые кровеносные сосуды могут быть образованы посредством двух различных механизмов: васкулогенеза или ангиогенеза. Ангиогенез представляет собой образование новых кровеносных сосудов посредством ответвления от существующих сосудов. Первичным стимулом для этого процесса может служить недостаточное снабжение питательными веществами и кислородом (гипоксия) клеток в ткани. Клетки могут реагировать посредством секреции ангиогенных факторов, которых существует множество; одним примером, на который часто ссылаются, является фактор роста сосудистого эндотелия (VEGF). Эти факторы инициируют секрецию протеолитических ферментов, которые расщепляют белки базальной мембраны, а также ингибиторов, которые ограничивают действие этих потенциально вредных ферментов. Другое заметное воздействие ангиогенных факторов состоит в том, что они вызывают миграцию и деление эндотелиальных клеток.
Эндотелиальные клетки, которые прикреплены к базальной мембране, которая образует сплошной слой вокруг кровеносных сосудов на внешней их стороне, не подвергаются митозу. Объединенный эффект от ослабления прикрепления и сигналов от рецепторов для ангиогенных факторов заставляет эндотелиальные клетки перемещаться, размножаться и трансформироваться и в итоге синтезировать базальную мембрану вокруг новых сосудов.
Ангиогенез является заметным при росте и реконструкции тканей, включая заживление ран и воспалительные процессы. Опухоли должны инициировать ангиогенез, когда они достигают миллиметрового размера, для того чтобы поддерживать свою скорость роста.
Ангиогенез сопровождается характерными изменениями в эндотелиальных клетках и их окружении. Поверхность этих клеток трансформируется при подготовке к миграции, и криптические структуры раскрываются там, где базальная мембрана разрушается, в дополнение к множеству белков, которые вовлечены в осуществление и регулирование протеолиза. В случае опухолей полученная в результате сеть кровеносных сосудов обычно дезорганизована с образованием резких изгибов, а также артериовенозных шунтов. Также считается, что ингибирование ангиогенеза является многообещающей стратегией для противоопухолевой терапии. Трансформации, сопровождающие ангиогенез, также являются очень многообещающими для диагностики, и одним из примеров служит злокачественное заболевание, но этот принцип также демонстрирует большие перспективы при воспалении и множестве воспалительных заболеваний, включая атеросклероз, причем макрофаги ранних атеросклеротических повреждений являются потенциальными источниками ангиогенных факторов.
Многие лиганды, вовлеченные в клеточную адгезию, содержат трипептидную последовательность аргинин-глицин-аспарагиновая кислота (RGD). Оказывается, что RGD-последовательность действует как первичный сайт узнавания между лигандами, представляющими эту последовательность, и рецепторами на поверхности клеток. В целом полагают, что вторичные взаимодействия между лигандом и рецептором повышают специфичность взаимодействия. Эти вторичные взаимодействия могут иметь место между группировками лиганда и рецептором, который непосредственно примыкает к RGD-последовательности либо на сайтах, которые находятся в удалении от RGD-последовательности.
Эффективное нацеливание и визуализация рецепторов интегрина, ассоциированных с ангиогенезом in vivo, требует поэтому селективного вектора на основе RGD с высоким сродством, который является химически устойчивым и стабильным. Более того, скорость выведения является важным фактором при конструировании агентов для визуализации с целью уменьшения проблем с фоновым излучением.
В WO 03/006491 описаны соединения на основе пептидов, мишенью которых являются рецепторы интегрина, ассоциированные с ангиогенезом. Однако существует необходимость в дополнительных таких соединениях на основе пептидов, полезных для диагностических методик визуализации, таких как SPECT и PET, а также для терапевтического лечения. В частности, существует необходимость в соединениях на основе пептидов, имеющих более высокую стабильность в реакционных условиях, применяемых для включения репортерной группировки, такой как радионуклид.
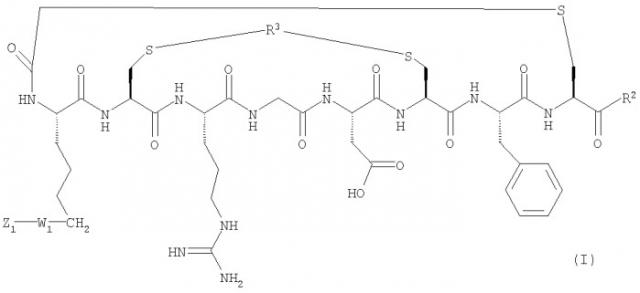
Таким образом, согласно первому аспекту изобретения предложено соединение формулы (I)
где R2 представляет собой
где b представляет собой целое число от 0 до 10;
R3 представляет собой С1-4алкиленовый или С2-4алкениленовый мостик;
W1 отсутствует или представляет собой спейсерную группировку, которая представляет собой C1-30гидрокарбильную группу, возможно включающую от 1 до 10 гетероатомов, выбранных из кислорода, азота и серы, и предпочтительно представляет собой производное глутаровой и/или янтарной кислоты и/или часть молекулы на основе полиэтиленгликоля и/или часть молекулы формулы
Z1 представляет собой противоопухолевый агент, хелатирующий агент или репортерную группировку.
Подходящие хелатирующие агенты Z1 включают агенты формулы А
где
каждый R1A, R2A, R3A и R1A независимо представляет собой группу RA,
каждая группа RA независимо представляет собой Н или С1-10алкил, С3-10алкиларил, С2-10алкоксиалкил, C1-10гидроксиалкил, C1-10алкиламин, C1-10фторалкил, либо 2 или более групп RA вместе с атомами, к которым они присоединены, образуют карбоциклическое, гетероциклическое, насыщенное или ненасыщенное кольцо,
или Z1 может представлять собой хелатирующий агент, представленный формулами (i), (ii), (iii) или (iv)
Предпочтительный пример хелатирующего агента представлен формулой (v)
Соединения формулы (I), содержащие хелатирующие агенты формулы А, могут быть помечены радиоактивными изотопами, показывая хорошую радиохимическую чистоту (РХЧ), при комнатной температуре в водных условиях при рН, близком к нейтральному.
Роль спейсерной группировки W1 заключается в том, чтобы Z1 находился на определенном расстоянии от активного сайта пептидного компонента. Например, спейсерная группировка W1 может отделять громоздкий противоопухолевый агент или хелатирующий агент от активного сайта пептида.
Дополнительные примеры подходящих хелатирующих агентов Z1 раскрыты в US-A-4647447, WO 89/00557, US-A-5367080, US-A-5364613 и дополнительно включают агенты, описанные в таблице.
В одном аспекте настоящего изобретения Z1 представлен противоопухолевым агентом. В этом аспекте соединение формулы (I) будет нацелено на ангиогенный сайт, ассоциированный с раком, и доставлять противоопухолевый агент к пораженному участку. Противоопухолевый агент может быть представлен циклофосфамидом, хлорамбуцилом, бусульфаном, метотрексатом, цитарабином, фторурацилом, винбластином, паклитакселом, доксорубицином, даунорубицином, этопозидом, тенипозидом, цисплатином, амсакрином, доцетакселом, а также может быть использован широкий ряд других противоопухолевых агентов.
Репортерные группировки (Z1) в соединениях формулы (I) могут представлять собой любые группировки, поддающиеся обнаружению либо непосредственно, либо опосредованно в диагностической процедуре визуализации in vivo. Предпочтительными являются репортерные группировки, которые испускают или могут вызывать испускание обнаружимого излучения (например, радионуклид, такой как испускающий позитроны радионуклид).
Для визуализации путем магнитного резонанса (МР) репортерная группировка должна представлять собой либо изотоп с ненулевым ядерным спином (таким как 19F) или вещество, обладающее спинами непарных электронов и, следовательно, парамагнитными, суперпарамагнитными, ферримагнитными или ферромагнитными свойствами; для световой визуализации репортерная группировка должна представлять собой светорассеиватель (например, окрашенную или неокрашенную частицу), светопоглотитель или светоизлучатель; для магнитометрической визуализации группировка должна обладать обнаружимыми магнитными свойствами; для электроимпедансной визуализации репортерная группировка должна воздействовать на электрический импеданс; и для сцинтиграфии, SPECT, PET и тому подобного репортерная группировка должна представлять собой радионуклид.
В целом определено, что репортерная группировка может представлять собой (1) хелатирующий агент, как он определен выше, хелатированный с металлом или многоатомным металлосодержащим ионом (то есть ТсО, и так далее), где металл является металлом с большим атомным номером (например, с атомным номером более чем 37), парамагнитный радикал (например, переходный металл или лантанид) или радиоактивный изотоп, (2) ковалентно связанный неметаллический радикал, который представляет собой сайт непарных электронов (например, кислород или углерод в виде стабильного свободного радикала), неметалл с большим атомным номером или радиоизотоп, (3) многоатомный кластер или кристалл, содержащий атомы с большим атомным номером, демонстрирующие кооперативные магнитные характеристики (например, суперпарамагнетизм, ферримагнетизм или ферромагнетизм), или содержащий радионуклиды.
Хелатированные с металлом репортерные группировки предпочтительно выбраны из группы: 90Y, 99mTc, 111In, 47Sc, 68Ga, 68Ga, 51Cr, 177mSn, 62Cu, 167Tm, 97Ru, 188Re, 177Lu, 199Au, 203Pb и 141Ce и хелатированы с хелатирующей группой, как определено выше.
Способы металлирования любых существующих хелатирующих агентов известны специалистам в данной области техники. Металлы могут быть включены в хелатирующий агент посредством любого из трех общепринятых способов: прямое включение, матричный синтез и/или переметаллирование. Прямое включение является предпочтительным.
Таким образом, желательно, чтобы ион металла легко образовывал комплекс с хелатирующим агентом, например, посредством просто воздействия или смешения водного раствора содержащей хелатирующий агент группировки с солью металла в водном растворе, предпочтительно имеющем рН в интервале от примерно 4 до примерно 11. Соль может представлять собой любую соль, но предпочтительно соль является водорастворимой солью металла, такой как галогенсодержащая соль, и более предпочтительно такие соли выбраны так, чтобы не препятствовать связыванию иона металла с хелатирующим агентом. Содержащая хелатирующий агент группировка находится предпочтительно в водном растворе при рН от примерно 5 до примерно 9, более предпочтительно рН от примерно 6 до примерно 8. Содержащая хелатирующий агент группировка может быть смешана с буферной солью, такой как цитрат, карбонат, ацетат, фосфат и борат с получением оптимального рН. Предпочтительно буферные соли выбраны так, чтобы не препятствовать последующему связыванию иона металла с хелатирующим агентом.
Следующие изотопы или изотопные пары могут быть использованы как для визуализации, так и для терапии без необходимости изменения методики введения радиоактивной метки или хелатирующего агента: 47Sc21; 141Ce58; 188Re75; 177Lu71; 199Au79; 47Sc21; 131I53; 67Cu29; 131I53 и 123I53; 188Re75 и 99mTc43; 90Y39 и 87Y39, 47Sc21 и 44Sc21; 90Y39 и 123I53; 146Sm62 и 153Sm62; и 90Y39 и 111In39.
Предпочтительные неметаллические атомные репортерные группировки включают радиоизотопы, такие как 123I, 131I и 18F, а также атомы ненулевого ядерного спина, такие как 19F, и тяжелые атомы, такие как I.
В предпочтительном аспекте изобретения Z1 в соединении формулы (I) включает испускающий позитроны радионуклид, включенный либо как простетическая группа, либо посредством реакций замещения или присоединения, либо посредством хелатообразования. Подходящие испускающие позитроны радионуклиды для этой цели включают 11С, 18F, 15О, 13N, 75Br, 122I, 124I, 82Rb, 68Ga и 62Cu, из которых 11С и 18F являются предпочтительными. Таким образом, полученное в результате соединение формулы (I) может быть использовано при визуализации путем позитронной эмиссионной томографии (PET).
Таким образом, согласно предпочтительному аспекту изобретения предложено соединение формулы (Ia)
где
R1 представляет собой либо связь, либо
где а представляет собой целое число от 1 до 30;
R2 представляет собой
где b представляет собой целое число от 0 до 10;
R3 представляет собой С1-4алкиленовый или С2-4алкениленовый мостик;
Линкер представляет собой С1-30гидрокарбильную группу, возможно включающую от 1 до 10 гетероатомов.
В соединениях формулы (Ia)
R3 представляет собой предпочтительно С1-4алкилен и более предпочтительно
-СН2-;
а представляет собой предпочтительно целое число от 1 до 10 и наиболее предпочтительно представляет собой 5;
b представляет собой предпочтительно 1.
В формуле (Ia) Линкер представляет собой C1-30гидрокарбильную группу, возможно включающую от 1 до 10 гетероатомов, таких как кислород или азот, и может быть выбран для обеспечения хорошей фармакокинетики in vivo, такой как подходящие характеристики экскреции. Подходящие линкерные группы включают алкильные, алкенильные, алкинильные цепи, ароматические, полиароматические и гетероароматические кольца и полимеры, включающие этиленгликолевые, аминокислотные или углеводные субъединицы. Линкер предпочтительно выбран из (II), (III) и (IV):
где
n представляет собой целое число от 1 до 20;
m представляет собой целое число от 1 до 10;
р представляет собой целое число от 1 до 20;
q представляет собой целое число от 0 до 4;
r представляет собой целое число от 1 до 10.
В формуле (II) n типично представляет собой от 2 до 6, предпочтительно 3, и m типично представляет собой от 1 до 4, предпочтительно 2.
В формуле (III) p типично представляет собой от 1 до 6, предпочтительно 3.
В формуле (IV) группа -(СН2)q- предпочтительно присоединена в пара-положении относительно амидной группы, q типично представляет собой от 0 до 4, предпочтительно 1, и r типично представляет собой от 1 до 4, предпочтительно 2.
Как показано в анализе конкурентного связывания in vitro, соединения формулы (I) и (Ia) связываются с рецепторами, ассоциированными с ангиогенезом. Эти соединения таким образом могут быть полезны для лечения, in vivo диагностики и визуализации заболеваний и состояний, ассоциированных с ангиогенезом.
Термин "заболевания и состояния, ассоциированные с ангиогенезом" включает такие заболевания и состояния, на которые ссылаются ниже. При этом также ссылаются на WO 98/47541.
Заболевания и состояния, ассоциированные с ангиогенезом, включают различные формы рака и метастаза, например рак груди, кожи, ободочной и прямой кишки, поджелудочной железы, предстательной железы, легкого или яичника.
Другие заболевания и состояния, ассоциированные с ангиогенезом, представляют собой воспаление (например, хроническое воспаление), атеросклероз, ревматоидный артрит и гингивит.
Дополнительно заболевания и состояния, ассоциированные с ангиогенезом, представляют собой артериовенозные мальформации, астроцитомы, хориокарциномы, глиобластомы, глиомы, гемангиомы (детского возраста, капиллярные), гепатомы, гиперплазию эндометрия, ишемизированный миокард, эндометриоз, саркому Капоши, дегенерацию желтого пятна, меланому, нейробластомы, окклюзионное поражение периферических артерий, остеоартрит, псориаз, ретинопатию (диабетическую, пролиферативную), склеродерму, семиномы и язвенный колит.
Таким образом, согласно дополнительному аспекту изобретения предложено соединение формулы (I) или (Ia) для применения в медицине, в частности в in vivo диагностике или визуализации, например, посредством PET, заболевания или состояния, ассоциированного с ангиогенезом.
Альтернативно, предложен способ in vivo диагностики или визуализации заболевания или состояния, ассоциированного с ангиогенезом, включающий стадию введения соединения формулы (I) или (Ia) в организм человека или животного с последующей генерацией изображения, предпочтительно РЕТ-изображения, части или всего указанного организма. Дополнительно предложен способ лечения заболевания или состояния, ассоциированного с ангиогенезом, включающий введение терапевтически эффективного количества соединения формулы (I) в организм человека или животного.
Соединения формулы (I) или (Ia) предпочтительно вводят в составе радиофармацевтического препарата. "Радиофармацевтический препарат" определен в настоящем изобретении как препарат, содержащий соединение формулы (I) или (Ia) в форме, подходящей для введения млекопитающему, такому как человек. Введение предпочтительно осуществляют посредством инъекции радиофармацевтического препарата в виде водного раствора. Такой радиофармацевтический препарат может, возможно, содержать дополнительные ингредиенты, такие как буферы, фармацевтически приемлемые солюбилизаторы (например, циклодекстрины или поверхностно-активные вещества, такие как плуроник, твин, или фосфолипиды), фармацевтически приемлемые стабилизаторы или антиоксиданты (такие как аскорбиновая кислота, гентизиновая кислота или пара-аминобензойная кислота) или наполнители для лиофилизации (такие как хлорид натрия или маннит). Радиофармацевтический препарат вводят в количестве, которое дает достоверное изображение, принимая во внимание природу исследуемого заболевания или состояния, массу пациента и другие подобные факторы, которые будут очевидны специалисту в данной области. Там, где репортерная группировка содержит металл, обычно дозы от 0,001 до 5,0 ммоль хелатного визуализирующего иона металла на килограмм массы тела пациента являются эффективными для достижения достоверного изображения. Для PET подходящее количество соединения формулы (I) или (Ia) составляет от 0,1 до 100 мКи, предпочтительно от 1 до 20 мКи.
Таким образом, в дополнительном аспекте изобретения предложен радиофармацевтический препарат, содержащий соединение формулы (I) или (Ia) и один или более чем один фармацевтически приемлемый эксципиент. В данном изобретении дополнительно предложен фармацевтический препарат, содержащий терапевтически эффективное количество соединения формулы (I) или его соли вместе с одним или более чем одним фармацевтически приемлемым адъювантом, эксципиентом или разбавителем.
Эффективная терапевтическая доза соединения формулы (I) будет зависеть от состояния и пациента, которого лечат, но в основном будет находиться в интервале от 1 пмоль/кг до 1 ммоль/кг массы тела.
Соединения формулы (I) могут быть получены при использовании способов органического синтеза, включая твердофазный метод Меррифилда, использующий автоматический синтезатор пептидов (J. Am. Chem. Soc., 85:2149 (1964)), и способов, аналогичных тем, которые описаны в WO 03/006491. Соединения формулы (I) могут быть очищены при использовании высокоэффективной жидкостной хроматографии (ВЭЖХ).
Соединение формулы (Ia) может быть получено из соответствующего соединения формулы (V)
где R1, R2 и R3 являются такими, как определено для соединения формулы (I), и Х представляет собой уходящую группу, выбранную из хлоро, бромо и иодо, и предпочтительно представляет собой хлоро;
путем взаимодействия с соответствующим соединением формулы (VI)
где Линкер является таким, как определено для соединения формулы (I).
Соединения формулы (V) являются новыми и таким образом представляют собой дополнительный аспект настоящего изобретения.
Взаимодействие соединений формул (V) и (VI) может быть осуществлено при использовании методик, описанных в международной заявке на патент WO 03/080544. В общих чертах взаимодействие может быть осуществлено в подходящем растворителе, например в водном буфере при рН в интервале от 5 до 11, и при неэкстремальной температуре от 5 до 70°С, предпочтительно при температуре окружающей среды.
Соединения формулы (V) могут быть получены стандартными способами пептидного синтеза, например твердофазным пептидным синтезом, например, как описано в Atherton, Е. и Sheppard, R.C.; "Solid Phase Synthesis"; IRL Press: Oxford, 1989. В WO 03/006491 также описан синтез аналогичных пептидов и в этом отношении включен в данное описание посредством ссылки. Включение мостиковой группы R3 может быть осуществлено путем взаимодействия соответствующего пептида, содержащего две свободные тиольные группы, с подходящим дихлоралканом или дихлоралкеном (таким как дихлорметан, когда R3 должен представлять собой метилен). Включение группы "Х-СН2С(O)-" в соединение формулы (V) может быть достигнуто путем взаимодействия N-концевой или аминосодержащей аминокислоты, предпочтительно лизина, этого пептида с реагентом формулы (VII)
в стандартных условиях для образования пептидной связи; где Х является таким, как определено для соединения формулы (V), a Z представляет собой -ОН или подходящую активирующую группу, такую как хлоро, бромо, фторо, -ОС(O)СН2-Х, где Х является таким, как определено для соединения формулы (V), или когда Z представляет собой -ОН, кислота может быть активирована in situ при использовании агентов, таких как гексафторфосфат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (HBTU) или N-оксид гексафторфосфата N-[(диметиламино)-1Н-1,2,3-триазоло[4,5-b]пиридин-1-илметилен]-N-метилметанаминия (HATU).
Соединения формулы (VI) могут быть получены стандартными способами, такими как те, которые описаны в международной заявке на патент WO 03/080544, например, из соответствующего соединения формулы (VIa)
где L представляет собой уходящую группу, такую как пара-толуолсульфонат, трифторметансульфонат или метансульфонат, и Линкер является таким, как определено для соединения формулы (VI), и R представляет собой водород или защитную группу тиола;
путем взаимодействия с водным [18F]-фторидом, полученным на циклотроне, соответствующим образом предварительно активированным посредством выпаривания из основания (например, из тетрабутиламмония или К2СО3/Криптофикс-222 (Kryptofix-222)), в подходящем растворителе, таком как ацетонитрил, N,N-диметилформамид или диметилсульфоксид, типично при повышенной температуре, например от 60 до 120°С, с последующим удалением любой защитной группы тиола при использовании стандартных способов.
Соединения формулы (VI), в которых Линкер представляет собой формулу (II), могут быть получены из соответствующего соединения формулы (VIb)
где L представляет собой уходящую группу, такую как пара-толуолсульфонат, трифторметансульфонат или метансульфонат, а n и m являются такими, как определено для формулы (II), и R представляет собой водород или защитную группу тиола;
путем взаимодействия с водным [18F]-фторидом, полученным на циклотроне, соответствующим образом предварительно активированным посредством выпаривания из основания (например, из тетрабутиламмония или К2СО3/Криптофикс-222), в подходящем растворителе, таком как ацетонитрил, N,N-диметилформамид или диметилсульфоксид, типично при повышенной температуре, например от 60 до 120°С, с последующим удалением любой защитной группы тиола при использовании стандартных способов.
Соединения формулы (VI), в которых Линкер представляет собой формулу (III), могут быть получены из соответствующего соединения формулы (VIc)
где L представляет собой уходящую группу, такую как пара-толуолсульфонат, трифторметансульфонат или метансульфонат, и р является таким, как определено для формулы (III), и R представляет собой водород или защитную группу тиола;
путем взаимодействия с водным [18F]-фторидом, полученным на циклотроне, соответствующим образом предварительно активированным посредством выпаривания из основания (например, из тетрабутиламмония или К2СО3/Криптофикс-222), в подходящем растворителе, таком как ацетонитрил, N,N-диметилформамид или диметилсульфоксид, типично при повышенной температуре, например от 60 до 120°С, с последующим удалением любой защитной группы тиола при использовании стандартных способов.
Соединения формулы (VI), в которых Линкер представляет собой формулу (IV), могут быть получены из соответствующего соединения формулы (VId)
где L' представляет собой уходящую группу, такую как иодо, пара-толуолсульфонат, трифторметансульфонат или метансульфонат, и когда q равен 0, L' может представлять собой нитро или соль иодония или аммония, а q и r являются такими, как определено для формулы (IV), и R представляет собой водород или защитную группу тиола;
путем взаимодействия с водным [18F]-фторидом, полученным на циклотроне, соответствующим образом предварительно активированным посредством выпаривания из основания (например, из тетрабутиламмония или К2СО3/Криптофикс-222), в подходящем растворителе, таком как ацетонитрил, N,N-диметилформамид или диметилсульфоксид, типично при повышенной температуре, например от 60 до 120°С, с последующим удалением любой защитной группы тиола при использовании стандартных способов.
В формулах (VIa), (VIb), (VIc) и (VId) подходящие защитные группы тиола включают (фенил)3С-(тритил) и другие, описание которых может быть найдено в Protecting Groups in Organic Synthesis, Theodora W. Greene and Peter G. M. Wuts, опубликованном John Wiley & Sons Inc. Удаление таких защитных групп тиола может быть осуществлено стандартными способами, такими как те, которые описаны Greene. Например, когда R представляет собой тритил, свободный тиол может быть образован посредством обработки разбавленной кислотой, например трифторуксусной кислотой в хлорсодержащем растворителе, таком как дихлорметан.
В одном предпочтительном аспекте соединения формул (VIa), (VIb), (VIc) и (VId) могут быть связаны с твердым носителем, таким как полимерные гранулы или покрытия, например тритиловый или хлортритиловый полимер. В этом аспекте избыток реагентов или побочных продуктов реакции радиофторирования может быть отделен от связанного с полимером продукта посредством промывки. Используя способы снятия защиты, как описано выше, осуществляют отщепление соединения формулы (VI) от твердого носителя. Этот метод может особенно подходить для автоматизированного получения соединений формулы (VI). Альтернативно, побочные продукты снятия защиты с тиола, когда они нерастворимы в реакционной смеси, могут быть удалены посредством фильтрации.
Согласно дополнительному аспекту изобретения предложен набор для получения радиофторированного пептида формулы (I), содержащего простетическую группу формулы (VIa), (VIb), (VIc) или (VIa) и активированный пептид формулы (V).
При применении набора соединение формулы (VIa), (VIb), (VIc) или (VId) превращают в соответствующее соединение формулы (VI), используя способы, описанные выше. Предпочтительно соединение формулы (VI) или любой его тиолзащищенный предшественник может быть отделен от отработанных реагентов посредством пропускания реакционной смеси через картридж для твердофазной экстракции (SPE). Картридж для SPE может содержать графитовый наполнитель или носитель С18. Любая защитная группа тиола может быть удалена, например, посредством добавления кислоты, такой как трифторуксусная кислота. Когда тиольная группа в соединении формулы (VI) защищена гидрофобной группой, такой как тритильная группа, снятие защиты может быть легко осуществлено на картридже для SPE, в результате чего гидрофобная защитная группа тиола (такая как тритил) остается связанной с носителем, тогда как меченую простетическую группу формулы (VI) элюируют с высокой чистотой и выходом. Соединение формулы (VI) будет затем добавлено к соединению формулы (V), которое может быть соответствующим образом растворено в водном буфере (рН 7-11). После взаимодействия при неэкстремальной температуре в течение от 1 до 60 мин меченый пептид может быть очищен, например, посредством SPE и собран.
Изобретение проиллюстрировано с помощью следующих примеров, в которых использованы следующие сокращения:
ДХМ: дихлорметан
ТФУ: трифторуксусная кислота
ТГФ: тетрагидрофуран
HBTU: гексафторфосфат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония
Boc: трет-бутоксикарбонил
Fmoc: 9-флуоренилметоксикарбонил
TIS: триизопропилсилан
Примеры
Пример 1: Получение RGD-содержащего пептида, меченного 3-фтор-пропилсульфанилом
Соединение, указанное в заголовке:
1а) Синтез 3-тритилсульфанил-пропан-1-ола
Тритилхлорид (27,9 мг; 0,1 ммоль) и триэтиламин (49 мкл; 0,5 ммоль) растворяли в ДХМ (2 мл) перед добавлением 3-меркапто-1-пропанола (9 мкл; 0,1 ммоль). ДХМ выпаривали при пониженном давлении через 6 часов и неочищенный продукт очищали посредством обращенно-фазовой препаративной хроматографии (колонка Vydac 218TP1022; растворители А=вода/0,1% ТФУ и В=СН3CN/0,1% ТФУ; градиент 30-70% В в течение 40 минут; скорость потока 10 мл/минуту; регистрация при 254 нм). Получили 6 мг очищенного вещества (аналитическая ВЭЖХ: колонка Phenomenex Luna С18,00В-4251-Е0: растворители: А=вода/0,1% ТФУ и В=СН3CN/0,1% ТФУ; градиент 30-70% В в течение 10 мин; скорость потока 1,0 мл/мин; время удерживания 7,73 мин, регистрируемое при 214 и 254 нм). Структуру подтвердили посредством ЯМР.
1b) Синтез 3-тритилсульфанил-пропилового эфира метансульфоновой кислоты
Мезилхлорид (6 мкл; 0,075 ммоль) добавляли к раствору 3-тритилсульфанил-пропан-1-ола (5 мг; 0,015 ммоль) и триэтиламина (32 мкл; 0,23 ммоль) в ТГФ (1 мл). Через 30 мин ТГФ выпаривали при пониженном давлении и неочищенный продукт растворяли в ДХМ, промывали насыщенным раствором гидрокарбоната натрия в воде, насыщенным раствором хлорида натрия и сушили MgSO4. Выход 10 мг получили после упаривания при пониженном давлении (аналитическая ВЭЖХ: колонка Luna C18,00B-4251-E0: растворители: А=вода/0,1% ТФУ и В=СН3CN/0,1% ТФУ; градиент 40-80% В в течение 10 минут; скорость потока 1,0 мл/мин; время удерживания 7,12 мин, регистрируемое при 214 и 254 нм). Структуру подтвердили посредством ЯМР.
1с) Синтез (3-фтор-пропилсульфанил)трифенилметана
Фторид калия (1,4 мг; 0,024 ммоль) и Криптофикс 222 (9,0 мг; 0,024 ммоль) растворяли в ацетонитриле (0,2 мл) (нагревание). Добавляли 3-тритилсульфанил-пропиловый эфир метансульфоновой кислоты (5 мг; 0,012 ммоль) в ацетонитриле (0,2 мл). Реакционную смесь нагревали до 80 градусов в течение 90 минут. Неочищенный продукт очищали посредством обращенно-фазовой препаративной хроматографии (колонка Vydac 218TP1022; растворители А=вода/0,1% ТФУ и В=СН3СТ/0,1% ТФУ; градиент 40-90% В в течение 40 мин; скорость потока 10 мл/мин; регистрация при 254 нм). Получили 2 мг очищенного материала (аналитическая ВЭЖХ: колонка Phenomenex Luna C18,00B-4251-E0: растворители: А=вода/0,1% ТФУ и В=СН2CN/0,1% ТФУ; градиент 40-80% В в течение 10 мин; скорость потока 1,0 мл/мин; время удерживания 8,2 мин, регистрируемое при 214 и 254 нм). Структуру подтвердили посредством ЯМР.
1d) Синтез Fmoc-Lys(Boc)-Cys(StBu)-Arg(Pmc)-Gly-Asp(OtBu)-Cys(StBu)-Phe-Cys(Trt)-Rink Amide AM полимера
Указанную в заголовке пептидную последовательность синтезировали на автоматическом синтезаторе пептидов ABI 433A, начиная с Rink Amide AM полимера с дозатором на 0,1 ммоль, используя 1 ммоль аминокислотные картриджи. Аминокислоты предварительно активировали, используя HBTU перед сочетанием.
1е) Синтез Fmoc-Lys(Boc)-цикло[Cys(CH2)-Arg(Pmc)-Gly-Asp(OtBu)-Cys]-Phe-Cys(Trt)-Rink Amide AM полимера
0,05 ммоль пептидил-полимера, полученного, как описано в (1d), обрабатывали раствором 346 мкл трибутилфосфина, 100 мкл воды и 2 мл диметилформамида. Реагенты удаляли через 90 минут и полимер промывали диметилформамидом и дихлорметаном. Полимер затем обрабатывали раствором 63 мг тетрабутиламмонийфторида и 2 мл дихлорметана. Реагенты удаляли посредством фильтрации через 2 часа и полимер промывали несколько раз дихлорметаном.
1f) Синтез CI-CH2CO-Lys-цикло[Cys(CH2)-Arg-Gly-Asp-Cys]-Phe-Cys-NH2
9-Флуоренилметоксикарбонильную группу удаляли из пептидил-полимера (1е) и N-конец подвергали хлорацетилированию при использовании ангидрида хлоруксусной кислоты. Одновременное удаление пептида и защитных групп боковых цепей из полимера проводили затем в 5 мл трифторуксусной кислоты (ТФУ), содержащей 2,5% триизопропилсилана и 2,5% воды, в течение 1 часа 40 мин.
После обработки получили 27 мг неочищенного пептида (аналитическая ВЭЖХ: градиент 0-40% В в течение 10 минут, где А=Н2O/0,1% ТФУ и В=СН3CN/0,1% ТФУ; 1 мл/мин; колонка Phenomenex Luna 3µ, С18 (2) 50×4,6 мм; детектирование УФ 214 нм; время удерживания продукта 7,79 мин).
Дополнительную идентификацию продукта проводили при использовании масс-спектрометрии с электрораспылением: ожидалось М+Н при 1018,3, обнаружено при 1018,3.
1g) Синтез цикло[СН2СО-Lys-цикло[Cys(СН2)-Arg-Gly-Asp-Cys]-Phe-Cys-NH2
27 мг пептидного продукта, полученного, как описано в (1f), растворяли в смеси вода/ацетонитрил. Доводили рН смеси до 8 раствором аммиака и перемешивали в течение 2 часов. После лиофилизации получили 26 мг требуемого продукта.
Очистку посредством препаративной ВЭЖХ (колонка Phenomenex Luna 5µ C18 (2) 250×21,20 мм) неочищенного вещества проводили при использовании 0-30% В, где
А=Н2O/0,1% ТФУ и В=СН2CN/0,1% ТФУ в течение 40 мин при скорости потока 10 мл/мин. После лиофилизации получили 9 мг чистого вещества. (Аналитическая ВЭЖХ: градиент 0-30% В в течение 10 мин, где А=Н2O/0,1% ТФУ и В=СН3CN/0,1% ТФУ; скорость потока 1 мл/мин; колонка Phenomenex Luna 3µ C18 (2) 50×4,6 мм; детектирование УФ 214 нм; время удерживания продукта 7,00 мин). Дополнительную идентификацию продукта проводили при использовании масс-спектрометрии с электрораспылением: ожидалось М+Н при 982,4, обнаружено при 982,3.
1h) Синтез цикло[-СН2СО-LYs(CI-СН2СО-амино-ПЭГ-цикло[Cys(CH2)-Arg-Gly-Asp-Cys]-Phe-Cys-NH2
9 мг пептида, полученного, как описано в (1g), 34 мг ангидрида Вос-амино-ПЭГ и 7 мкл N-метилморфолина растворяли в 1 мл диметилформамида и смесь перемешивали в течен