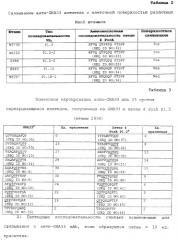
Моноклональное антитело, направленное против gna33 пептида, и его применение
Иллюстрации
Показать всеИзобретение раскрывает моноклональное антитело, направленное против GNA33 пептида с определенной аминокислотной последовательностью, которое проявляет комплемент-опосредованную бактерицидную и/или опсоническую активность против бактерий Neisseria meningitidis серогруппы В (MenB). На основе моноклонального антитела сконструирована композиция для лечения или профилактики MenB заболевания, и использование композиции способствует выработке иммунной реакции против указанных бактерий при ее введении в организм субъекта-млекопитающего. Моноклональное антитело по изобретению может быть использовано также для выделения молекулярного миметика эпитопа бактерии Neisseria meningitidis серогруппы В (MenB) путем контактирования антитела с предполагаемым миметиком и выделением образующегося комплека антитело-миметик. Антитела по изобретению и композиции на их основе можно эффективно использовать для профилактики MenB заболевания, а также для диагностики MenB инфекции. 5 н.п. ф-лы, 5 ил., 6 табл.
Реферат
Область изобретения
Настоящее изобретение относится, в основном, к бактериальным патогенам. В частности, настоящее изобретение относится к молекулярным миметикам эпитопа, экспонированного на поверхности петли 4 PorA Neisseria meningitidis серогруппы В (MenB) P1.2 сероподтипа, и к вырабатываемым против них антителам.
Предпосылки изобретения
Neisseria meningitidis является агентом, вызывающим бактериальный менингит и сепсис. Менингококки подразделяют на серологические группы на основании иммунологических характеристик капсулярных антигенов и антигенов клеточных стенок. Известные в настоящее время серогруппы включают А, В, С, W-135, X, Y, Z и 29Е. Полисахариды, ответственные за специфичность серогрупп, были выделены из некоторых из этих групп, включая А, В, С, W-135 и Y.
N. meningitidis серогруппы В (именуемая здесь как "MenB" или "NmB") отвечает за большой процент бактериальных менингитов у младенцев и детей, проживающих в США и Европе. Этот организм вызывает также летальный сепсис у молодых людей. Экспериментальные MenB вакцины, состоящие из пузырьков белка внешней мембраны (ОМР), в некоторой степени защищают подростков. Однако при вакцинации младенцев никакой защиты не наблюдается, и они составляют возрастную группу, подверженную наибольшему риску заболевания. Кроме того, ОМР вакцины являются серотип-специфическими и подтип-специфическими, и доминантные MenB штаммы подвержены как географическим, так и временным изменениям, что ограничивает применимость таких вакцин.
Эффективные капсулярные вакцины на основе полисахаридов были разработаны против мениногококковых заболеваний, вызываемых серогруппами А, С, Y и W135. Однако аналогичные попытки создать MenB полисахаридную вакцину потерпели неудачу из-за слабой иммуногенности капсулярного MenB полисахарида(именуемого здесь "MenB PS"). MenB PS является гомополимером N-ацетил (α2→8) нейраминовой кислоты. Escherlchia coil K1 имеет идентичный капсулярный полисахарид. Антитела, вырабатываемые против MenB PS, перекрестно реагируют с полисиаловой кислотой (PSA). PSA в большом количестве экспрессируется в фетальных тканях и в тканях новорожденных, особенно на адгезионных молекулах нервных клеток ("NCAM"), расположенных в тканях головного мозга. PSA также обнаружена, но в меньшей степени, в тканях взрослых индивидуумов, включая ткани почек, сердца и нервные ткани органов обоняния. Таким образом, большинство анти-MenB PS антител являются аутоантителами. Поэтому такие антитела обладают способностью вредно воздействовать на развитие плода или могут привести к аутоиммунному заболеванию.
MenB PS производные были получены в ходе попыток преодолеть недостатки, связанные со слабой иммуногенностыо MenB PS. Например, были описаны С3-С8 N-ацил-замещенные производные MenB PS. См. ЕР публикацию №504202 В, Jennings et al. Аналогично, в патенте США №4727136 Jennings et al. раскрыта N-пропионилированная молекула MenB PS, обозначаемая здесь как "NPr-MenB PS". Сообщалось, что у мышей, иммунизованных гликоконъюгатами NPr-MenB PS, вырабатываются высокие титры IgG антител. Jennings et al. (1986) J. Immunol. 137:1708. У кроликов, используя эти производные, вырабатывают две различные популяции антител, которые, как предполагают, связаны с двумя различными эпитопами, один из которых используется природным MenB PS, а другой - нет. Бактерицидная активность была обнаружена в популяции антител, которые перекрестно не реагируют с MenB PS. Jennings et al. (1987) J. Exp.Med. 165:1207. Идентичность бактериального поверхностного эпитопа (эпитопов), реагирующего с защитными антителами, которые вырабатываются под действием этого конъюгата, остается неизвестной. Кроме того, из-за того, что подмножество антител, вырабатываемых в ответ на эту вакцину, является аутореактивным в отношении полисиаловой кислоты хозяина (Granoff et al.(1998) J. Immunol 160:5028), безопасность применения этой вакцины для людей остается сомнительной.
Несмотря на эти попытки, при использовании обычных подходов не удалось идентифицировать антигены, которые были бы безопасны и были бы способны обеспечить широкую защиту от MenB инфекции.
Существовал значительный интерес к использованию молекулярных миметиков антигенов для индуцирования защитных иммунных реакций в ответ на различные патогены, а также для лечения раковых и аутоиммунных заболеваний. Такой подход к созданию вакцин для профилактики инфекционных заболеваний характеризуется наибольшей применимостью, когда рассматриваемый антиген токсичен, или если его трудно выделить, или если желательно вызвать иммунную реакцию в ответ на ограниченное число эпитопов. Тем не менее, существует относительно небольшое количество исследований, в которых сообщается об успешном применении вакцин с миметиками для выработки защитных антител к патогену. В патенте США 6048527 был раскрыт ряд функционально активных антител, направленных против MenB PS производных. Эти антитела перекрестно не реагируют или реагируют слабо с тканями хозяина, и таким образом риск вызвать аутоиммунное заболевание сводится к минимуму. В патент США №6030619 раскрыты молекулярные миметики уникальных эпитопов MenB PS, которые были идентифицированы с использованием этих антител. Однако обнаружение пептидомиметиков других MenB антигенов продолжает представлять значительный интерес.
Была описана полная геномная последовательность MenB, штамма МС58. Tettelin et al., Science (2000) 287:1809. Были идентифицированы полные геномные последовательности нескольких белков, которые вызывают реакции бактерицидных антител сыворотки. Эти белки содержат консервативные последовательности, и оказалось, что они экспонированы на поверхности инкапсулированных MenB штаммов. P1zza et al., Science (2000) 287:1816. Один из этих белков представляет GNA33 (полученный из генома антиген). GNA33 является липопротеином, и предсказанная аминокислотная последовательность демонстрирует гомологичность со связанной с мембраной литической мышиной трансгликозилазой (MItA) из E.coli и Synechocystis sp.Lommatzsch et al., J. Bacteriol. (1997) 179:5465-5470. GNA33 является высоко консервативным среди Neisseria meningitidis. Pizza, et al., Science (2000) 287:1816. У мышей, иммунизованных рекомбинантным GNA33, вырабатываются высокие титры сывороточных бактерицидных антител, измеренные против инкапсулированных MenB штамма 2996. Интенсивность гуморального ответа аналогична интенсивности ответа у контрольных животных, иммунизованных ОМР пузырьками, полученными из штамма 2996. Однако механизм, с помощью которого GNA33 вызывает выработку защитных антител, не был определен, не был также определен объем защитной реакции в ответ на различные MenB штаммы.
Совершенно очевидно, что было бы весьма желательно получить безопасную и эффективную вакцину против MenB.
Краткое содержание изобретения
Настоящее изобретение основано на неожиданном обнаружении того факта, что GNA33 вызывает выработку защитных антител против MenB, имитируя эпитоп, экспонированный на поверхности петли 4 PorA штаммов сероподтипа Р1.2. Функциональная активность таких антител была оценена, как здесь раскрыто, с использованием in vitro и in vivo функциональных анализов, которые предсказывают способность молекулярных агентов защищать человека от менингококковых заболеваний.
Соответственно, в одном из вариантов предмет настоящего изобретения относится к пептидам GNA33, которые включают эпитопы, которые можно использовать для выработки антител, которые обладают функциональной активностью против MenB бактерий. Пептиды включают последовательности более короткие, чем полноразмерная последовательность GNA33. В наиболее предпочтительных вариантах пептиды включают аминокислотную последовательность QTP и, необязательно, дополнительные фланкирующие последовательности, предшествующие или следующие после QTP последовательности, предпочтительно содержащие 1-50 или больше аминокислот, но меньше, чем в полноразмерной последовательности, например 1-3, 1-5, или 1-10, или 1-25, или любое целое число в указанных интервалах, располагаясь либо с С-, либо с N-конца QTP последовательности. Пример GNA33 последовательности представлен на ФИГ.3 (SEQ ID NO: 1). QTP занимает положения 106-108 на ФИГ.3. Следует учитывать, что последовательность не ограничена последовательностями, фланкирующими QTP, такими как представлены на ФИГ.3, так как различные MenB штаммы, такие как здесь раскрыты, имеют различные фланкирующие последовательности. Последовательности PorA участка в различных штаммах известны, и некоторые из них представлены в таблице 2.
В некоторых вариантах GNA33 пептид включает аминокислотную последовательность, выбранную из группы, состоящей из FQTPV (SEQ ID NO: 2), FQTPVHS (SEQ ID NO: 3), AFQTPVHS(SEQ ID NO: 4), QAFQTPVHS (SEQ ID NO: 5), AQAFQTPVHS (SEQ ID NO: 6), AQAFQTPVH (SEQ ID NO: 7), AQAFQTPV (SEQ ID NO: 8), QAFQTPVHSF (SEQ ID NO: 9), AFQTPVHSFQ (SEQ ID NO: 10), FQTPVHSFQA (SEQ ID NO: 11), QTPVHSFQAK (SEQ ID-NO: 12), DVSAQAFQTP (SEQ ID NO: 55), VSAQAFQTPV (SEQ ID NO: 13) и SAQAFQTPVH (SEQ ID NO: 14).
В других вариантах целью изобретения является использование GNA33 полипептидов в качестве носителей для встраивания других эпитопов серологически отличающихся внешних мембранных белков, а также в качестве обычных носителей.
В другом варианте изобретение относится к полинуклеотидам, кодирующим эти пептиды, а также к рекомбинантным векторам, включающим полинуклеотиды, к клеткам-хозяевам, включающим векторы, и к рекомбинантным способам получения пептидов.
Еще в других вариантах настоящее изобретение относится к антителам, направленным против GNA33 эпитопов, причем эти антитела способны связываться с GNA33 эпитопами и/или демонстрируют функциональную активность против MenB бактерий. Как будет раскрыто далее, антитело демонстрирует функциональную активность против MenB организма, если молекула антитела проявляет комплементопосредованную бактерицидную активность и/или опсоническую активность против MenB, определяемую с помощью описываемых здесь анализов. Репрезентативные GNA33 эпитопы включают QTP, FQTPV (SEQ ID NO: 2), FQTPVHS (SEQ ID NO: 3), AFQTPVHS (SEQ ID NO: 4), QAFQTPVHS (SEQ ID NO: 5), AQAFQTPVHS (SEQ ID NO: 6), AQAFQTPVH (SEQ ID NO: 7), AQAFQTPV (SEQ ID NO: 8), QAFQTPVHSF (SEQ ID NO: 9), AFQTPVHSFQ (SEQ ID NO: 10), FQTPVHSFQA (SEQ ID NO: 11), QTPVHSFQAK (SEQ ID NO: 12), DVSAQAFQTP (SEQ ID NO: 55), VSAQAFQTPV (SEQ ID NO: 13) и SAQAFQTPVH (SEQ ID NO: 14).
Другой вариант изобретения относится к моноклональным антителам, направленным против GNA33 эпитопов, и к гибридомам, продуцирующим эти моноклональные антитела. Предпочтительно, чтобы моноклональные антитела проявляли функциональную активность против MenB организма.
Еще один вариант рассматриваемого изобретения относится к способам выделения других молекулярных миметиков эпитопов MenB и к молекулярным миметикам, идентифицируемым этими способами. Эти способы включают:
(a) получение популяции молекул, включающей предполагаемый молекулярный миметик эпитопа MenB;
(b) контактирование популяции молекул с описанными здесь антителами в условиях, которые обеспечивают иммунологическое связывание антитела с молекулярным миметиком, если он присутствует, сопровождающееся образованием комплекса; и
(c) выделение комплексов из не связанных молекул.
В другом варианте рассматриваемое изобретение относится к композиции, включающей GNA33 или пептид GNA33, включающий эпитоп, как указано выше, в комбинации с фармацевтически приемлемым эксципиентом.
В еще одном варианте изобретение относится к композиции, включающей антитело, направленное против GNA33 полипептида в комбинации с фармацевтически приемлемым эксципиентом.
В другом варианте изобретение относится к способу индуцирования у млекопитающих иммунной реакции против Neisseria meningitidis серогруппы В, включающему введение индивидууму GNA33 пептида, как указано выше.
В другом варианте рассматриваемое изобретение относится к способу лечения или профилактики MenB заболевания у млекопитающих, включающему введение индивидууму эффективного количества вышеуказанных композиций.
В другом варианте изобретение относится к способу детектирования антител против Neisseria meningitidis серогруппы В в биологическом образце, включающему
(а) получение биологического образа;
(b) осуществление взаимодействия указанного биологического образца с GNA33 полипептидом в условиях, которые обеспечивают антителам против Neisseria meningitidis серогруппы В, если они присутствуют в биологическом образце, связываться с GNA33 полипептидом с образованием комплекса антитело/GNA33 полипептид; и
(c) определение присутствия или отсутствия комплекса,
тем самым определяя присутствие или отсутствие в образце антител против Neisseria meningitidis серогруппы В.
Репрезентативные GNA33 полипептиды включают GNA33 пептид, который включает аминокислотную последовательность, выбранную из группы, состоящей из QTP, FQTPV (SEQ ID-NO: 2), FQTPVHS (SEQ ID NO: 3), AFQTPVHS (SEQ ID NO: 4), QAFQTPVHS (SEQ ID NO: 5), AQAFQTPVHS (SEQ ID NO: 6), AQAFQTPVH (SEQ ID NO: 7), AQAFQTPV (SEQ ID NO: 8), QAFQTPVHSF (SEQ ID NO: 9), AFQTPVHSFQ (SEQ ID NO: 10),.FQTPVHSFQA (SEQ ID NO: 11), QTPVHSFQAK (SEQ ID NO: 12), DVSAQAFQTP (SEQ ID NO: 55), VSAQAFQTPV (SEQ ID NO: 13) и SAQAFQTPVH (SEQ ID NO: 14).
Эти и другие варианты настоящего изобретения будут понятны специалистам на основании приведенного здесь описания.
Краткое описание чертежей
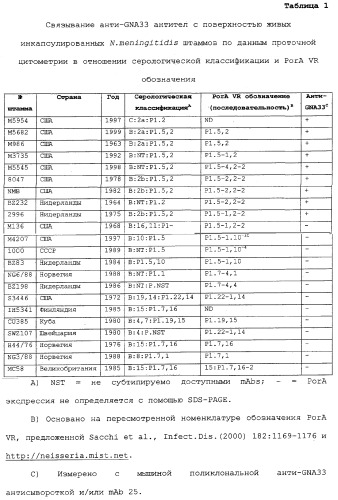
ФИГ.1 демонстрирует связывание анти-GNA33 антисыворотки (1А) и антител с поверхностью инкапсулированных NmB штаммов. ФИГ.1А демонстрирует связывание поликлональной анти-GNA33 антисыворотки и контрольных mAb с живыми инкапсулированными NmB 10 штаммами 2996, М3735, М4207, и МС58 по данным непрямой проточной флуоресцентной цитометрии. Контрольные mAb и антисыворотка включают анти-серогруппы В, капсулярно-специфическое мышиное mAb (SEAM 12, Granoff et al., J.Immunol.(1998) 160:5028-5036), N. meningitidis сероподтип mAb анти-PorA P1.2 и поликлональную антисыворотку мышей, иммунизованных везикулами наружных мембран E.coli. ФИГ.1 В демонстрирует связывание анти-GNA33 mAb 25 и контрольных mAb с NmB штаммами М3735, М4207 и МС58. Мышиные контрольные mAb включают mAb, обладающие иной специфичностью (VIG1Q), и те же антикапсулярные и анти-PorA P1.2 mAb, что раскрыты выше для ФИГ.1А.
ФИГ.2 демонстрирует Вестерн-блоттинг полных мембранных фракций, полученных из различных MenB штаммов, и выделенных с использованием SDS-PAGE. ФИГ.2А демонстрирует реактивность с анти-GNA33 mAb 25. Полоса 1. rGNA33. Полоса 2. Полный белок, полученный из контрольных клеток E.coli. Полосы 3,4 и 5 соответственно: полный белок, полученный из MenB штаммов NG3/88 (Р1.1), МС58 (P1.7, 16) и мутанта МС58, в котором был инактивирован ген, кодирующий GNA33 (MC58ΔGNA33). Полосы 6,7,8 и 9: полный белок MenB штаммов BZ232, BZ232ΔGNA33, NMB и NMBΔGNA33 соответственно. Все четыре штамма относятся к сероподтипу P1.5,2. ФИГ.2В демонстрирует результаты Вестерн-блоттинга тех же образцов белка, что раскрыты для ФИГ.2А, но с использованием анти-PorA Р1.2 mAb в качестве первично определяемого антитела.
ФИГ.3 (SEQ ID NO: 1) демонстрирует полноразмерную аминокислотную последовательность репрезентативного GNA33 полипептида. Подчеркнутые аминокислоты, занимающие положения 1-21, соответствуют лидерной последовательности.
ФИГ.4 демонстрирует связывание анти-GNA33 mAb 25 с прогрессивно уменьшающимися пептидами, соответствующими сегментам (А) GNA33 и (В) PorA P1.2 (Штамм 2996). Соответствующие представленные пептиды были идентифицированы на основании картирования с перекрывающимися 10-мерными пептидами, полученными из каждого белка, и, как показано, содержат эпитоп, распознаваемый mAb 25.
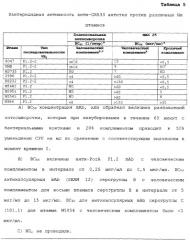
ФИГ. 5 демонстрирует связывание мышиных mAb с живыми инкапсулированными NmB штаммами по данным непрямой проточной флуоресцентной цитометрии. Тестированные mAb раскрыты в описании к ФИГ.1В. ФИГ.5А демонстрирует зависящее от концентрации связывание анти-GNA33 mAb 25 со штаммами 8047 (BC50=15 мкг/мл с человеческим комплементом) и BZ232 (ВС50>150 мкг/мл с человеческим комплементом). Оба штамма оказались восприимчивы к бактериолизу при тестировании на кроликах (см. текст). ФИГ.5В демонстрирует зависящее от концентрации связывание анти-GNA33 со штаммами М986 (PorA VR2 типа P1.2) и М5682 (PorA VR2 типа P1.2), по сравнению со штаммом 8047 (PorA VR2 типа P1.2-2). M986 был устойчив в отношении анти-GNA33 бактериолиза (человеческий или кроличий), М5682 был восприимчив (кроличий комплемент), и штамм 8047 был восприимчив (человеческий или кроличий).
Подробное описание изобретения
При осуществлении настоящего изобретения на практике используют, если нет других указаний, общепринятые способы иммунологии, микробиологии и молекулярной биологии, известные специалистам. Такие методики подробно описаны в литературе. См., например, Sambrook, et al. Molecular Cloning: A Laboratory Manual (2nd Edition, 1989); Sambrook and Russell, Molecular Cloning: A Laboratory Manual (2001); Morrison and Boyd, Organic Chemistry (3rd Edition 1973); Carey and Sundberg, Advanced Organic Chemistry (2nd Edition, 1985); Smith, M. В., Organic Synthesis (1994); Perbal, A Practical Guide to Molecular Cloning (1984); и Handbook of Experimental Immunology, Vols. I-IV (D.M. Weir and C.C. Blackwell eds., 1986, Blackwell Scientific Publications).
Как использовано в настоящем описании и прилагаемой формуле изобретения, формы единственного числа включают также формы множественного числа, если в контексте нет других четких указаний.
I. Определения
При описании настоящего изобретения будут использованы следующие термины, и эти определения будут представлены далее.
Под термином "GNA33 полипептид" подразумевают полипептид, полученный из GNA33 белка, который способен вызвать иммунологическую реакцию против MenB, такую как выработка антител, которые демонстрируют функциональную активность против MenB бактерий, как определено далее. Этот термин можно использовать для обозначения отдельных макромолекул или гомогенных, или гетерогенных популяций антигенных макромолекул, полученных из GNA33. Для целей настоящего изобретения GNA33 полипептид можно получить из любого из различных известных штаммов MenB. GNA33 последовательность для штамма 2996 представлена на ФИГ.3 (SEQ ID NO: 1). Однако известен целый ряд GNA33 последовательностей из других штаммов MenB. См., например, GenBank регистрационные номера С81244, В82023, AF226395, AF226392, AF226390, AF226403, AF226413, AF226412, AF226387, AF226409, AF22641, AF226397, AF226389, AF226393, AF226416, AF226414, AF226402, AF226404, AF235145, AF235144, AF235143, Neisseria meningitidis; E83491, Pseudonionas aeruginosa (штамм PA01); AF300471, Zymomonas mobilis; AAK85834, Agrobacterium tumefacience; CAC41396, Sinorhizobium meliloti; AAK25702, Caulobacter crescentus; 376334, Synechocystis sp. (штамм РСС 6803); AAK03012, Pasteurella multocida; Q9KPQ4, Vibrio cholerae; AAB40463, AAC45723, P46885, Escherichia coli; P57531, Buchnera aphidicola (Acyrthosiphon P1sum); NP143714, Pyrococcus horikoshii.
В том смысле, как здесь использован, термин "GNA33 полипептид" включает также молекулу, полученную из природной GNA33 последовательности, а также полученные рекомбинантно или синтезированные химически GNA33 полипептиды, включая полноразмерную ссылочную GNA33 последовательность, содержащую или не содержащую сигнальную последовательность (аминокислоты 1-21, ФИГ.3), а также GNA33 пептиды, которые остаются иммуногенными, как будет раскрыто далее.
Термин "аналог" относится к производным ссылочной молекулы. Аналог может сохранять биологическую активность, как указано выше, такую как способность вызывать выработку антител с функциональной активностью против MenB. Обычно термин "аналог" относится к соединениям, содержащим последовательность природного полипептида и структуру с одним или более из аминокислотных добавлений, замещений (обычно консервативных по природе) и/или делеций, по сравнению с природной молекулой, до тех пор, пока эти модификации не нарушают активности. Предпочтительно аналог должен, по крайней мере, иметь ту же самую биологическую активность, что и исходная молекула, и может даже проявлять повышенную активность по сравнению с активностью исходной молекулы. Способы получения аналогов полипептидов известны специалистам и раскрыты далее.
Например, аналог обычно должен обладать, по крайней мере, около 50% аминокислотной идентичностью к ссылочной молекуле, более предпочтительно около 75-85% идентичностью и наиболее предпочтительно около 90-95% идентичностью или больше, в отношении соответствующей части последовательности рассматриваемого природного пептида. Аминокислотная последовательность должна содержать не более чем около 10-75 замещений аминокислот, или не более чем около 5-50 замещений аминокислот, или даже только 1, 2, 3 или вплоть до 5 замещений, или любое число в указанном выше интервале. Наиболее предпочтительными замещениями обычно являются консервативные по своей природе замещения, т.е. такие замещения, которые происходят внутри семейства аминокислот. В этом отношении аминокислоты обычно подразделяют на четыре семейства: (1) кислотные - аспартат и глутамат; (2) основные - лизин, аргинин, гистидин; (3) неполярные - аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) полярные незаряженные аминокислоты - глицин, аспарагин, глутамин, цистин, серин, треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируют как ароматические аминокислоты. Например, небезосновательно предположить, что выделенная замена лейцина изолейцином или валином или наоборот и аспартата глутаматом или наоборот; треонина серином или наоборот; или аналогичные консервативные замены аминокислот структурно родственными аминокислотами не окажут существенного воздействия на активность. Белки, содержащие практически те же аминокислотные последовательности, что и ссылочная молекула, но содержащие небольшие аминокислотные замещения, которые практически не влияют на иммуногенность белка, подпадают поэтому под определение GNA33 полипептида. Специалисты могут легко определить представляющие интерес участки молекулы, которые можно модифицировать с разумным сходством, сохраняя биологическую активность, как здесь определено.
"GNA33 пептид " представляет собой GNA33 полипептид, как здесь раскрыто, который включает менее чем полноразмерную молекулу ссылочного GNA33, и который включает, по крайней мере, один эпитоп, как определено далее. Таким образом, композиция, включающая GNA33 пептид, должна включать часть полнораэмерной молекулы, но не всю рассматриваемую GNA33 молекулу. Не ограничивающие примеры GNA33 пептидов включают QTP, FQTPV (SEQ ID NO: 2), FQTPVHS (SEQ ID NO: 3), AFQTPVHS (SEQ ID NO: 4), QAFQTPVHS (SEQ ID NO: 5), AQAFQTPVHS (SEQ ID NO: 6), AQAFQTPVH (SEQ ID NO: 7), AQAFQTPV (SEQ ID NO: 8), QAFQTPVHSF (SEQ ID NO: 9), AFQTPVHSFQ (SEQ ID NO: 10), FQTPVHSFQA (SEQ ID NO: 11), QTPVHSFQAK (SEQ ID NO: 12), DVSAQAFQTP (SEQ ID NO: 55), VSAQAFQTPV (SEQ ID NO: 13) и SAQAFQTPVH (SEQ ID NO: 14).
"Молекулярные миметики" MenB представляют собой молекулы, которые функционально имитируют, по крайней мере, один эпитоп, экспрессируемый в MenB бактерии. Такие молекулярные миметики можно использовать в вакцинных композициях и для индукции антител для диагностических или терапевтических применений, как будет раскрыто, далее. Молекулярные миметики включают (но этим не ограничиваются): небольшие органические соединения; нуклеиновые кислоты и производные нуклеиновых кислот; сахариды или олигосахариды; пептидомиметики, включая пептиды, белки и их производные, такие как пептиды, содержащие непептидные органические фрагменты, синтетические пептиды, которые могут содержать (или не содержать) аминокислоты и/или пептидные связи, но при этом сохраняют структурные и функциональные особенности пептидного лиганда; пирролидины; пептоиды и олигопептиоиды, которые представляют собой молекулы, содержащие N-замещенный глицин, такие как те, что раскрыты Simon et al. (1992) Proc. Natl. Acad. Sci. USA 89:9367; и антитела, включая анти-идиотипические антитела. Способы идентификации и получения молекулярных миметиков более подробно раскрыты далее.
Термин "антитело" охватывает препараты поликлональных и моноклональных антител, а также препараты, включающие гибридные антитела, измененные антитела, гуманизированные антитела, F(ab')2 фрагменты, F(ab) молекулы, Fv фрагменты, одноцепочечный фрагмент, вариабельно представленный на фаге (scFv), однодоменные антитела, химерические антитела и их функциональные фрагменты, которые демонстрируют свойства иммунологического связывания молекул родственных антител.
В том смысле, как здесь использован, термин "моноклональное антитело", относится к композиции антител с гомогенной популяцией антител. Термин не ограничивается способом получения антител. Термин включает все молекулы иммуноглобулинов, а также Fab молекулы, F(ab')2 фрагменты, Fv фрагменты, одноцепочечный фрагмент, вариабельно представленный на фаге (scFv), гуманизированные антитела и другие молекулы, которые демонстрируют свойства иммунологического связывания исходных молекул моноклональных антител. Способы получения поликлональных и моноклональных антител известны специалистам и более подробно раскрыты далее.
Под термином "эпитоп" подразумевают сайт на антигене, которому соответствуют специфические В клетки и Т клетки. Термин также используют как взаимозаменяемый с терминами "антигенная детерминанта" или "сайт антигенной детерминанты". Сайты В клеточных эпитопов на белках, полисахаридах или других биомерах могут состоять из фрагментов различных частей макромолекул, которые были собраны вместе в результате укладки. Эпитопы такого типа именуют конформационными или прерывистыми эпитопами, так как в этом случае сайт состоит из сегментов полимера, которые прерывисты в линейной последовательности, но непрерывны в уложенной конформации (конформациях). Эпитопы, которые состоят из одиночных сегментов биополимеров или других молекул, называют непрерывными или линейными эпитопами. Т клеточные эпитопы обычно ограничены линейными пептидами. Пептидный эпитоп может включать 5 или более аминокислот в пространственной конформации, которая уникальна для эпитопа. Обычно эпитоп состоит из, по крайней мере, 5-8 таких аминокислот и чаще состоит из, по крайней мере, 8-10 таких аминокислот или более. Способы определения пространственной конформации аминокислот известны специалистам и включают, например, кристаллографическое исследование с помощью рентгеновских лучей и двумерную спектроскопию ядерного магнитного резонанса.
Эпитопы можно идентифицировать, используя любое количество методик картирования эпитопов, которые хорошо известны специалистам. См., например, Epitope Mapping Protocols in Methods in Molecular Biology, Vol.66 (Glenn E. Morris, Ed., 1996) Humana Press, Totowa, New Jersey. Например, линейные эпитопы можно определить, одновременно синтезируя большое число пептидов на твердых подложках, пептидов, соответствующих участкам молекулы белка, и осуществляя взаимодействия пептидов с антителами, при этом пептиды должны быть прикреплены к подложкам. Такие методики хорошо известны специалистам и описаны, например, в патенте США №4708871; Geysen et al. (1984) Proc. Natl. Acad. Sci. USA 81:3998-4002; Geysen et al. (1986) Molec. Immunol. 23:709-715, причем все они включены сюда для ссылки. Аналогично, конформационные эпитопы можно легко идентифицировать, определяя пространственные конформации аминокислот, например, с помощью кристаллографического исследования с помощью рентгеновских лучей, или используя двумерную спектроскопию ядерного магнитного резонанса. См., например, Epitope Mapping Protocols выше. Для определения антигенных участков конкретной молекулы можно использовать компьютерные программы, которые определяют уровни гидропатии из аминокислотных последовательностей, используя характеристики гидрофобности и гидрофильности каждой из 20 аминокислот, как раскрыто, например, Kyte et al., J. Mol. Biol. (1982) 157:105-132; и Норр and Woods, Proc. Natl. Acad. Sci. USA (1981) 78:3824-3828. Например, в методике Норр и Woods каждой из аминокислот приписывается численная величина гидрофильности, а затем эти значения повторно усредняются по пептидной цепи. Точки наивысших средних значений гидрофильностей являются индикаторами антигенных участков молекулы.
Антитело проявляет "функциональную активность" против MenB организма, если молекула антитела демонстрирует комплемент-опосредованную бактерицидную активность и/или опсоническую активность против MenB при определении с использованием описанных выше анализов.
Под терминами "очищенный" и "выделенный" подразумевают (когда речь идет о полипептиде или полинуклеотиде), что указанная молекула присутствует при практическом отсутствии других биологических макромолекул такого же типа. Термин "очищенный" в том смысле, как здесь использован, предпочтительно означает, что присутствует, по крайней мере 75% по весу, более предпочтительно, по крайней мере 85% по весу, еще более предпочтительно, по крайней мере 95% по весу, и наиболее предпочтительно, по крайней мере 98% по весу, биологических макромолекул одного типа. Термин "выделенный" полинуклеотид, который кодирует конкретный полипептид, относится к молекулам нуклеиновой кислоты, которые практически не содержат других молекул нуклеиновой кислоты, которые не кодируют рассматриваемый полипептид; однако молекулы могут включать некоторые дополнительные основания или фрагменты, которые не оказывают вредного воздействия на основные характеристики композиции.
Под термином "рекомбинантный GNA33 полипептид" подразумевают GNA33 полипептид, обладающий биологической активностью, определенной с использованием описанных выше методик, и полученный с помощью методик рекомбинантных ДНК, как здесь раскрыто. Обычно ген, кодирующий нужный GNA33 полипептид, клонируют, а затем эксперссируют в трансформированных организмах, как будет раскрыто далее. Организм-хозяин экспрессирует чужеродный ген с получением GNA33 полипептида в условиях экспрессии. При получении с использованием рекомбинантных методик полипептиды настоящего изобретения можно получить без других молекул, которые обычно присутствуют в клетках. Например, можно легко получить GNA33 полипептидные композиции, которые не содержат даже следовых примесей MenB белка, так как единственным MenB белком, продуцируемым рекомбинантными не-MenB клетками-хозяевами, является рекомбинантный GNA33 полипептид.
Термин "полинуклеотид" или "молекула нуклеиновой кислоты" в том смысле, как здесь использован, относится к полимерной форме нуклеотидов любой длины, либо к рибонуклеотидам, либо к дезоксирибонуклеотидам. Этот термин относится только к первичной структуре молекулы, и поэтому включает двух- и одноцепочечные ДНК и РНК. Он также включает известные типы модификаций, например метки, которые известны специалистам, метилирование, "кэпы", замещения аналогами одного или более из встречающихся в природе нуклеотидов, внутринуклеотидные модификации, например, такие как с незаряженными связями (например, метилфосфонатами, сложными фосфотриэфирами, фосфоамидатами, карбаматами и т.д.) и заряженными связями (например, фосфоротиоатами, фосфородитиоатами и т.д.), такими, которые содержат подвешенные фрагменты, такие как, например, белки (включая, например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин, и т.д.), с такими интеркаляторами (например, акридином, псораленом и т.д.), которые содержат хелаты (например, металлы, радиоактивные металлы, бор, окислительные металлы и т.д.), такими, которые содержат алкилирующие агенты, модифицированные связи (например, альфа-аномерные нуклеиновые кислоты, и т.д.), а также немодифицированные формы полинуклеотида.
Термин "рекомбинантная ДНК молекула" или "рекомбинантный полинуклеотид" используют здесь для обозначения полинуклеотида геномного, кДНК, полусинтетического или синтетического происхождения, который, в результате его происхождения или манипуляций: (1) не ассоциирован со всем или частью полинуклеотида, с которым он ассоциирован в природе, (2) связан с полинуклеотидом, который отличается от полинуклеотида, с которым он связан в природе, или (3) не встречается в природе. Таким образом, термин охватывает "полученные синтетически" молекулы нуклеиновой кислоты.
"Кодирующая последовательность" представляет собой молекулу нуклеиновой кислоты, которая транслирована в полипептид, обычно с использованием мРНК, помещенная под контроль соответствующих регуляторных последовательностей. Границы кодирующей последовательности можно определить по кодону начала трансляции у 5'-конца и кодону остановки трансляции у 3'-конца. Кодирующая последовательность может включать (но этим не ограничивается), кДНК и рекомбинантные нуклеотидные последовательности.
Термин "контрольные последовательности" относится к последовательностям нуклеиновых кислот, которые необходимы для осуществления экспрессии кодирующих последовательностей, к которым они присоединены. Природа таких контрольных последовательностей различается в зависимости от организма-хозяина; в прокариотах такие контрольные последовательности обычно включают промотор, сайт связывания рибосомы и последовательность терминации транскрипции; в эукариотах такие контрольные последовательности обычно включают промоторы и последовательности терминации транскрипции. Термин "контрольные последовательности" должен включать, как минимум, все компоненты, которые необходимы для осуществления экспрессии кодирующей последовательности, и может также включать дополнительные компоненты, например лидерные последовательности и гибридные партнерские последовательности.
Контрольный элемент, такой как промотор, "управляет транскрипцией" кодирующей последовательности в клетке, когда РНК полимераза связывает промотор и транскрибирует кодирующую последовательность в мРНК, которая затем транслируется в полипептид, кодируемый кодирующей последовательностью.
Термин "функционально связанный" относится к непосредственному соседству, когда описываемые таким образом компоненты находятся в таком положении относительно друг друга, которое обеспечивает их функционирование нужным образом. Контрольную последовательность "функционально связанную" с кодирующей последовательностью лигируют таким образом, что экспрессия кодирующей последовательности достигается в условиях, совместимых с контрольной последовательностью. Контрольным элементам нет необходимости находиться в непосредственной близости к кодирующей последовательность, если только они функционируют так, чтобы управлять ее экспрессией. Так например, между промотором и кодирующей последовательностью могут находиться встроенные нетранслируемые, но все еще транскрибируемые последовательности, и при этом промотор можно рассматривать как "функционально связанный" с кодирующей последовательностью.
В том смысле, как здесь использован, термин "экспрессионная кассета" относится к молекуле, включающей, по крайней мере, одну кодирующую последовательность, функционально связанную с контрольной последовательностью, которая включает все нуклеотидные последовательности, необходимые для транскрипции клонированных копий кодирующей последовательности и трансляции мРНК в соответствующую клетку-хозяина. Такие экспрессионные кассеты можно использовать для экспрессии эукариотических генов в различных хозяев, таких как бактерии, сине-зеленые водоросли, растительные клетки, дрожжевые клетки, клетки насекомых и клетки животных. В рамках настоящего изобретения экспрессионные кассеты могут включать (но этим не ограничивается) векторы клонирования, специфически сконструированные плазмиды, вирусы или вирусные частицы. Кассеты могут дополнительно включать начало репликации для аутономной репликации в клетках-хозяевах, селектируемые маркеры, различные сайты рестрикции, потенциал для большого числа копий и сильные промоторы.
Под термином "вектор" подразумевают любой генетический элемент, такой как плазмида, фаг, транспозон, космида, хромосома, вирус и т.д., которые способны к репликации, если связаны с соответствующими контрольными элементами, и который может переносить генную последовательность между клетками. Таким образом, термин включает носители для клонирования и экспрессии, а также вирусные векторы.
Клетка была "трансформирована" экзогенным полинуклеотидом, если этот полинуклеотид был введен внутрь клеточной мембраны. Экзогенный полинуклеотид может быть (а может и не быть) интегрирован (ковалентно связан) в хромосомную ДНК, образуя геном клетки. Например, в прокариотах и дрожжах экзогенная ДНК может находиться на эписомальном элементе, таком как плазмида. Что касается эукариотических клеток, стабильно трансформированной клеткой является такая клетка, в которой экзогенная ДНК была интегрирована в хромосому таким образом, что она наследуется дочерними клетками в результате хромосомной репликации. Такая стабильность демонстрируется способностью эукариотической клетки создавать клеточные линии или клоны, состоящие из популяции дочерних клеток, содержащих экзогенную ДНК.
"Клеткой-хозяином" является клетка, которая была трансформирована, или способна к трансформации, экзогенной молекулой нуклеиновой кислоты.
Термин "гомология" относится к проценту идентичности между двумя полинуклеотидами или двумя полипептидными фрагментами. Две ДНК или две полипептидные последовательности являются "практически гомологичными" друг другу, если последовательности демонстрируют, по крайней мере, около 50%, предпочтительно, по крайней мере, около 75%, более предпочтительно, по крайней мере, около 80%-85%, предпочтительно, по крайней мере, около 90%, и наиболее предпочтительно, по крайней мере, около 95%-98% идентичности последовательност