Мутантная ацетолактатсинтаза и способ продукции разветвленных l-аминокислот
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой мутантную ацетолактатсинтазу бактерий (AHAS I), в которой L-аминокислота в позиции 17, 30 и/или 33 в малой субъединице природной ацетолактатсинтазы из Escherichia coli заменена на другую L-аминокислоту или несколько L-аминокислот встроены в указанную позицию или позиции, и ингибирование валином по типу обратной связи в указанной субъединице ослаблено. Изобретение касается также фрагмента ДНК, кодирующего указанную ацетолактатсинтазу, которым трансформируют бактерию рода Escherichia для получения разветвленной L-аминокислоты. Изобретение позволяет получать разветвленные L-аминокислоты с высокой степенью эффективности. 5 н. и 12 з.п. ф-лы, 8 ил., 5 табл.
Реферат
Область техники
Настоящее изобретение относится к биотехнологии, в частности к способу получения L-аминокислот, таких как разветвленные L-аминокислоты. Более конкретно, настоящее изобретение касается использования нового фермента со снятым ингибированием L-валином по типу обратной связи, который участвует в биосинтезе разветвленных L-аминокислот. А именно, настоящее изобретение касается новой мутантной ацетолактатсинтазы (AHAS I) со снятым ингибированием L-валином по типу обратной связи из Е.coli, бактерии семейства Enterobacteriaceae, которая содержит этот фермент, и способа получения разветвленных L-аминокислот методом ферментации с использованием штаммов этих бактерий.
Описание предшествующего уровня техники
Обычно L-амнокислоты получают в промышленном масштабе методом ферментации с использованием штаммов микроорганизмов, выделенных из природных источников, или их мутантов. В большинстве случаев микроорганизмы модифицируют таким образом, чтобы увеличить промышленный выход L-аминокислот.
Описано много технологий для увеличения производственного выхода L-аминокислот, включая трансформацию микроорганизмов рекомбинантной ДНК (см., например, патент США 4278765). Другие технологии увеличения производственного выхода включают увеличение активности ферментов, участвующих в биосинтезе аминокислот и/или снижение чувствительности целевых ферментов к ингибированию по типу обратной связи продуцируемой L-аминокислотой (см., например, выложенную заявку Японии 56-18596 (1981), заявку РСТ WO 95/16042 или патенты США US 5661012 и US 6040160).
Биосинтез изолейцина, лейцина и валина осуществляется через разветвленный метаболический путь, в котором общим для каждого продукта являются три стадии. Реакция с участием ацетолактатсинтазы (синоним: AHAS - Acetohydroxyacid synthase) является первым этапом биосинтеза, общим для каждого из этих продуктов. Эти реакции катализируются изоферментами и являются мишенями для ингибирования конечным продуктом валином; указанная регуляция играет главную роль для физиологического контроля этого пути метаболизма в бактерии. Реакция включает конденсацию активного ацетальдегида (происходящего из пирувата) с эфиром α-кетобутирата или пирувата, в результате чего образуется α-ацето-α-гидроксибутират (предшественник изолейцина) или α-ацетолактат (предшественник лейцина и валина) соответственно.
Было описано, что валин и его кето-кислотный предшественник α-кетоизовалериановая кислота ингибируют рост штамма Е.coli K12 и то, что изолейцин снимает это ингибирование (Tatum E.L., Fed. Proc. 8:511 (1946)). В настоящее время концепция о том, что ингибирование валином в основном является результатом блокирования синтеза α-ацето-α-гидроксибутирата является общепринятой. Изучение штамма E.coli K12 показало, что этот штамм содержит структурные гены для трех активностей AHAS, обозначаемых изоферментами AHAS I, AHAS II, и AHAS III. AHAS I и AHAS III оба ингибируются валином, тогда как AHAS II устойчив к этому ингибированию; однако AHAS II экспрессируется в клетках штамма Е.coli K12 необычным образом (Guardiola J. et al., Mol. Gen. Genet. 156:17-25 (1977)). Все изоферменты AHAS из энтеробактерий состоят из большой и малой субъединиц в составе терамера α2β2, при этом большие субъединицы обладают каталитической функцией, а малые субъединицы осуществляют регуляторную функцию. Малые субъединицы абсолютно необходимы для проявления чувствительности фермента к ингибированию валином по типу обратной связи. Изучение индивидуальных свойств субъединиц изоферментов AHAS I и AHAS III (Weinstock О. et al., J. Bacteriol. 174:5560-5566 (1992)) показало, что малые субъединицы специфически индуцируют каталитически компетентную конформацию целого фермента и стабилизируют переходное состояние.
На модели валин-связывающей области регуляторной малой субъединицы AHAS III из Е.coli были получены несколько малых субъединиц, укороченные на разную длину со стороны С-конца. Эти малые субъединицы с укороченными на различную длину С-концами индуцировали недостаточную чувствительность к валину у укороченных ферментов AHAS III (Mendel S. et al., J. Mol. Biol.10; 325(2):275-84 (2003)).
Однако в настоящее время отсутствуют сообщения, описывающие мутантную бактериальную ацетолактатсинтазу (AHAS I) со снятым ингибированием валином и использование мутантной ацетолактатсинтазы для целей увеличения продуцирования разветвленных L-аминокислот соответствующими штаммами-продуцентами L-аминокислот.
Описание изобретения
Целью настоящего изобретения является предоставление новой мутантной бактериальной ацетолактатсинтазы для получения штаммов-продуцентов разветвленных L-аминокислот, обладающих повышенной продуктивностью L-лейцина, L-изолейцина или L-валина, и предоставление способа получения L-лейцина, L-изолейцина или L-валина с использованием этих штаммов.
Эта цель была достигнута путем конструирования новой мутантной ацетолактатсинтазы из Е.coli. Мутантная ацетолактатсинтаза из Е.coli была сконструирована таким образом, что имеет мутацию в регуляторной субъединице ilvN, а именно мутацию Asn-17, Ala-30 и/или Ala-33. Было показано, что использование такой мутантной ацетолактатсинтазы может увеличить продукцию разветвленной L-аминокислоты при условии, если в штамм-продуцент разветвленной L-аминокислоты ввести несколько копий мутантного фермента. Так было осуществлено настоящее изобретение.
Целью настоящего изобретения является предоставление малой субъединицы мутантной ацетолактатсинтазы (AHAS I) из бактерий, причем L-аминокислота в позиции 17, 30 и/или 33 в малой субъединице ацетолактатсинтазы природного типа из Escherichia coli заменена на другую аминокислоту или несколько аминокислот встроены в указанную или указанные позиции, в результате чего фермент становится нечувствительным к ингибированию валином по типу обратной связи.
Также целью настоящего изобретения является предоставление малой субъединицы мутантной бактериальной ацетолактатсинтазы (AHAS I), описанной выше, причем аспарагин в позиции 17 ацетолактатсинтазы природного типа заменен на лизин.
Также целью настоящего изобретения является предоставление малой субъединицы мутантной бактериальной ацетолактатсинтазы (AHAS I), описанной выше, причем аланин в позиции 30 ацетолактатсинтазы природного типа заменен на пролин.
Также целью настоящего изобретения является предоставление малой субъединицы мутантной бактериальной ацетолактатсинтазы (AHAS I), описанной выше, причем аланин в позиции 33 ацетолактатсинтазы природного типа заменен на последовательность из 12-и аминокислот, имеющую в своем составе сайт терминации трансляции.
Также целью настоящего изобретения является предоставление мутантной ацетолактатсинтазы из бактерий, включающей малую субъединицу, описанную выше.
Также целью настоящего изобретения является предоставление мутантной бактериальной ацетолактатсинтазы, описанной выше, причем указанная природная ацетолактатсинтаза происходит из Escherichia coli.
Также целью настоящего изобретения является предоставление мутантной бактериальной ацетолактатсинтазы, описанной выше, которая включает делецию, замену, вставку или добавление одной или нескольких аминокислот в одной или более позиций, кроме позиций 17, 30 и/или 33, причем фермент становится нечувствительным к ингибированию валином по типу обратной связи.
Также целью настоящего изобретения является предоставление фрагмента ДНК, кодирующего мутантную ацетальдегидсинтазу, описанную выше.
Также целью настоящего изобретения является предоставление бактерии семейства Enterobacteriaceae, которая содержит фрагмент ДНК, описанный выше, и обладает способностью к продукции разветвленных L-аминокислот.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, причем указанная разветвленная L-аминокислота выбрана из группы, состоящей из L-лейцина, L-изолейцина и L-валина.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, причем активность мутантной ацетолактатсинтазы в этой бактерии увеличена.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, причем бактерия принадлежит к роду Escherichia.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, причем активность мутантной ацетолактатсинтазы увеличена путем усиления экспрессии гена, кодирующего мутантную ацетолактатсинтазу.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, причем активность мутантной ацетолактатсинтазы увеличена способом, выбранном из группы, включающей:
а) увеличение количества копий гена мутантной ацетолактатсинтазы,
б) модифицирование последовательности, контролирующей экспрессию гена таким образом, что экспрессия этого гена усиливается.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, причем количество копий гена увеличено путем встраивания нескольких копий гена мутантной ацетолактатсинтазы в хромосому бактерии.
Также целью настоящего изобретения является предоставление способа получения разветвленных L-аминокислот, включающего выращивание бактерии, описанной выше, в питательной среде и выделение разветвленных L-аминокислот из культуральной жидкости.
Также целью настоящего изобретения является предоставление способа, описанного выше, причем бактерия обладает усиленной экспрессией генов, участвующих в метаболических путях биосинтеза разветвленных L-аминокислот.
Также целью настоящего изобретения является предоставление способа, описанного выше, причем указанная разветвленная L-аминокислота выбрана из группы, состоящей из L-лейцина, L-изолейцина и L-валина.
Настоящее изобретение более подробно будет описано ниже.
<1> Мутантная ацетолактатсинтаза и мутантный ген ilvN.
Термин «бактериальная ацетолактатсинтаза» означает, что ацетолактатсинтаза присутствует в бактерии семейства Enterobacteriaceae, в коринебактериях, бактериях, принадлежащих к роду Bacillus и т.д.. Семейство Enterobacteriaceae включает бактерии, принадлежащие к роду Escherichia, Erwinia, Providencia, и Serratia. Бактерии рода Escherichia являются предпочтительными.
Термин «активность ацетолактатсинтазы» означает способность фермента катализировать реакцию с образованием 2-ацето-2-гидроксибутирата и СО2 из пирувата и 2-оксобутаноата. Ацетолактатсинтазная активность экстрактов может быть измерена с использованием метода F.C.Stormer и Н.Е.Umbarger (Biochem. Biophys. Res. Commun., 17, 5, 587-592 (1964)).
Ацетогидроксибутаноатсинтаза I/ацетолактатсинтаза I (AHAS I) является гетеротетрамерным белком, состоящим из двух каталитических и двух регуляторных доменов (Weinstock О. et al., J. Bacteriol., 174(17), 5560-5566 (1992)). Общепринятым является то, что большая субъединица (са. 60-kDa) является каталитической, тогда как малая субъединица - регуляторной. AHAS I кодируется генами ilvB и ilvB.
Замена в малой субъединице ацетолактатсинтазы из Escherichia coli [EC 4.1.3.18] аминокислоты аспарагин в позиции 17 и/или аланин в позиции 30 на любую аминокислоту, предпочтительно на лизин в позиции 17, на пролин в позиции 30 приводит к формированию мутантного белка со снятым ингибированием валином по типу обратной связи. Также замена аланина в позиции 33 на любую аминокислоту, предпочтительно на последовательность из 12-и аминокислот, содержащих сайт терминации трансляции приводит к формированию укороченного белка из 45-и аминокислот ilvB33 (SEQ ID NO:11). Этот мутантный белок также устойчив к ингибированию валином по типу обратной связи.
Ацетолактатсинтаза, содержащая замену, или замены и/или вставку в позиции 17 вместо аспарагина, в позиции 30 вместо аланина и/или в позиции 33 вместо аланина в природном варианте ацетолактатсинтазы, может обозначаться как «мутантная ацетолактатсинтаза». Фрагмент ДНК, кодирующий мутантную ацетолактатсинтазу, может обозначаться как «мутантный ген ilvB» или как «мутантный ген ацетолактатсинтазы». Ацетолактатсинтаза без замены или замен и/или без вставки может обозначаться как «природная ацетолактатсинтаза».
Ген ilvB (синоним - b3671) кодирует большую субъединицу ацетолактатсинтазы. Ген ilvB (нуклеотиды, комплементарные нуклеотидам с номерами с 3849119 по 3850807; в последовательности с инвентарным номером NC_000913.2, gi: 16129170 в GenBank) расположен между генами ilvB и ivbL на хромосоме штамма Е.coli K-12.
Ген ilvB (синоним - b3670) кодирует малую субъединицу ацетолактатсинтазы Ген ilvB (нуклеотиды, комплементарные нуклеотидам с номерами с 3848825 по 3849115; в последовательности с инвентарным номером NC_000913.2, gi: 49175990 в GenBank) расположен между генами uhpA и ilvB на хромосоме штамма E.coli K-12. Нуклеотидная последовательность гена ilvB и аминокислотная последовательность малой субъединицы ацетолактатсинтазы, которую кодирует ген ilνB, показана на SEQ ID NO:1 и SEQ ID NO:2 соответственно.
Мутантная ацетолактатсинтаза получается путем введения мутаций в природный вариант гена ilvB с использованием известных методов. Поэтому оперон ilvBN, состоящий из генов ivB и ilvB, может быть получен методом ПЦР (полимеразная цепная реакция; ссылка на White T.J. et al., Trends Genet., 5, 185 (1989)) с использованием праймеров, синтезированных на основе нуклеотидной последовательности гена. Гены, кодирующие ацетолактатсинтазу из других микроорганизмов, могут быть получены подобным способом.
Мутантная ацетолактатсинтаза может включать делецию, замену, вставку или добавление одной или нескольких аминокислот в одной или в нескольких позициях, кроме позиций 17, 30 и/или 33, при условии, что активность ацетолактатсинтазы при этом не снизится. Число «несколько» аминокислот различается в зависимости от позиции или типа аминокислотных остатков в трехмерной структуре белка. Это объясняется тем, что некоторые аминокислоты похожи друг на друга по структуре и функции, которую они выполняют в белке, и взаимная замена таких аминокислот не приводит к значительному изменению в трехмерной структуре или функции белка. Поэтому в качестве мутантной ацетолактатсинтазы может выступать белок, который имеет гомологию не менее чем 70%, предпочтительно не менее чем 80% и наиболее предпочтительно не менее чем 95% по отношению к полной аминокислотной последовательности ацетолактатсинтазы, при условии, что активность ацетолактатсинтазы при этом сохраняется.
Замена, делеция, вставка или добавление одной или нескольких аминокислотных остатков должны представлять собой консервативную мутацию или консервативные мутации таким образом, чтобы сохранялась активность фермента. Репрезентативная консервативная мутация является консервативной заменой. Примеры консервативных замен включают замену Ala на Ser или Thr, замену Arg на Gin, His или Lys, замену Asn на Glu, Gln, Lys, His или Asp, замену Asp на Asn, Glu или Gln, замену Cys на Ser или Ala, замену Gln на Asn, Glu, Lys, His, Asp или Arg, замену Glu на Asn, Gln, Lys или Asp, замену Gly на Pro, замену His на Asn, Lys, Gln, Arg или Tyr, замену Il на Leu, Met, Val или Phe, замену Leu на Ile, Met, Val или Phe, замену Lys на Asn, Glu, Gln, His или Arg, замену Met на Il, Leu, Val или Phe, замену Phe на Trp, Tyr, Met, Il или Leu, замену Ser на Thr or Ala, замену Thr на Ser или Ala, замену Trp на Phe или Tyr, замену Tyr на His, Phe или Trp, и замену Val на Met, Ile или Leu.
В рамках настоящего изобретения ссылка на порядковый номер аминокислотного остатка, например, фраза «аминокислотные остатки в позициях 17, 30 и/или 33» означает места расположения этих остатков в аминокислотной последовательности белка ацетолактатсинтазы природного типа из Е.coli, показанной на SEQ ID NO:2. В ацетолактатсинтазе из Е.coli природного типа в позиции 17 расположен аспарагин, аминокислотный остаток в позиции 30 является аланином, аминокислотный остаток в позиции 33 - также аланин. Положение аминокислотного остатка может меняться. Например, если аминокислотный остаток введен в N-концевую часть, то аминокислотный остаток, в действительности локализованный в позиции 17, 30 и/или 33, становится позицией 18, 31 и/или 34. В этом случае аминокислотный остаток в первоначальной позиции 17, 30 и/или 33 является аминокислотным остатком в позиции 17, 30 и/или 33 согласно настоящему изобретению.
Для того чтобы идентифицировать L-аминокислоту в позиции 17, 30 и/или 33 ацетолактатсинтазы из Е.coli, необходимо сопоставить аминокислотную последовательность ацетолактатсинтазы из Е.coli (SEQ ID NO:2) с аминокислотной последовательностью ацетолактатсинтазы из интересующей бактерии и установить L-аминокислоты в позициях 17, 30 и/или 33 в ацетолактатсинтазе из интересующей бактерии.
Фрагмент ДНК, который кодирует главным образом тот же белок, что и мутантная ацетолактатсинтаза, описанная выше, может быть получен, например, путем модификации нуклеотидной последовательности ДНК, кодирующей ацетолактатсинтазу, например, посредством сайт-направленного мутагенеза таким образом, что один или несколько аминокислотных остатков в специфическом сайте удаляют, заменяют, вставляют или добавляют. Фрагмент ДНК, модифицированный как описано выше, может быть получен с помощью общеизвестных мутагенных воздействий. Такие воздействия включают обработку препарата ДНК, содержащего ген ilvN в условиях in vitro, гидроксиламином, или обработку микроорганизма, например бактерии, принадлежащей к роду Escherichia и содержащей указанный мутантный ген ilvN, УФ-облучением или реагентами, такими как N-метил-N'-нитро-N-нитрозогуанидин (NTG) или азотистой кислотой.
Замена, делеция, инсерция или добавление нуклеотидов, как описано выше, может также включать мутации, имеющие место в природе, которые (мутация или вариант), например, возникают на основе индивидуальных различий внутри вида или рода бактерий, которые содержат ацетолактатсинтазу.
Фрагмент ДНК, который кодирует главным образом тот же белок, что и мутантная ацетолактатсинтаза, описанная выше, может быть получен, например, выделением фрагмента ДНК, которая способна гибридизоваться с зондом, имеющим в своем составе полную нуклеотидную последовательность гена ilvN или его часть в жестких условиях и которая кодирует белок, обладающий активностью ацетолактатсинтазы из клеток, содержащих мутантную ацетолактатсинтазу, которые были подвергнуты мутагенному воздействию.
В рамках настоящего изобретения термин «жесткие условия» означает такие условия, при которых так называемые специфические гибриды, например гибриды, имеющие гомологию не менее чем 60%, предпочтительно не менее чем 70%, наиболее предпочтительно не менее чем 80% и еще более предпочтительно не менее чем 90% и в наибольшей степени предпочтительно не менее чем 95%, формируются, а неспецифические гибриды, например гибриды, имеющие более низкую гомологию, чем указано выше, не формируются. Например, показательными являются жесткие условия, при которых ДНК способна гибридизоваться при отмывке один или более раз, предпочтительно два или три раза при концентрации соли, эквивалентной обычным условиям отмывки при гибридизации по Саузерну, то есть 1×SSC, 0.1% SDS, предпочтительно 0.1×SSC, 0.1% SDS, при 60°С. Длительность отмывки зависит от типа мембраны, используемой для блотинга и, как правило, является той, что рекомендуют производители. Например, рекомендуемая продолжительность отмывки для мембраны Hybond™ N+ nylon (Amersham, США) в жестких условиях составляет 15 минут. Количество отмывок предпочтительно может составлять от 2-х до 3-х раз. Длина зонда может быть выбрана соответствующим образом в зависимости от условий гибридизации и обычно составляет от 100 п.о. до 1000 п.о.
Уровень гомологии между аминокислотными последовательностями белков и между нуклеотидными последовательностями фрагментов ДНК может быть определен с использованием таких программ построения выравнивания, как BLAST search, FASTA search и Clustal W.
Программа BLAST (Basic Local Alignment Search Tool) является эвристическим алгоритмом поиска, используемым программами blastp, blastn, blastx, megablast, tblastn, и tblastx; эти программы обрабатывают результаты своего поиска с использованием статистических методов, разработанных Karlin, Samuel and Stephen F Altschul ("Methods for assessing the statistical significance of molecular sequence features by using general scoring schemes". Proc. Natl. Acad. Sci. USA, 1990, 87:2264-68; "Applications and statistics for multiple high-scoring segments in molecular sequences". Proc, Natl. Acad. Sci. USA, 1993, 90:5873-7). Программа «FASTA search» описана W.R.Pearson ("Rapid and Sensitive Sequence Comparison with FASTP and FASTA", Methods in Enzymology, 1990 183:63-98). Программа «Clustal W» описана Thompson J.D., Higgins D.G. and Gibson T.J. ("CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice", Nucleic Acids Res. 1994, 22:4673-4680).
Ген, который гибридизуется в условиях, описанных выше, включает гены, которые имеют стоп-кодон внутри кодирующей области, и гены, которые являются неактивными в связи с мутацией активного сайта. Однако такие затруднения могут быть легко устранены путем лигирования гена с коммерчески доступным экспрессирующим вектором и путем оценки ацетолактатсинтазной активности экспрессируемого белка.
<2> Бактерия согласно настоящему изобретению.
Бактерия согласно настоящему изобретению является бактерией-продуцентом разветвленных L-аминокислот, принадлежит к семейству Enterobacteriaceae и содержит фрагмент ДНК, который кодирует мутантную ацетолактатсинтазу. Кроме того, бактерия согласно настоящему изобретению является бактерией-продуцентом разветвленных L-аминокислот семейства Enterobacteriaceae, в которой активность мутантной ацетолактатсинтазы повышена. Конкретно, бактерия согласно настоящему изобретению является бактерией-продуцентом разветвленных L-аминокислот семейства Enterobacteriaceae, причем продукция разветвленных L-аминокислот этой бактерией увеличена путем увеличения активности белка согласно настоящему изобретению. Бактерия согласно настоящему изобретению является бактерией-продуцентом разветвленных L-аминокислот, принадлежащей к роду Escherichia, причем продукция разветвленных L-аминокислот этой бактерией увеличена путем увеличения активности белка согласно настоящему изобретению, а именно мутантной ацетолактатсинтазы со снятым ингибированием валином по типу обратной связи в этой бактерии. Более конкретно, бактерия согласно настоящему изобретению содержит фрагмент ДНК со сверхэкспрессированным геном ilvB в хромосоме или в плазмиде в бактерии и обладает повышенной активностью по продукции разветвленных L-аминокислот.
Согласно настоящему изобретению термин «бактерия, обладающая способностью к продукции разветвленной L-аминокислоты» означает бактерию, обладающую способностью к продукции и выделению разветвленной L-аминокислоты, такой как L-лейцин, L-изолейцин и L-валин в питательную среду, когда бактерия согласно настоящему изобретению выращивается в указанной питательной среде. Способность вырабатывать разветвленную L-аминокислоту может быть придана микроорганизму или усилена в нем путем селекционного выведения.
Фраза «бактерия, обладающая способностью к продукции разветвленной L-аминокислоты» в качестве применяемого здесь термина также означает бактерию, способную продуцировать и вызывать накопление разветвленной L-аминокислоты в питательной среде в больших количествах по сравнению с диким типом или родительским штаммом и предпочтительно означает, что указанный микроорганизм способен накапливать в среде разветвленные L-аминокислоты в количестве не менее чем 0.5 г/л, более предпочтительно не менее чем 1.0 г/л. Показательными L-аминокислотами являются L-лейцин, L-изолейцин и L-валин.
Семейство Enterobacteriaceae включает бактерии, принадлежащие к роду Escherichia, Enterobacter, Erwinia, Klebsiella, Pantoea, Photorhabdus, Providencia, Salmonella, Serratia, Shigella, Morganella, Yersinia и так далее. Более конкретно, могут быть использованы бактерии, классифицируемые как принадлежащие к семейству Enterobacteriaceae в соответствии с таксономией, используемой в базе данных NCBI (National Center for Biotechnologylnformation) (http://www.ncbi.nlm.nih.gov/htbmpost/Taxonomy/wgetorg?mode=Tree&id=1236&lvl=3&keep=1&srchmode=1&unlock). Бактерия, принадлежащая к роду Escherichia или Pantoea, предпочтительна.
Термин «бактерия, принадлежащая к роду Escherichia» означает, что бактерия относится к роду Escherichia в соответствии с классификацией, известной специалисту в области микробиологии. В качестве примера микроорганизма, принадлежащего к роду Escherichia, использованного в настоящем изобретении, но не ограничивается только ею, может быть упомянута бактерия Escherichia coli (E.coli).
Фраза «активность мутантной ацетолактатсинтазы увеличена» означает, что удельная активность выше, чем в немодифицированном штамме, например диком штамме. Примеры увеличения активностей включают увеличение количества молекул мутантной ацетолактатсинтазы в расчете на одну клетку и увеличение специфической активности в расчете на одну молекулу мутантной ацетолактатсинтазы и так далее. Кроме того, в качестве примера, для сравнения может быть использован дикий штамм, например штамм Escherichia coli K-12. В результате усиления активности мутантной ацетолактатсинтазы увеличивается количество разветвленных L-аминокислот в культуральной жидкости.
Увеличение активности мутантной ацетолактатсинтазы в бактериальной клетке может быть достигнуто путем усиления экспрессии гена, кодирующего указанную мутантную ацетолактатсинтазу. Может быть использован любой ген, кодирующий мутантную ацетолактатсинтазу, полученный или выделенный из бактерии семейства Enterobacteriaceae или из коринеформной бактерии. Среди них гены, полученные из бактерии, принадлежащей к роду Escherichia, являются предпочтительными.
Трансформирование бактерии фрагментом ДНК, кодирующим белок, означает введение фрагмента ДНК в клетку бактерии, например путем общеизвестных методов с целью усиления экспрессии гена, кодирующего белок согласно настоящему изобретению и с целью увеличения активности белка в бактериальной клетке.
Способы усиления экспрессии гена включают увеличение количества копий гена. Введение гена в вектор, который способен функционировать в бактерии, принадлежащей к роду Escherichia, увеличивает количество копий гена. Для этих целей предпочтительно могут быть использованы мультикопийные вектора, такие как pBR322, pUC19, pBluescript KS+, pACYC177, pACYC184, pAYC32, pMW119, pET22b или подобные им. Усиление экспрессии гена может быть также достигнуто путем введения нескольких копий гена в бактериальную хромосому, например, методом гомологичной рекомбинации или подобными ей методами.
Также усиление экспрессии гена может быть достигнуто путем помещения фрагмента ДНК согласно настоящему изобретению под контроль сильного промотора. Сила промотора определяется частотой инициации синтеза РНК. Способы оценки силы промотора и примеры сильных промоторов описаны Deuschle U., Kammerer W., Gentz R., Bujard H. (Promoters in Escherichia coli: a hierarchy of in vivo strength indicates alternate structures. EMBO J. 1986, 5, 2987-2994). В качестве примера, промотор РR известен как сильный конститутивный промотор. В качестве других сильных промоторов известны PL промотор, lac промотор, trp промотор, trc промотор фага лямбда и другие.
Усиление трансляции может быть достигнуто путем введения в фрагмент ДНК согласно настоящему изобретению более эффективной последовательности Шайна-Дальгарно (SD-последовательность) вместо природной SD-последовательности, в случае, если природная SD-последовательность предшествует стартовому кодону mRNA, которая взаимодействует с 168-рРНК (Shine J. and Dalgamo L., Proc. Natl. Acad. Sci. USA, 1974, 71, 4, 1342-6).
Использование сильного промотора можно сочетать с увеличением количества копий гена.
Методами получения плазмидной ДНК, гибридизации, ПЦР, приготовления плазмидной ДНК, разрезания и лигирования ДНК, трансформации, выбора олигонуклеотидов в качестве праймеров и подобными им могут являться обычные методы, хорошо известные специалисту в данной области. Эти методы описаны, например, в книге Sambrook J. and Russell D. "Molecular Cloning A Laboratory Manual, Third Edition", Cold Spring Harbor Laboratory Press (2001).
Бактерия согласно настоящему изобретению может быть получена путем введения ранее упомянутых фрагментов ДНК в бактериальную клетку, которая уже способна продуцировать разветвленную L-аминокислоту. С другой стороны, бактерия согласно настоящему изобретению может быть получена путем придания способности к продукции разветвленной L-аминокислоты бактерии, уже содержащей указанные фрагменты ДНК.
В качестве родительского штамма используются бактерии-продуценты L-валина, принадлежащие к роду Escherichia, такие как штаммы Н-81 (VKPM В-8066), NRRL В-12287 и NRRL В-12288 (патент США US4391907), VKPM B-4411 (патент США US 5658766), VKPM В-7707 (Европейская патентная заявка ЕР 1016710 А2) или подобные им. Также используются бактерии-продуценты L-лейцина, принадлежащие к роду Escherichia, такие как штаммы Н-9070 (FERM ВР-4704) и Н-9072 (FERM ВР-4706) (патент США US 5744331), VKPM B-7386 и VKPM B-7388 (патент РФ RU 2140450), W1485atpA401/pMWdAR6, W1485lip2/pMWdAR6 и AJ12631/pMWdAR6 (Европейский патент ЕР 0872547) или подобные им. Также используются штаммы бактерий-продуцентов L-изолейцина, принадлежащих к роду Escherichia, такие как штамм (NZ10) TDH6/pVIC40, pMWD5 (Hashiguchi К. et al., Biosci. Biotechnol. Biochem., 63(4), 672-679 (1999)) или штамм AJ12919, описанный в Европейской патентной заявке ЕР 685555 A1, или подобные им штаммы.
<3> Способ согласно настоящему изобретению.
Способ согласно настоящему изобретению включает продукцию разветвленной L-аминокислоты, такой как L-лейцин, L-изолейцин и L-валин, путем выращивания бактерий согласно настоящему изобретению в питательной среде, обеспечивающего выработку разветвленной L-аминокислоты в культуральную жидкость и выделение разветвленной L-аминокислоты из культуральной жидкости.
Согласно настоящему изобретению выращивание, выделение и очистка разветвленных L-аминокислот из культуральной или подобной ей жидкости может быть осуществлена способом, подобным традиционным способам ферментации, в которых аминокислота продуцируется с использованием бактерии. Питательная среда, используемая для выращивания, может быть как синтетической, так и натуральной, при условии, что указанная среда содержит источники углерода, азота, минеральные добавки и, если необходимо, соответствующее количество питательных добавок, необходимых для роста микроорганизмов. К источникам углерода относятся различные углеводы, такие как глюкоза и сахароза, а также различные органические кислоты. В зависимости от способа ассимиляции выбранной бактерии может быть использован спирт, включая этанол и глицерин. В качестве источника азота могут использоваться различные неорганические соли аммония, такие как аммиак и сульфат аммония, другие соединения азота, такие как амины, природные источники азота, такие как пептон, гидролизат соевых бобов, ферментолизат микроорганизмов. В качестве минеральных добавок могут использоваться фосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, хлорид кальция и подобные им соединения. При необходимости в питательную среду могут быть добавлены дополнительные питательные вещества. Например, если для роста бактерии необходимо присутствие пролина (ауксотрофность по пролину), то в питательную среду может быть добавлено значительное количество пролина.
Выращивание осуществляется предпочтительно в аэробных условиях, например при перемешивании культуральной жидкости на качалке, взбалтывании с аэрацией, при температуре в пределах от 20 до 42°С, предпочтительно в пределах от 37°С до 40°С; рН среды поддерживают в пределах от 5 до 9, предпочтительно от 6.5 до 7.2; рН среды можно доводить аммиаком, карбонатом кальция, различными кислотами, основаниями и буферными растворами. Обычно выращивание в течение от 1-го до 5-и дней приводит к накоплению целевой L-аминокислоты в культуральной жидкости.
После выращивания твердые остатки, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования или фильтрацией через мембрану, а затем L-аминокислота может быть выделена и очищена методами ионообменной хроматографии, концентрирования и кристаллизации.
Примеры
Настоящее изобретение будет более подробно описано ниже со ссылкой на следующие неограничивающие настоящее изобретение Примеры.
Пример 1. Клонирование оперона ilvBN, кодирующего AHAS I из Е.coli
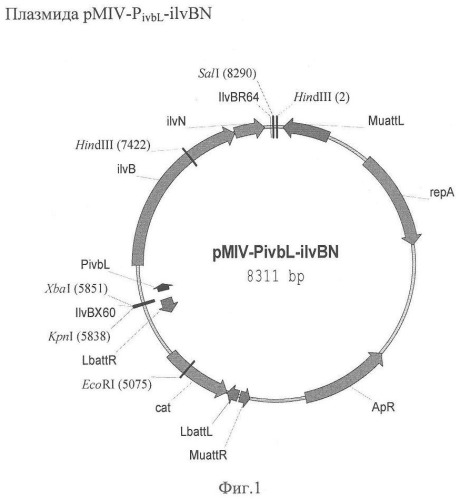
Опреон ilvBN клонировали на векторе pMIV5JS как продукт ПЦР размером 2439 п.о. Конструирование вектора описано ниже в Примере-ссылке 1. Хромосому штамма MG1655 использовали в качестве матрицы для ПЦР. Синтетические олигонуклеотиды ilvBX60 (SEQ ID NO:3) и ilvBR64 (SEQ ID NO:4) использовали в качестве праймеров. Праймер ilvBX60 содержит на своем 5'-конце сайт рестрикции XbaI, а праймер ilvBR64 содержит на своем 5'-конце сайт рестрикции SalI. Температурный профиль ПЦР был следующим: денатурация в течение 5 минут при температуре 94°С; профиль для 30-и последующих циклов: 30 с при 94°С, 30 с при 59°С, 2 мин при 72°С; стадия элонгации: 7 мин при 72°С. Продукт ПЦР размером 2449 п.о. очищали в агарозном геле, обрабатывали рестриктазами XbaI и SalI и клонировали в вектор pMIV5JS, который предварительно обрабатывали теми же рестриктазами. В качестве реципиентного штамма для клонирования использовали штамм B7ΔilvBNΔilvGMΔilvIH. Конструирование штамма B7ΔilvBNΔilvGMΔilvIH описано ниже в Примере-ссылке 2. Полученная в результате плазмида pMIV-PivbL-ilvBN (Фиг.1) комплементировала AHAS- фенотип штамма B7ΔilvBNΔilvGMΔilvIH.
Пример 2. Выведение мутантных штаммов Е.coli, обладающих изоформой I ацетолактатсинтазы (IlvBNValR), устойчивой к ингибированию валином по типу обратной связи.
Штамм B7ΔilvBNΔilvGMΔilvIH/pMIV-PivbL-ilvBN, описанный в Примере 1, содержит только один оперон, кодирующий AHAS (оперон ilvBN). Спонтанные мутанты, устойчивые к ингибированию валином, отбирали на чашках с минимальной средой, дополненной валином в концентрации 1 г/л. Активность ацетолактатсинтазы и ферментов, устойчивых к ингибированию L-валином, определяли в неочищенных экстрактах по методу F.C.Stomer and H.E.Umbarger (Biochem. Biophys. Res. Commun., 17, 5, 587-592 (1964)). Для получения неочищенных лизатов клетки выращивали на минимальной среде М9 до достижения ими конца логарифмической фазы роста, отмывали 100 мМ буфером КН2PO4/K2HPO4, дополненным 100 мМ KCl, рН 7.0. Неочищенные клеточные лизаты приготавливали путем обработки клеток в том же буфере ультразвуковым излучением. Плазмиды, выделенные из отобранных мутантов, устойчивых к ингибированию валином, использовали для ретрансформации AHAS-дефицитного штамма B7ΔilvBNΔilvGMΔilvIH. В результате была получена плазмида pMIV-PivbL-ilvBNValR33, которая обеспечивает рост AHAS-дефицитного реципиентного штамма, устойчивого к ингибированию валином.
Эта плазмида содержит оперон, кодирующий AHAS I, устойчивый к ингибированию валином. Измеряли остаточную активность AHAS в присутствии 10 мМ L-валина. Остаточная активность AHAS = активности в присутствии 10 мМ L-валина (нмоль/мин мг)·100%/активность в отсутствии L-валина (нмоль/мин мг). Активность AHAS измеряли по методу F.C.Stormer and H.E.Umbarger (Biochem. Biophys. Res. Commun., 17, 5, 587-592 (1964)). Результаты измерения активности AHAS для этого штамма представлены в Табл.1.
Пример 3. Нуклеотидная последовательность гена, кодирующего AHAS I Е.coli, устойчивую к ингибированию валином.
Для секвенирования фрагмента ДНК, несущего ilvBN и клонированного
в pMIV-PivbL-ilvBN33 использовали пять олигонуклеотидов: ML74 (SEQ ID NO:5), LattRS1 (SEQ ID NO:6), ilvbS31 (SEQ ID NO:7), ilvbS32 (SEQ ID NO:8) и ilvbS33 (SEQ ID NO:9). Стратегия секвенирования представлена на Фиг.2.
Полученная нуклеотидная последовательность показана в Перечне последовательностей как ilvBN33 (SEQ ID NO:10). Сравнение этой последовательности с помощью расчетных программам выявило прямой повтор фрагмента из 34 нуклеотидов в области кодирования малой субъединицы. Мутантный ген назвали ilvN33 (Фиг.3). Реконструирование аминокислотной последовательности исходя из нуклеотидной последовательности фрагмента ДНК выявило четыре аминокислотные замены и более раннюю терминацию трансляции, приводящие к синтезу белка IlvN33, укороченного на 45 аминокислот (SEQ ID NO:11).
Пример 4. Интеграция оперона PivbL-ilvBNValR33 в хромосому штамма, дефицитного по AHAS, с последущим вырезанием маркера cat.
1. Интеграция генов cat-PivbL-ilvBNValR33 в хромосому.
Для интеграции mini-Mu::cat-PivbL-ilvBNValR33 в хромосому бактерии использовали стандартную процедуру. Вектор pMIV-PivbL-ilvBNValR33 вводили в клетки B7ΔilvBNΔilvGMΔilvIH/pMH10. Mu-транспозазу, кодируемую плазмидой рМН10 (производная плазмиды pACYC177, содержащая ген KmR, гены А и В фага Mu, кодирующие Mu-транспозазу, ген cts62, кодирующий Mu репрессор, и репрессор гена cI857 фага лямбда) (Европейский патент ЕР 1149911) индуцировали инкубацией в течение 20-и минут при температуре 44°С сразу после трансформации.
Клоны, устойчивые к хлорамфиниколу (CmR), отбирали при температуре 30°С на чашках с LB агаром, содержащим хлорамфиникол в концентрации 20 мг/л. После удаления обоих плазмид путем выращивания этих клонов на агаре LB, получили клоны CmRKmSАрS, способные расти на минимальной среде без добавок.
В результате получили штамм B7ΔilvBNΔilvGMΔilvIH mini-Mu::cat-PivbL-ilvBNValR33, сод