Способ производства извлеченного из нематоды противосвертывающего белка (nap)
Иллюстрации
Показать всеИзобретение относится к генной инженерии, конкретно к получению извлеченных из нематоды противосвертывающих белков (NAP), и может быть использовано в медицине. Для получения лекарственного средства на основе NAP проводят культивирование метанотрофных дрожжевых клеток-хозяев, кодирующих rNAPc2 или rNAPc2/пролин, до желаемой клеточной плотности. Далее выделяют NAP из указанных дрожжевых клеток-хозяев катионообменной хроматографией в расширяющемся слое. Для очистки лекарственного вещества NAP используют хроматографию гидрофобного взаимодействия. Выделение NAP и его очистку проводят при значениях рН ниже 4. Изобретение позволяет упростить и повысить эффективность способа получения противосвертывающих белков из нематоды. 3 н. и 22 з.п. ф-лы, 6 ил., 7 табл.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка заявляет приоритет совместно рассматриваемой заявки «Способ лечения геморрагического заболевания с использованием ингибитора фактора VIIa/тканевого фактора», поданной 6 мая 2003 г.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способу производства белков, которые являются противосвертывающими веществами плазмы человека, и к белкам, произведенным данным способом. Конкретно настоящее изобретение относится к способам производства очищенных, извлеченных из нематоды противосвертывающих белков (NAP) и относится к очищенным NAP, произведенным по данному способу. В частности, настоящее изобретение относится к лекарственным веществам NAP и лекарственным продуктам NAP, и способам их производства.
УРОВЕНЬ ТЕХНИКИ
Открытие и очистку лечебных белков, которые имеют потенциальное значение как фармацевтические препараты, можно выполнить в научно-исследовательской лаборатории с использованием материалов и методов, которые не подходят для крупномасштабного промышленного производства фармацевтических продуктов. Чтобы производить фармацевтические продукты в промышленном масштабе, биотехнологические производственные операции должны быть надежными и масштабируемыми без создания угрозы качеству продукта (Gottschalk, 2003, BioProcess Intl 1 (4):54-61). Производственные процессы для фармацевтических продуктов должны обеспечивать рентабельные способы, повышенную выработку продукта, достаточный объем, чтобы удовлетворить спрос, и, в идеале, должны обеспечивать масштабируемость способа, чтобы реагировать на колебания в потребности. Производственные процессы для терапевтических белков должны совершенствовать рентабельные способы производства больших количеств белка в функционирующей форме, так же как способы очистки белка, чтобы производить фармацевтический продукт подходящей чистоты для его предполагаемого использования.
«Исследовательские» способы очистки белка, также известные как «лабораторные» или «стендовые» способы, часто тесно связаны со способами, которые использовались, чтобы обнаружить и охарактеризовать терапевтический белок. Часто выработки только микрограммов или миллиграммов очищенного белка достаточно для охарактеризования белка и определения последовательности его аминокислот. Даже после того как разработана экспрессионная система для рекомбинантного производства терапевтического белка, такие экспрессионные системы не обязательно подходят для производства белка в промышленном масштабе. Кроме того, в исследовательских способах очистки могут использоваться органические растворители, сильные кислоты или другие реактивы, которые нежелательно или непрактично использовать в промышленном масштабе, и иногда их не разрешено использовать в производстве фармацевтических продуктов. Кроме того, в данных способах очистки могут использоваться такие методы разделения, как эксклюзионная или высокоэффективная жидкостная хроматография (ВЭЖХ), которые являются мощными способами очистки в лаборатории, но которые трудно масштабировать до уровня промышленного производства.
Способы пилотного производства, например объемов ферментации от 10 л до 100 л клеток хозяина, экспрессирующего терапевтический белок, подходят для дальнейшего исследования способа производства или для производства количеств терапевтического белка, достаточных для ранних клинических испытаний, но даже способы пилотного производства не всегда возможно масштабировать до производства количеств, требующихся для более поздней фазы клинических испытаний.
Один подход к увеличению объема биотехнологического производства включает расширение производительности или эффективности микробной экспрессионной системы. Для производства терапевтических белков доступно множество известных биологических «фабрик». Однако, поскольку продукция функционирующего белка тесно связана с клеточными механизмами организма, производящего белок, каждая экспрессионная система имеет преимущества и недостатки для использования в крупномасштабном производстве фармацевтических продуктов, в зависимости от белка. E. coli была «фабрикой» выбора для экспрессии многих белков, потому что с ней легко обращаться, она растет быстро, требует недорогой питательной среды и может секретировать белок в питательную среду, что облегчает выделение. Тем не менее, многие эукариотические белки, произведенные в E. coli, производятся в нефункционирующей, незаконченной форме, являются негликозилированными или не имеют других посттрансляционных изменений, кроме того, они не образуют соответствующих дисульфидных мостиков и не формируют соответствующей трехмерной конформации. Кроме того, вещество, произведенное в E. coli, может быть загрязнено эндотоксином. С подобными ограничениями часто сталкиваются при использовании видов Bacillus в качестве экспрессионных систем. Культуры клеток млекопитающих предоставляют малые количества эукариотических белков с надлежащим гликозилированием и конформацией, но культуры клеток млекопитающих дорогостоящи, их масштаб бывает трудно увеличить до промышленного уровня, они могут быть нестабильными и могут требовать использования сыворотки животных. Экспрессионные системы из клеток насекомого быстрые, их относительно легко разрабатывать, и они предлагают хорошие уровни экспрессии белков млекопитающих, но могут быть доростоящими, только умеренно масштабируемыми, и могут давать ненадлежащее гликозилирование. Дрожжевые экспрессионные системы популярны, потому что их легко выращивать, они быстрые и масштабируемые; однако некоторые дрожжевые экспрессионные системы дают неустойчивые результаты, и иногда трудно достигнуть высоких выходов.
Одной из дрожжевых экспрессионных систем, которая показалась многообещающей, является метанотрофная Pichia pastoris. По сравнению с другими эукариотическими экспрессионными системами Pichia предлагает много преимуществ, потому что она лишена как эндотоксиновой проблемы, связанной с бактериями, так и проблемы вирусного загрязнения белков, произведенных в культурах клеток животных (Cino, Am Biotech Lab, May 1999). В отсутствие глюкозы Pichia в качестве источника углерода использует метанол, используя индуцируемый метанолом промотор алкогольоксидазы (AOX1), который в норме подавляет экспрессию фермента, катализирующего первый этап метаболизма метанола, в качестве индуцируемого метанолом промотора, чтобы управлять экспрессией гетерологичных белков. Скорость пролиферативного роста Pichia делает ее легко масштабируемой до промышленного уровня производства, хотя трудности при увеличении масштаба включают управление pH, ограниченность кислорода, ограниченность питательных веществ, колебания температуры и соображения безопасности при использовании метанола (Gottschalk, 2003, BioProcess Intl 1(4):54-61; Cino Am Biotech Lab, May 1999). Производство с Pichia pastoris, согласно нынешним условиям Good Manufacturing Practice (cGMP), возможно в масштабе 1000 л ферментации (Gottschalk, 2003, BioProcess Intl 1 (4):54-61).
Другой подход к увеличению объема биотехнологического производства состоит в улучшении выделения белков и переработки продуктов ферментации. В переработке процессы должны быть регулируемыми, чтобы приспособиться к изменениям и улучшениям титра ферментации, композиции питательной среды и жизнеспособности клеток при максимизации производительности в существующем объеме (Gottschalk, 2003, BioProcess Intl 1 (4):54-61). Недавние успехи хроматографии и фильтрации обеспечивают значительное увеличение селективности, выделения и предлагают большие объемы и малое время цикла, сравнимые с большим объемом и высокими уровнями экспрессии в современных процессах периодической ферментации с подпиткой (Gottschalk, 2003, BioProcess Intl 1 (4):54-61).
Несмотря на большие успехи в улучшении биотехнологического производства, не существует всеобъемлющих решений, годных для любого белка. Способ производства определенного терапевтического белка требует новых и рационализаторских решений проблем, которые могут быть специфичными для данного белка или семейства белков. Аналогично, успешные коммерческие применения часто зависят от комбинации специфических свойств белка или семейства белков и способов производства, используемых для производства данного белка или семейства белков в качестве фармацевтических продуктов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем изобретении предлагается способ производства очищенных извлеченных из нематоды противосвертывающих белков (NAP) и очищенного лекарственного вещества NAP и лекарственных продуктов NAP, произведенных данным способом. В настоящем изобретении предлагается способ производства больших (промышленного масштаба) количеств лекарственного вещества NAP и лекарственного продукта NAP. В частности, в настоящем изобретении предлагается способ производства лекарственного вещества NAP, включающий этапы: (a) процесс ферментации, включающий производство NAP в подходящем хозяине, где по меньшей мере одна последовательность, кодирующая NAP, интегрирована в геном хозяина; (b) процесс выделения, в котором NAP отделяется от клеток и фрагментов клеток; и (c) процесс очистки для очистки лекарственного вещества NAP от загрязнений. Подходящим хозяином является Pichia pastoris. Способ может дополнительно включать введение лекарственного вещества NAP в окончательную лекарственную композицию. Способ может дополнительно включать процесс заполнения, включающий фильтрацию в потоке лекарственного вещества NAP в окончательной лекарственной композиции, и этап заполнения, который может включать разделение лекарственного вещества NAP в окончательной лекарственной композиции на дозированные формы, чтобы произвести лекарственный продукт NAP, и может дополнительно включать лиофилизацию лекарственного продукта NAP. Предлагаемый здесь способ может использоваться для производства очищенного лекарственного вещества NAP или лекарственного продукта NAP из rNAPc2 (AcaNAPc2), rNAPc2/пролин (AcaNAPc2/пролин), AcaNAP5, AcaNAP6, AcaNAP23, AcaNAP31, AcaNAP42, AcaNAP48, AceNAP5, AceNAP7, AduNAP4, AcaNAP24, AcaNAP25, AcaNAP44 или AcaNAP46.
В настоящем изобретении предлагается лекарственное вещество NAP, произведенное способом, раскрытым здесь. В настоящем изобретении предлагается лекарственное вещество NAP, произведенное с использованием NAP, выбранным из, но не ограниченным rNAPc2 (AcaNAPc2), rNAPc2/пролин (AcaNAPc2/пролин), AcaNAP5, AcaNAP6, AcaNAP23, AcaNAP31, AcaNAP42, AcaNAP48, AceNAP5, AceNAP7, AduNAP4, AcaNAP24, AcaNAP25, AcaNAP44 или AcaNAP46. В одном варианте осуществления лекарственное вещество NAP по настоящему изобретению может быть произведено с использованием rNAPc2/пролин. Настоящее изобретение дополнительно предлагает лекарственный продукт NAP, произведенный способом, раскрытым здесь. В настоящем изобретении предлагается лекарственный продукт NAP, произведенный с использованием NAP, выбранным из, но не ограниченным rNAPc2 (AcaNAPc2), rNAPc2/пролин (AcaNAPc2/пролин), AcaNAP5, AcaNAP6, AcaNAP23, AcaNAP31, AcaNAP42, AcaNAP48, AceNAP5, AceNAP7, AduNAP4, AcaNAP24, AcaNAP25, AcaNAP44 или AcaNAP46. В одном варианте осуществления лекарственное вещество NAP по настоящему изобретению производится с использованием rNAPc2/пролин.
В соответствии с другим аспектом настоящего изобретения предлагается способ производства лекарственных веществ rNAPc2/пролин и лекарственных продуктов rNAPc2/пролин. Настоящее изобретение дополнительно предлагает лекарственное вещество rNAPc2/пролин и лекарственные продукты rNAPc2/пролин, произведенные способом, раскрытым здесь. В частности, в настоящем изобретении предлагается способ производства лекарственного вещества rNAPc2/пролин, включающий процесс ферментации, процесс выделения и процесс очистки. Предлагаемый здесь способ включает процесс ферментации, где rNAPc2/пролин производится в Pichia pastoris, имеющей по меньшей мере одну последовательность, кодирующую rNAPc2/пролин, интегрированную в геном, где процесс ферментации включает ферментацию посевного материала, чтобы размножить клетки хозяина до желаемой клеточной плотности, и процесс промышленной ферментации, включающий ферментацию с периодической подачей глицерина, ферментацию с подпиткой глицерином, ферментацию с адаптацией к метанолу и ферментацию с индукцией метанолом продолжительностью приблизительно до семи дней. Способ, предлагаемый здесь, дополнительно предусматривает процесс выделения, включающий ионообменную хроматографию во взвешенном слое, чтобы отделить rNAPc2/пролин от клеток и фрагментов клеток. Способ, предлагаемый здесь, дополнительно предлагает процесс очистки, включающий гидрофобную хроматографию, использующую среду для гидрофобной хроматографии, сбор фракций rNAPc2/пролин, по меньшей мере одну ультрафильтрацию/диафильтрацию (UF/DF) фракций rNAPc2/пролин, ионообменную хроматографию и сбор фракций rNAPc2/пролин с ионообменной хроматографии, где фракции rNAPc2/пролин с ионообменной хроматографии содержат лекарственное вещество rNAPc2/пролин. В соответствии с одним аспектом способ включает управление температурой ферментации, в частности, поддерживание температуры ферментации с адаптацией к метанолу приблизительно 28±2°С в течение приблизительно первых четырех часов и приблизительно 25±1°С в оставшееся время ферментации с адаптацией к метанолу. В соответствии с другим аспектом, поддерживается рН приблизительно 2,9±0,1 в течение ферментации с адаптацией к метанолу и ферментации с индукцией метанолом. В одном варианте осуществления процесс выделения включает хроматографию во взвешенном слое на ионообменной смоле Streamline SP XL при рН приблизительно 3,2±0,2, и этап очистки включает гидрофобную хроматографию на Source 15PHE при рН приблизительно 3,0±0,1, и ионную хроматографию на Source 15Q с последующей UF/DF фракций NAP с ионообменной хроматографии.
Дополнительно предлагается способ производства жидкого лекарственного продукта rNAPc2/пролин, включающий производство лекарственного вещества rNAPc2/пролин по способу, описанному выше, после которого следуют введение лекарственного вещества rNAPc2/пролин в окончательную лекарственную композицию, процесс заполнения, включающий фильтрацию в потоке и этап заполнения, включающий распределение rNAPc2/пролин в окончательную дозированную форму, такое распределение в емкость или флакон, чтобы получить жидкий лекарственный продукт rNAPc2/пролин, и может дополнительно включать лиофилизацию лекарственного продукта rNAPc2/пролин. В настоящем изобретении предлагается жидкий лекарственный продукт rNAPc2/пролин, произведенный данным способом, и лиофилизованный лекарственный продукт rNAPc2/пролин, произведенный данным способом.
В настоящем изобретении предлагается способ производства больших (в промышленном масштабе) количеств лекарственного вещества NAP, в частности лекарственного вещества rNAPc2/пролин. Из лекарственного вещества NAP, произведенного по предложенному здесь способу, может быть приготовлена лекарственная форма, которая может быть приготовлена в виде лекарственного продукта NAP, в том числе в виде жидкого лекарственного продукта NAP или лиофилизованного лекарственного продукта NAP. Кроме того, из лекарственного вещества rNAPc2/пролин, произведенного предлагаемым здесь способом, может быть приготовлена лекарственная форма, которая может быть распределена в виде лекарственного продукта rNAPc2/пролин, в том числе в виде жидкого лекарственного продукта rNAPc2/пролин или лиофилизованного лекарственного продукта rNAPc2/пролин.
Данный способ подходит для эффективного промышленного производства лекарственного вещества NAP и лекарственных продуктов NAP желаемых уровней активности и чистоты. Напротив, ранее раскрытые способы очистки NAP были исследовательскими способами, которые невозможно масштабировать для крупномасштабного производства NAP, и использовали реактивы и материалы, которые не желательны в производстве лекарственных веществ и лекарственных продуктов. Например, ранее раскрытый способ выделения включал центрифугирование для удаления клеток. В предшествующем способе супернатант затем очищался катионообменной хроматографией, гель-фильтрационной хроматографией (также известной как эксклюзионная хроматография), и, наконец, обращенно-фазовой хроматографией. Однако, как предлагается здесь, свойства NAP, в особенности rNAPc2/пролин, допускают изменения исследовательского способа с тем, чтобы заменить этап центрифугирования масштабируемым и обеспечивающим очистку способом, устранить трудномасштабируемые этапы гель-фильтрационной хроматографии и обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ), которые включают использование огнеопасного органического растворителя и специализированного оборудования, и улучшить чистоту конечного продукта. В предлагаемом здесь способе этап ионообменной хроматографии во взвешенном слое, в частности, этап хроматографии во взвешенном слое Streamline SP XL, устранил операции многих блоков, обычно используемых для этапа процесса промышленного выделения (например, комбинацию микрофильтрации с ультрафильтрацией). Как предлагается здесь, этап Streamline SP XL использовался, чтобы отделить rNAPc2/пролин от фрагментов клеток и перевести продукт в буфер, подходящий для первого этапа очистки. Хотя в ранее раскрытом способе использовалась гель-фильтрационная и обращенно-фазовая хроматография, данные колоночные этапы в настоящем изобретении замещены гидрофобной хроматографией (HIC) и анионообменной хроматографией, в частности HIC с использованием Source 15PHE и анионообменной хроматографией с использованием Source 15Q, что привело к существенной очистке rNAPc2/пролин посредством удаления белковых и небелковых загрязнений. Представляется, что относительно низкая изоэлектрическая точка rNAPc2/пролин (pH 4,1) и других NAP может участвовать в создании того неожиданного результата, что более высокое связывание с матрицей и более высокое общее выделение продукта с этапа HIC зависит от выполнения данного этапа хроматографии при низком pH - приблизительно 3,2. Кроме того, отдача процесса явилась результатом выполнения этапов при pH приблизительно 3, начиная с поздних этапов ферментации и заканчивая хроматографией на Streamline и HIC, что устраняло замену буфера между этапами.
КРАТКОЕ ОПИСАНИЕ ФИГУР
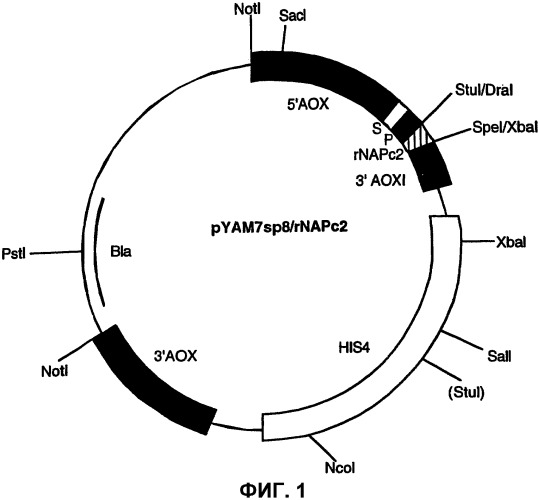
На фиг.1 изображена векторная карта экспрессионного вектора rNAPc2/пролин Pichia pastoris pYAM7sp8/rNAPc2/proline, используемого для производства rNAPc2/pro, показывающая контрольные точки.
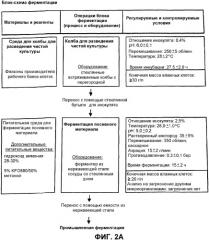
На фиг. 2A и 2B изображена блок-схема ферментации, показывающая используемые материалы и реактивы, используемый процесс и оборудование, и регулируемые и контролируемые условия на каждом этапе процесса ферментации; ферментация начинается с подготовки колбы для посевного материала и продолжается от ферментации посевного материала до промышленной ферментации.
На фиг.3 изображена блок-схема выделения, показывающая используемые материалы и реактивы, используемый процесс и оборудование, и регулируемые и контролируемые условия на каждом этапе процесса выделения.
На фиг. 4A и 4B изображена блок-схема очистки, показывающая используемые материалы и реактивы, используемый процесс и оборудование, и регулируемые и контролируемые условия на каждом этапе процесса очистки; очистка включает этапы гидрофобной хроматографии на Source 15PHE, этап ультрафильтрации/диафильтрации #1 (UF/DF#1), этап ионообменной хроматографии на Source 15Q, этап заключительной UF/DF, фильтрацию в потоке, заполнение и хранение очищенного продукта.
На фиг.5 изображена блок-схема жидкого лекарственного продукта, показывающая используемые материалы и реактивы, используемый процесс и оборудование, и регулируемые и контролируемые условия на каждом этапе процесса изготовления жидкого лекарственного продукта. Данный процесс включает этап смешивания, этап фильтрации и заполнения, и передачу флаконов с жидким лекарственным продуктом на склад.
На фиг.6 изображена блок-схема приготовления лиофилизованного лекарственного продукта, показывающая используемые материалы и реактивы, используемый процесс и оборудование, и регулируемые и контролируемые условия на каждом этапе процесса приготовления лиофилизованного лекарственного продукта. Процесс включает этап UF/DF, этап смешивания, этап фильтрации в потоке и заполнения, и передачу в блок лиофилизации.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении предлагается способ производства очищенных извлеченных из нематоды противосвертывающих белков (NAP), таких как раскрытые в патентах США № (далее «США») 5863894; 5864009; 5866542; 5866543; 5872098; и 5945275 (полное содержание каждого из них включено посредством ссылки), где NAP, охарактеризованные до настоящего времени, имеют противосвертывающее действие и/или обладают активностью сериновых протеаз. В настоящем изобретении предлагаются очищенные NAP, произведенные заявленным способом, где такой очищенный NAP представляет собой лекарственное вещество NAP, из которого может быть приготовлена лекарственная форма в виде лекарственного продукта NAP. Настоящее изобретение может особенно подходить для производства полипептидов, включающих по меньшей мере один домен NAP. В настоящем изобретении предлагаются лекарственные вещества NAP и лекарственные продукты NAP, произведенные по способу, раскрытому здесь. В одном варианте осуществления настоящего изобретения предлагается способ производства лекарственного вещества rNAPc2/пролин и лекарственного продукта rNAPc2/пролин, и предлагается лекарственное вещество rNAPc2/пролин и лекарственный продукт rNAPc2/пролин, произведенные по способу, раскрытому здесь.
Извлеченные из нематоды противосвертывающие белки (NAP) называются так потому, что первый первоначально выделенный NAP был извлечен из нематоды, собачьей анкилостомы, Ancyclostoma caninum. Термин «домен NAP» относится к последовательности, которая, как полагают, обладает противосвертывающими свойствами. Как правило, домен NAP представляет собой аминокислотную последовательность, содержащую меньше чем приблизительно 120 аминокислотных остатков, и содержащую 10 остатков цистеина, как раскрыто в США 5863894; 5864009; 5866542; 5866543; 5872098 и 5945275. «Домен NAP» может также относиться к нуклеиновым кислотам или нуклеотидным последовательностям, кодирующим одну или более аминокислотных последовательностей или полипептидов, имеющих домены NAP. Показательные домены NAP, аминокислотные последовательности NAP, характеристики, в общих чертах определяющие данное семейство белков и молекул нуклеиновой кислоты, которые кодируют такие белки, раскрыты в США 5863894; 5864009; 5866542; 5866543; 5872098 и 5945275.
Лекарственные вещества NAP по настоящему изобретению включают противосвертывающие средства, характеризующиеся ингибированием свертывания крови, которое включает свертывание плазмы. Лекарственные вещества NAP по настоящему изобретению включают, среди прочих, те, которые увеличивают время свертывания плазмы человека, измеренное по протромбиновому времени (ПВ) и/или активированному частичному тромбопластиновому времени (АЧТВ), как раскрыто в США 5863894; 5864009; 5866542; 5866543; 5872098 и 5945275. Специалист в данной области может использовать другие методы анализа, чтобы определить противосвертывающую активность лекарственных веществ NAP. Специалист в данной области может аналогично использовать другие методы анализа, чтобы определить другие биологические активности лекарственных веществ NAP.
Термины «AcaNAPc2» или «rNAPc2» относятся к рекомбинантному белку семейства NAP. Получение и последовательность AcaNAPc2 описаны в США 5866542.
Термины «AcaNAPc2/пролин», «AcaNAPc2P», «rNAPc2/пролин» и «rNAPc2/Pro» относятся к рекомбинантному белку, имеющему аминокислотную последовательность AcaNAPc2, которая была изменена с тем, чтобы добавить остаток пролина к С-концу последовательности AcaNAPc2.
«Лекарственное вещество» или «активный фармацевтический ингредиент (API)» относится к фармацевтически активному веществу, из которого впоследствии вместе с наполнителями может быть приготовлена лекарственная форма, чтобы произвести лекарственный продукт. Лекарственное вещество может находиться в неразделенной на дозы форме. «Лекарственный продукт» относится к законченной дозированной лекарственной форме (например, капсуле, таблетке, жидкому продукту в флаконе, лиофилизованному порошку в флаконе), содержащей лекарственное вещество в буфере окончательной композиции и обычно содержащей неактивные ингредиенты. Лекарственный продукт может быть лекарственной формой, приготовленной из лекарственного вещества. «Наполнитель» относится к неактивным ингредиентам, преднамеренно добавленным к лекарственному продукту, где понимается, что инертные наполнители не имеют фармакологических свойств в используемых количествах. «Загрязнение» относится к компоненту, присутствующему в лекарственном веществе, композиции API, или лекарственном продукте, который не является желаемым продуктом, связанном с продуктом веществом или инертным наполнителем, где понимается, что загрязнение может быть связанным с продуктом или связанным со способом. «Продукты деградации» относятся к вариантам, в частности к молекулярным вариантам, возникающим с течением времени от изменений в лекарственном веществе или лекарственном продукте вследствие света, pH, температуры, воды или реакции с инертным наполнителем либо системой емкости/упаковки/крышки.
«USP» относится к стандартам, представленным в Фармакопее США (USP) и Национальном фармакологическом справочнике (NF) (United States Pharmacopeial Convention, Inc., Роквилл, Мэриленд (2002), «USP26-NF-21», полное содержание которого тем самым включено посредством ссылки), и в Эталонах USP. Дополнительную информацию можно найти на http://www.usp.org или в USP-NF.
В настоящем изобретении предлагается способ производства лекарственного вещества NAP высокой чистоты, в котором на любой стадии ферментации или очистки не используется сырье животного происхождения. Данный способ масштабируем и подходит для проведения в промышленном масштабе. В настоящем изобретении предлагается способ производства лекарственного вещества NAP и лекарственного продукта NAP, где способ включает процессы ферментации, выделения, очистки, фильтрации и заполнения. Предлагается способ ферментации, по которому NAP производится в подходящем хозяине, где кодирующие NAP последовательности интегрированы в геном хозяина. Предлагается способ выделения, который улучшает выход и чистоту белков, выделяемых с этапа ферментации, где способ выделения позволяет более эффективно захватывать NAP по сравнению с традиционной методикой, такой как микрофильтрация и ультрафильтрация. Предлагается способ очистки, в котором лекарственное вещество NAP очищается от загрязнений, где желаемые композиции получают с использованием комбинации способов, включающих, но не ограниченных ультрафильтрацией, диафильтрацией, гидрофобной хроматографией и ионообменной хроматографией. Предлагается необязательный процесс заполнения, где лекарственный продукт NAP вводится в упаковочную тару и может быть лиофилизован.
Способы по настоящему изобретению подходят для производства лекарственного вещества NAP и лекарственных продуктов NAP. Специалист в данной области может изменить способы, как раскрыто здесь, чтобы улучшить экспрессию, выделение, очистку, приготовление лекарственной формы или заполнение, относящиеся к конкретному лекарственному веществу NAP. В неограничивающем примере специалист в данной области может определить изоэлектрическую точку (pI) конкретного интересующего NAP и может незначительно отрегулировать условия, такие как связывающая способность или pH этапа хроматографии, чтобы достигнуть улучшенной очистки желаемого лекарственного вещества NAP. В настоящем изобретении предлагаются лекарственные вещества NAP, очищенные как раскрыто здесь, из NAP, включая, но не ограничиваясь AcaNAPc2, AcaNAPc2/пролин, AcaNAP5, AcaNAP6, AcaNAP23, AcaNAP31, AcaNAP42, AcaNAP48, AceNAP5, AceNAP7, AduNAP4, AcaNAP24, AcaNAP25, AcaNAP46 и AcaNAP44. В частности, в настоящем изобретении предлагается rNAPc2/пролин. Специалист в данной области может определить другие белки NAP, подходящие для использования в способах, раскрытых здесь, для производства очищенного лекарственного вещества NAP.
Ферментация
В настоящем изобретении предлагается процесс ферментации, при котором NAP продуцируется в подходящем хозяине. Как предложено, одна или более последовательностей, кодирующих NAP, интегрированы в геном хозяина, и хозяин производит NAP в течение процесса ферментации. В одном варианте осуществления rNAPc2/пролин продуцируется Pichia pastoris в виде секретируемого белка в процессе ферментации, как предлагается здесь.
Как предлагается здесь, процесс ферментации включает процесс ферментации посевного материала, где клетки-хозяева размножаются до желаемой клеточной плотности, и процесс промышленной ферментации, где NAP производится до желаемого титра. Процесс ферментации посевного материала обеспечивает соответственно плотный инокулят для процесса промышленной ферментации, производящей высокие уровни NAP. Процесс ферментации, предлагаемый здесь, далее включает промышленную ферментацию для продуцирования высоких уровней NAP. Промышленная ферментация включает различные фазы: периодическую подачу глицерина; подпитку глицерином; адаптацию к метанолу и индукцию метанолом. В фазе периодической подачи глицерина формируется биомасса. В фазе подпитки глицерином к культуре подается обогащенный глицерином раствор, чтобы увеличить биомассу и подавить экспрессию. В фазе адаптации к метанолу подача глицерина прекращается и заменяется подачей метанола, который индуцирует продуцирование NAP хозяином. В фазе индукции метанолом поддерживаются условия конца фазы адаптации к метанолу, чтобы поддержать продуцирование NAP.
В соответствии с одним аспектом, чтобы достичь желаемого высокого титра NAP, управляют диапазоном pH ферментации. В одном варианте осуществления pH для ферментации удерживается в диапазоне pH приблизительно 2,9±0,1 единицы pH в течение ферментации с адаптацией к метанолу и ферментации с индукцией метанолом. В соответствии с другим аспектом управляют температурой ферментации. В одном варианте осуществления в фазу адаптации к метанолу удерживается температура приблизительно 28±2°C в течение первых четырех часов, чтобы содействовать успешной адаптации к подаче метанола, а в оставшееся время фазы адаптации к метанолу удерживается температура приблизительно 25±1°C, чтобы содействовать высокому титру NAP. В соответствии с одним аспектом титр NAP продолжает увеличиваться без вредных влияний на продукт в течение приблизительно семи дней, чем достигается высокий общий выход NAP.
В иллюстративных вариантах осуществления предлагаемый здесь процесс ферментации проводили в 15 л, 100 л, 150 л и 1000 л ферментерах и материал из 15, 100 и 150 л ферментации очищали, чтобы произвести лекарственное вещество NAP. В одном варианте осуществления в процессе ферментации продуцируется rNAPc2/пролин с высоким титром. В различных вариантах осуществления ферментация для продуцирования rNAPc2/пролин проводилась в 15 л, 100 л, 150 л и 1000 л ферментерах, и лекарственное вещество rNAPc2/пролин было очищено из 15, 100 и 150 л ферментации.
Выделение
В настоящем изобретении предлагается способ выделения, повышающий выход и чистоту белков NAP с этапа ферментации. Предлагаемый здесь процесс выделения позволяет захватить NAP и удалить клетки и фрагменты клеток, где предложенный здесь способ выделения более эффективен по сравнению с традиционной методикой, такой как микрофильтрация/ультрафильтрация. Не желая быть ограниченной данной теорией, повышенная эффективность предложенного здесь выделения может вытекать из комбинации аспектов системы Pichia, а именно того, что Pichia pastoris создает плотную биомассу в течение ферментации. Кроме того, белки NAP представляют собой относительно малые белки и, следовательно, требуют мембран для ультрафильтрации с малыми порами, которые имеют малую скорость потока, что приводит к большой продолжительности процесса. В соответствии с одним аспектом в процессе выделения используется ионообменная хроматография, включая использование ионообменной хроматографии во взвешенном слое, чтобы отделить NAP от клеток и фрагментов клеток и перевести продукт в буфер, подходящий для использования на последующих этапах очистки. В одном варианте осуществления для выделения лекарственного вещества NAP, как описано здесь, используется блок хроматографии во взвешенном слое на ионообменной смоле Streamline SP XL (Amersham Biosciences). В другом варианте осуществления rNAPc2/пролин отделяется от фрагментов клеток-хозяев, экспрессмрующих rNAPc2, с использованием хроматографии во взвешенном слое. В особенно предпочтительном варианте осуществления rNAPc2/пролин выделяется с использованием ионообменного блока Streamline XL.
Альтернативно, способ выделения, эффективно захватывающий NAP после этапа ферментации, может быть выполнен с использованием способов, отличающихся от ионообменной хроматографии во взвешенном слое. Специалист в данной области может проверить и оценить альтернативные способы захвата NAP и удаления клеток и фрагментов клеток, включающие, но не ограниченные аффинной хроматографией, центрифугированием, фильтрацией, дифференциальным осаждением и другими способами, которые будут определены.
Очистка
В настоящем изобретении предлагается процесс очистки, посредством которого лекарственное вещество NAP очищается от загрязнений. Как предлагается здесь, способ очистки включает гидрофобную хроматографию, сбор фракций NAP, по меньшей мере одну ультрафильтрацию и диафильтрацию (UF/DF) фракций NAP, ионообменную хроматографию, сбор фракций NAP с ионообменной хроматографии, еще один этап UF/DF и заключительную фильтрацию. Понятно, что каждый этап, предложенный в процессе очистки, увеличивает чистоту лекарственного вещества NAP, так что специалист в данной области может определить степень чистоты, требуемую для конкретного применения, и выбрать этапы и условия, необходимые, чтобы достигнуть желаемого уровня чистоты лекарственного вещества NAP. Общая эффективность способа была повышена путем поддержания низкого рН (приблизительно 3) раствора, начиная с жидкой среды для ферментации и включая этап выделения и первый этап очистки (гидрофобную хроматографию на Source 15PHE). Данные этапы были специально разработаны для выполнения при том же самом pH, чтобы удалить этапы смены pH/буфера, требующиеся в других способах, таким образом уменьшая затраты времени и труда, так же как уменьшая потенциальные потери продукта. Данные этапы выполняются при pH ниже приблизительно 5, предпочтительно при pH ниже приблизительно 4, более предпочтительно при pH приблизительно 3. В одном варианте осуществления в гидрофобной хроматографии используется среда для гидрофобной хроматографии Source 15PHE при pH приблизительно 3,0±0,1. Как предлагается здесь, в способе очистки используется гидрофобная хроматография, чтобы удалить загрязнения, где использование низкого pH позволяет гидрофобной среде связывать бульшие количества NAP и использование градиентного элюирования позволяет разделить близкородственные загрязнения. Как предлагается здесь, фракция NAP, элюированная со среды для гидрофобной хроматографии, подвергается ультрафильтрации и диафильтрации (UF/DF), чтобы сконцентрировать продукт и выполнить смену буфера, после чего NAP в подходящем буфере наносится на ионообменную среду, чтобы удалить бульшую часть оставшихся белковых и небелковых загрязнений, включая близкородственное загрязнение. Наконец, как предлагается здесь, фракция NAP, собранная с ионообменной хроматографии, содержащая высокоочищенное лекарственное вещество NAP (API), подвергается UF/DF, чтобы сконцентрировать лекарственное вещество NAP и перевести его в буфер окончательной композиции.
В одном варианте осуществления профильтрованный, приведенный в надлежащее состояние элюат с этапа хроматографии на Streamline SP XL, используемого для выделения NAP, вводится в колонку со средой для гидрофобной хроматографии Source 15PHE (Amersham Biosciences) при низком pH (приблизительно 3,0±0,1), где значительное количество NAP связывается с колонкой, после чего следует градиентное элюирование Source 15PHE, добавка гидроксида натрия, чтобы поднять pH приблизительно до 5 или выше, и затем UF/DF элюированной фракции NAP, после которой раствор NAP вводится в колонку со средой для ионной хроматографии Source 15Q (Amersham Biosciences), и градиентное элюирование используется, чтобы отделить лекарственное вещество NAP от близкородственных загрязнений. В одном варианте осуществления фракции NAP после ионообменной хроматографии содержат лекарственное вещество NAP