2-арилуксусные кислоты, их производные и содержащие их фармацевтические композиции
Иллюстрации
Показать всеИзобретение относится к новому применению соединений 2-арилуксусной кислоты и амидов формулы (I) и их фармацевтически приемлемых солей, где А включает атом X и представляет собой фенил или 5-6-членное гетероароматическое кольцо, необязательно содержащее гетероатом, выранный из N; цифрами 1 и 2 отмечены соответствующие положения на кольце А; атом X выбран из N (азота) и С (углерода); R означает замещающую группу на кольце А, выбранную из: - группы в 3 (мета) положении, выбранной из группы, включающей прямой или разветвленный С1-С5-алкил, С2-С5-ацил; - группы в 4 (пара) положении, выбранной из группы, включающей С1-С5-алкил, С1-С5-алкансульфониламино, замещенный галогенами; Ну представляет небольшую гидрофобную группу со значением коэффициента стерической затрудненности ν в интервале между 0,5 и 0,9 (где ν представляет стерическую константу Чартона (Charton steric constant) для заместителей), включающую метил, этил, хлор, бром, группа Y выбрана из О (кислорода) и NH; когда Y означает О (кислород), R′ означает Н (водород); когда Y означает NH, R′ выбран из групп: -Н, - остатка формулы SO2Rd, где Rd означает С1-С6-алкил, при получении лекарственного средства, являющегося ингибитором индуцированного IL-8 PMN хемотаксиса (CXCR1) или индуцированного GRO-α PMN хемотаксиса (CXCR2).
3 н. и 11 з.п. ф-лы, 2 табл., 4 ил.
Реферат
Краткое описание изобретения
Настоящее изобретение относится к 2-арилуксусным кислотам и их производным, к содержащим их фармацевтическим композициям, которые используют для предупреждения и лечения повреждений тканей вследствие осложненного рекрутинга полиморфно-ядерных нейтрофил (ПМК лейкоцитов) на месте воспаления. В частности, изобретение относится к 2-фенилуксусной кислоте и ее производным, используемым для лечения IL-8 опосредованных заболеваний, таких как псориаз, язвенный колит, ХОБЛ, и нарушений, вызванных ишемией и реперфузией.
Предпосылки создания изобретения
На химическое стимулирование (при стимулировании веществами, называемыми хемокинами) реагируют конкретные клетки крови (макрофаги, гранулоциты, нейтрофилы, полиморфно-ядерные), мигрируя вдоль концентрационного градиента стимулирующего агента в процессе, называемом хемотаксис. Основные известные стимулирующие агенты или хемокины представлены продуктами распада комплемента С5а, некоторыми N-формилпептидами, образованными при лизисе бактериальной поверхности, или пептидами синтетического происхождения, такими как формилметиониллейцилфенилаланин (f-MLP), и главным образом рядом цитокинов, включая интерлейкин-8 (IL-8, также называемый CXCL8). Интерлейкин-8 представляет собой эндогенный хемотактический фактор, образованный большинством ядерных клеток, таких как фибробласты и макрофаги. В некоторых патологических состояниях, отличающихся осложненным рекрутментом нейтрофилов, более сильное повреждение тканей на месте связано с инфильтрацией нейтрофильных клеток. Недавно была широко освещена роль нейтрофильной активации при определении повреждения, связанного с постишемической реперфузией и легочной гепероксией.
Биологическая активность IL-8 опосредована взаимодействием интерлейкина с мембранными рецепторами CXCR1 и CXCR2, которые принадлежат семейству семи трансмембранных рецепторов, выраженных на поверхности человеческих нейтрофилов, и определенных типов T-клеток (L. Xu et al., J. Leukocyte Biol., 57, 335, 1995). Известны селективные лиганды, которые могут распознавать между CXCR1 и CXCR2: GRO-α является примером CXCR2 селективного хемотактического фактора.
Потенциальная патогенная роль IL-8 в легочных заболеваниях (воспаление легких, синдром острого респираторного заболевания, астма, хроническое воспаление легких и фиброзный цистит) и особенно в патогенезисе ХОБЛ (хронической обструктивной болезни легких) через рецептор CXCR2 подробно рассмотрена (D. WP Hay and H.M.Sarau., Current Opinion in Pharmacology 2001, 1:242-247).
Характеристическая нейтрофильная аккумуляция происходит в остром и хроническом патологическом состоянии, например в сильно воспаленных и неподдающихся терапии областях псориазных поражений. Нейтрофилы хемотактически притягиваются и активируются за счет синергического действия хемокинов, IL-8 и Gro-α, выделяемых стимулированными кератиноцитами, а также C5a/C5a-desArg фракции, образуемой в результате альтернативной комплементарной активации (T.Terui et al., Exp. Dermatol., 9, 1, 2000).
Новые классы сильнодействующих и селективных ингибиторов биологической активности IL-8 (амиды R-2-арилпропионовой кислоты и N-ацилсульфонамиды) описаны как эффективные ингибиторы индуцированного IL-8 нейтрофилами хемотаксиса и дегрануляции (WO 01/58852; WO 00/24710). Кроме того, описаны новые подклассы R и S 2-фенилпропионовых кислот (WO 03/043625) как сильнодействующие ингибиторы IL-8, полностью лишенные нежелательного ингибирующего действия энзима цикло-оксигеназы (ЦОК). Ингибирование синтеза простагландина, обусловленное ингибированием ЦОК, в действительности включает увеличение образования цитокина, который приводит к усилению нежелательных про-воспалительных эффектов нейтрофилов.
Подробное описание изобретения
Исследования медицинской химии показали существенную роль метильной группы на пропионовой цепочке 2-арилпропионовых кислот в проявлении ими их ингибирующего IL-8 действия.
Авторы изобретения действительно показали, что 2-[4-изобутилфенил]уксусная кислота (ибуфенак) и 2-[3-бензоилфенил]уксусная кислота (кетофенак), хорошо известные ингибиторы ЦОК, принадлежащие к семейству фенилуксусных кислот, не проявляют никакого ингибирующего IL-8 действия, которое, в отличие от этого, проявляется в сильнодействующих соответствующих фенилпропионовых кислотах, таких как ибупрофен и кетопрофен.
Обычно у 2-фенилуксусных кислот и их производных, таких как амиды и сульфонамиды, отсутствует любое ингибирующее IL-8 действие, и это подтверждает существенную роль метильной группы в соответствующих 2-фенилпропионовых производных.
Авторы настоящего изобретения завершили SAR исследования на различных классах 2-арилпропионовых кислот и производных, описанных выше, которые позволили точно выявить фармокофорную структуру, присущую всем этим новым классам игибиторов IL-8.
Фармокофор определяется как совокупность стерических и электронных требований к классу биологически активных соединений, необходимых для обеспечения биологической активности; обычно фармакофор можно рассматривать как совокупность стерических и электронных требований, необходимых для обеспечения положительных взаимодействий между биологически активной молекулой и ее мишенью. Предположение, при изучении фармакофора, состоит в том, что все соединения в обучающей последовательности разделяют тот же механизм и взаимодействуют с той же биологической мишенью.
Авторы изобретения определили две фармокофорные модели: первую модель, обеспечивающую биологическую активность ингибиторов IL-8, селективно действующих на опосредованный CXCR1 путь метаболизма (далее по тексту CXCR1 ингибиторы), и во вторую модель, представляющую стерический и электронный рекрутинг ингибиторов IL-8 , двойственно действующих на опосредованные CXCR1 и CXCR2 пути метаболизма (далее по тексту CXCR1/CXCR2 ингибиторы). Эти две модели отвечают за наблюдаемые зависимости активности от структуры, поскольку все испытанные неактивные молекулы напротив двух полных фармокофорных гипотез либо отличаются отсутствием значительных признаков наложения (непригодная), либо отвечают фармакофорной гипотезе в высоко энергетических конформациях. Две вновь найденные фармакофорные модели разделяют четыре из соответственно пяти и шести признаков; эти четыре признака полностью совмещаются в химическом пространстве 3D. Схема общей части фармокофорных моделей показана на фиг.1.
Описание чертежей
На фиг.1 графически показаны четыре общих отличительных признака фармакофоров соответственно ингибиторов CXCR1 и ингибиторов CXCR1/CXCR2. Следующие типы отличительных признаков входят в фармокофорную часть: два акцептора водородных связей, одна ароматическая гидрофобность и одна алифатическая гидрофобность. Гидрофобные части (ароматическая и алифатическая) представлены сферами радиусом 1,7 Ангстрем. Акцептор водородных связей представлен векторной функцией, состоящей из двух сфер, чьи центры тяжести отстоят на 3,0 Ангстрема. Более мелкая (радиусом 1,7 Ангстрем) сфера определяет положение атома акцептора водородных связей на лиганде, а более крупная сфера (2,3 Ангстрем) определяет проекцию точки акцептора водородной связи от места рецептора. Сплошная сфера представляет точное расположение в пространстве 3D метильной группы фенилпропионового остатка.
| На фиг.2 представлено наложение следующих арилпропионовых производных: |
R(-)2-(4-изобутилфенил)пропионовая кислота; R(-) 2-(4-изобутилфенил)пропионилметансульфонамид; R(-)-N-(2'-гидроксиэтоксиэтил)-2-(4-изобутилфенил)пропионамид. Сплошная сфера представляет точное расположение в 3D пространстве метильной группы фенилпропионового остатка.
На фиг.3 представлено наложение следующих арилуксусных производных: (2-метил-4-изобутилфенил)уксусная кислота; (2-метил-4-изобутилфенил)ацетилметансульфонамид; (2-метил-4-изобутилфенил)ацетамид.
На фиг.4 показано наложение следующих арилуксусных производных: (5-бензоил-1-метил-1Н-пиррол-2-ил)уксусная кислота; (1-бензоил-2-метил-1Н-индол-3-ил)ацетилметансульфонамид; (2-хлор-3-бензоилфенил)ацетамид.
Получение фармакофора осуществляли с применением программного обеспечения Catalyst ™, version 4.7 (Molecular Simulations, Inc., San Diego, CA), которое предназначено идентифицировать общие конфигурации активных молекул по их химическим признакам. Конфигурация представляет собой набор относительных положений в 3D пространстве, каждое из которых связано с типом признака. Все соединения в обучающей последовательности описаны в терминах их химических функций, связанных с 3D пространством. Кроме того, каждый химический фрагмент может быть рассмотрен программой как более чем один признак, на базе установленного сходства. Например, ароматическое кольцо может «установить» оба гидрофобных взаимодействия и π-π взаимодействия в целевом узле, и это различное поведение относят к различным признакам (гидрофобным, гидрофобным ароматическим). Функциональная группа в молекуле может быть связана с более чем одним признаком, в зависимости от ее химических и физических свойств, и различные функциональные группы могут демонстрировать схожесть свойств при взаимодействии с целью, картируя таким образом тот же признак.
Анализ определений признаков и выбор признаков представляют собой решающую стадию построения гипотезы фармакофора. Хорошо известно, что наиболее важные силы, включенные в молекулярное распознавание, представлены электростатическими взаимодействиями, водородными связями и гидрофобными взаимодействиями. Авторами изобретения приняты определения нескольких признаков, относящихся к химической природе группы по способности осуществлять конкретные взаимодействия, ответственные за биологическую активность.
Определения признаков
Акцептор водородной связи (АВС) (липид)
Признак, связанный с липидным акцептором водородных связей, характеризуется следующими типами атомов или групп атомов, которые представляют собой доступные с поверхности атомы азота, кислорода или серы (за исключением атомов высшей валентности), которые имеют одну пару и заряд меньше или равный нулю.
Поскольку рассматривается липидное окружение, все основные амины (первичные, вторичные и третичные) включены в определение. Водородная связь представляет собой сильно направленное взаимодействие, этот признак косвенно связан с теоретическим положением соответствующего донора водорода. Положения трех водородных связей рассматриваются, например, на карбонильной группе (акцепторе), две первые - вдоль идеальных положений одиночных пар и третья - вдоль направления связи С=О.
Гидрофобность (алифатическая, ароматическая)
Признак гидрофобности определяется как непрерывная совокупность атомов, которые не являются соседними ни с какой концентрацией заряда (заряженными атомами или электроотрицательными атомами), в конформационном варианте структуры, в котором атомы являются поверхностно доступными, включая фенил, циклоалкил, изопропил и метил.
Тем не менее необходимо было различить признак ароматической гидрофобности от признака алифатической гидрофобности, чтобы установить удовлетворительную корреляцию с биологическими результатами. Первый учитывает только ароматические атомы, последний учитывает только алифатические атомы.
Считается, что молекула отвечает конфигурации, только если обладает набором относительных признаков и конкретной конформацией, так что ее признаки могут быть наложены на соответствующие «идеальные» положения. Набор признаков можно рассматривать как наложенный, если каждый признак лежит в пределах конкретного расстояния с учетом допуска от идеальной точки.
Координаты абсолютных сферических центроид каждого признака перечислены ниже:
Ароматическая гидрофобность имеет картезианские координаты +2,588; +0,613; -1,940 соответственно вдоль осей XYZ.
Алифатическая гидрофобность имеет картезианские координаты +1,788; +2,693; +1,260 соответственно вдоль осей XYZ.
Проецированная точка 1 акцептора водородной связи имеет картезианские координаты -2,713; +2,333; +2,840 соответственно вдоль осей XYZ.
Положение 1 акцептора водородной связи имеет картезианские координаты -0,233; 0,936, +1,877 соответственно вдоль осей XYZ.
Проецированная точка 2 акцептора водородной связи (необязательная) имеет картезианские координаты
-5,013; -1,188; -0,400 соответственно вдоль осей XYZ.
Исходная точка 2 акцептора водородной связи (необязательная) имеет картезианские координаты
-2,688; -1,514, +1,472 соответственно вдоль осей XYZ.
Картирование первых трех признаков (алифатической гидрофобности, ароматической гидрофобности, акцептора водородной связи 1) является определяющим для биологической ингибирующей IL-8 активности класса; четвертый признак (акцептор водородной связи 2) может быть необязательно картирован молекулами класса, но присутствие акцептора водородной связи второй группы не является необходимым.
На все расстояния между химическими признаками установлены допуски +0,5 Ангстрем и на все геометрические углы установлены допуски ± 20 градусов.
Как рассмотрено выше, необходимы другие фармакофорные точки, чтобы завершить фармакофорный анализ, но их описание не относится к предмету настоящего изобретения. Наблюдаемая CXR1/CXR2 селективность в классе строго связана со способностью ингибиторов соответствовать конкретным точкам в необщей части фармакофора.
Наоборот, если речь идет об общей части фармакофора, общий принцип наложения наблюдается для ингибиторов CXR1 и ингибиторов CXR1/CXR2, принадлежащих классам 2-фенилпропионовых кислот, 2-фенилпропионилсульфонамидов и 2-фенилпропионамидов, как показано на фиг.2. Сплошные сферы представляют точное расположение в пространстве 3D метильных групп фенилпропионового фрагмента.
В восстановленных лигандах, которые частично или полностью картируют эту гипотезу (фиг.2), фенильный остаток 2-фенилпропионовой химической структуры всегда очень хорошо соответствуют признаку ароматической гидрофобности; признак акцептора водородной связи (АВС) 1 довольно хорошо подтверждается карбонильным кислородом пропионильного остатка; признак акцептора водородной связи (АВС) 2 необязательно подтверждается атомом второго акцептора водородной связи на остатке, соединенном с амидным или сульфонамидным азотом; признак алифатической гидрофобности наглядно подтверждается метильной группой пропионильного остатка. Фенилуксусные кислоты и производные в свете вышеизложенных соображений не соответствуют фармакофорной гипотезе, поскольку определяющий признак алифатической гидрофобности, представленный сплошной сферой на фиг.2, отсутствует в химической структуре.
Авторы изобретения установили, что выбранные подклассы 2-арилуксусных кислот и их производные, которые не содержат метильной группы в пропионильном остатке, проявляют неожиданную способность эффективно ингибировать опосредованный IL-8 хемотаксис и дегрануляцию нейтрофилов.
Таким образом, настоящее изобретение относится к применению соединений 2-арилуксусной кислоты и производных формулы (I):
и их фармацевтически приемлемых солей,
где
А включает атом Х и представляет собой 5-6-членное ароматическое или гетероароматическое кольцо, необязательно содержащее гетероатом, или дополнительный гетероатом, когда Х означает N, выбранный из N (азота), О (кислорода), S (серы); 5-6-членное ароматическое или гетероароматическое кольцо необязательно конденсировано со вторым кольцом с образованием бициклическоих ароматических или гетероароматических структур;
цифрами 1 и 2 отмечены соответствующие положения на кольце А;
атом Х выбран из N (азота) и С (углерода);
R означает замещающую группу на кольце А, выбранную из:
- группы в 3 (мета) положении, выбранной из групп: прямой или разветвленный С1-С5 алкил, С2-С5-алкенил или С2-С5-алкинил, замещенный или незамещенный фенил, прямой или разветвленный С1-С5 гидроксиалкил, С2-С5-ацил, замещенный или незамещенный бензоил;
- группы в 4 (пара) положении, выбранной из групп: С1-С5-алкил, С2-С5-алкенил или С2-С5-алкинил, С3-С6-циклоалкил, С1-С5-ацилокси, замещенный или незамещенный бензоилокси, С1-С5-ациламино, замещенный или незамещенный бензоиламино, С1-С5-сульфонилокси, замещенный или незамещенный бензолсульфонилокси, С1-С5-алкансульфониламино, замещенный или незамещенный бензолсульфониламино, С1-С5-алкансульфонилметил, замещенный или незамещенный бензолсульфонилметил, 2-фурил; 3-тетрагидрофурил; 2-тиофенил; 2-тетрагидротиофенил или С1-С8-алканоил, циклоалканоил или арилалканоил-С1-С5-алкиламино;
Hy представляет небольшую гидрофобную группу со значением коэффициента стерической затрудненности ν в интервале между 0,5 и 0,9 Е (где ν представляет стерическую константу Чартона (Charton steric constant) для заместителей), включающую метил, этил, хлор, бром, метокси, трифторметил;
группа Y выбрана из О (кислорода) и NH;
когда Y означает О (кислород), R' означает Н (водород);
когда Y означает NH, R' выбран из групп:
-Н, С1-С5-алкил, С1-С5-циклоалкил, С1-С5-алкенил;
-остатка аминокислоты, включающего прямой или разветвленный С1-С6-алкил, С1-С6-циклоалкил, С1-С6-алкенил, фенилалкил, замещенный одной или несколькими карбокси (СООН) группами;
- остатка аминокислоты, включающего прямой или разветвленный С1-С6-алкил, С1-С6-циклоалкил, С1-С6-алкенил, фенилалкил, содержащий в цепи гетероатом, выбранный из кислорода и серы, и одну или несколько карбокси (СООН) групп;
- остатка формулы -CH2-CH2-Z-(CH2-CH2O)nR'', где R'' представляет собой H или C1-C5-алкил, n означает целое число от 0 до 2 и Z означает кислород или серу;
-остатка формулы -(CH2)n-NRaRb, где n означает целое число от 0 до 5 и каждый из радикалов Ra и Rb, который может быть одинаковым или различным, представляет собой C1-C6-алкил, С1-С6-алкенил или альтернативно радикалы Ra и Rb, вместе с атомом азота, к которому они присоединены, образуют 3 - 7-членный гетероцикл формулы (II)
- где W означает простую связь, СН2, О, S или N-Rc, где Rc означает Н, С1-С6-алкил или С1-С6-алкилфенил;
- остатка OR'', где R'' означает Н, метил, карбоксиметил;
- остатка формулы SO2Rd, где Rd означает С1-С6-алкил, С1-С6-циклоалкил, С1-С6-алкенил;
при получении лекарственного средства для ингибирования индуцированного IL-8 PMN хемотаксиса человека.
Ароматическое кольцо в А группе может быть необязательно замещено дополнительными группами, такими как С1-С5-алкил или галоген.
Термин «замещенный» в вышеуказанных определениях означает остаток, замещенный группой, выбранной из числа таких групп, как С1-С5-алкил, галоген, гидрокси, С1-С5-алкокси, амино, С1-С5-алкиламино, нитро или цианогруппа.
Предпочтительными А группами в соединениях формулы (I) являются ароматические или гетероароматические кольца, выбранные из числа таких групп, как бензол, нафталин, пиридин, пиримидин, пиррол, имидазол, фуран, тиофен, индол и 7-аза-индол.
Предпочтительными соединениями формул (I) являются те, в которых группа YR' означает OH;
предпочтительными R' группами, когда Y означает NH, являются:
- аминокислотный остаток глицина, β-аланина, γ-аминомасляной кислоты или остатки L-α-аминокислоты, выбранные в группе L-аланин, валин, лейцин, изолейцин, нор-лейцин, фенилаланин, S-метилцистеин, метионин;
- остаток формулы -CH2-CH2-O-(CH2-CH2O)R'', где R'' означает H или С1-С5-алкил;
- остаток формулы -(CH2)n-NRaRb, где n означает целое число от 2 до трех, более предпочтительно - 3, и группа NRaRb означает N,N-диметиламин, N,N-диэтиламин, 1-пиперидил, 4-морфолил, 1-пирролидил, 1-пиперазинил, 1-(4-метил)пиперазинил;
- остаток OR', в котором R' означает Н, метил;
остаток формулы SO2Rd, где Rd означает метил, этил или изопропил.
Предпочтительными R группами в соединениях формулы (I) являются 3'-бензоил, 3'-(4-хлорбензоил), 3'-(4-метилбензоил), 3'-ацетил, 3'-пропионил, 3'-избутаноил, 3'-этил, 3'-изопропил, 4'-изобутил, 4'-трифторметансульфонилокси, 4'-бензолсульфонилокси, 4'-трифторметансульфониламино, 4'-бензолсульфониламино, 4'-бензолсульфонилметил, 4'-ацетилокси, 4'-пропионилокси, 4'-бензоилокси, 4'-ацетиламино, 4'-пропиониламино, 4'-бензоиламино.
Предпочтительными Hy группами в соединениях формулы (I) являются метил, этил, хлор, бром, метокси, трифторметил.
Особенно предпочтительным является применение соединений, выбранных из числа следующих:
(3-бензоил-2-метилфенил)уксусная кислота
(2-хлор-3-пропионилфенил)уксусная кислота
(3-изопропил-2-метилфенил)уксусная кислота
(4-изобутил-2-метилфенил)уксусная кислота
{2-метил-4-[(фенилсульфонил)амино]фенил}уксусная кислота
{2-метил-4-[(трифторметансульфонил)амино]фенил}уксусная кислота
{2-хлор-4-[(трифторметансульфонил)окси]фенил}уксусная кислота
(5-ацетил-1-метил-1Н-пиррол-2-ил)уксусная кислота
[1-метил-5-(4-метилбензоил)-1Н-пиррол-2-ил]уксусная кислота
(5-бензоил-1-метил-1Н-пиррол-2-ил)уксусная кислота
[1-метил-5-(4-хлорбензоил)-1Н-пиррол-2-ил]уксусная кислота
(5-изобутирил-1-метил-1Н-пиррол-2-ил)уксусная кислота
(1-бензоил-2-метил-1Н-пиррол-3-ил)уксусная кислота
(1-бензоил-2-хлор-1Н-пиррол-3-ил)уксусная кислота
(1-бензоил-2-метил-1Н-индол-3-ил)уксусная кислота
[1-(4-хлорбензоил)-2-метил-1Н-индол-3-ил]уксусная кислота
(1-изопропил-2-метил-1Н-пиррол[2,3-b]пиридин-3-ил)уксусная кислота
(3-бензоил-2-метоксифенил)уксусная кислота
(5-ацетил-1-метил-1Н-пиррол-2-ил)ацетамид
(5-ацетил-1-метил-1Н-пиррол-2-ил)-N-карбоксиметилацетамид
(S)(5-ацетил-1-метил-1Н-пиррол-2-ил)-N-(2-карбоксиэтил) ацетамид
(5-ацетил-1-метил-1Н-пиррол-2-ил)-N-(3-диметиламинопропил) ацетамид
(S)(5-ацетил-1-метил-1Н-пиррол-2-ил)-N-(1-карбокси-2-метоксиэтил)ацетамид
(4-изобутил-2-метилфенил)ацетамид
(2-хлор-3-пропионилфенил)-N-(3-диметиламиноэтил)ацетамид
(3-изопропил-2-метилфенил)-N-[3-(1-пиперидинил)пропил]ацетамид
(3-бензоил-2-метилфенил)ацетамид
(1-бензоил-2-метил-1Н-индол-3-ил)ацетамид
(1-бензоил-2-метил-1Н-индол-3-ил)-N-(3-диметиламинопропил)ацетамид
[1-(4-хлорбензоил)-2-метил-1Н-индол-3-ил]ацетамид
[1-(4-хлорбензоил)-5-метокси-2-метил-1Н-индол-3-ил]ацетамид
{2-хлор-4-[(трифторметансульфонил)окси]фенил}-N-(2-гидроксиэтоксиэтил)ацетамид
(1-бензоил-2-метил-1Н-пиррол-3-ил)-N-(2-метоксиэтил)ацетамид
(1-бензоил-2-хлор-1Н-пиррол-3-ил)-N-[3-(1-морфолино)пропил]ацетамид
(5-изобутирил-1-метил-1Н-пиррол-2-ил)ацетамид
(5-бензоил-1-метил-1Н-пиррол-2-ил)-N-(2-карбоксиметил)ацетамид
[1-метил-5-(4-хлорбензоил)-1Н-пиррол-2-ил]-N-(2-гидроксиэтоксиэтил)ацетамид
[1-метил-5-(4-хлорбензоил)-1Н-пиррол-2-ил]ацетамид
{2-метил-4-[(фенилсульфонил)амино]фенил}-N-(3-диметиламинопропил)ацетамид
(3-бензоил-2-метоксифенил)ацетамид.
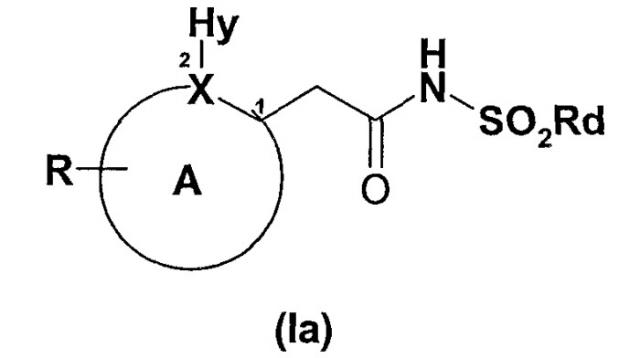
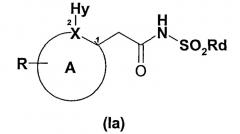
Настоящее изобретение также относится к новым 2-арилуксусным кислотам и производным формулы (Ia)
и их фармацевтически приемлемым солям;
где:
А включает атом Х и представляет собой 5-6-членное ароматическое или гетероароматическое кольцо, необязательно включающее гетероатом, или дополнительный гетероатом, когда Х означает N, выбранный из N(азота), О (кислорода), S (серы); и 5-6-членное ароматическое или гетероароматическое кольцо необязательно конденсировано со вторым кольцом с образованием бициклических ароматических или гетероароматических структур;
цифрами 1 и 2 отмечены соответствующие положения на кольце А;
атом Х выбран из N (азота) и С (углерода);
R означает замещающую группу на кольце А, выбранную из:
- группы в 3 (мета) положении, выбранной из групп: прямой или разветвленный С1-С5 алкил, С2-С5-алкенил или С2-С5-алкинил, замещенный или незамещенный фенил, прямой или разветвленный С1-С5 гидроксиалкил, С2-С5-ацил, замещенный или незамещенный бензоил;
- группы в 4 (пара) положении, выбранной из групп: С1-С5 алкил, С2-С5-алкенил или С2-С5-алкинил, С3-С6-циклоалкил, С1-С5-ацилокси, замещенный или незамещенный бензоилокси, С1-С5-ациламино, замещенный или незамещенный бензоиламино, С1-С5-сульфонилокси, замещенный или незамещенный бензолсульфонилокси, С1-С5-алкансульфониламино, замещенный или незамещенный бензолсульфониламино, С1-С5-алкансульфонилметил, замещенный или незамещенный бензолсульфонилметил, 2-фурил; 3-тетрагидрофурил; 2-тиофенил; 2-тетрагидротиофенил или С1-С8-алканоил, циклоалканоил или арилалканоил-С1-С5-алкиламино, таких как ацетил-N-метиламино, пивалоил-N-этиламино.
Hy представляет собой небольшую гидрофобную группу со значением коэффициента стерической затрудненности ν в интервале между 0,5 и 0,9 Е (где ν представляет стерическую константу Чартона (Charton) для заместителей), включающую метил, этил, хлор, бром, метокси, трифторметил;
Rd означает С1-С6-алкил, С1-С6-циклоалкил, С1-С6-алкенил.
Предпочтительными соединениями формулы (Ia) являются те, в которых А означает бензол, пиридин, пиримидин, пиррол, имидазол, фуран, тиофен, индол;
Rd представляет собой метил, этил или изопропил;
Hy выбран из метила, этила, хлора, брома, метокси, трифторметила.
Особенно предпочтительными соединениями настоящего изобретения являются:
(5-ацетил-1-метил-1Н-пиррол-2-ил)ацетил метансульфонамид
(4-изобутил-2-метилфенил)ацетил метансульфонамид
{2-метил-4-[(трифторметансульфонил)амино]фенил}ацетил метансульфонамид
[1-метил-5-(4-метилбензоил)-1Н-пиррол-2-ил]ацетилметансульфонамид.
Соединения формулы (Ia), в которых Rd имеет вышеуказанные значения, получают преобразованием соединения формулы (I), в которой YR' означает ОН, в реакционноспособное промежуточное соединение, такое как ацилгалогенид, предпочтительно - ацилхлорид, или известный «активный сложный эфир», предпочтительно - бензотриазолиловый сложный эфир, и осуществлением взаимодействия с соединением формулы NH2SO2Rd в присутствии подходящего основания, предпочтительно - трет-бутоксида калия. Соединения согласно изобретению, несмотря на отсутствие метильной группы на пропионовой цепочке, являются эффективными и селективными ингибиторами PMN хемотаксиса человека, индуцированного IL-8.
Как рассмотрено выше, молекулы, не содержащие вышеуказанную метильную группу на хиральном атоме углерода пропионовой цепочки, обычно оказываются неактивными в пробе на индуцированный IL-8 хемотаксис благодаря ключевой роли метильной группы в картировании признака алифатической гидрофобности фармакофора.
Общий характер наложения соединений согласно изобретению на гипотезу фармакофора, описанную выше и представленную на фиг.1, показан на фиг.3 и 4.
На фиг.3 показано наложение следующих соединений, принадлежащих классу арилуксусных производных: (2-метил-4-изобутилфенил)уксусная кислота; (2-метил-4-изобутилфенил)ацетилметансульфонамид; (2-метил-4-изобутилфенил)ацетамид.
На фиг.4 показано наложение следующих соединений, принадлежащих классу арилуксусных производных: (5-бензоил-1-метил-1Н-пиррол-2-ил)уксусная кислота; (1-бензоил-2-метил-1Н-индол-3-ил)ацетилметансульфонамид; (2-хлор-3-бензоилфенил)ацетамид.
Соединения настоящего изобретения обладают сильной биологической активностью вследствие неожиданного свойства гидрофобной группы (Hy) в положении 2 (формула I) точно отражать признак алифатической гидрофобности модели фармакофора, представленной сплошными сферами на фиг.3 и 4. Общий характер наложения фармакофора действительно наблюдается для соединений формулы (I). Гидрофобная группа (Hy) восстановленных лигандов, которые частично или полностью картируют эту гипотезу, неизменно подтверждают признак алифатической гидрофобности (сплошная сфера, фиг.3). Кроме того, соединения формулы (I) показывают требуемое конформационное расположение функциональных групп для того, чтобы полностью или частично картировать другие точки фармакофорной гипотезы в низкоэнергетической конформации.
Соединения настоящего изобретения обладают большим преимуществом из-за отсутствия хирального атома углерода относительно известных ингибиторов IL-8, принадлежащих семейству 2-арилпропионовых кислот и их производных. Способ получения и очистки известных 2-арилпропионовых кислот и их производных действительно требует разработки сложных энантиоселективных условий или введения стадии оптического разрешения с последующим нежелательным ростом стоимости активного элемента.
Соединения настоящего изобретения формулы (I) и (Ia) обычно выделяют в форме их аддитивных солей как органических, так и неорганических фармацевтически приемлемых кислот и оснований.
Примеры упомянутых кислот выбраны из числа таких кислот, как соляная кислота, серная кислота, фосфорная кислота, метансульфоновая кислота, фумаровая кислота, лимонная кислота.
Примеры упомянутых оснований выбраны из числа таких оснований, как гидроксид натрия, гидроксид калия, гидроксид кальция, (D,L)-лизин, L-лизин, трометамин.
Соединения настоящего изобретения формулы (I) испытаны in vitro на их способность ингибировать хемотаксис полиморфно-ядерных лейкоцитов (далее по тексту PMN) и моноцитов, индуцированный фракциями IL-8 и GRO-α. Для этой цели, чтобы выделить PMN из гепаринизованной человеческой крови, мононуклеаты удалили седиментацией на декстране (по способу, раскрытой W.J. Ming et al., J. Immunol., 138, 1409, 1987) и красные кровяные тельца - гипотоническим раствором. Жизнеспособность клеток рассчитывали по эксклузии трипана (Trypan) синего, а отношение циркулирующих полиморфонуклеатов оценивали по клеточному центрифугату после окрашивания Diff Quick.
Человеческий рекомбинант IL-8 (Pepro Tech) применяли как стимулирующий агент в экспериментах по хемотаксису с получением практически идентичных результатов: лиофилизированный протеин растворяли в объеме HBSS, содержащем 0,2% альбумина бычьей сыворотки (BSA), чтобы таким образом получить основной раствор, имеющий концентрацию 10-5 М, предназначенный для разбавления HBSS до концентрации 10-9 М, для проб на хемотаксис.
При осуществлении пробы на хемотаксис (согласно W. Falket et al., J. Immunol. Methods, 33, 239, 1980) применяли не содержащие PVP фильтры с пористостью 5 мкм и микрокамеры, пригодные для репликации.
Соединения настоящего изобретения формул (I) и (Ia) оценивали в концентрационном интервале между 10-6 и 10-10 М; для этой цели их добавляли в одинаковой концентрации как на нижние поры, так и на верхние поры микрокамеры. Оценку способности соединений настоящего изобретения формулы I ингибировать индуцированный IL-8 хемотаксис человеческих моноцитов проводили в соответствии с методом, описанным Van Damme J. et al.(Eur. J. Immunol., 19, 2367, 1989).
Особенно предпочтительным является применение соединений формулы (I), в которых группы R представляют собой 3'-бензоил, 3'-(4-хлорбензоил), 3'-(4-метилбензоил), 3'-ацетил, 3'-пропионил, 3'-изобутаноил, 4'-трифторметансульфонилокси, 4'-бензолсульфонилокси, 4'-трифторметансульфониламино, 4'-бензолсульфониламино, 4'-бензолсульфонилметил, 4'-ацетилокси, 4'-пропионилокси, 4'-бензоилокси, 4'-ацетиламино, 4'-пропиониламино, 4'-бензоиламино; такая активность позволяет применять эти соединения при лечении связанных с IL-8 паталогий, когда включается проводящий путь CXCR2 или в сочетании с передачей сигнала CXCR1. Двойные ингибиторы IL-8 и GRO-α индуцированных биологических активностей являются сильно предпочтительными с точки зрения терапевтических областей применения, но описанные соединения, действующие селективно на CXCR1 IL-8 рецептор или CXCR2 GRO-α/IL-8 рецептор, могут найти полезные терапевтические области применения при лечении конкретных паталогий, как описано ниже.
Биологическая активность соединений, показывающих высокую эффективность и как ингибиторов индуцированного IL-8 PMN хемотаксиса (CXCR1), и как двойных ингибиторов индуцированного IL-8 и GRO-α PMN хемотаксиса (CXCR1/CXCR2), представлена в таблице 1.
| Таблица 1 | ||
| Данные по биологической активности на CXCR1 и CXCR2 рецепторах (% ингибирования) | ||
| Соединение | IL-8 (c=10-8M) | GRO-α (c=10-8M) |
| (5-изобутирил-1-метил-1Н-пиррол-2-ил)уксусная кислота | 58±11 | 65±11 |
| (5-ацетил-1-метил-1Н-пиррол-2-ил)уксусная кислота | 60±7 | 65±5 |
| (5-ацетил-1-метил-1Н-пиррол-2-ил)ацетамид | 54±10 | 44±9 |
| (5-ацетил-1-метил-1Н-пиррол-2-ил)ацетилметансульфонамид | 50±10 | 46±14 |
| (4-изобутил-2-метилфенил)уксусная кислота | 60±10 | 4±8 |
| (3-изопропил-2-метилфенил)уксусная кислота | 62±8 | 5±10 |
| (4-изобутил-2-метилфенил)ацетилметансульфонамид | 67±14 | 0±10 |
| (2-хлор-3-пропионилфенил)уксусная кислота | 67±14 | 27±8 |
| {2-метил-4-[(трифторметансульфонил)амино]фенил}ацетилметансульфонамид | 60±7 | 52±5 |
Все соединения настоящего изобретения показали высокую степень селективности относительно ингибирования индуцированного IL-8 хемотаксиса по сравнению с хемотаксисом, индуцированным C5a(10-9M) или f-MLP(10-8M).
Установлено, что соединения формулы (I) и (Ia) полностью неэффективны как ингибиторы ферментов циклооксигеназы (ЦОК). В большинстве случаев соединения формулы (I) не участвуют в образовании PGE2, индуцированного в мышиных макрофагах стимулированием липополисахаридов (LPS, 1 мкг/мл) при концентрации в интервале между 10-5 и 10-7 М. Ингибирование образования PGE2, которое может быть записано, чаще всего происходит на пределе статистической значимости и находится ниже 15-20% от базовой величины. Пониженная эффективность ингибирования ЦОК составляет преимущество для терапевтического применения соединений настоящего изобретения, поскольку ингибирование синтеза простагландина является стимулом для клеток макрофага умножить синтез TNF-α (индуцированный LPS или пероксидом водорода), который является важным медиатором нейтрофильной активации и стимулом для образования интерлейкина-8 цитокина.
В свете экспериментальных доказательств, рассмотренных выше, и роли интерлейкина-8 (IL-8) и родственных ему соединений в процессах, включающих активацию и инфильтрацию нейтрофилов, соединения настоящего изобретения особенно целесообразны для применения при лечении таких болезней, как псориаз (R.J. Nicholoff et al., Am. J. Pathol., 138, 129, 1991). Другими болезнями, которые можно лечить с применением соединений настоящего изобретения, являются кишечные хронические воспалительные паталогии, такие как язвенный колит (Y.R. Mahida et al., Clin. Sci., 82, 273, 1992), и меланома, хронические обструктивные болезни легких (ХОБЛ), буллезный пемфигоид, ревматоидный артрит (M.Selz et al., J. Clin. Invest., 87, 463, 1981), индиопатический фиброз (E. J. Miller, цитированная выше, и P.C. Carré et al., J. Clin. Invest., 88, 1882, 1991), гломерулонефрит (T.Wada et al., J. Exp. Med., 180, 1135, 1994), и для предупреждения и лечения поражений, наносимых ишемией и реперфузией.
Ингибиторы активации CXCR1 и CXCR2 находят широкое применение, как рассмотрено в деталях выше, особенно при лечении хронических воспалительных патологий (например, псориаза), в которых активация обоих рецепторов IL-8 играет решающую патофизиологическую роль в развитии болезни.
В действительности известно, что активация CXCR1 важна при опосредованном IL-8 PMN хемотаксисе (Hammond M et al., J. Immunol., 155, 1428, 1995). С другой стороны, предполагается, что активация CXCR2 важна при опосредованной IL-8 эпидермальной клеточной пролиферации и ангиогенезисе псориатических пациентов (Kulke R. Et al., J. Invest. Darmatol., 110, 90, 1998).
Кроме того, селективные антагонисты CXCR2 находят особенно важное терапевтическое применение при лечении важных легочных болезней, таких как хронические обструктивные болезни легких ХОБЛ (D.WP Hay and H.M. Sarau., Current Opiniom in Pharmacology 2001, 1:242-247).
Поэтому другая цель настоящего изобретения относится к применению соединений формулы (I) и (Ia) при изготовлении лекарственного препарата для лечения псориаза, язвенного колита, меланомы, хронической обструктивной болезни легких (ХОБЛ), булл