4,6-диметил-2-хлор-3-(5-х-1,2,4-оксадиазолил-3)-пиридины в качестве антидотов 2,4-дихлорфеноксиуксусной кислоты
Иллюстрации
Показать всеОписываются новые химические биологически активные вещества. В качестве веществ, снижающих отрицательное воздействие гербицида 2,4-дихлорфеноксиуксусной кислоты на растения подсолнечника, предложены 4,6-диметил-2-хлор-3-(5-Х-1,2,4-оксадиазолил-3)пиридины формулы 1-3. Задачей настоящего изобретения является расширение ряда биологически активных веществ, полученных синтетическим путем, для их применения в сельском хозяйстве в качестве антидотов 2,4-Д. 1 табл.
Реферат
Изобретение относится к синтетическим, химическим биологически активным веществам из ряда гетероциклических соединений формулы 1-3:
1 X = этил;
2 X = н-пропил;
3 X = 2-нитрофенил;
защищающим растения от фитотоксического действия гербицида 2,4-дихлорфеноксиуксусной кислоты (антидотам).
Как известно, подсолнечник является чрезвычайно чувствительной культурой к гербицидам группы 2,4-Д, и в случаях непреднамеренного попадания гербицида на его посевы потери могут составлять, в зависимости от дозы, до 100% [1. Д.И.Чкаников, М.С.Соколов. Гербицидное действие 2,4-Д и других галоидфеноксикислот. - М.: Наука, 1973].
До сих пор защита вегетирующих растений подсолнечника от повреждающего действия 2,4-Д остается актуальной и нерешенной.
К наиболее близким аналогам по структуре заявляемых соединений может быть отнесен 4,6-диметил-2-хлор-3-(5-фенил-1,2,4-оксадиазолил-3)пиридин 4 [2. И.Г.Дмитриева, Л.В.Дядюченко, Е.А.Кайгородова. Особенности взаимодействия некоторых 2-хлорникотинонитрилов с гидроксиламином. Синтез 3-(1,2,4-оксадиазолил-3)пиридинов и их фрагментация под действием электронного удара. Изв. Вузов. Химия и хим. технол. - 2005. - Т.48. - Вып.11. - С.14-17]:
В качестве аналога по свойствам известен Сульфален [3. «Антидот гербицидов гормонального действия 2,4-дихлорфеноксиуксусной кислоты и 4-амино-3,5,6-трихлорпиколиновой кислот» пат. РФ №2043021 от 10.09.95, заявка №5042089 от 14.05.92] 5:
Сульфален формулы 5 используется в качестве средства снижения негативного действия гербицида 2,4-Д, он в дозе 200 г/га применяется по поврежденным вегетирующим растениям. В то же время Сульфален широко применяется в качестве антибактериального средства в медицинской практике, его синтез описан в литературе [4. В.Г.Беликов. Фармацевтическая химия. - М.: Высшая школа. 1985. с.383, 768]. Однако антидотная активность Сульфалена является недостаточно высокой.
Задачей настоящего изобретения является расширение арсенала биологически активных веществ, полученных синтетическим путем, для применения их в сельском хозяйстве в качестве антидотов.
Это достигается применением 4,6-диметил-2-хлор-3-(5-Х-1,2,4-оксадиазолил-3)пиридинов 1-3 на проростках подсолнечника.
Заявляемые соединения получали известным методом: термолизом соответствующих O-ацилзамещенных 4,6-диметил-2-хлорпиридил-3-амидоксимов 6-8 при кипячении в ледяной уксусной кислоте [2]:
1,6 X = этил;
2,7 X = н-пропил;
3,8 X = фенил.
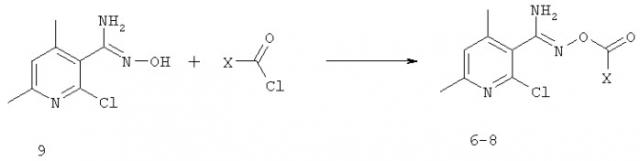
В свою очередь, O-ацилзамещенные 4,6-диметил-2-хлорпиридил-3-амидоксимы 6-8 синтезированы взаимодействием 4,6-диметил-2 пиридин-3-амидоксима 9 с хлорангидридами карбоновых кислот [2]:
Изобретение иллюстрируется следующими примерами.
Пример 1. 4,6-диметил-2-хлор-3-(5-этил-1,2,4-оксадиазолил-3)-пиридин (соединение 1).
Смесь 0,8 г (3,14 ммоль) O-этилкарбонил-4,6-диметил-2-хлорпиридил-3-амидоксима и 8 мл ледяной уксусной кислоты кипятят 2-2,5 ч, реакционную массу упаривают досуха, остаток растворяют в 10 мл эфира, раствор фильтруют через слой силикагеля марки LS 5/40 высотой 1,5 см, растворитель упаривают. Получают 0,51 г (68%) целевого соединения 1 в виде бесцветного масла.
Найдено, %: С 55,26; Н 5,27; N 17,79. С11Н12ClN3О;
Вычислено, %: С 55,59; Н 5,09; N 17,68.
ПМР, δ, м.д. (группа): 1,32 (3Н, т, СН3СН2, J=7,3 Гц); 2,40 (3Н, с, 4-СН3); 2,45 (3Н, с, 6-СН3), 2,66 (2Н, к, СН3СН2, J=7,3 Гц); 7,11 (1Н, с, 5-Н Ру).
Пример 2. 4,6-диметил-2-хлор-3-(5-н-пропил-1,2,4-оксадиазолил-3)-пиридин (соединение 2).
Смесь 0,8 г (2,97 ммоль) O-пропилкарбонил-4,6-диметил-2-хлор-пиридил-
3-амидоксима и 8 мл ледяной уксусной кислоты кипятят 2-2,5 ч, реакционную массу упаривают досуха, остаток растворяют в 10 мл эфира, раствор фильтруют через слой силикагеля марки LS 5/40 высотой 1,5 см, растворитель упаривают. Получают 0,49 г (65%) целевого соединения 2 в виде бесцветного масла.
Найдено, %: С 57,51; Н 5,44; N 16,86; С12H14ClN3О;
Вычислено, %: С 57,26; Н 5,61; N 16,69.
ПМР, δ, м.д. (группа): 0,83 (3Н, т, СН3CH2CH2, J=7,1 Гц); 1,56…165 (2Н, м, СН3СН2СН2, J=7,1 Гц); 2,33 (2Н, т, СН3СН2CH2, J=7,1 Гц); 2,41 (3Н, с, 4-СН3); 2,45 (3Н, с, 6-СН3); 7,31 (1Н, с, 5-Н Ру).
Пример 3. 4,6-диметил-2-хлор-3-[5-(2-нитрофенил)-1,2,4-оксадиазолил-3]-пиридин (соединение 3).
Смесь 1,0 г (2,87 ммоль) O-2-нитрофенилкарбонил-4,6-диметил-2-хлорпиридил-
3-амидоксима и 12 мл ледяной уксусной кислоты кипятят 3,5-4 ч, реакционную массу упаривают досуха, остаток перекристаллизовывают из ДМФА. Получают 0,74 г (78%) целевого соединения 3 в виде кристаллов с т.пл. 226-228°С.
Найдено, %: С 54,40; Н 3,28; N 16,82; С15Н11ClN4О3;
Вычислено, %: С 54,48; Н 3,35; N 16,94.
ПМР, δ, м.д. (группа): 2,25 (3Н, с, 4-СН3); 2,40 (3Н, с, 6-СН3); 7,19 (1Н, с, 5-НРу), 7,47…8,18 (4Н, м, Ar).
Пример 4. 4,6-диметил-2-хлор-3-(5-фенил-1,2,4-оксадиазолил-3)пиридин (соединение 4).
Смесь 0,8 г (2,63 ммоль) O-фенилкарбонил-4,6-диметил-2-хлорпиридил-
3-амидоксима и 8 мл ледяной уксусной кислоты кипятят 2-2,5 ч, реакционную массу упаривают досуха, остаток перекристаллизовывают из гексана. Получают 0,51 г (68%) целевого соединения с т.пл. 116-117°С.
Найдено, %: С 63,29; Н 4,38; N 14,54; C15H12ClN3O;
Вычислено, %: С 63,05; Н 4,23; N 14,71.
ПМР, δ, м.д. (группа): 2,25 (3Н, с, 4-СН3), 2,55 (3Н, с, 6-СН3), 7,42 (1Н, с, 5-Н Ру), 7,68…8,40 (5Н, м, Ph).
Пример 5. Оценка соединений 1-4 на антидотную активность на проростках подсолнечника.
Проросшие семена подсолнечника с длиной зародышевого корешка 2-4 мм помещали на 1 ч в раствор 2,4-дихлорфеноксиуксусной кислоты (2,4-Д) в концентрации 10-3% в расчете получения 40-60% ингибирования роста гипокотиля. После гербицидного воздействия проростки промывали водой и помещали в растворы испытываемых на антидотную активность веществ в концентрациях 10-2, 10-3, 10-4, 10-5% (вариант гербицид + антидот). Спустя 1 ч семена промывали водой и раскладывали на полосы фильтровальной бумаги (размер 10×75 см) по 20 штук, которые сворачивали в рулоны и помещали в стаканы с 50 мл воды. Дальнейшее проращивание семян проводили в термостате в течение 3 суток при температуре 28°С. Температура растворов и промывной воды 28°С.
Семена варианта «гербицид» (эталон сравнения) выдерживали 1 ч в растворе 2,4-Д в концентрации 10-3% и 1 ч в воде.
Семена контрольного варианта 2 часа выдерживали в воде.
Повторность опыта трехкратная. В каждой повторности использовали по 20 штук семян.
Защитный (антидотный) эффект определяли по увеличению длины гипокотиля и корня в варианте гербицид + антидот относительно названных величин в варианте «гербицид» (эталон).
Статистическая обработка экспериментальных данных проведена с использованием t-критерия Стьюдента при Р=0,95.
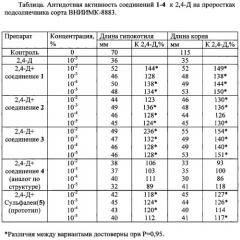
Результаты исследований приведены в таблице.
Как видно из данных таблицы, применение на фоне воздействия гербицида предлагаемых в качестве антидотов 4,6-диметил-2-хлор-3-(5-Х-1,2,4-оксадиазолил-3)пиридинов 1-3 резко ослабляет токсическое действие гербицида.
Соединения 1-3 снижали отрицательное действие 2,4-Д на гипокотили проростков подсолнечника на 28-44% при использовании в основном в трех и более концентрациях, в то время как соединение 4 (аналог по структуре) защитного действия не проявлял, а величина антидотного эффекта Сульфалена (прототипа) составляла 12-24%.
Соединения 1-4 снижали ингибирующее действие 2,4-Д на корни проростков на 30-54% также при использовании в трех и более концентрациях, соединение 4 не увеличивало длину корня проростков, а Сульфален (прототип) проявлял антидотный эффект на уровне 17-27%.
Таким образом, применение заявляемых 4,6-диметил-2-хлор-3-(5-Х-1,2,4-оксадиазолил-3)пиридинов в качестве антидотов позволяет эффективно защитить подсолнечник от отрицательного воздействия 2,4-Д, а также расширить ассортимент известных антидотов.
4,6-Диметил-2-хлор-3-(5-Х-1,2,4-оксадиазолил-3)пиридины формулы 1-3: 1 Х = этил;2 Х = н-пропил;3 Х = 2-нитрофенил;проявляющие антидотную активность по отношению к 2,4-дихлор-феноксиуксусной кислоте на подсолнечнике.